
Ac??tone
Contexte des ??coles Wikip??dia
Ce contenu de Wikipedia a ??t?? s??lectionn?? par SOS Enfants d'aptitude dans les ??coles ?? travers le monde. enfants SOS est le plus grand don de charit?? du monde enfants orphelins et abandonn??s la chance de la vie familiale.
| Ac??tone | |
|---|---|
 |  |
 |  |
Nom ?? privil??gier UICPA Propanone | |
Propane-2-one | |
Autres noms Dim??thylformald??hyde Dim??thylc??tone | |
| Identificateurs | |
| Abr??viations | DMK |
| Num??ro CAS | 67-64-1 |
| PubChem | 180 |
| ChemSpider | 175 |
| UNII | 1364PS73AF |
| Num??ro CE | 200-662-2 |
| Num??ro ONU | 1090 |
| KEGG | D02311 |
| MeSH | Ac??tone |
| ChEBI | CHEBI: 15347 |
| ChEMBL | CHEMBL14253 |
| Num??ro RTECS | AL31500000 |
| Beilstein R??f??rence | 635680 |
| Gmelin R??f??rence | 1466 |
| 3DMet | B00058 |
| images de Jmol-3D | Image 1 Image 2 |
SMILES
| |
InChI
| |
| Propri??t??s | |
| Formule mol??culaire | C 3 H 6 O |
| Masse molaire | 58,08 g mol -1 |
| Apparence | Liquide incolore (blanc sous forme de neige comme quand solide) |
| Densit?? | 0,7925 g / cm 3 |
| Point de fusion | -94,9 ?? C, 178 K, -139 ?? F |
| Point d'??bullition | 56,53 ?? C, 330 K, 134 ?? F |
| Solubilit?? dans l'eau | miscible |
| Acidit?? (p K a) | 24,2 |
| Indice de r??fraction (n D) | 1,35900 (20 ?? C) |
| Viscosit?? | 0,3075 c P |
| Structure | |
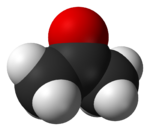
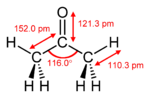
| Forme mol??culaire | trigonale plane au C = O |
| Moment de dip??le | 2,91 R?? |
| Risques | |
| FS | MSDS externe |
| Classification UE | |
| Phrases-R | R11, R36, R66, R67 |
| Phrases S | (S2), S9, S16, S26 |
| NFPA 704 |  3 1 0
|
| Point d'??clair | -17 ?? C |
| D'auto-inflammation temp??rature | 465 ?? C |
| Limites d'explosivit?? | 4,0 ?? 57,0 |
| Valeur limite | 500 ppm (TWA), 750 ppm (STEL) |
| LD 50 | > 2000 mg / kg, par voie orale (rat) |
| Des compos??s apparent??s | |
| Connexes solvants | Eau ??thanol Isopropanol Tolu??ne |
| Page de donn??es suppl??mentaire | |
| Structure et propri??t??s | n, ε r, etc. |
| Thermodynamique donn??es | comportement de phase Solide, liquide, gaz |
| Les donn??es spectrales | UV, IR, RMN , MS |
Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
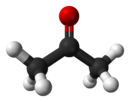
L'ac??tone est le compos?? organique avec la formule (CH 3) 2 CO. Ce mobile, liquide incolore, inflammable est l'exemple le plus simple des c??tones . L'ac??tone est miscible avec l'eau et sert comme un important solvant en soi, typiquement en tant que solvant de choix pour des fins de nettoyage en laboratoire. ?? propos de 5100000 tonnes ont ??t?? produites dans le monde en 2009, principalement pour une utilisation comme solvant et la production de le m??thacrylate de m??thyle et le bisph??nol A. domestique courante utilise de l'ac??tone sont tels que l'ingr??dient actif dans dissolvant et comme un diluant ?? peinture. Ce est un bloc de construction courants en chimie organique.
L'ac??tone est produite naturellement et ??limin??s dans le corps humain ?? la suite de processus m??taboliques normaux. Tests de toxicit?? sur la reproduction montrer qu'il a un faible potentiel de provoquer des probl??mes de reproduction. En fait, le corps augmente naturellement le niveau d'ac??tone chez les femmes enceintes, m??res qui allaitent et les enfants parce que leurs besoins ??nerg??tiques plus ??lev??s conduisent ?? des niveaux plus ??lev??s de la production de l'ac??tone. La communaut?? m??dicale utilise maintenant c??tog??ne r??gimes qui augmentent l'ac??tone dans le corps pour r??duire les crises d'??pilepsie chez les nourrissons et les enfants qui souffrent d'??pilepsie r??fractaire r??calcitrant.
Production
L'ac??tone est produit directement ou indirectement ?? partir de propylene. Le plus souvent, dans le proc??d?? au cum??ne, le benz??ne est alkyle avec du prop??ne et r??sultant le cum??ne (isopropylbenz??ne) est oxyd?? pour donner du ph??nol et de l'ac??tone:
- C 6 H 5 CH (CH 3) 2 + O 2 → C 6 H 5 OH + (CH 3) 2 CO
Cette conversion implique l'interm??diaire de l'hydroperoxyde de cum??ne, C 6 H 5 C (OOH) (CH 3) 2.
Des m??thodes de production plus ??g??s
Auparavant, l'ac??tone a ??t?? r??alis?? par la distillation s??che de les ac??tates, par exemple l'ac??tate de calcium. Pendant la Premi??re Guerre mondiale ac??tone a ??t?? produit par des bact??ries fermentation, tel que d??velopp?? par Chaim Weizmann (plus tard le premier pr??sident de Isra??l ) afin d'aider ?? l'effort de guerre britannique. Cette Processus ac??tone butanol ??thanol a ??t?? abandonn?? en raison des faibles rendements.
Biosynth??se
De petites quantit??s d'ac??tone sont produits dans le corps par la decarboxylation de les corps c??toniques.
Utilisations
Environ un tiers de l'ac??tone au monde est utilis?? comme solvant, et un quart est consomm?? comme un pr??curseur de le m??thacrylate de m??thyle. Cette application commence par la conversion initiale de l'ac??tone pour la cyanhydrine d'ac??tone:
- (CH 3) 2 CO + HCN → (CH 3) 2 C (OH) CN
Dans une ??tape ult??rieure, le nitrile est hydrolyse au insatur?? amide, qui est est??rifi??:
- (CH 3) 2 C (OH) CN + CH 3 OH → CH 2 = (CH 3) CCO 2 CH 3 NH 3 +
La troisi??me utilisation importante d'ac??tone (environ 20%) implique sa condensation avec du ph??nol pour donner Bisph??nol A:
- (CH 3) 2 CO + 2 C 6 H 5 OH → (CH 3) 2 C (C 6 H 4 OH) 2 + H 2 O
Le bisph??nol-A est un composant de nombreux polym??res tels que polycarbonates, les polyur??thanes, et des r??sines ??poxy.
Comme solvant
L'ac??tone est un bon solvant pour la plupart des mati??res plastiques et des fibres synth??tiques y compris ceux utilis??s dans des bouteilles de laboratoire en polystyr??ne , polycarbonate et certains types de polypropylene. Il est id??al pour amincissement r??sine de fibre de verre, le nettoyage du mat??riel en fibre de verre et la dissolution en deux parties des ??poxydes et superglue avant le durcissement. Il est utilis?? comme un composant volatil de certaines peintures et vernis. Comme un d??graissant robuste, il est utile dans la pr??paration de m??tal avant la peinture; il se amincit ??galement des r??sines de polyester, vinyle et les adh??sifs.
Plusieurs millions de kg d'ac??tone sont consomm??s dans la production de l'alcool de solvants m??thylisobutylc??tone et la m??thyl isobutyl c??tone. Ces produits se pr??sentent par l'interm??diaire d'une premi??re aldolisation pour donner diac??tone alcool.
- 2 (CH 3) 2 → CO (CH 3) 2 (OH) CH 2 C (O) CH 3 C
L'ac??tone est utilis?? comme solvant dans l'industrie pharmaceutique et en tant qu'agent de d??naturation dans de l'alcool d??natur??. L'ac??tone est ??galement pr??sent en tant que excipient dans certains produits pharmaceutiques.
Stockage de l'ac??tyl??ne
Bien inflammable lui-m??me, l'ac??tone est aussi largement utilis?? comme solvant pour le transport et le stockage s??r de l'ac??tyl??ne , qui ne peut ??tre mise en pression en toute s??curit?? en tant que compos?? pur. Des r??cipients contenant un mat??riau poreux sont d'abord remplis avec de l'ac??tone suivie d'ac??tyl??ne, qui se dissout dans l'ac??tone. Un litre d'ac??tone peut dissoudre environ 250 litres d'ac??tyl??ne.
Les applications m??dicales et cosm??tiques
L'ac??tone est utilis?? dans une vari??t?? d'applications m??dicales et cosm??tiques g??n??rales et est aussi list?? en tant que composant dans les additifs alimentaires et les emballages alimentaires.
L'ac??tone est couramment utilis?? dans le processus de rajeunissement de la peau dans les cabinets m??dicaux et les spas m??dicaux. Depuis l'??poque de l'Egypte ancienne, les gens ont eu recours ?? des m??thodes de chemexfoliation, ??galement connu sous le pelage chimique, pour rajeunir la peau. Agents couramment utilis??s aujourd'hui pour les peelings chimiques sont l'acide salicylique, l'acide glycolique, acide salicylique 30% dans l'??thanol, et l'acide trichlorac??tique (TCA). Avant chemexfoliation, la peau doit ??tre correctement nettoy?? et l'exc??s de graisse retir??e. Ce processus est connu comme le d??graissage. Ac??tone, SOLISEP, ou une combinaison de ces agents est couramment utilis?? dans ce processus.
utilisations de laboratoire
En laboratoire, on utilise l'ac??tone comme polaire solvant aprotique dans une gamme de r??actions organiques, tels que S N 2 r??actions. L'utilisation d'un solvant de l'ac??tone est ??galement critique pour le Oxydation de Jones. Ce est un solvant commun pour le rin??age verrerie de laboratoire en raison de son faible co??t et de la volatilit??, cependant, il ne forme pas un az??otrope avec l'eau (voir az??otrope (donn??es)). En d??pit de son utilisation commune comme une suppos??e agent de s??chage, il ne est pas efficace, sauf par d??placement en vrac et la dilution. L'ac??tone peut ??tre refroidi avec de la glace s??che ?? -78 ?? C sans cong??lation; ac??tone / bains de glace s??che sont couramment utilis??s pour effectuer des r??actions ?? basse temp??rature. L'ac??tone est fluorescent sous une lumi??re ultraviolette, et la vapeur peut ??tre utilis?? comme traceur fluorescent dans des exp??riences d'??coulement de fluide.
Les usages domestiques et autres cr??neaux
L'ac??tone est souvent le composant primaire dans des agents de nettoyage tels que dissolvant. Ac??tate d'??thyle, un autre solvant organique, est parfois utilis?? ainsi. L'ac??tone est un composant de d??capant colle et il enl??ve facilement r??sidus de verre et la porcelaine.
Il peut ??tre utilis?? en tant qu'agent artistique; quand on le frotte sur le dos d'une impression laser ou la photocopie plac?? face vers le bas sur une autre surface et bruni fermement, le toner des transferts d'images ?? la surface de destination.
Maquilleurs utilisent l'ac??tone pour enlever l'adh??sif de la peau de la compensation des perruques et des moustaches en immergeant l'??l??ment dans un bain d'ac??tone, puis en ??liminant le r??sidu de colle ramolli avec une brosse dure.
Certains passionn??s de l'automobile ajoutent ac??tone ?? environ 1 500 ?? participer ?? leur carburant, la suite d'all??gations d'am??lioration de l'??conomie de carburant et la vie du moteur.
S??curit??
Inflammabilit??
Le danger le plus commun associ?? avec de l'ac??tone est son extr??me inflammabilit??. Il auto-enflamme ?? une temp??rature de 465 ?? C (869 ?? F). ?? des temp??ratures sup??rieures de l'ac??tone point de -20 ?? C (-4 ?? F) flash, des m??langes air comprises entre 2,5% et 12,8% d'ac??tone, en volume, peut exploser ou provoquer un incendie flash. Les vapeurs peuvent se ??couler le long des surfaces vers des sources d'ignition ??loign??es et arri??re. D??charge statique peut aussi enflammer les vapeurs d'ac??tone.
Information sur la sant??
L'ac??tone a ??t?? largement ??tudi?? et est g??n??ralement reconnue comme ayant une faible toxicit?? aigu?? et chronique en cas d'ingestion et / ou par inhalation. L'inhalation de concentrations ??lev??es (autour de 9200 ppm) dans l'air a caus?? une irritation de la gorge chez l'homme en aussi peu que 5 minutes. L'inhalation de concentrations de 1000 ppm a caus?? une irritation de l'oeil et de la gorge en moins de 1 heure; Toutefois, Inhalation 500 ppm d'ac??tone dans l'air n'a pas caus?? de sympt??mes d'irritation chez les humains m??me apr??s 2 heures d'exposition. L'ac??tone est actuellement pas consid??r??e comme une canc??rog??ne, mutag??ne ou un produit chimique une pr??occupation pour les effets neurotoxiques chroniques.
L'ac??tone peut ??tre trouv?? comme ingr??dient dans une vari??t?? de produits de consommation allant des cosm??tiques aux aliments transform??s et non transform??s. L'ac??tone a ??t?? class?? comme un GRAS (Generally Recognized as Safe) substance quand il est pr??sent dans les boissons, p??tisseries, desserts, et conserve ?? des concentrations allant de 5 ?? 8 mg / L. En outre, une ??tude am??ricano-europ??enne commune a constat?? que de l'ac??tone "les risques pour la sant?? sont faibles."
Toxicologie
L'ac??tone est cens?? pr??senter une toxicit?? l??g??re en utilisation normale, et il n'y a pas de preuves solides d'effets chroniques sur la sant?? si des pr??cautions de base sont respect??es.
?? des concentrations tr??s ??lev??es de vapeurs, l'ac??tone est irritant et, comme beaucoup d'autres solvants, peut d??primer le syst??me nerveux central. Ce est aussi un irritant au contact avec les yeux, et un potentiel risque d'aspiration pulmonaire. Dans un cas document??, l'ingestion d'une quantit?? importante d'ac??tone conduit ?? une toxicit?? syst??mique, bien que le patient finit par compl??tement r??cup??r??. Certaines sources estiment LD 50 pour l'ingestion humaine ?? 1,159 g / kg; DL 50 par inhalation souris est donn??e ?? 44 g / m 3, pendant 4 heures.
L'ac??tone a ??t?? d??montr?? que effets anticonvulsivants chez les mod??les animaux de l'??pilepsie , en l'absence de toxicit??, lorsqu'ils sont administr??s ?? des concentrations millimolaires. Il a ??t?? ??mis l'hypoth??se que la faible teneur en glucides riches en mati??res grasses r??gime c??tog??ne utilis?? cliniquement pour contr??ler l'??pilepsie r??sistante aux m??dicaments chez les enfants fonctionne en ??levant l'ac??tone dans le cerveau.
- EPA EPCRA Radiation (1995). EPA retir?? ac??tone ?? partir de la liste des "produits chimiques toxiques" entretenus vertu de l'article 313 de la Emergency Planning and Community Right to Know Act (EPCRA). En prenant cette d??cision, l'EPA a effectu?? un examen approfondi des donn??es disponibles sur la toxicit?? sur l'ac??tone et a constat?? que l'ac??tone "pr??sente une toxicit?? aigu?? seulement ?? des niveaux qui d??passent largement rejets et des expositions qui en r??sultent??, et en outre que l'ac??tone "pr??sente une faible toxicit?? dans des ??tudes chroniques."
- G??notoxicit??. L'ac??tone a ??t?? test??e en plus de deux douzaines in vitro et in vivo dans des essais.
Ces ??tudes indiquent que l'ac??tone ne est pas g??notoxique.
- Canc??rog??nicit??. EPA en 1995 a conclu: ??Il ne existe actuellement aucune preuve pour sugg??rer un sujet de pr??occupation pour la canc??rog??nicit??." (EPCRA examen, d??crit ?? la section 3.3). NTP scientifiques ont recommand?? contre les essais de toxicit?? chronique / de canc??rog??nicit?? de l'ac??tone, car ??les ??tudes ne ont d??montr?? prechronic une r??ponse toxique tr??s doux ?? tr??s fortes doses chez les rongeurs."
- Neurotoxicit?? et la neurotoxicit?? d??veloppementale. Le potentiel neurotoxique ?? la fois de l'ac??tone et l'isopropanol, le pr??curseur m??tabolique de l'ac??tone, ont ??t?? largement ??tudi??es. Ces ??tudes d??montrent que, bien que l'exposition ?? de fortes doses d'ac??tone peut provoquer des effets transitoires du syst??me nerveux central, de l'ac??tone ne est pas neurotoxique. Une directive ??tude de neurotoxicit?? d??veloppementale a ??t?? r??alis??e avec de l'isopropanol, et aucun des effets neurotoxiques de d??veloppement ont ??t?? identifi??s, m??me ?? la plus forte dose test??e. (SIAR, pp. 1, 25, 31).
- L'environnement. Lorsque l'EPA exempt?? de la r??glementation de l'ac??tone comme un compos?? organique volatil (COV) en 1995, l'EPA a d??clar?? que cette exemption serait "contribuer ?? la r??alisation de plusieurs objectifs environnementaux importants et appuierait les efforts de pr??vention de la pollution de l'EPA." 60 Fed. Reg. 31634 (16 Juin, 1995). 60 Fed. Reg. 31634 (16 Juin, 1995). EPA a not?? que l'ac??tone pourrait ??tre utilis?? "comme un substitut pour plusieurs compos??s qui sont ??num??r??s comme les polluants atmosph??riques dangereux (HAP) en vertu de l'article 112 de la [Clean Air] Loi.
Effets sur l'environnement
Ac??tone se ??vapore rapidement, m??me de l'eau et du sol. Une fois dans l'atmosph??re, il est d??grad?? par la lumi??re UV avec une demi-vie de 22 jours. Ac??tone dissipe lentement dans le sol, les animaux ou les cours d'eau, car il est parfois consomm?? par les micro-organismes, mais ce est un contaminant significative des eaux souterraines en raison de sa forte solubilit?? dans l'eau. Le LD 50 de l'ac??tone pour poisson est de 8,3 g / l d'eau (soit environ 0,8%) de plus de 96 heures, et sa demi-vie de l'environnement est d'environ 1 ?? 10 jours. L'ac??tone peut poser un risque important de rar??faction de l'oxyg??ne dans les syst??mes aquatiques en raison de l'activit?? microbienne consommer.
Peroxyde d'ac??tone
Lorsqu'il est oxyd??, forme ac??tone ac??tone peroxyde comme sous-produit, qui est un compos?? tr??s instable. Elle peut ??tre form??e accidentellement, par exemple lors de d??chets peroxyde d'hydrog??ne est vers?? dans un solvant des d??chets contenant de l'ac??tone. peroxyde d'ac??tone est plus de dix fois plus sensible aux frottements et chocs nitroglyc??rine. En raison de son instabilit??, il est rarement utilis??, en d??pit de sa synth??se chimique facile.

