
Le peroxyde d'hydrog??ne
Saviez-vous ...
SOS croit que l'??ducation donne une meilleure chance dans la vie des enfants dans le monde en d??veloppement aussi. Avant de vous d??cider ?? propos de parrainer un enfant, pourquoi ne pas en apprendre davantage sur diff??rents organismes de parrainage premier ?
| Le peroxyde d'hydrog??ne | |
|---|---|
 |  |
Le dioxyde de dihydrog??ne | |
Autres noms μ-1κO, 2κO'-Dioxidodihydrogen | |
| Identificateurs | |
| Num??ro CAS | 7722-84-1 |
| Num??ro RTECS | MX0900000 |
| Propri??t??s | |
| Formule mol??culaire | H 2 O 2 |
| Masse molaire | 34,0147 g ?? mol -1 ??. |
| Apparence | Couleur bleue tr??s p??le; en solution incolore |
| Densit?? | 1,4 g / cm 3, un liquide |
| Point de fusion | -11 ?? C (262,15 K) |
| Point d'??bullition | 150,2 ?? C (423,35 K) |
| Solubilit?? dans l'eau | Miscible |
| Acidit?? (p K a) | 11,65 |
| Viscosit?? | 1,245 c P ?? 20 ?? C |
| Moment de dip??le | 2,26 R?? |
| Risques | |
| FS | 30% msds de peroxyde d'hydrog??ne 60% msds de peroxyde d'hydrog??ne |
| Phrases-R | R5, R8, R20, R22, R35 |
| Phrases S | (S1), (S2), S17, S26, S28, S36, S37, S39, S45 |
| Principal dangers | Oxydant, corrosive |
| NFPA 704 |  0 3 1 OX |
| Point d'??clair | Ininflammable |
| Des compos??s apparent??s | |
| Des compos??s apparent??s | Eau Ozone Hydrazine |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
Le peroxyde d'hydrog??ne (H 2 O 2) est un liquide bleu tr??s p??le qui appara??t incolore dans une solution dilu??e, l??g??rement plus visqueux que l'eau. Ce est un peu acide . Il a une forte propri??t??s oxydantes et est donc un puissant agent de blanchiment qui est surtout utilis?? pour blanchir le papier, mais a ??galement trouv?? une utilisation en tant que d??sinfectant, en tant que oxydant, en tant que antiseptique, et fus??es (en particulier dans des concentrations ??lev??es que peroxyde haute test (HTP)) comme un monopropellant, et syst??mes de diergol. La capacit?? d'oxydation du peroxyde d'hydrog??ne est tellement forte que le produit chimique est consid??r?? comme une tr??s les esp??ces r??actives de l'oxyg??ne.
Histoire
Le peroxyde d'hydrog??ne a ??t?? isol?? pour la premi??re en 1818 par Louis Jacques Th??nard en faisant r??agir le peroxyde de baryum avec de l'acide nitrique . Une version am??lior??e de ce proc??d?? utilise de l'acide chlorhydrique , suivie par de l'acide sulfurique pour pr??cipiter le du sulfate de baryum sous-produit. Le processus de Th??nard a ??t?? utilis?? ?? partir de la fin du 19e si??cle jusqu'au milieu du 20e si??cle. M??thodes de production modernes sont discut??s ci-dessous.
Utilisations
Applications industrielles
Environ 50% de la production mondiale de peroxyde d'hydrog??ne en 1994 a ??t?? utilis?? pour fabrication de p??te et de papier-blanchiment. D'autres applications de blanchiment sont de plus en plus importante que le peroxyde d'hydrog??ne est consid??r?? comme une alternative respectueuse de l'environnement au chlore de blanchiment-based. Il est tr??s corrosif pour les m??taux.
D'autres applications industrielles majeurs pour le peroxyde d'hydrog??ne comprennent la fabrication de Le percarbonate de sodium et le perborate de sodium, utilis?? comme agents de blanchiment doux ?? blanchisserie d??tergents. Il est utilis?? dans la production de certaines des peroxydes organiques tels que le peroxyde de dibenzoyle, utilis?? dans polym??risations et autres proc??d??s chimiques. Le peroxyde d'hydrog??ne est ??galement utilis?? dans la production de les ??poxydes tels que l'oxyde de propyl??ne. La r??action avec des acides carboxyliques correspondant produit un peroxyacide. L'acide perac??tique et l'acide m??ta-chloroperoxybenzo??que (mCPBA g??n??ralement abr??g??) sont pr??par??s ?? partir d'acide ac??tique et de l'acide m??ta-chlorobenzo??que, respectivement. Celui-ci est g??n??ralement mis ?? r??agir avec des alc??nes pour donner le ??poxyde.
Dans le proc??d?? de fabrication de circuits imprim??s, le peroxyde d'hydrog??ne en m??lange avec de l'acide sulfurique a ??t?? utilis?? comme produit chimique de microetch pour rendre rugueuse la surface de cuivre pr??paration.
Combinaison d'un catalyseur en poudre pr??cieux, le peroxyde d'hydrog??ne, de m??thanol et d'eau ?? base de m??tal peut produire de la vapeur surchauff??e ?? une ?? deux secondes, lib??rant uniquement de CO 2 et la vapeur ?? haute temp??rature pour une vari??t?? de fins ..
Les usages domestiques
- H 2 O 2 (environ 15%) dilu?? est utilis?? pour blanchir humaine cheveux, d'o?? l'expression "peroxyde blonde". Il est absorb?? par la peau lors d'un contact et cr??e une peau locale capillaire embolie qui appara??t comme un blanchiment temporaire de la peau. Il est utilis?? pour blanchir les os qui doivent ??tre mis sur l'affichage. La force d'une solution peut ??tre d??crite comme un pourcentage ou en volume, o?? 1% de peroxyde d'hydrog??ne lib??re 3,3 volumes d'oxyg??ne lors decomposition.Thus, une solution ?? 3% est ??quivalent ?? 10 volumes et une solution ?? 6% ?? 20 volume, etc.
- 3% de H 2 O 2 est utilis?? m??dicalement pour nettoyer les plaies, retirer les tissus morts, et comme orale agent de d??bridement. Peroxyde arr??te lente (petit bateau) saignements de la plaie / suintement, ainsi. La plupart des solutions de peroxyde over-the-counter ne sont pas adapt??s pour l'ingestion.
- 3% de H 2 O 2 est efficace pour traiter les frais (rouge) taches de sang dans les v??tements et sur d'autres points. Il doit ??tre appliqu?? ?? des v??tements avant taches de sang peuvent ??tre accidentellement "set" avec de l'eau chauff??e. L'eau froide et au savon sont ensuite utilis??s pour ??liminer le peroxyde sang trait??.
- Le Food and Drug Administration (FDA) a class?? peroxyde d'hydrog??ne comme une faible priorit?? de r??glementation (LRP) m??dicament pour utilisation dans le contr??le champignon sur les ??ufs de poissons et de poissons. (Voir ectoparasite.)
- Certains jardiniers et les utilisateurs de hydroponique pr??conisent l'utilisation de peroxyde d'hydrog??ne dans des solutions d'arrosage. Ils affirment que sa d??composition lib??re de l'oxyg??ne spontan??e qui am??liore le d??veloppement des racines d'une plante et aide ?? traiter pourriture des racines (cellulaire de mort racine en raison du manque d'oxyg??ne).
- Les tests de laboratoire effectu??s par les pisciculteurs au cours des derni??res ann??es ont d??montr?? que m??nage commun peroxyde d'hydrog??ne peut ??tre utilis?? en toute s??curit?? ?? fournir de l'oxyg??ne pour les petits poissons. Le peroxyde d'hydrog??ne par d??composition lib??re de l'oxyg??ne quand il est expos?? ?? des catalyseurs tels que le dioxyde de mangan??se.
- Le peroxyde d'hydrog??ne est un oxydant fort efficace dans le contr??le de sulfure et les odeurs li??es organiques dans les syst??mes de collecte et de traitement des eaux us??es. Il est g??n??ralement appliqu?? ?? un syst??me d'eaux us??es lorsqu'il existe un temps de r??tention de 30 minutes ?? 5 heures avant le sulfure d'hydrog??ne est lib??r??. Le peroxyde d'hydrog??ne oxyde le sulfure d'hydrog??ne et la promotion de la bio-oxydation d'odeurs organiques. Le peroxyde d'hydrog??ne se d??compose en oxyg??ne et en eau, en ajoutant de l'oxyg??ne dissous dans le syst??me annulant ainsi une certaine demande biologique en oxyg??ne (DBO).
- Le peroxyde d'hydrog??ne est utilis?? avec ester ph??nylique d'oxalate et d'une appropri??e teindre en b??tons lumineux comme un agent oxydant. Il r??agit avec l'ester pour former un CO 2 instable dim??re qui excite le colorant ?? une ??tat excit??; le colorant ??met un photon (lumi??re) quand il d??tend spontan??ment revenir ?? la ??tat fondamental.
Stockage
Les r??glementations varient, mais de faibles concentrations, comme 2,5% sont largement disponibles et l??gal d'acheter ?? usage m??dical. De petites quantit??s de nombreuses concentrations et qualit??s diff??rentes peuvent ??tre entrepos??es l??galement et sont utilis??s avec quelques r??glements.
Le peroxyde d'hydrog??ne doit ??tre stock?? dans un r??cipient fait d'un mat??riau qui ne r??agit pas avec et ne catalyse pas la d??composition. De nombreux mat??riaux et proc??d??s sont disponibles, certains aciers inoxydables, de nombreux plastiques, verres et certains alliages d'aluminium sont compatibles.
Le peroxyde est un oxydant puissant et doit ??tre stock?? loin des sources de carburant et les sources de contamination catalytique (voir section de d??composition ). Outre les risques d'incendie ??videntes, la vapeur de peroxyde peut r??agir avec les hydrocarbures et les alcools pour former des explosifs de contact. Puisque l'oxyg??ne est form?? lors de la d??composition du peroxyde naturel, l'augmentation r??sultante de pression peut provoquer un r??cipient (par exemple en verre), les bidons. Le peroxyde doit ??tre conserv?? au frais, sous forme de vapeur de peroxyde peut exploser au-dessus de 70 ?? C. D??c??s ont eu lieu du stockage dans des r??cipients mal ??tiquet??s en raison de sa similitude apparente ?? l'eau.
Utilisation comme carburant
H 2 O 2 peut ??tre utilis?? soit en tant que monopropellant (non m??lang?? avec le combustible) ou en tant que composant d'un oxydant bipropellant fus??e. Utilisation comme monopropellant profite de la d??composition de 70 ?? 98 +% de concentration du peroxyde d'hydrog??ne en vapeur d'eau et d'oxyg??ne. Le propulseur est pomp??e dans une chambre de r??action o?? un catalyseur, g??n??ralement un ??cran d'argent ou de platine, d??clenche la d??composition, produire de la vapeur ?? plus de 600 ?? C qui est expuls?? ?? travers un buse, de production pouss??e. H 2 O 2 produit un maximum monopropellant impulsion sp??cifique (I sp) de 161 s (1,6 kN / kg de la ??), qui en fait un monopropellant faible performance. Peroxyde g??n??re beaucoup moins pouss??e que toxique l'hydrazine, mais ne est pas toxique. Le Rocketbelt utilis?? peroxyde d'hydrog??ne monopropellant.
En bipropellant H 2 O 2 est d??compos?? pour br??ler un combustible comme oxydant. Impulsions sp??cifiques aussi ??lev??es que 350 s (3,5 kN ?? s / kg) peuvent ??tre atteints, selon le carburant. Peroxyde utilis?? comme comburant donne un je sp l??g??rement inf??rieur ?? celui de l'oxyg??ne liquide, mais est dense, stockable, non cryog??nique et peut ??tre plus facilement utilis??e pour actionner des turbines ?? gaz pour donner des pressions ??lev??es. Il peut ??galement ??tre utilis?? pour le refroidissement par r??cup??ration de moteurs de fus??e. Peroxyde a ??t?? utilis?? avec succ??s comme comburant dans les fus??es allemandes guerre mondiale-II (par exemple, T-Stoff pour la Me-163), et pour la britannique ?? bas prix Black Knight et Black Arrow lanceurs.
Dans les ann??es 1940 et 1950 les Walter turbine utilis?? peroxyde d'hydrog??ne utilis?? dans les sous-marins en plong??e; il se est r??v??l?? ??tre trop bruyant et n??cessitent trop d'entretien par rapport ?? syst??mes d'alimentation diesel-??lectrique. Certains torpilles utilis??es peroxyde d'hydrog??ne comme oxydant ou propulseur, mais ce ??tait dangereux et a ??t?? abandonn??e par la plupart marines. fuites de peroxyde d'hydrog??ne ont ??t?? bl??m??s pour les naufrages de HMS Sidon et de la Sous-marin russe Koursk. Il a ??t?? d??couvert, par exemple, par la marine japonaise dans les essais de torpilles, que la concentration de H 2 O 2 dans les virages ?? angle droit dans HTP tuyauterie peut souvent conduire ?? des explosions dans des sous-marins et de torpilles. Le peroxyde d'hydrog??ne est encore utilis??e sur Soyouz pour entra??ner des turbines ?? gaz de turbopompes de puissance, cependant. SAAB Underwater Systems est la fabrication du Torpedo 2000. Cette torpille, utilis?? par la marine su??doise, est aliment?? par un moteur ?? piston propuls?? par HTP comme oxydant et k??ros??ne comme combustible dans un syst??me de bipropellant.
Bien que rarement utilis?? aujourd'hui comme un monopropellant pour les gros moteurs, petite peroxyde d'hydrog??ne contr??le d'attitude propulseurs sont encore en usage sur certains satellites. Ils sont faciles ?? ??trangler, et plus s??r pour alimenter et g??rer avant le lancement de propulseurs ?? hydrazine. Cependant, hydrazine est plus souvent utilis?? dans les vaisseaux spatiaux en raison de son sup??rieur impulsion sp??cifique et baisse du taux de d??composition.
R??cemment H 2 O 2 / propyl??ne a ??t?? propos??e comme une approche peu co??teuse ??tape unique ?? l'orbite: un r??servoir de carburant propyl??ne contenant a une vessie flottant dans ce contenant H 2 O 2. Cette combinaison offre 15% sup??rieure Je sp O2 / RP4 (un le k??ros??ne utilis?? comme propergol), n'a pas besoin ou des turbines le stockage ou le mat??riel cryog??nique, et r??duit consid??rablement le co??t du servomoteur. Le potentiel de cette et d'autres syst??mes alternatifs est discut?? en d??tail Ing??nierie Dunn.
Usage th??rapeutique
Le peroxyde d'hydrog??ne est g??n??ralement reconnu comme s??r (GRAS) en tant que agent antimicrobien, un agent oxydant et ?? d'autres fins par le US Agence am??ricaine des produits alimentaires et m??dicaux.
Le peroxyde d'hydrog??ne a ??t?? utilis??e en tant que agent antiseptique et anti-bact??rienne pendant de nombreuses ann??es en raison de son effet oxydant. Bien que son utilisation a diminu?? au cours des derni??res ann??es avec la popularit?? de mieux sentir et plus facilement disponible sur les produits en vente libre, il est encore utilis?? par de nombreux h??pitaux, les m??decins et les dentistes dans la st??rilisation, le nettoyage et le traitement de tout, des sols ?? proc??dures de canal.
- Comme beaucoup d'antiseptiques oxydatives, de l'hydrog??ne perioxide cause des dommages l??gers ?? tissu dans des plaies ouvertes, mais il est ??galement efficace pour arr??ter rapidement saignement capillaire (lent suintement de sang de petits vaisseaux dans abrasions), et est parfois utilis?? avec parcimonie ?? cet effet, ainsi que le nettoyage .
- Le peroxyde d'hydrog??ne peut ??tre utilis?? comme une p??te dentifrice en m??lange avec des quantit??s correctes de bicarbonate de soude et le sel.
- Le peroxyde d'hydrog??ne et peroxyde de benzoyle sont parfois utilis??s pour traiter l'acn?? .
- Le peroxyde d'hydrog??ne est utilis?? en tant que ??m??tique dans la pratique v??t??rinaire.
- utilisations ??alternatives??
- Certaines personnes ont essay?? d'utiliser du peroxyde comme un traitement pour le cancer. Le American Cancer Society d??clare qu '??il ne existe aucune preuve scientifique que le peroxyde d'hydrog??ne est un traitement du cancer s??re, efficace ou utile", et conseille les patients canc??reux ?? "rester dans les soins de m??decins qualifi??s qui utilisent des m??thodes ??prouv??es de traitement et approuv?? les essais cliniques de prometteuse de nouveaux traitements. "
- Une autre proc??dure alternative m??dicale controvers??e est inhalation de peroxyde d'hydrog??ne ?? une concentration d'environ 1%. Utilisation interne de peroxyde d'hydrog??ne a une histoire de causer fatal troubles sanguins, et sa derni??re utilisation comme traitement th??rapeutique a ??t?? li??e ?? plusieurs d??c??s .
Propri??t??s physiques
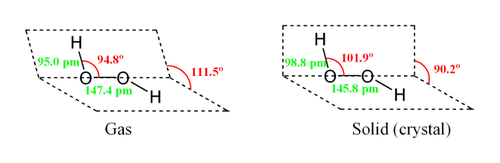
Tandis que le conform??re contre minimiserait r??pulsions st??riques, un angle de torsion de 90 ?? permettrait d'optimiser le m??lange entre le type-p rempli orbital de l'oxyg??ne (l'un des doublets libres) et le LUMO du obligataire vicinal OH. Refl??tant un compromis entre les deux interactions, gazeux et du peroxyde d'hydrog??ne liquide adopte une anticlinal forme "biais??e". Cette conformation de rotation est un compromis entre l'anticorps anti conformateur, ce qui minimiserait r??pulsion st??rique, et entre le conform??re syn qui associe liaisons OH avec doublets libres sur les atomes d'oxyg??ne. Malgr?? le fait que la liaison OO est une simple liaison, la mol??cule a une barri??re remarquablement ??lev??e pour achever la rotation de 29,45 kJ / mol (par rapport ?? 12,5 kJ / mol pour la barri??re de rotation de l'??thane ). La barri??re augmentation est ??galement attribuable ?? la r??pulsion entre une paire unique et d'autres paires libres. Le angles de liaison sont affect??s par une liaison hydrog??ne, ce qui est en rapport avec la diff??rence de structure entre gazeux et formes cristallines; en effet une large gamme de valeurs est vu dans les cristaux contenant du H 2 O 2 mol??culaire.
Propri??t??s chimiques
H 2 O 2 est l'un des oxydants les plus puissants connus - plus fort que le chlore , le dioxyde de chlore, et le permanganate de potassium . En outre, par catalyse, H 2 O 2 peut ??tre converti en radicaux hydroxyles (.OH) avec une r??activit?? secondes seulement fluor.
| Oxydant | potentiel d'oxydation, V |
|---|---|
| Fluor | 3.0 |
| Radical hydroxyle | 2,8 |
| Ozone | 2.1 |
| Le peroxyde d'hydrog??ne | 1,8 |
| Le permanganate de potassium | 1,7 |
| Le dioxyde de chlore | 1,5 |
| Chlore | 1.4 |
Le peroxyde d'hydrog??ne peuvent se d??composer spontan??ment dans l'eau et de l'oxyg??ne. Il se agit g??n??ralement comme un agent oxydant, mais il existe de nombreuses r??actions o?? il agit comme un agent r??ducteur, lib??rant de l'oxyg??ne en tant que sous-produit.
Il forme ??galement facilement ?? la fois organique et inorganique peroxydes.
D??composition
Le peroxyde d'hydrog??ne se d??compose toujours (dismute) exothermique dans l'eau et de l'oxyg??ne gazeux spontan??ment:
- 2 H 2 O 2 → 2 H 2 O + O 2
Ce processus est tr??s favorable; il a un Δ H o de -98,2 kJ ?? mol -1 et un Δ G o de -119,2 kJ ?? mol -1 et une ΔS de 70,5 J ?? mol -1 ?? K -1. La vitesse de d??composition d??pend de la temp??rature et la concentration du peroxyde, ainsi que la le pH et la pr??sence d'impuret??s ou des stabilisants. Le peroxyde d'hydrog??ne est incompatible avec de nombreuses substances qui catalysent la d??composition, y compris la plupart des m??taux de transition et leurs compos??s. Catalyseurs communs incluent le dioxyde de mangan??se et d'argent . La m??me r??action est catalys??e par la enzyme catalase, trouv?? dans le foie, dont la fonction principale dans le corps est l'??limination des sous-produits toxiques de m??tabolisme et la r??duction de la le stress oxydatif. La d??composition se produit plus rapidement dans alcalin, de sorte que l'acide est souvent ajout?? comme stabilisant.
La lib??ration de l'oxyg??ne et de l'??nergie dans la d??composition a des effets secondaires dangereux. Renverser haute peroxyde de concentration sur une substance inflammable peut causer un feu imm??diat, qui est en outre aliment??e par l'oxyg??ne lib??r?? par la d??composition du peroxyde d'hydrog??ne. Peroxyde haute r??sistance (??galement appel?? peroxyde haute test ou HTP) doit ??tre conserv??e dans un r??cipient a??r?? appropri?? pour emp??cher l'accumulation de gaz d'oxyg??ne, ce qui serait contraire conduire ?? la rupture ??ventuelle du r??cipient.
En pr??sence de certains catalyseurs, tels que Fe 2+ ou Ti 3+, la d??composition peut prendre un autre chemin, avec des radicaux libres, tels que HO ?? ( hydroxyle) et HOO ?? sont form??es. Une combinaison de H 2 O 2 et de Fe 2+ est connu comme Le r??actif de Fenton.
Une concentration commun pour le peroxyde d'hydrog??ne est "20 volume", ce qui signifie que, lorsque 1 volume de peroxyde d'hydrog??ne est d??compos??, il produit 20 volumes d'oxyg??ne. Un 20 "volume" concentration de peroxyde d'hydrog??ne est ??quivalente ?? 1,67 mole / dm 3 ( Solution molaire), soit environ 6%.
Le peroxyde d'hydrog??ne est disponible dans les pharmacies est la solution de trois pour cent. Dans de telles faibles concentrations, il est moins stable et se d??compose rapidement. Il est g??n??ralement stabilis?? avec ac??tanilide, une substance qui a des effets secondaires toxiques en quantit??s importantes.
Les r??actions d'oxydor??duction
En solution aqueuse, le peroxyde d'hydrog??ne peut se oxyder ou r??duire une vari??t?? d'ions inorganiques. Quand il agit comme un agent r??ducteur, de l'oxyg??ne gazeux est ??galement produite. Dans l'acide solution Fe 2+ est oxyd?? en Fe 3+,
- 2 Fe 2+ (aq) + H 2 O 2 + 2 H + (aq) → 2 Fe 3+ (aq) + 2H 2 O (l)
et sulfite (SO 3 2-) est oxyd?? en sulfate (SO 4 2-). Cependant, le permanganate de potassium est r??duit en Mn 2+ par H 2 O 2 acide. Sous conditions alcalines, cependant, certaines de ces r??actions inverser; par exemple, Mn 2+ est oxyd?? en Mn 4+ (comme MnO 2).
Un autre exemple de peroxyde d'hydrog??ne agissant comme un agent r??ducteur est la r??action avec l'hypochlorite de sodium, ce est un proc??d?? commode de pr??paration d' oxyg??ne dans le laboratoire.
- NaOCl + H 2 O 2 → S + 2 NaCl + H 2 O
Le peroxyde d'hydrog??ne est souvent utilis?? comme un agent d'oxydation en chimie organique. Une application est pour l'oxydation de thio??thers ?? sulfoxydes. Par exemple, m??thyle ph??nyl sulfure est oxyd?? en sulfoxyde de m??thyle ph??nyle avec un rendement de 99% dans le methanol en 18 heures (ou 20 minutes en utilisant un Catalyseur TiCl3):
- Ph-S-CH 3 + H 2 O → 2 Ph-S (O) -CH 3 + H 2 O
Alcaline de peroxyde d'hydrog??ne est utilis?? pour ??poxydation des alc??nes d??ficients en ??lectrons, tels que les acides acryliques, ainsi que pour l'oxydation de alkylboranes aux alcools , la seconde ??tape consistant ?? hydroboration-oxydation.
La formation de compos??s peroxyd??s
Le peroxyde d'hydrog??ne est un acide faible, et il peut former hydroperoxyde ou peroxyde des sels ou des d??riv??s de nombreux m??taux.
Par exemple, lors de l'addition ?? une solution aqueuse de l'acide chromique (CrO 3) ou des solutions acides de sels dichromate, il formera un peroxyde bleu CrO instable (O 2) 2. En solution aqueuse, il se d??compose rapidement pour former de l'oxyg??ne gazeux et des sels de chrome.
Il peut ??galement produire peroxoanions par r??action avec anions ; par exemple, la r??action avec borax conduit ?? perborate de sodium, un agent de blanchiment utilis?? dans les d??tergents ?? lessive:
- Na 2 B 4 O 7 + 4 H 2 O 2 + 2 NaOH → 2 Na 2 B 2 O 4 (OH) 4 + H 2 O
H 2 O 2 convertit les acides carboxyliques (RCOOH) en acides peroxyd??s (RCOOOH), qui sont eux-m??mes utilis??s comme agents oxydants. Le peroxyde d'hydrog??ne r??agit avec l'ac??tone pour former le peroxyde d'ac??tone, et elle interagit avec l'ozone pour former le trioxyde d'hydrog??ne. La r??action avec l' ur??e produit peroxyde de carbamide, utilis?? pour le blanchiment des dents. Une addition d'acide-base avec l'oxyde de triph??nylphosphine est un "support" utile pour H 2 O 2 dans certaines r??actions.
Le peroxyde d'hydrog??ne r??agit avec l' ozone pour former Trioxyde d'hydrog??ne.
Alcalinit??
Le peroxyde d'hydrog??ne est beaucoup plus faible la base que l'eau, mais il peut encore former des adduits avec des acides tr??s forts. Le superacide HF / SBF cinq formes compos??s instables contenant le [H 3 O 2] + ions.
Fabrication
Le peroxyde d'hydrog??ne est fabriqu?? aujourd'hui presque exclusivement par le l'auto-oxydation de 2-??thyl-9,10-dihydroxyanthrac??ne (C 16 H 14 O 2) de la 2-??thylanthraquinone (C 16 H 12 O 2) et du peroxyde d'hydrog??ne en utilisant l'oxyg??ne de l'air.

Dans cette r??action, les groupes hydroxy sur le cycle milieu de anthrac??ne sont d??proton?? et sont transform??s en c??tones , tandis que deux doubles liaisons sont perdues de l'anneau interm??diaire et sont remplac??s = O doubles liaisons dans les groupes c??tone C. Le d??riv?? de l'anthraquinone est alors extrait et r??duites en le compos?? dihydroxy utilisant l'hydrog??ne gazeux en pr??sence d'un m??tal catalyseur . L'??quation g??n??rale du processus est trompeusement simple:
- H 2 + O 2 → H 2 O 2
Cependant, les aspects ??conomiques du proc??d?? d??pendent de recyclage efficace de la quinone et des solvants d'extraction, et du hydrog??nation catalytique .
Anciennement processus inorganiques ont ??t?? utilis??s, en utilisant la ??lectrolyse d'une solution aqueuse d' acide sulfurique ou acide le bisulfate d'ammonium (NH 4 HSO 4), suivie par hydrolyse du peroxydisulfate ((SO 4) 2) 2-, qui est form??e.
En 1994, la production mondiale de H 2 O 2 ??tait d'environ 1,9 millions tonnes et ont augment?? ?? 2,2 millions en 2006, dont la plupart ??tait ?? une concentration de 70% ou moins. En cette ann??e en vrac 30% H 2 O 2 vendu pour environ US $ 0,54 par kg , soit l'??quivalent de 1,50 $ par kg (0,68 US $ par lb) sur une "base de 100%".
Concentration
Le peroxyde d'hydrog??ne fonctionne mieux comme propulseur dans extr??mement ??lev?? concentrations-- environ plus de 70%. Bien que ne importe quelle concentration de peroxyde va g??n??rer un peu de gaz chaud (vapeur d'eau plus un peu d'oxyg??ne), ?? des concentrations sup??rieures ?? environ 67%, la chaleur de d??composer le peroxyde d'hydrog??ne devient suffisamment grande pour vaporiser compl??tement la totalit?? du liquide ?? la temp??rature normale. Cela repr??sente un point tournant la s??curit?? et l'utilisation, car la d??composition de toute concentration sup??rieure ?? ce montant est capable de transformer le liquide enti??rement ?? gaz chauff?? (plus la concentration, le plus chaud le gaz r??sultant). Ce m??lange tr??s chaud vapeur / oxyg??ne peut alors ??tre utilis?? pour g??n??rer une pouss??e maximale, puissance, ou de travail, mais elle rend aussi la d??composition de la mati??re explosive beaucoup plus dangereux.
Des concentrations normales de qualit?? propulseur varie donc de 70 ?? 98%, avec les qualit??s courantes de 70, 85, 90 et 98%. Beaucoup de ces qualit??s et variantes sont d??crits en d??tail dans les ??tats-Unis num??ro de sp??cification de propergol MIL-P-16005 F r??vision, ce qui est actuellement disponible. Les fournisseurs disponibles concentration ??lev??e de qualit?? propulseur peroxyde d'hydrog??ne sont g??n??ralement l'une des grandes soci??t??s commerciales qui rendent d'autres qualit??s de peroxyde d'hydrog??ne; y compris Solvay Interox, FMC, Degussa et Peroxyde Propulsion. D'autres soci??t??s qui ont fait grade propulseur peroxyde d'hydrog??ne dans un pass?? r??cent comprennent Air Liquide et DuPont. DuPont a r??cemment vendu son entreprise de fabrication de peroxyde d'hydrog??ne ?? Degussa.
Propulseur peroxyde d'hydrog??ne de qualit?? est disponible ?? des acheteurs qualifi??s. Typiquement ce produit chimique est vendu seulement aux soci??t??s commerciales ou des institutions gouvernementales qui ont la capacit?? de g??rer et d'utiliser le mat??riel correctement. Les non-professionnels ont achet?? 70% ou plus faible concentration de peroxyde d'hydrog??ne (les 30% restant est de l'eau avec des traces d'impuret??s et de mati??res de stabilisation, tels que des sels d'??tain, les phosphates, les nitrates, et d'autres additifs chimiques), et une augmentation de sa concentration eux-m??mes. Beaucoup d'amateurs tentent distillation , mais ce est extr??mement dangereux avec du peroxyde d'hydrog??ne; vapeur de peroxyde peut se enflammer ou exploser en fonction de combinaisons sp??cifiques de temp??rature et de pression. En g??n??ral, ne importe quel point d'??bullition de masse haute concentration de peroxyde d'hydrog??ne ?? la pression ambiante va produire de la vapeur de peroxyde d'hydrog??ne en phase qui peut exploser. Ce risque est att??nu??, mais pas enti??rement ??limin?? avec distillation sous vide. D'autres approches pour la concentration de peroxyde d'hydrog??ne sont barbotage et cristallisation fractionn??e.
Forte concentration de peroxyde d'hydrog??ne est facilement disponible dans 70, 90, et 98% des concentrations dans les tailles de 1 gallon, 30 gallons, et les volumes de camion-citerne en vrac. Propulseur de qualit?? peroxyde d'hydrog??ne est utilis?? sur les syst??mes militaires actuelles et est dans les programmes de recherche et d??veloppement pour la d??fense et l'a??rospatiale nombreux. Beaucoup de soci??t??s de roquettes financement priv?? utilisent le peroxyde d'hydrog??ne, notamment Blue Origin, et certains groupes amateurs ont exprim?? leur int??r??t dans la fabrication de leur propre peroxyde, pour leur utilisation et ?? vendre de petites quantit??s d'autres.
Risques
Le peroxyde d'hydrog??ne, soit sous forme pure ou dilu??e, peut pr??senter plusieurs risques:
- Au-dessus d'environ 10% les concentrations, le peroxyde d'hydrog??ne peuvent d??gager des vapeurs qui peuvent exploser au-dessus de 50 ?? C (158 ?? F) ?? la pression atmosph??rique normale. Ceci peut alors provoquer une explosion de vapeur liquide bouillant expansion ( BLEVE) du liquide restant. La distillation de peroxyde d'hydrog??ne ?? des pressions normales est donc tr??s dangereux.
- vapeurs de peroxyde d'hydrog??ne peuvent former explosifs de contact sensibles avec des hydrocarbures tels que des graisses. R??actions dangereuses allant de l'allumage ?? explosion ont ??t?? rapport??s avec des alcools , des c??tones , des acides carboxyliques (en particulier l'acide ac??tique ), des amines et de phosphore . Le dicton est ??peroxydes tuent Pharmacies '.
- Le peroxyde d'hydrog??ne, en cas de d??versement sur les v??tements (ou d'autres mat??riaux inflammables), sera pr??f??rentiellement ??vaporer l'eau jusqu'?? ce que la concentration atteint une r??sistance suffisante, puis des v??tements se enflammer spontan??ment. ;
- Peroxyde d'hydrog??ne concentr?? (> 50%) est corrosif, et m??me des solutions int??rieur-r??sistance peut provoquer une irritation des yeux, muqueuses et la peau. L'ingestion de solutions de peroxyde d'hydrog??ne est particuli??rement dangereux, comme dans l'estomac d??composition lib??re des quantit??s importantes de gaz (10 fois le volume d'une solution ?? 3%) conduisant ?? une h??morragie interne. L'inhalation de plus de 10% peut provoquer une irritation pulmonaire grave.
- De faibles concentrations de peroxyde d'hydrog??ne, de l'ordre de 3% ou moins, seront chimiquement blanchir de nombreux types de v??tements il entre en contact avec une teinte ros??tre. Il faut ??tre prudent lors de l'utilisation des produits courants qui peuvent contenir du peroxyde d'hydrog??ne, comme nettoyant du visage ou de la solution pour lentilles de contact, qui Splatter facilement sur d'autres surfaces.
Le peroxyde d'hydrog??ne est produite naturellement en tant que sous-produit du m??tabolisme de l'oxyg??ne, et pratiquement tous les organismes poss??dent des enzymes appel??es les peroxydases, qui se d??compose en apparence inoffensive catalytique de faibles concentrations de peroxyde d'hydrog??ne en eau et oxyg??ne (voir la d??composition ci-dessus).
Lors d'un incident, plusieurs personnes ont ??t?? bless??es apr??s un d??versement de peroxyde d'hydrog??ne ?? bord Vol Northwest Airlines 957 parce qu'ils ont confondu pour l'eau.
Pendant la Seconde Guerre mondiale certains camps d'extermination tu??s exp??rimentalement les gens avec des injections de peroxyde d'hydrog??ne.
Le peroxyde d'hydrog??ne a ??galement fait partie des ingr??dients dans les bombes du m??tro de Londres Juillet 21, 2005, qui ne ont pas explos??.
Une MSDS contiendra plus d'informations sur les risques du travail avec ce produit chimique.

