
Acide carboxylique
Contexte des ??coles Wikip??dia
Enfants SOS offrent un chargement complet de la s??lection pour les ??coles pour une utilisation sur les intranets des ??coles. Une bonne fa??on d'aider d'autres enfants est de parrainer un enfant

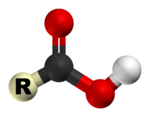
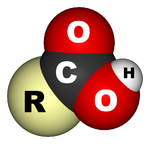
Les acides carboxyliques sont des acides organiques caract??ris??s par la pr??sence d'un groupe carboxyle , qui a la formule -C (= O) OH, -COOH habituellement ??crit ou -CO 2 H. Les acides carboxyliques sont Acides de Br??nsted-Lowry - ils sont donneurs de protons. Les sels et les anions d'acides carboxyliques sont appel??s carboxylates.
Le plus simple de la s??rie des acides carboxyliques sont les acides alcano??ques, R-COOH, o?? R est un atome d'hydrog??ne ou un groupe alkyle groupe. Les compos??s peuvent aussi avoir deux ou plusieurs groupes acide carboxylique par mol??cule.
Propri??t??s physiques
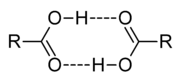
Les acides carboxyliques sont polaire, et la forme des liaisons hydrog??ne entre eux. A des temp??ratures ??lev??es, en phase vapeur, les acides carboxyliques existent habituellement sous forme de paires dim??res. Des acides carboxyliques inf??rieurs (1 ?? 4 carbones) sont de miscible ?? l'eau, tandis que les acides carboxyliques sup??rieurs sont beaucoup moins solubles en raison de la nature hydrophobe de plus en plus de la cha??ne alkyle. Ils ont tendance ?? ??tre assez soluble dans des solvants moins polaires comme les ??thers et les alcools.
Les acides carboxyliques sont largement r??pandus dans la nature et sont typiquement acides faibles, ce qui signifie qu'ils seulement partiellement dissocier en H + cations et RCOO - anions dans aqueuse solution. Par exemple, ?? la temp??rature ambiante, seulement 0,02% des acides ac??tiques mol??cules sont dissoci??es dans l'eau.
??tant donn?? que les acides carboxyliques sont des acides faibles, dans l'eau, les deux formes existent dans un ??quilibre:
- RCOOH ↔ RCOO - + H +
L'acidit?? des acides carboxyliques peut se expliquer soit par la stabilit?? de l'acide ou de la stabilit?? de la de base conjugu?? ?? l'aide effets inductifs ou des effets de r??sonance.
Stabilit?? de l'acide
Utilisation des effets inductifs, l'acidit?? des acides carboxyliques peut ??tre rationalis??e par les deux ??lectron??gatifs oxyg??ne atomes de distorsion les nuages d'??lectrons entourant la liaison OH, l'affaiblissant. La faible liaison OH provoque la mol??cule d'acide pour ??tre moins stable, et l'origine de l'atome d'hydrog??ne labile pour ??tre, donc il se dissocie facilement pour donner l'ion H +. Depuis l'acide est instable, l' ??quilibre se situera sur la droite.
D'autres atomes ou groupes ??lectron??gatifs, tels que le chlore ou un groupe hydroxyle, substitu??s sur le groupe R ont un semblable, quoique moindre effet. La pr??sence de ces groupes augmente l'acidit?? par effets inductifs. Par exemple, l'acide trichloroac??tique (trois groupes -Cl) est un acide plus fort que l'acide lactique (un groupe -OH), qui ?? son tour est plus fort que l'acide ac??tique (pas de constituant ??lectron??gatif).
Stabilit?? de la base conjugu??e
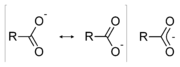
L'acidit?? d'un acide carboxylique peut aussi se expliquer par des effets de r??sonance. Le r??sultat de la dissociation d'un acide carboxylique est un produit stabilis?? par r??sonance dans laquelle la charge n??gative est partag??e (d??localis??) entre les deux atomes d'oxyg??ne. Chacune des liaisons carbone-oxyg??ne a ce qu'on appelle une caract??ristique partielle double liaison. ??tant donn?? que la base conjugu??e est stabilis??e, l'??quilibre ci-dessus se trouve sur la droite.
Spectroscopie
Les acides carboxyliques sont plus facilement identifi??es comme telles par spectrom??trie infrarouge. Ils pr??sentent une forte ??tirement C = O ?? entre 1680 et 1725 cm -1, et le tron??on caract??ristique OH du groupe carboxyle appara??t comme un pic large dans les 2500 ?? 3000 cm -1 r??gion.
Dans une H spectrom??trie RMN, l'hydrog??ne hydroxyle appara??t dans la zone de 10 ?? 13 ppm, mais il est souvent soit ??largi ou non respect??e par ??change avec des traces d'eau.
Synth??se
- Les acides carboxyliques peuvent ??tre pr??par??s par oxydation des alcools primaires et ald??hydes avec des oxydants forts tels que Bichromate de potassium, Le r??actif de Jones, le permanganate de potassium , ou le chlorite de sodium.
- Ils peuvent ??galement ??tre produits par le clivage oxydant d' ol??fines par le permanganate de potassium ou le dichromate de potassium. En particulier, ne importe quel groupe alkyle sur un noyau benz??nique sera enti??rement oxyd?? en un acide carboxylique, ind??pendamment de sa longueur de cha??ne. Ce est la base pour la synth??se industrielle de l'acide benzo??que ?? partir de tolu??ne .
- Les acides carboxyliques peuvent ??tre ??galement obtenues par hydrolyse de des nitriles, des esters, ou des amides, avec l'addition d'acide ou de base.
- Ils peuvent ??galement ??tre pr??par??s ?? partir de l'action d'un R??actif de Grignard sur le dioxyde de carbone , bien que cette m??thode ne est pas utilis??e dans l'industrie.
Les acides carboxyliques peuvent ??galement se former ?? partir des r??actions suivantes:
- Dismutation d'un ald??hyde en R??action de Cannizzaro
- R??am??nagement des dic??tones dans le benzilic r??arrangement acide
- L'halog??nation suivie d'une hydrolyse des c??tones m??thyliques de la r??action haloforme
- L'hydroformylation d'un alc??ne suivie d'une hydrolyse en le R??action de Koch
- R??actions moins communes impliquant la g??n??ration d'acides benzo??que sont les von Richter r??action de nitrobenz??nes et la R??action de Kolbe-Schmitt ?? partir de ph??nols .
R??actions
- Les acides carboxyliques r??agissent avec des bases pour former des sels de carboxylate, dans lequel l'hydrog??ne du groupe hydroxyle (-OH) est remplac?? par un m??tal cationique . Ainsi, l'acide ac??tique pr??sent dans le vinaigre r??agit avec bicarbonate de sodium (bicarbonate de sodium) pour former de l'ac??tate de sodium, le dioxyde de carbone et de l'eau:
- CH 3 COOH + NaHCO 3 → CH 3 COONa + CO 2 + H 2 O
- Les acides carboxyliques r??agissent ??galement avec des alcools et des amines pour donner esters et amides. Comme d'autres alcools et des ph??nols , le groupe hydroxyle d'acides carboxyliques peut ??tre remplac?? par un atome de chlore en utilisant le chlorure de thionyle pour donner des chlorures d'acyle.
- Comme avec tous les compos??s carbonyl??s, les protons sur la α-carbone sont labiles en raison de c??to-??nol tautom??risation. Ainsi, l'α-carbone est facilement halog??n?? dans le Hell-Volhard halog??nation-Zelinsky.
- Le Arndt-Eistert synth??se ins??re un groupe α-m??thyl??ne en un acide carboxylique.
- Le Un r??arrangement de Curtius convertit les acides carboxyliques ?? isocyanates.
- Le R??action de Schmidt convertit les acides carboxyliques ?? des amines .
- Les acides carboxyliques sont d??carboxyl??s en HUNSDIECKER r??action.
- Le R??action de Dakin-West convertit un acide amin?? ?? l'extr??mit?? amino-c??tone correspondante.
- Dans la d??gradation Barbier-Wieland (1912), le groupe alpha-m??thyl??ne dans un acide carboxylique aliphatique est ??limin?? dans une s??quence d'??tapes de r??action, de mani??re efficace une cha??ne grasse.
- L'addition d'un groupe carboxyle en un compos?? qui est connu comme carboxylation; l'enl??vement de decarboxylation est une. Les enzymes qui catalysent ces r??actions sont connues sous le nom (carboxylases EC 6.4.1) et d??carboxylases (CE 4.1.1).
Nomenclature et exemples
Le anion carboxylate R-COO - est g??n??ralement nomm?? avec le -ate suffixe, l'acide ac??tique afin, par exemple, devient un ion ac??tate. Dans la nomenclature IUPAC , les acides carboxyliques ont un suffixe d'acide -oic (par exemple, l'acide octad??cano??que). En nomenclature commune, le suffixe est habituellement de l'acide -ic (par exemple, acide st??arique).
| Les atomes de carbone | Nom commun | Nom IUPAC | Formule chimique | L'emplacement ou l'utilisation commune |
|---|---|---|---|---|
| 1 | L'acide formique | L'acide formique | HCOOH | Les piq??res d'insectes |
| 2 | Acide ac??tique | Acide ac??tique | CH 3 COOH | Vinaigre |
| 3 | L'acide propionique | Propano??que | CH 3 CH 2 COOH | |
| 4 | L'acide butyrique | Butano??que | CH 3 (CH 2) 2 COOH | Beurre rance |
| 5 | L'acide val??rique | Pentano??que | CH 3 (CH 2) 3 COOH | |
| 6 | Capro??que | Hexano??que | CH 3 (CH 2) 4 COOH | |
| 7 | L'acide ??nanthique | Heptano??que | CH 3 (CH 2) 5 COOH | |
| 8 | L'acide caprylique | Acide octano??que | CH 3 (CH 2) 6 COOH | |
| 9 | L'acide p??largonique | L'acide nonano??que | CH 3 (CH 2) 7 COOH | |
| 10 | L'acide caprique | L'acide d??cano??que | CH 3 (CH 2) 8 COOH | |
| 12 | L'acide laurique | L'acide dod??cano??que | CH 3 (CH 2) 10 COOH | Huile de noix de coco |
| 16 | L'acide palmitique | L'acide hexad??cano??que | CH 3 (CH 2) 14 COOH | |
| 18 | Acide st??arique | L'acide st??arique | CH 3 (CH 2) 16 COOH |
D'autres acides carboxyliques comprennent:
- ?? cha??ne courte acides monocarboxyliques insatur??s
- L'acide acrylique (acide 2-propano??que) - CH 2 = CHCOOH, utilis?? dans la synth??se de polym??res
- Les acides gras - moyenne ?? longue cha??ne satur??s et acides monocarboxyliques insatur??s, ?? nombre pair d'atomes de carbone
- L'acide docosahexa??no??que - suppl??ment nutritionnel
- L'acide eicosapenta??no??que - suppl??ment nutritionnel
- Les acides amin??s - les blocs de construction de prot??ines
- C??toacides - acides d'importance biochimique qui contiennent une c??tone groupe
- L'acide pyruvique
- Acide ac??toac??tique
- Les acides carboxyliques aromatiques
- L'acide benzo??que - C 6 H 5 COOH; le benzoate de sodium, le sel de sodium de l'acide benzo??que est utilis?? comme conservateur alimentaire
- L'acide salicylique - dans de nombreux produits de soins de la peau
- Les acides dicarboxyliques - contenant deux groupes carboxyle
- Acide aldarique - une famille d'acides de sucre
- L'acide oxalique - dans de nombreux aliments
- L'acide malonique
- L'acide malique - trouve dans les pommes
- L'acide succinique - un composant de la cycle de l'acide citrique
- L'acide glutarique
- L'acide adipique - le monom??re utilis?? pour produire nylon
- - Acides tricarboxyliques contenant trois groupes carboxyle
- L'acide citrique - trouv?? dans les agrumes
- Acides alpha hydroxy - contenant un groupe hydroxy
- L'acide lactique (acide 2-hydroxypropano??que) - pr??sent dans le lait aigre

