
Le dioxyde de carbone
Contexte des ??coles Wikip??dia
Les articles de cette s??lection ??coles ont ??t?? organis??s par sujet du programme d'??tudes gr??ce aux b??n??voles d'enfants SOS. Cliquez ici pour plus d'informations sur les enfants SOS.
| Le dioxyde de carbone | |
|---|---|
 | |
 | |
Le dioxyde de carbone | |
Autres noms Gaz acide carbonique; anhydride carbonique; glace s??che (solide) | |
| Identificateurs | |
| Num??ro CAS | 124-38-9 |
| PubChem | 280 |
| Num??ro CE | 204-696-9 |
| Num??ro RTECS | FF6400000 |
| images de Jmol-3D | Image 1 |
|
SMILES
| |
InChI
| |
| Propri??t??s | |
| Formule mol??culaire | CO 2 |
| Masse molaire | 44,0095 (14) g / mol |
| Apparence | gaz incolore |
| Densit?? | 1600 g / L, solide; 1,98 g / L, le gaz |
| Point de fusion | -57 ?? C (216 K) (sous pression) |
| Point d'??bullition | -78 ?? C (195 K), ( sublime) |
| Solubilit?? dans l'eau | 1,45 g / L |
| Acidit?? (p K a) | 6,35 et 10,33 |
| Viscosit?? | 0,07 c P ?? -78 ?? C |
| Moment de dip??le | z??ro |
| Structure | |
| Forme mol??culaire | lin??aire |
| Des compos??s apparent??s | |
| Connexe oxydes | monoxyde de carbone ; sous-oxyde de carbone; monoxyde de dicarbon; trioxyde de carbone |
| Page de donn??es suppl??mentaire | |
| Structure et propri??t??s | n, ε r, etc. |
| Thermodynamique donn??es | comportement de phase Solide, liquide, gaz |
| Les donn??es spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
Le dioxyde de carbone ( formule chimique : CO 2) est un compos?? chimique constitu?? de deux oxyg??ne atomes li?? de fa??on covalente ?? un seul carbone atomique. Il se agit d'un gaz ?? temp??rature et pression normales et existe dans l'atmosph??re terrestre dans cet ??tat. Il est actuellement ?? une concentration moyenne mondiale d'environ 383 ppm par le volume dans l'atmosph??re de la terre, bien que cela varie ?? la fois selon le lieu et l'heure. Le dioxyde de carbone est un important gaz ?? effet de serre parce qu'il transmet la lumi??re visible mais absorbe fortement dans la infrarouge.
Le dioxyde de carbone est produit par tous les animaux, les plantes, les champignons et les micro-organismes pendant respiration et est utilis?? par les plantes lors de la photosynth??se . Il se agit de faire des sucres qui peuvent ??tre consomm??s soit ?? nouveau dans la respiration ou utilis??s comme mati??re premi??re pour la croissance des plantes. Il est, par cons??quent, une composante majeure de la cycle du carbone. Le dioxyde de carbone est g??n??r?? comme sous-produit de la combustion de combustibles fossiles ou de mati??res v??g??tales, parmi d'autres proc??d??s chimiques. inorganique est le dioxyde de carbone en sortie volcans et autres les processus g??othermiques tels que sources chaudes.
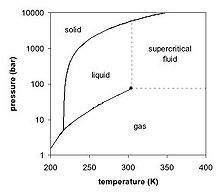
Le dioxyde de carbone n'a pas d'??tat liquide ?? des pressions inf??rieures ?? 5,1 atm, mais est un solide ?? des temp??ratures inf??rieures ?? -78 ?? C. A l'??tat solide, le dioxyde de carbone est commun??ment appel?? glace s??che .
Le CO 2 est un oxyde acide: une solution aqueuse devient d??cisif du bleu au rose.
Propri??t??s chimiques et physiques
Le dioxyde de carbone est un gaz incolore et inodore. Lorsqu'il est inhal?? ?? des concentrations beaucoup plus ??lev??es que les niveaux atmosph??riques habituels, il peut produire un go??t amer dans la bouche et une sensation de br??lure dans le nez et la gorge. Ces effets r??sultent de la dissolution du gaz dans le muqueuses et salive, formant une solution faible de l'acide carbonique. Cette sensation peut ??galement se produire lors d'une tentative d'??touffer un rot apr??s avoir bu une boisson gazeuse. Les montants ci-dessus 5 000 ppm sont consid??r??es comme tr??s malsain, et ceux-dessus d'environ 50 000 ppm (??gale ?? 5% en volume) sont consid??r??s comme dangereux pour la vie animale.
?? temp??rature et pression standard, la densit?? de dioxyde de carbone est d'environ 1,98 kg / m??, soit environ 1,5 fois celle de l'air . La mol??cule de dioxyde de carbone (O = C = O) contient deux doubles liaisons et a une forme lin??aire. Il n'a pas ??lectrique dip??le, et comme il est pleinement oxyd??, il est mod??r??ment r??actif et est ininflammable, mais supporte la combustion des m??taux tels que le magn??sium .
 |
 |
A -78,51 ?? C ou -109,3 ?? F, le dioxyde de carbone passe directement d'une phase solide ?? une phase gazeuse par sublimation, ou ?? partir gazeux ?? solide ?? travers d??p??t. Dioxyde de carbone solide est normalement appel?? ?? glace s??che ??, un marque g??n??rique. Il a ??t?? observ?? pour la premi??re en 1825 par le chimiste fran??ais Charles Thilorier. La glace s??che est couramment utilis?? comme agent de refroidissement, et il est relativement peu co??teux. Une propri??t?? commode ?? cet effet est que se sublime de dioxyde de carbone solides directement dans la phase gazeuse ne laissant aucun liquide. Il peut souvent ??tre trouv??es dans les ??piceries et les laboratoires, et il est ??galement utilis?? dans l'industrie du transport maritime. Le plus grand usage non-refroidissement de la glace s??che est d??capage.
Liquide forme de dioxyde de carbone ?? seulement des pressions sup??rieures ?? 5,1 atm; la triple point de dioxyde de carbone est d'environ 518 kPa ?? -56,6 ?? C (voir diagramme de phase, ci-dessus). Le point critique est 7,38 MPa ?? 31,1 ?? C.
Une autre forme de dioxyde de carbone solide, un est possible verre amorphe forme, mais pas ?? la pression atmosph??rique. Cette forme de verre, appel?? Carbonia, a ??t?? produit par surfusion CO 2 chauff??e ?? une pression extr??me (40-48 Ou GPa environ 400 000 atmosph??res) dans un enclume diamant. Cette d??couverte confirme la th??orie que le dioxyde de carbone pourrait exister dans un ??tat de verre semblable ?? d'autres membres de sa famille ??l??mentaire, comme le silicium ( en verre de silice ) et le germanium . Contrairement silice et Germanie verres, cependant, le verre de Carbonia ne est pas stable ?? des pressions normales et revient ?? gaz lorsque la pression est rel??ch??e.
Histoire de la compr??hension humaine
Le dioxyde de carbone a ??t?? un des premiers gaz d'??tre d??crit comme une substance distincte de l'air. Au XVIIe si??cle, le Chimiste flamand Jean-Baptiste Van Helmont observ?? que quand il a br??l?? charbon de bois dans un r??cipient ferm??, la masse de la cendre r??sultant ??tait bien inf??rieure ?? celle du charbon actif d'origine. Son interpr??tation est que le reste du charbon avait ??t?? transmu?? en une substance invisible qu'il a appel?? un ??gaz?? ou ??esprit sauvage" (spiritus sylvestre).
Les propri??t??s du dioxyde de carbone ont ??t?? ??tudi??s de mani??re plus approfondie dans les ann??es 1750 par le m??decin ??cossais Joseph Black. Il a constat?? que calcaire ( carbonate de calcium ) peut ??tre chauff??e ou trait??e avec des acides pour donner un gaz qu'il appelle ??air fixe??. Il a observ?? que l'air fixe ??tait plus dense que l'air et ne supportaient ni flamme ou la vie animale. Il a ??galement constat?? que lorsque barbotage ?? travers une solution aqueuse de chaux ( l'hydroxyde de calcium), il serait pr??cipiter le carbonate de calcium. Il a utilis?? pour illustrer ce ph??nom??ne que le dioxyde de carbone est produit par la respiration des animaux et la fermentation microbienne. En 1772, chimiste anglais Joseph Priestley a publi?? un document intitul?? Impr??gnation eau avec l'air fixe dans lequel il d??crit un processus de gouttes d'acide sulfurique (ou huile de vitriol que Priestley savait) sur la craie pour produire du dioxyde de carbone, et en for??ant le gaz ?? dissoudre en agitant un bol de l'eau en contact avec le gaz.
Le dioxyde de carbone a ??t?? liqu??fi?? (?? des pressions ??lev??es) en 1823 par Humphry Davy et Michael Faraday . La premi??re description de dioxyde de carbone solide a ??t?? donn??e par Charles Thilorier, qui en 1834 a ouvert un r??cipient sous pression de dioxyde de carbone liquide, seulement pour trouver que le refroidissement produite par l'??vaporation rapide du liquide a donn?? une ??neige?? de CO 2 solide.
Isolement
Le dioxyde de carbone peut ??tre obtenu ?? partir de l'air distillation . Toutefois, on obtient de tr??s faibles quantit??s de CO 2. Une grande vari??t?? de r??actions chimiques donn?? dioxyde de carbone, telle que la r??action entre la plupart des acides et de la plupart des carbonates de m??taux. Par exemple, la r??action entre l'acide sulfurique et du carbonate de calcium (calcaire ou la craie) est repr??sent??e ci-dessous:
- H 2 SO 4 + CaCO 3 → CaSO 4 + H 2 CO 3
Le H 2 CO 3 se d??compose ensuite ?? l'eau et de CO 2. De telles r??actions se accompagnent de la formation de mousse ou des bulles, ou les deux. Dans l'industrie, ces r??actions sont r??pandus parce qu'ils peuvent ??tre utilis??s pour neutraliser les acides courants de d??chets.
La production de la chaux vive (CaO) un produit chimique qui a une large utilisation, de calcaire par chauffage ?? environ 850 ?? C produit aussi CO 2:
- CaCO 3 → CaO + CO 2
Le la combustion de tout le carbone de combustibles, tels que le m??thane ( gaz naturel ), distillats de p??trole ( essence, diesel, le k??ros??ne, le propane ), mais ??galement du charbon et le bois, produiront du dioxyde de carbone et, dans la plupart des cas, de l'eau. A titre d'exemple la r??action chimique entre le m??thane et l'oxyg??ne est donn??e ci-dessous.
- CH 4 + 2 O 2 → CO 2 + 2 H 2 O
Fer ?? repasser est r??duit ?? partir de ses oxydes avec coke dans un haut-fourneau, la production fonte et dioxyde de carbone:
- 2 Fe 2 O 3 + 3 C → 4 Fe + 3 CO 2
Levure m??tabolise le sucre pour produire du dioxyde de carbone et d' ??thanol , aussi connu comme l'alcool, dans la production de vins, bi??res et autres spiritueux:
- C 6 H 12 O 6 → CO 2 + 2 2 C 2 H 5 OH
Tous organismes a??robies produisent du CO 2 quand ils se oxydent les glucides , les acides gras et les prot??ines dans les mitochondries des cellules. Le grand nombre de r??actions impliqu??es sont extr??mement complexes et ne d??crit facilement. Faire r??f??rence ?? ( respiration cellulaire, respiration ana??robie et la photosynth??se ). Photoautotrophes (centrales, cyanobact??ries) utiliser un autre modus operandi: Les plantes absorbent le CO 2 de l'air, et, avec de l'eau, r??agissent pour former des glucides:
- n CO 2 + n H 2 O → (CH 2 O) n + 2 n O
Le dioxyde de carbone est soluble dans l'eau, dans laquelle il interconvertit spontan??ment entre le CO 2 et H 2 CO 3 ( l'acide carbonique). Les concentrations relatives de CO 2, H 2 CO 3, et la forme d??proton??e HCO -
3 ( bicarbonate) et CO 2
3 ( carbonate ) d??pendent de la pH. Dans l'eau neutre ou l??g??rement alcalin (pH> 6,5), les pr??domine forme de bicarbonate (> 50%) de devenir le plus fr??quent (> 95%) au pH de l'eau de mer, tandis que dans l'eau tr??s alcalin (pH> 10,4) pr??dominant (> 50%) sous forme est le carbonate. Les formes de bicarbonate et de carbonate sont tr??s solubles, tels que l'eau de l'oc??an air ??quilibr??e (pH l??g??rement alcalin avec typique = 8.2 ?? 8.5) contient environ 120 mg de bicarbonate par litre.
La production industrielle
Le dioxyde de carbone est fabriqu?? principalement de six processus:
- Comme un sous-produit de l'ammoniac et d'hydrog??ne plantes, o?? le m??thane est converti en CO 2;
- De la combustion de bois et de combustibles fossiles ;
- En tant que sous-produit de fermentation de sucre dans le brassage de la bi??re , le whisky et d'autres alcooliques boissons ;
- De la d??composition thermique de pierre ?? chaux, du CaCO 3, pour la fabrication de chaux, CaO;
- En tant que sous-produit de fabrication de phosphate de sodium;
- Directement ?? partir de dioxyde de carbone naturel ressorts, o?? il est produit par l'action de l'eau acidifi??e ?? calcaire ou dolomite.
Utilisations

Le dioxyde de carbone est utilis?? par l'industrie alimentaire, l'industrie p??troli??re et l'industrie chimique. Il est utilis?? dans de nombreux produits de consommation n??cessitant un gaz sous pression, car il est peu co??teux et non inflammable, et parce qu'il subit une transition de phase de gaz ?? liquide ?? la temp??rature ambiante sous une pression d'environ 60 r??alisable bar (870 psi, 59 atm), ce qui permet beaucoup plus de dioxyde de carbone pour se adapter dans un conteneur donn?? que le contraire serait. Les gilets de sauvetage contiennent souvent des bo??tes de dioxyde de carbone sous pression de l'inflation rapide. capsules en aluminium sont ??galement vendus comme des fournitures de gaz comprim?? pour carabines ?? air comprim??, marqueurs de paintball, pour gonfler les pneus de v??lo, et pour faire Seltz. Vaporisation rapide de dioxyde de carbone liquide est utilis?? pour le sautage dans les mines de charbon. De fortes concentrations de dioxyde de carbone peuvent ??galement ??tre utilis??s pour tuer les parasites, tels que la Mite commune.
Le dioxyde de carbone est utilis?? pour produire gazeuses boissons gazeuses et eau gazeuse. Traditionnellement, la carbonatation de la bi??re et du vin mousseux vient par fermentation naturelle, mais certains fabricants carbonate ces boissons artificiellement. Un bonbon appel?? Pop Rocks est mis sous pression avec du gaz de dioxyde de carbone ?? environ 40 bars (600 psi). Lorsqu'il est plac?? dans la bouche, il se dissout (tout comme d'autres bonbons durs) et lib??re des bulles de gaz avec un pop audible.
Agents levants produisent du dioxyde de carbone pour provoquer lever la p??te. La levure de boulanger produit du dioxyde de carbone par fermentation de sucres ?? l'int??rieur de la p??te, tout en levures chimiques chimiques tels que poudre ?? p??te et bicarbonate de soude de dioxyde de carbone de presse lorsque chauff??s ou expos??s ?? des acides .

Le dioxyde de carbone est le gaz le plus couramment utilis?? comprim?? pour les syst??mes pneumatiques et des outils de pression portables robots de combat.
Le dioxyde de carbone ??teint les flammes, et certains extincteurs, en particulier ceux con??us pour les feux ??lectriques, contiennent du dioxyde de carbone liquide sous pression. Le dioxyde de carbone trouve ??galement une utilisation comme une atmosph??re de soudage , bien que dans l'arc de soudage, il r??agit ?? oxyder la plupart des m??taux. Utilisation dans l'industrie automobile est commun en d??pit des preuves significatives que soudures r??alis??es dans le dioxyde de carbone sont brittler que ceux r??alis??s dans des atmosph??res inertes, et que ces joints de soudure se d??gradent au fil du temps en raison de la formation d'acide carbonique. Il est utilis?? en tant que gaz de soudage, principalement parce qu'il est beaucoup moins cher que des gaz inertes tels que l' argon ou l'h??lium .
Le dioxyde de carbone liquide est un bon solvant pour beaucoup lipophiles compos??s organiques , et est utilis?? pour retirer la caf??ine du caf?? . Tout d'abord, les grains de caf?? verts sont tremp??s dans l'eau. Les f??ves sont plac??s dans le haut d'une colonne de soixante-dix pieds (21 m??tres) de haut. Le fluide de dioxyde de carbone ?? environ 93 ?? C entre par le bas de la colonne. La caf??ine diffuse hors des grains et dans le dioxyde de carbone.
Le dioxyde de carbone a commenc?? ?? attirer l'attention de la solvants industries pharmaceutiques et autre traitement chimique comme une alternative moins toxique pour les plus traditionnels tels que organochlor??s. Il est utilis?? par certains nettoyeurs ?? sec pour cette raison. (Voir la chimie verte.)
Les plantes ont besoin de dioxyde de carbone pour effectuer la photosynth??se , et les serres peuvent enrichir leurs atmosph??res avec du CO 2 suppl??mentaires pour stimuler la croissance de la plante, depuis sa concentration en basse atmosph??re actuelle est juste au-dessus de la "suffocation" niveau pour plantes vertes. Une photosynth??se Connexes chute de la concentration de dioxyde de carbone dans un compartiment de serre peut tuer les plantes vertes. A des concentrations ??lev??es, le dioxyde de carbone est toxique pour la vie animale, augmentant ainsi la concentration de 10 000 ppm (1%) pendant plusieurs heures peut ??liminer les organismes nuisibles tels que aleurodes et t??tranyques dans une serre.
Il a ??t?? propos?? que le dioxyde de carbone provenant de la production d'??nergie est mis ?? barboter dans des ??tangs ?? cultiver des algues qui pourraient ensuite ??tre converti en biodiesel carburant. En m??decine, jusqu'?? 5% de dioxyde de carbone pur est ajout?? ?? l'oxyg??ne pour la stimulation de la respiration apr??s apn??e et ?? stabiliser l'??quilibre O 2 / CO 2 dans le sang.
Un type courant de gaz industriel laser est le laser ?? dioxyde de carbone.
Le dioxyde de carbone peut ??galement ??tre combin?? avec l'oxyde de limon??ne pelures d'orange ou autres des ??poxydes pour cr??er des polym??res et des plastiques.
Le dioxyde de carbone est utilis?? dans la r??cup??ration assist??e du p??trole o?? il est inject?? dans ou adjacent ?? la production de puits de p??trole, habituellement sous des conditions supercritiques. Il se agit ?? la fois comme un agent sous pression et, lorsqu'il est dissous dans la clandestinit?? p??trole brut , r??duit consid??rablement sa viscosit??, permettant ?? l'huile de se ??couler plus rapidement ?? travers la terre ?? l'??limination ainsi. Dans les champs p??troliers matures, de vastes r??seaux de tuyauterie sont utilis??s pour transporter le dioxyde de carbone pour les points d'injection.
Dans l'industrie chimique, le dioxyde de carbone est utilis?? pour la production d' ur??e , les carbonates et bicarbonates, et le salicylate de sodium.
Le liquide et le dioxyde de carbone solide sont importants r??frig??rants, en particulier dans l'industrie alimentaire, o?? ils sont employ??s pendant le transport et le stockage de cr??me glac??e et d'autres aliments congel??s. Dioxyde de carbone solide est appel??e ??glace s??che?? et est utilis?? pour les petites exp??ditions o?? l'??quipement de r??frig??ration ne est pas pratique.
Le dioxyde de carbone liquide (industrie nomenclature R744 / R-744) a ??t?? utilis?? comme r??frig??rant avant la d??couverte de R-12 et est susceptible de profiter d'une renaissance en raison de pr??occupations environnementales. Ses propri??t??s physiques sont tr??s favorables pour le refroidissement, la r??frig??ration et le chauffage, ayant une capacit?? de refroidissement volum??trique ??lev??. En raison de son fonctionnement ?? des pressions allant jusqu'?? 130 bars, CO 2 syst??mes n??cessitent des composants tr??s r??sistants qui ont d??j?? ??t?? mis au point pour la production en s??rie dans de nombreux secteurs. Dans la climatisation automobile, dans plus de 90% de toutes les conditions de conduite, R744 fonctionne plus efficacement que les syst??mes utilisant R-134a. Ses avantages environnementaux ( GWP de 1, non la couche d'ozone, non-toxique, non inflammable) pourrait rendre l'avenir fluide de travail pour remplacer les HFC dans les voitures actuelles, supermarch??s, chaudes pompes ?? chaleur de l'eau, entre autres. Certaines applications: Coca-Cola a d??p??ch?? CO 2 ?? base de refroidisseurs de boissons et de la L'arm??e am??ricaine se int??resse ?? CO 2 de r??frig??ration et de chauffage.
?? la fin de 2007, on pr??voit que le secteur automobile mondial pour d??cider de la prochaine g??n??ration de r??frig??rant dans la climatisation automobile. CO 2 est une option discut??e. (Voir La guerre Cool)
Dans l'atmosph??re de la Terre
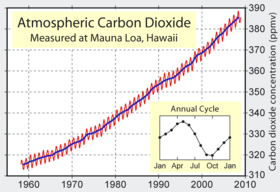
Le dioxyde de carbone dans l'atmosph??re de la terre est consid??r??e comme un gaz de trace qui se d??roulent actuellement ?? une concentration moyenne d'environ 385 parties par million en volume ou 582 parties par million en masse. La masse de l' atmosph??re terrestre est de 5,14 ?? 10 18 kg, de sorte que la masse totale de dioxyde de carbone dans l'atmosph??re est de 3,0 ?? 10 15 kg (3,000 gigatonnes). Sa concentration varie selon les saisons (voir graphique ?? droite) et aussi consid??rablement sur une base r??gionale: dans les zones urbaines, il est g??n??ralement plus ??lev?? et ?? l'int??rieur, il peut atteindre 10 fois la concentration de fond atmosph??rique.
Le dioxyde de carbone est un gaz ?? effet de serre ; voir l'effet de serre pour plus.
En raison d'activit??s humaines telles que la combustion de combustibles fossiles et la d??forestation, la concentration de dioxyde de carbone dans l'atmosph??re a augment?? d'environ 35% depuis le d??but de l' ??re de l'industrialisation . En 1999, 2244804000 tonnes de CO 2 ont ??t?? produites aux Etats-Unis en raison de la production d'??nergie ??lectrique. Ce est un taux de 0,6083 kg (1,341 livres) par kWh de sortie.
Il ya cinq 100.000.000 ann??es dioxyde de carbone ??tait 20 fois plus ??lev??e qu'aujourd'hui, diminuant ?? 4-5 fois au cours de la Jurassic p??riode, puis maintenu un lent d??clin jusqu'?? ce que la r??volution industrielle , avec une r??duction particuli??rement rapide survenant il ya 49 millions d'ann??es.
Jusqu'?? 40% des gaz ??mis par certains volcans pendant suba??rien ??ruptions volcaniques est le dioxyde de carbone. Selon les meilleures estimations, les volcans lib??rent environ 130 ?? 230.000.000 tonnes (145 ?? 255.000.000 tonnes) de CO 2 dans l'atmosph??re chaque ann??e. Le dioxyde de carbone est ??galement produite par des sources chaudes telles que celles sur le site Bossoleto pr??s de Rapolano Terme en Toscane, Italie. Ici, dans une d??pression en forme de bol d'environ 100 m de diam??tre, les concentrations locales de CO 2 mont??e ?? plus de 75% du jour au lendemain, suffisante pour tuer les insectes et les petits animaux, mais chaleureux rapidement lorsque ensoleill??e et se dispersent par convection pendant la journ??e concentrations localement ??lev??es de CO 2, produite par la perturbation de l'eau profonde du lac satur?? de CO 2 on pense qu'ils ont caus?? 37 morts au Lac Monoun, Cameroun en 1984 et 1700 bless??s au lac Nyos au Cameroun en 1986. Toutefois, les ??missions de CO 2 par les activit??s humaines sont actuellement plus de 130 fois sup??rieure ?? la quantit?? ??mise par les volcans, se ??levant ?? environ 27 milliards de tonnes par an (30 milliard de tonnes).
Dans les oc??ans
Il est environ 50 fois plus de carbone dissous dans les oc??ans sous forme de CO 2 et de CO 2 des produits d'hydratation comme il en existe dans l'atmosph??re. Les oc??ans agissent comme un ??norme puits de carbone, ayant "absorb?? environ un tiers de toutes les ??missions humaines de CO 2 g??n??r?? ?? ce jour." En g??n??ral, la solubilit?? des gaz diminue ?? mesure que la temp??rature de l'eau augmente. En cons??quence dioxyde de carbone est lib??r?? de l'eau de mer dans l'atmosph??re que les temp??ratures de l'oc??an augmentent.
R??le biologique
Le dioxyde de carbone est un produit final dans les organismes qui obtiennent l'??nergie de d??composition des sucres, des graisses et des acides amin??s avec l'oxyg??ne dans le cadre de leur m??tabolisme, dans un processus connu sous le nom respiration cellulaire. Cela comprend toutes les plantes, les animaux, de nombreux champignons et certaines bact??ries. Chez les animaux sup??rieurs, le dioxyde de carbone circule dans le sang ?? partir des tissus du corps dans les poumons o?? il est exhal??. Dans les installations qui utilisent la photosynth??se, le dioxyde de carbone est absorb?? ?? partir de l'atmosph??re.
R??le dans la photosynth??se
Les plantes absorbent le dioxyde de carbone de l'atmosph??re par la photosynth??se, aussi appel?? l'assimilation du carbone, qui utilise l'??nergie lumineuse pour produire des mati??res v??g??tales organiques en combinant du dioxyde de carbone et eau. L'oxyg??ne libre est lib??r?? sous forme de gaz provenant de la d??composition des mol??cules d'eau, tandis que l'hydrog??ne est s??par?? en ses protons et d'??lectrons et utilis?? pour produire de l'??nergie chimique par photophosphorylation. Cette ??nergie est requise pour la fixation du dioxyde de carbone dans le Cycle de Calvin pour former des sucres. Ces sucres peuvent ensuite ??tre utilis??s pour la croissance ?? l'int??rieur de la plante par la respiration.
M??me lorsque ventil??, dioxyde de carbone doit ??tre introduite dans les serres de maintenir la croissance des plantes, comme la concentration de dioxyde de carbone peut tomber pendant la journ??e ?? aussi peu que 200 ppm (une limite de C3 fixation du carbone photosynth??se). Les plantes peuvent potentiellement atteindre jusqu'?? 50 pour cent plus rapide ?? des concentrations de 1000 ppm de CO 2 par rapport aux conditions ambiantes.
Plantes ??mettent ??galement CO 2 lors de la respiration, de sorte que ce ne est que pendant les phases de croissance que les plantes sont absorbeurs nets. Par exemple, une for??t en croissance va absorber beaucoup de tonnes de CO 2 chaque ann??e, mais une for??t mature produira autant de CO 2 provenant de la respiration et de la d??composition des sp??cimens morts (par exemple, les branches tomb??es) utilis?? dans biosynth??se chez les plantes en croissance. Ind??pendamment de cela, les for??ts matures sont toujours valables puits de carbone, en aidant ?? maintenir l'??quilibre dans l'atmosph??re de la Terre. En outre, et ce est essentiel ?? la vie sur terre, la photosynth??se du phytoplancton absorbe le CO 2 dissous dans l'oc??an sup??rieur et favorise ainsi l'absorption de CO 2 de l'atmosph??re.
Toxicit??
la teneur en dioxyde de carbone dans l'air frais varie entre 0,03% (300 ppm) et 0,06% (600 ppm), en fonction de l'emplacement (voir la carte graphique de CO 2 en temps r??el).
L'air expir?? d'une personne est d'environ 4,5% de dioxyde de carbone en volume.
Il est dangereux en cas d'inhalation dans des concentrations ??lev??es (sup??rieures ?? 5% en volume, ou 50 000 ppm). La valeur limite de courant de seuil (TLV) ou le niveau maximal qui est consid??r?? comme s??r pour les adultes en bonne sant?? pour une journ??e de travail de huit heures est de 0,5% (5000 ppm). Le niveau de s??curit?? maximal pour les nourrissons, les enfants, les personnes ??g??es et les personnes avec des probl??mes de sant?? cardio-pulmonaire est significativement moins.
Ces chiffres sont valables pour le dioxyde de carbone pur. Dans les espaces int??rieurs occup??s par des personnes de la concentration de dioxyde de carbone atteindra des niveaux plus ??lev??s que dans l'air ext??rieur pur. Des concentrations sup??rieures ?? 1000 ppm provoquent une g??ne dans plus de 20% des occupants, et l'inconfort augmentera avec l'augmentation de la concentration de CO 2. La g??ne est caus??e par divers gaz issus de la respiration et de la transpiration humaine, et non par CO 2 lui-m??me. ?? 2000 ppm, la majorit?? des occupants se sentiront un degr?? significatif d'inconfort, et beaucoup d??veloppera des naus??es et des maux de t??te. La concentration de CO 2 entre 300 et 2500 ppm est utilis??e comme un indicateur de la qualit?? de l'air int??rieur.
La toxicit?? aigu?? de dioxyde de carbone est parfois appel?? par les noms donn??s aux mineurs par: blackdamp (??galement appel?? starter humide ou Stythe). Les mineurs seraient tenter de se alerter ?? des niveaux dangereux de dioxyde de carbone dans un puits de mine en apportant un canari en cage avec eux comme ils ont travaill??. Le canari in??vitablement mourir avant CO 2 atteint des niveaux toxiques pour les gens. Le dioxyde de carbone a caus?? une grande perte de vie au lac Nyos au Cameroun en 1986, quand une remont??e de CO 2 -laden eau du lac rapidement recouvert une grande zone peupl??e environnante .. Le dioxyde de carbone plus lourd forc??s de quitter l'oxyg??ne de survie pr??s de la surface, tuant pr??s de deux mille personnes.
Les niveaux de dioxyde de carbone (ppm CDPL) sont un substitut pour mesurer les polluants int??rieurs qui peuvent causer des occupants de cro??tre somnolence, des maux de t??te, ou de la fonction ?? des niveaux d'activit?? inf??rieurs. Pour ??liminer la majeure Plaintes de qualit?? de l'air int??rieur, CDPL totale int??rieure doivent ??tre r??duits ?? 600 ci-dessous. NIOSH consid??re que les concentrations de l'air int??rieur qui d??passent 1000 sont un marqueur sugg??rant une ventilation inad??quate. ASHRAE recommande qu'ils ne d??passent pas 1000 dans un espace. OSHA limite concentrations dans le milieu de travail pour 5000 pour des p??riodes prolong??es. L'Institut national am??ricain pour la s??curit?? et la sant?? au travail limite de br??ves expositions (jusqu'?? dix minutes) ?? 30 000 et consid??re CDPL d??passant 40 000 comme " danger imm??diat pour la vie et la sant??. "Les gens qui respirent 50000 pour plus d'une demi-heure de show signes de aigu?? hypercapnie, tout en respirant 70 000 - 100 000 peut produire une perte de conscience en seulement quelques minutes. En cons??quence, le dioxyde de carbone, soit sous forme de gaz ou de la glace s??che, doivent ??tre manipul??s seulement dans des zones bien ventil??es.
La physiologie humaine
CO 2 est transport?? dans le sang de trois mani??res diff??rentes. (Les pourcentages exacts varient selon qu'il se agisse de sang art??riel ou veineux).
- La majeure partie (environ 70% - 80%) est converti en ions bicarbonates HCO 3 - par l'enzyme anhydrase carbonique dans les cellules rouges du sang, par r??action de CO 2 + H 2 O → H 2 CO 3 → H + + HCO 3 -.
- 5% - 10% est dissous dans le plasma
- 5% - 10% est li?? ?? comme l'h??moglobine compos??s carbamino
Le CO 2 li?? ?? l'h??moglobine ne se lie pas au m??me site que l'oxyg??ne. Au lieu de cela, il se combine avec les groupes N-terminaux sur les quatre cha??nes de globine. Toutefois, en raison de des effets allost??riques sur la mol??cule d'h??moglobine, la fixation de CO 2 diminue la quantit?? d'oxyg??ne qui est li?? ?? une pression partielle donn??e d'oxyg??ne.
L'h??moglobine, la principale mol??cule de transport de l'oxyg??ne dans les globules rouges, peuvent transporter l'oxyg??ne et le dioxyde de carbone, bien que de fa??on tr??s diff??rente. La diminution de la fixation de dioxyde de carbone dans le sang en raison de l'augmentation des niveaux d'oxyg??ne est connu comme le Haldane effet et il est important dans le transport de dioxyde de carbone des tissus vers les poumons. A l'inverse, une augmentation de la pression partielle de CO 2 ou un pH inf??rieur provoqueront le d??chargement de l'oxyg??ne de l'h??moglobine. Ceci est connu comme la Effet Bohr.
Le dioxyde de carbone peut ??tre l'un des m??diateurs de locaux autor??gulation de l'approvisionnement en sang. Si ses niveaux sont ??lev??s, le capillaires se dilatent pour permettre un ??coulement de sang sup??rieure ?? celle du tissu.
Ions bicarbonates sont essentielles pour r??glementer le pH du sang. Le taux de respiration d'une personne influence le niveau de CO 2 dans le sang. Respirer ce est trop lente ou peu profonde peut causer acidose respiratoire, tout en respirant qui est trop rapide peut conduire ?? hyperventilation, ce qui peut causer alcalose respiratoire.
Bien que le corps a besoin d'oxyg??ne pour le m??tabolisme, de faibles niveaux d'oxyg??ne ne stimulent pas la respiration. Plut??t, la respiration est stimul??e par les niveaux de dioxyde de carbone plus ??lev??s. En cons??quence, respirer de l'air ?? basse pression ou un m??lange de gaz sans oxyg??ne ?? tous (comme l'azote pur) peut conduire ?? une perte de conscience. Cela est particuli??rement p??rilleux pour haute altitude pilotes de chasse. Ce est aussi pourquoi les agents de bord instruisent passagers, en cas de perte de pression dans la cabine, ?? appliquer le masque ?? oxyg??ne avant de se aider les autres - sinon on risque de perte de connaissance sans ??tre conscient du p??ril imminent.
Selon une ??tude r??alis??e par le D??partement de l'Agriculture des ??tats-Unis, la respiration d'une personne moyenne g??n??re environ 450 litres (environ 900 grammes) de dioxyde de carbone par jour.

