gaz ?? effet de serre
Saviez-vous ...
Les articles de cette s??lection ??coles ont ??t?? organis??s par sujet du programme d'??tudes gr??ce aux b??n??voles d'enfants SOS. Pour comparer les organismes de bienfaisance de parrainage ce est le meilleur lien de parrainage .
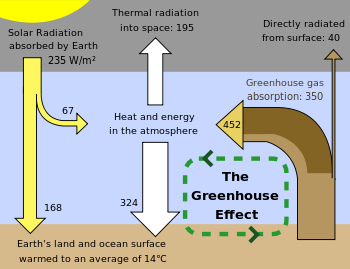
Un gaz ?? effet de serre (GES parfois abr??g??) est un gaz dans une atmosph??re qui absorbe et ??met un rayonnement ?? l'int??rieur de la domaine de l'infrarouge thermique. Ce processus est la cause fondamentale de l' effet de serre . Les effet primaire des gaz dans l' atmosph??re terrestre sont la vapeur d'eau , dioxyde de carbone , m??thane , l'oxyde nitreux et l'ozone . Dans le syst??me solaire , les atmosph??res de V??nus, Mars, et Titan contient aussi des gaz qui causent l'effet de serre. gaz ?? effet de serre affectent grandement la temp??rature de la Terre ; sans eux, la surface de la Terre serait en moyenne d'environ 33 ?? C plus froid que la moyenne actuelle de 14 ?? C (57 ?? F).
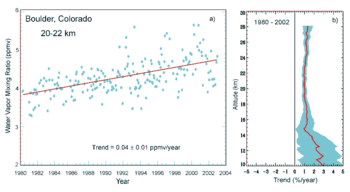
Depuis le d??but de la r??volution industrielle , la combustion de combustibles fossiles a contribu?? ?? une augmentation de 40% de la concentration de dioxyde de carbone dans l'atmosph??re de 280 ppm ?? 397 ppm, en d??pit de l'absorption d'une grande partie des ??missions de divers "puits" naturels impliqu??s dans la cycle du carbone. Dioxyde de carbone anthropique (CO 2) (ie, les ??missions produites par les activit??s humaines) proviennent de de combustion combustibles ?? base de carbone, principalement le bois , le charbon , l'huile et le gaz naturel .
Gaz dans l'atmosph??re de la Terre
gaz ?? effet de serre
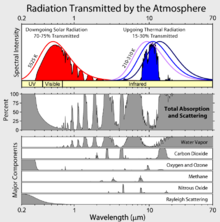
gaz ?? effet de serre sont ceux qui peuvent absorber et ??mettre un rayonnement infrarouge, mais pas le rayonnement dans ou pr??s du spectre visible. Dans l'ordre, l'effet de serre les plus abondants dans l'atmosph??re terrestre sont:
- la vapeur d'eau (H 2 O)
- dioxyde de carbone (CO 2)
- le m??thane (CH 4)
- l'oxyde nitreux (N 2 O)
- l'ozone (O 3)
Les concentrations atmosph??riques de gaz ?? effet de serre sont d??termin??es par l'??quilibre entre les sources (??missions de gaz provenant des activit??s humaines et des syst??mes naturels) et les puits (l'enl??vement du gaz de l'atmosph??re par conversion en un compos?? chimique diff??rente). La proportion restante d'une ??mission dans l'atmosph??re apr??s un temps sp??cifi?? est " Fraction Airborne "(AF). Plus pr??cis??ment, l'AF est le rapport annuel de l'augmentation atmosph??rique dans une ann??e donn??e aux ??missions totales de cette ann??e. Pour l'AF CO 2 au cours des 50 derni??res ann??es (1956-2006) a augment?? ?? 0,25 ?? 0,21% / an.
Non-effet de serre
Bien que contribuant ?? de nombreuses autres r??actions physiques et chimiques, les principaux constituants de l'atmosph??re, l'azote (N 2), l'oxyg??ne (O 2), et de l'argon (Ar), ne sont pas l'effet de serre. C'est parce que des mol??cules contenant deux atomes d'un m??me ??l??ment tel que le N 2 et O 2 et mol??cules monoatomiques tels que l'argon (Ar) ont aucun changement net dans leur moment de dip??le quand ils vibrent et sont donc presque totalement affect?? par rayonnement infrarouge. Bien que les mol??cules contenant deux atomes de diff??rents ??l??ments tels que le monoxyde de carbone (CO) ou chlorure d'hydrog??ne (HCl) absorbe IR, ces mol??cules sont de courte dur??e dans l'atmosph??re en raison de leur r??activit?? et la solubilit??. Parce qu'ils ne contribuent pas de mani??re significative ?? l'effet de serre, ils sont g??n??ralement omis lors de l'examen ?? effet de serre.
Effets radiatifs indirects
Certains gaz ont des effets radiatifs indirects (si oui ou non ils sont eux-m??mes un gaz ?? effet de serre). Cela se produit de deux mani??res principales. Une fa??on est que quand ils se d??composent dans l'atmosph??re qu'ils produisent un autre gaz ?? effet de serre. Par exemple le m??thane et le monoxyde de carbone (CO) sont oxyd??s pour donner du dioxyde de carbone (et l'oxydation du m??thane produit ??galement de la vapeur d'eau, qui seront consid??r??s ci-dessous). Oxydation du CO en CO 2 produit directement clairement une augmentation du for??age radiatif bien que la raison est subtile. Le pic de l'??mission infrarouge thermique de la surface de la Terre est tr??s proche d'une forte bande d'absorption vibrationnelle de CO 2 (667 cm -1). D'autre part, la bande de vibration unique de CO ne absorbe IR des fr??quences beaucoup plus ??lev??es (2145 cm -1), o?? l'??mission thermique ~ 300K de la surface est au moins un facteur de dix plus faible. D'autre part, l'oxydation du m??thane en CO 2 qui n??cessite des r??actions avec le radical OH, produit une r??duction imm??diate, puisque le CO 2 est un gaz ?? effet de serre plus faible que le m??thane; mais il a une dur??e de vie plus longue. Comme d??crit ci-dessous ce ne est pas toute l'histoire, depuis les oxydations de CO et de CH 4 sont ??troitement li??s par les deux radicaux OH consommateurs. Dans tous les cas, le calcul de l'effet radiatif total doit inclure ?? la fois la force directe et indirecte.
Un deuxi??me type d'effets indirects qui se passe quand des r??actions chimiques dans l'atmosph??re impliquant ces gaz changent les concentrations de gaz ?? effet de serre. Par exemple, la destruction de compos??s de m??thane non organiques volatils (COVNM) dans l'atmosph??re peuvent produire de l'ozone. La taille de l'effet indirect peut d??pendre fortement de o?? et quand le gaz est ??mis.
Le m??thane a un certain nombre d'effets indirects, en plus de la formation de CO 2. Tout d'abord, le principal produit chimique qui d??truit le m??thane dans l'atmosph??re est la radical hydroxyle (OH). Le m??thane r??agit avec OH et un moyen de plus de m??thane afin que la concentration de OH descend. En effet, le m??thane augmente sa propre dur??e de vie atmosph??rique et donc son effet radiatif global. Le second effet est que l'oxydation du m??thane peut produire de l'ozone. En troisi??me lieu, ainsi que de faire CO 2 l'oxydation du m??thane produit de l'eau; ce est une source importante de vapeur d'eau dans la stratosph??re qui est par ailleurs tr??s sec. CO et COVNM produisent ??galement du CO 2 quand ils sont oxyd??s. Ils ??liminent OH de l'atmosph??re, ce qui conduit ?? de plus fortes concentrations de m??thane. L'effet surprenant, ce est que le potentiel de r??chauffement plan??taire de CO est trois fois celui du CO 2. Le m??me processus qui convertit COVNM en dioxyde de carbone peut ??galement conduire ?? la formation d'ozone troposph??rique. Halocarbures ont un effet indirect, car ils d??truisent l'ozone stratosph??rique. Enfin hydrog??ne peut conduire ?? la production d'ozone et CH 4 augmente ainsi que la production de vapeur d'eau dans la stratosph??re.
Contribution de nuages ?? l'effet de serre de la Terre
Le principal contributeur non-gaz ?? l'effet de serre de la Terre, nuages, aussi absorbent et ??mettent un rayonnement infrarouge et donc avoir un effet sur les propri??t??s radiatives des GES. Les nuages sont des gouttelettes d'eau ou cristaux de glace en suspension dans l'atmosph??re.
Impacts sur l'effet de serre global
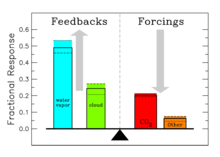
La contribution de chaque gaz ?? l'effet de serre est affect??e par les caract??ristiques de ce gaz, son abondance, et les effets indirects qu'il peut causer. Par exemple, sur un kg pour base kg les effets radiatifs directs de m??thane est environ 72 fois plus puissant que le dioxyde de carbone sur une p??riode de 20 ans, mais il est pr??sent dans des concentrations beaucoup plus faibles de sorte que son effet radiatif direct total est plus petit, et il a une dur??e de vie atmosph??rique plus courte. D'autre part, en plus de son m??thane d'impact radiatif direct a un grand effet radiatif indirect, car il contribue ?? la formation d'ozone. Shindell et al. (2005) soutiennent que la contribution au changement climatique ?? partir de m??thane est au moins le double des estimations pr??c??dentes en raison de cet effet.
Lorsque selon leur indice de leur contribution directe ?? l'effet de serre, les plus importants sont:
| Compos?? | Formule | Contribution (%) |
|---|---|---|
| La vapeur d'eau et les nuages | H 2 O | 36 ?? 72% |
| Le dioxyde de carbone | CO 2 | 9-26% |
| M??thane | CH 4 | 4-9% |
| Ozone | O 3 | 3-7% |
En plus des principaux gaz ?? effet ??num??r??s ci-dessus, d'autres gaz de serre comprennent l'hexafluorure de soufre, hydrofluorocarbures et perfluorocarbures (voir Liste GIEC effet de serre). Certaines effet de serre ne sont pas souvent r??pertori??s. Par exemple, trifluorure d'azote a une grande potentiel de r??chauffement global (GWP), mais ne est pr??sent en tr??s petites quantit??s.
Proportion des effets directs ?? un moment donn??
Il ne est pas possible d'affirmer qu'un certain gaz provoque un pourcentage exact de l'effet de serre. Ce est parce que certains des gaz absorbent et ??mettent des radiations aux m??mes fr??quences que les autres, de sorte que l'effet de serre total ne est pas simplement la somme de l'influence de chaque gaz. Les extr??mit??s sup??rieures des fourchettes indiqu??s sont pour chaque gaz seul; les extr??mit??s inf??rieures repr??sentent les chevauchements avec d'autres gaz. En outre, certains gaz tels que le m??thane sont connus pour avoir des effets indirects qui sont encore quantifi??s.
Dur??e de vie atmosph??rique
En plus de la vapeur d'eau , qui a un temps de s??jour d'environ neuf jours, les principaux gaz ?? effet sont bien m??lang??s, et prennent de nombreuses ann??es pour laisser l'atmosph??re. M??me se il ne est pas facile de conna??tre avec pr??cision le temps qu'il faut ?? effet de serre de quitter l'atmosph??re, il ya des estimations pour les principaux gaz ?? effet de serre. Jacob (1999) d??finit la dur??e de vie 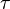 d'un atmosph??rique esp??ce X dans un mod??le ?? une bo??te que la dur??e moyenne d'une mol??cule de X reste dans la bo??te. Math??matiquement
d'un atmosph??rique esp??ce X dans un mod??le ?? une bo??te que la dur??e moyenne d'une mol??cule de X reste dans la bo??te. Math??matiquement 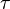 peut ??tre d??fini comme le rapport de la masse
peut ??tre d??fini comme le rapport de la masse 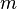 (En kg) de X dans la zone de son taux d'??limination, qui est la somme du d??bit de X de la bo??te (
(En kg) de X dans la zone de son taux d'??limination, qui est la somme du d??bit de X de la bo??te ( 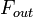 ), La perte chimique de X (
), La perte chimique de X (  ), Et d??p??t de X (
), Et d??p??t de X ( 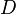 ) (Tous en kg / s):
) (Tous en kg / s): 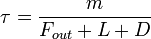 . Si on se arr??tait de verser une quelconque de ce gaz dans la bo??te, puis apr??s un temps
. Si on se arr??tait de verser une quelconque de ce gaz dans la bo??te, puis apr??s un temps 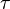 , Sa concentration serait r??duit de moiti?? environ.
, Sa concentration serait r??duit de moiti?? environ.
La dur??e de vie atmosph??rique d'une esp??ce mesure donc le temps n??cessaire pour r??tablir l'??quilibre apr??s une augmentation ou une diminution soudaine de sa concentration dans l'atmosph??re. Atomes ou de mol??cules individuelles peuvent ??tre perdues ou d??pos??s dans les puits tels que le sol, les oc??ans et autres eaux, ou de la v??g??tation et d'autres syst??mes biologiques, la r??duction de l'exc??s de concentrations de fond. Le d??lai moyen d'y parvenir est la dur??e moyenne de vie.
Le dioxyde de carbone a une dur??e de vie atmosph??rique variable et ne peut ??tre pr??cis??ment sp??cifi??. La dur??e de vie atmosph??rique de CO 2 est estim?? de l'ordre de 30 ?? 95 ans. Ce chiffre repr??sente mol??cules de CO 2 ??tant ??limin??es de l'atmosph??re en m??langeant dans l'oc??an, la photosynth??se, et d'autres processus. Cependant, ce qui exclut les flux d'??quilibrage de CO 2 dans l'atmosph??re des r??servoirs g??ologiques, qui ont des taux plus lent caract??ristiques. Si plus de la moiti?? du CO 2 ??mis est ??limin?? de l'atmosph??re ?? l'int??rieur d'un si??cle, une fraction (environ 20%) de CO 2 ??mis reste dans l'atmosph??re pendant des milliers d'ann??es. Des questions similaires se appliquent ?? d'autres gaz de serre, dont beaucoup ont des dur??es de vie moyennes plus que le CO 2. Par exemple, N 2 O a une dur??e de vie atmosph??rique moyenne de 114 ann??es.
Le for??age radiatif
La Terre absorbe une partie de l'??nergie rayonnante re??ue du soleil, refl??te certaines d'entre elles comme la lumi??re et refl??te ou re-rayonne le dossier ?? l'espace, chaleur. La temp??rature de surface de la Terre d??pend de cet ??quilibre entre l'??nergie entrant et sortant. Si ce bilan ??nerg??tique est d??cal??, la surface de la Terre pourrait devenir plus chaud ou plus froid, conduisant ?? une vari??t?? de changements dans le climat mondial.
Un certain nombre de m??canismes naturels et artificiels peut affecter l'??quilibre de l'??nergie et de la force des changements globaux du climat de la Terre. gaz ?? effet de serre sont un tel m??canisme. gaz ?? effet de serre dans l'atmosph??re absorbent et r??-??mettent partie de l'??nergie rayonn??e sortant de la surface de la Terre, en faisant que la chaleur d'??tre retenu dans la basse atmosph??re. Comme expliqu?? ci-dessus , certains ?? effet de serre restent dans l'atmosph??re pendant des d??cennies, voire des si??cles, et peuvent donc influer sur le bilan ??nerg??tique de la Terre sur une longue p??riode de temps. Les facteurs qui influencent le bilan ??nerg??tique de la Terre peuvent ??tre quantifi??s en termes de " climat for??age radiatif. "de for??age radiatif positif indique r??chauffement (par exemple, en augmentant ou en diminuant l'??nergie entrant la quantit?? d'??nergie qui se ??chappe de l'espace), tandis que le for??age n??gatif est associ?? ?? un refroidissement.
Potentiel de r??chauffement plan??taire
Le potentiel de r??chauffement global (PRG) d??pend ?? la fois l'efficacit?? de la mol??cule sous forme de gaz ?? effet de serre et de sa dur??e de vie atmosph??rique. GWP est mesur??e par rapport ?? la m??me masse de CO 2 et ??valu?? pour un d??lai sp??cifique. Ainsi, si un gaz a un haut (positif) for??age radiatif mais aussi une courte dur??e de vie, il aura une grande GWP sur une ??chelle de 20 ans mais un petit sur une ??chelle de 100 ans. Inversement, si une mol??cule a une dur??e de vie atmosph??rique de plus de CO 2 son PRP va augmenter avec l'??chelle de temps consid??r??e. Le dioxyde de carbone est d??fini pour avoir un PRP de 1 sur toutes les p??riodes de temps.
Le m??thane a une dur??e de vie atmosph??rique de 12 ?? 3 ans et un PRG de 72 plus de 20 ans, 25 plus de 100 ans et 7,6 plus de 500 ans. La diminution des temps plus longs GWP est parce que m??thane est d??grad?? ?? l'eau et le CO 2 par des r??actions chimiques dans l'atmosph??re.
Des exemples de la dur??e de vie atmosph??rique et GWP par rapport au CO 2 pour plusieurs effet de serre sont donn??s dans le tableau suivant:
| nom de gaz | Chimique formule | Vie (ann??es) | Potentiel de r??chauffement global (PRG) pour l'horizon de temps donn?? | ||
|---|---|---|---|---|---|
| 20-yr | 100-yr | 500-yr | |||
| Le dioxyde de carbone | CO 2 | Voir au dessus | 1 | 1 | 1 |
| M??thane | CH 4 | 12 | 72 | 25 | 7.6 |
| Le protoxyde d'azote | N 2 O | 114 | 289 | 298 | 153 |
| CFC-12 | CCl 2 F 2 | 100 | 11 000 | 10 900 | 5 200 |
| HCFC-22 | CHClF 2 | 12 | 5 160 | 1 810 | 549 |
| T??trafluorom??thane | 4 CF | 50 000 | 5 210 | 7 390 | 11 200 |
| Hexafluor??thane | C 2 F 6 | 10 000 | 8 630 | 12 200 | 18 200 |
| L'hexafluorure de soufre | SF 6 | 3 200 | 16 300 | 22 800 | 32 600 |
| Trifluorure d'azote | NF 3 | 740 | 12 300 | 17 200 | 20 700 |
L'utilisation de CFC-12 (?? l'exception des utilisations essentielles) a ??t?? ??limin??e en raison de ses appauvrissant l'ozone propri??t??s. La suppression progressive des moins actifs HCFC-compos??s seront termin??s en 2030.
Effet de serre anthropiques
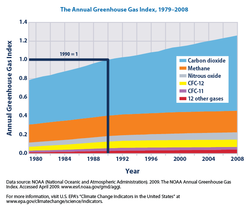
Depuis environ 1750 activit?? humaine a augment?? la concentration de dioxyde de carbone et d'autres gaz ?? effet de serre. Les concentrations atmosph??riques mesur??es de dioxyde de carbone sont actuellement 100 ppm plus ??lev??e que les niveaux pr??-industriels. Les sources naturelles de dioxyde de carbone sont plus de 20 fois plus grande que les sources dues ?? l'activit?? humaine, mais sur des p??riodes plus longues de quelques ann??es sources naturelles sont ??troitement ??quilibr??s par les puits naturels, principalement la photosynth??se des compos??s de carbone par les plantes et le plancton marin. En raison de cet ??quilibre, la fraction molaire de l'atmosph??re de dioxyde de carbone est maintenue entre 260 et 280 parties par million ?? 10.000 ans entre la fin du dernier maximum glaciaire et le d??but de l'??re industrielle.
Il est probable que anthropique (ce est ?? dire, d'origine humaine) le r??chauffement, telle que celle en raison de niveaux de gaz ?? effet de serre ??lev??es, a eu une influence perceptible sur de nombreux syst??mes physiques et biologiques. Le r??chauffement projet?? d'avoir une gamme de cons??quences , y compris l'??l??vation du niveau de la mer , l'augmentation de fr??quence et la gravit?? de certains des ??v??nements m??t??orologiques extr??mes, perte de biodiversit??, changements et r??gionales dans la productivit?? agricole.
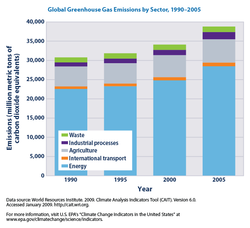
Les principales sources de gaz ?? effet de serre dues ?? l'activit?? humaine sont:
- combustion de combustibles fossiles et d??forestation conduit ?? des concentrations plus ??lev??es de dioxyde de carbone dans l'air. changement d'affectation des terres (principalement de la d??forestation dans les tropiques) repr??sentent jusqu'?? un tiers du total des ??missions de CO 2 d'origine anthropique.
- b??tail la fermentation ent??rique et gestion du fumier, le paddy de riz l'agriculture, l'utilisation des terres et des zones humides changements, pertes dans les gazoducs, et les ??missions d'enfouissement ventil??s couverts menant ?? m??thane concentrations atmosph??riques ??lev??es. Beaucoup de style plus r??cent qui fosses septiques enti??rement ventil??s qui am??liorent et ciblent le processus de fermentation sont ??galement des sources de m??thane atmosph??rique.
- l'utilisation des chlorofluorocarbures (CFC) dans syst??mes de r??frig??ration et l'utilisation des CFC et des halons dans syst??mes d'extinction d'incendie et proc??d??s de fabrication.
- activit??s agricoles, y compris l'utilisation d'engrais, qui conduisent ?? l'oxyde nitreux sup??rieur (N 2 O) concentrations.
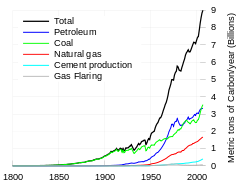
Les sept sources de CO 2 provenant de la combustion de combustibles fossiles sont (avec des contributions de pourcentage pour 2000 ?? 2004):
| Sept principal combustible fossile les sources de combustion | Contribution (%) |
|---|---|
| Les combustibles liquides (par exemple, essence, fioul) | 36% |
| Les combustibles solides (par exemple, le charbon ) | 35% |
| Combustibles gazeux (par exemple, le gaz naturel ) | 20% |
| La production de ciment | 3% |
| Le torchage du gaz industriel et au puits | <1% |
| Les hydrocarbures non-combustible | <1% |
| "International les combustibles de soute "de transport non inclus dans les inventaires nationaux | 4% |
Le dioxyde de carbone , m??thane , l'oxyde nitreux (N 2 O) et trois groupes de (gaz fluor??s l'hexafluorure de soufre (SF 6), les hydrofluorocarbones (HFC), et perfluorocarbures (PFC)) sont les principaux gaz ?? effet de serre anthropiques, et sont r??gis par la Protocole de Kyoto internationale trait??, qui est entr?? en vigueur en 2005. Les limites des ??missions sp??cifi??es dans le Protocole de Kyoto expire en 2012. Le Accord de Cancun, a convenu en 2010, comprend des engagements volontaires pris par 76 pays pour contr??ler les ??missions. Au moment de l'accord, ces 76 pays ??taient collectivement responsables de 85% des ??missions mondiales annuelles.
Bien que CFC sont des gaz ?? effet de serre, ils sont r??gis par la Protocole de Montr??al, qui a ??t?? motiv?? par la contribution de CFC pour la couche d'ozone plut??t que par leur contribution au r??chauffement climatique. Notez que la couche d'ozone a seulement un r??le mineur dans l'effet de serre que les deux processus sont souvent confondus dans les m??dias.
R??le de la vapeur d'eau
La vapeur d'eau repr??sente le plus grand pourcentage de l'effet de serre, entre 36% et 66% pour les conditions de ciel clair et entre 66% et 85% si l'on inclut les nuages. les concentrations de vapeur d'eau fluctuent r??gional, mais l'activit?? humaine ne affecte pas significativement les concentrations de vapeur d'eau, sauf ?? l'??chelle locale, comme ?? proximit?? des champs irrigu??s. La concentration atmosph??rique de la vapeur est tr??s variable et d??pend en grande partie de la temp??rature, de moins de 0,01% dans les r??gions extr??mement froides jusqu'?? 20% dans les r??gions chaudes et humides.
Le temps de s??jour moyen d'une mol??cule d'eau dans l'atmosph??re est seulement d'environ neuf jours, par rapport aux ann??es ou des si??cles pour d'autres gaz de serre tels que le CH 4 et CO 2. Ainsi, la vapeur d'eau r??pond ?? et amplifie les effets des autres gaz ?? effet de serre. Le Formule de Clapeyron ??tablit que l'air peut contenir plus de vapeur d'eau par unit?? de volume quand il se r??chauffe. Ceci et d'autres principes de base indique que le r??chauffement de l'accroissement des concentrations des autres gaz augmente ??galement la concentration de vapeur d'eau (en supposant que le l'humidit?? relative reste ?? peu pr??s constante; mod??lisation et ??tudes observationnelles trouver que ce est effectivement le cas). Parce que la vapeur d'eau est un gaz ?? effet de serre, il en r??sulte un r??chauffement suppl??mentaire et est donc " r??troaction positive "qui amplifie le r??chauffement d'origine. Finalement autres processus terrestres contrebalanc?? ces ??valuations positives, la stabilisation de la temp??rature mondiale ?? un nouvel ??quilibre et de pr??venir la perte de l'eau de la Terre par une V??nus comme emballement effet de serre.
Encore une fois en supposant humidit?? relative constante, le ??quation de Clausius-Clapeyron montre que la vapeur d'eau augmente ?? peu pr??s exponentiellement avec la temp??rature, ?? environ 7% pour des temp??ratures typiques.
??limination de l'atmosph??re (??puits??)
Les processus naturels
Ces gaz peuvent ??tre retir??es de l'atmosph??re par divers proc??d??s, comme une cons??quence de:
- un changement physique (condensation et la pr??cipitation ??liminer la vapeur d'eau de l'atmosph??re).
- une r??action chimique dans l'atmosph??re. Par exemple, le m??thane est oxyd?? par r??action avec l'??tat naturel hydroxyle radical OH ?? et d??grad?? en CO 2 et la vapeur d'eau (CO 2 provenant de l'oxydation du m??thane ne est pas inclus dans le m??thane Potentiel de r??chauffement global). Autres r??actions chimiques comprennent une solution solide et la chimie en phase survenant dans les a??rosols atmosph??riques.
- un ??change physique entre l'atmosph??re et les autres compartiments de la plan??te. Un exemple est le m??lange de gaz atmosph??riques dans les oc??ans.
- une modification chimique ?? l'interface entre l'atmosph??re et les autres compartiments de la plan??te. Ce est le cas pour le CO 2, qui est r??duite par la photosynth??se des plantes, et qui, apr??s dissolution dans les oc??ans, r??agit pour former l'acide carbonique et bicarbonate et carbonate ions (voir l'acidification des oc??ans).
- une changement photochimique. Les halocarbures sont dissoci??es par UV lumi??re lib??rant Cl et F ?? ?? que radicaux libres dans le stratosph??re avec des effets n??fastes sur l'ozone (halocarbures sont g??n??ralement trop stable ?? dispara??tre par r??action chimique dans l'atmosph??re).
??missions n??gatives
Un certain nombre de technologies d'??limination des ??missions de GES dans l'atmosph??re. Les plus largement analys??s sont ceux qui enl??vent le dioxyde de carbone de l'atmosph??re, que ce soit ?? des formations g??ologiques telles que bio??nergie avec capture et stockage du carbone et capture du dioxyde de carbone de l'air, ou sur le sol comme ce est le cas avec biochar. Le GIEC a soulign?? que de nombreux mod??les de sc??narios climatiques ?? long terme exigent ?? grande ??chelle des ??missions n??gatives caus??es par l'homme pour ??viter de graves changements climatiques.
Histoire de la recherche scientifique
Fin des scientifiques du 19??me si??cle exp??rimentalement d??couvert que N 2 et O 2 ne absorbent pas le rayonnement infrarouge (appel??, ?? cette ??poque, "rayonnement sombre") de tout, au contraire, de l'eau, en tant que v??ritable vapeur et condens??s sous la forme de gouttelettes microscopiques en suspension dans les nuages, ainsi que CO 2 et d'autres mol??cules gazeuses poly-atomique, faire absorber le rayonnement infrarouge. Il a ??t?? reconnu au d??but du 20??me si??cle que l'effet de serre dans l'atmosph??re effectu??s temp??rature globale de la Terre sup??rieure ?? ce qu'elle serait sans eux. Au cours de la fin du 20e si??cle, un consensus scientifique ??volu?? que des concentrations croissantes de gaz de serre dans l'atmosph??re sont ?? l'origine d'une augmentation substantielle des temp??ratures mondiales et des changements ?? d'autres parties du syst??me climatique, avec des cons??quences pour l'environnement et pour la sant?? humaine.