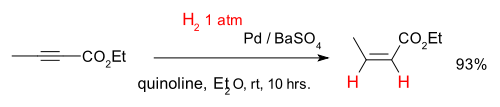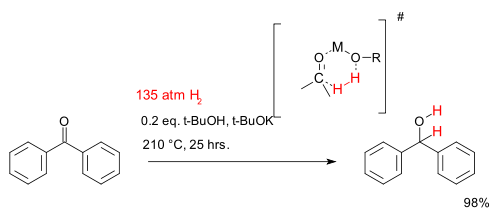Hydrog??nation
Saviez-vous ...
Arrangeant une s??lection Wikipedia pour les ??coles dans le monde en d??veloppement sans internet ??tait une initiative de SOS Enfants. Voir http://www.soschildren.org/sponsor-a-child pour conna??tre le parrainage d'enfants.
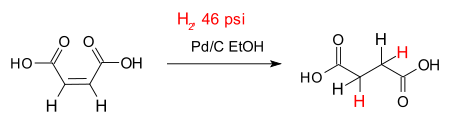
L'hydrog??nation est une classe de r??actions chimiques qui conduisent ?? une addition d' hydrog??ne (H 2) g??n??ralement ?? insatur??s compos??s organiques . Le processus constitue l'ajout d' hydrog??ne des atomes ?? la des doubles liaisons d'une mol??cule par l'utilisation d'un catalyseur . L'hydrog??ne contribue ??galement ?? triples liaisons, se ils sont pr??sents. Des substrats typiques comprennent les alc??nes , des alcynes, des c??tones , nitriles, et imines. La plupart des hydrog??nations agit de l'addition directe d'hydrog??ne diatomique (H 2), mais certains comportent les sources de l'hydrog??ne, H 2 pas: ces proc??d??s sont appel??s hydrog??nations de transfert. La r??action inverse, l'??limination de l'hydrog??ne, est appel??e d??shydrog??nation. Une r??action mettant en jeu l'hydrog??ne et le clivage d'une liaison carbone-oxyg??ne ou liaison carbone-azote est appel??e L'hydrog??nolyse. L'hydrog??nation est diff??rente de protonation ou Outre hydrure (par exemple de l'utilisation de le borohydrure de sodium): dans hydrog??nation, les produits ont la m??me charge que les r??actifs.
L'exemple classique d'une hydrog??nation est l'addition d'hydrog??ne ?? insaturation liaisons entre carbone atomes , la conversion des alc??nes ?? alcanes . Un exemple simple est l'hydrog??nation de de l'acide mal??ique l'acide succinique repr??sent?? sur la droite. De nombreuses applications importantes se trouvent dans la p??trochimiques, industries pharmaceutiques et alimentaires.
Les probl??mes de sant?? associ??s ?? l'hydrog??nation de graisses insatur??es pour produire graisses satur??es et gras trans est un aspect important de la conscience actuelle des consommateurs.
Processus
Hydrog??nation comporte trois volets:
- la substrat insatur??,
- l'atome d'hydrog??ne (ou une source d'hydrog??ne) et, invariablement,
- un catalyseur.
Les utilisations technologiques plus grande ??chelle de H 2 et l'hydrog??nation sont r??actions d'hydrog??nolyse associ??s aux industries des produits chimiques ?? la fois lourdes et fines. L'hydrog??nation est l'addition de H 2 ?? insatur??s des compos??s organiques tels que des alc??nes destin?? ?? mettre en alcanes et ald??hydes pour donner les alcools . Les r??actions d'hydrog??nation n??cessitent des catalyseurs m??talliques, souvent ceux constitu??s de platine ou similaire m??taux pr??cieux.
L'ajout de H 2 ?? une alc e ne offre un alk une amende dans la r??action protypical:
- RCH = CH 2 + H 2 → RCH 2 CH 3 (R = alkyle , aryle)
Une caract??ristique importante de l'alc??ne et alcyne deux hydrog??nations homog??nes et h??t??rog??nes est que l'addition d'hydrog??ne se effectue avec addition syn avec de l'hydrog??ne entrant par le c??t?? le moins encombr??.
Catalyseurs
A l'exception rare, pas de r??action au-dessous de 480 ?? C se produit entre H 2 et les compos??s organiques en l'absence de catalyseurs m??talliques. Le catalyseur se lie simultan??ment ?? la fois le H 2 et le substrat insatur?? et facilite leur union. des m??taux du groupe du platine, notamment le platine , palladium , rhodium et ruth??nium , sont des catalyseurs tr??s actifs. Tr??s catalyseurs actifs fonctionnent ?? des temp??ratures plus basses et des pressions plus faibles de H 2. Des catalyseurs de m??taux non pr??cieux, en particulier ceux ?? base de nickel (tels que Le nickel de Raney et Urushibara nickel) ont ??galement ??t?? d??velopp??s comme des alternatives ??conomiques mais elles sont souvent plus lent ou exiger des temp??ratures plus ??lev??es. Le compromis est l'activit?? (vitesse de r??action) vs. co??t du catalyseur et le co??t du mat??riel requis pour l'utilisation de hautes pressions.
Deux grandes familles de catalyseurs sont connus - homog??ne et h??t??rog??ne. Les catalyseurs homog??nes se dissolvent dans le solvant qui contient le substrat insatur??. Les catalyseurs h??t??rog??nes sont des solides qui sont en suspension dans le m??me solvant ou avec le substrat sont trait??s avec un substrat gazeux. Dans l'industrie pharmaceutique et pour des applications chimiques sp??ciaux, soluble " "Homog??ne" "catalyseur sont parfois employ??, tel que le rhodium ?? base de compos?? connu sous le nom Le catalyseur de Wilkinson, ou l' iridium ?? base Catalyseur de Crabtree.
L'activit?? et la s??lectivit?? des catalyseurs peuvent ??tre ajust??es en modifiant l'environnement autour du m??tal, ?? savoir le sph??re de coordination. Diff??rent faces d'un catalyseur h??t??rog??ne cristalline pr??sentent des activit??s distinctes, par exemple. De m??me, les catalyseurs h??t??rog??nes sont affect??s par leurs supports, ce est ?? dire sur le mat??riau avec le catalyseur h??t??rog??ne est li??. Les catalyseurs homog??nes sont affect??es par leur ligands. Dans de nombreux cas, des modifications tr??s empiriques comportent des "poisons". S??lectifs Ainsi, un catalyseur choisi avec soin peut ??tre utilis?? pour hydrog??ner des groupes fonctionnels sans affecter d'autres, comme l'hydrog??nation d'alc??nes sans toucher cycles aromatiques, ou l'hydrog??nation s??lective de des alcynes en alc??nes ?? l'aide de Catalyseur de Lindlar. Pour substrats prochiraux, la s??lectivit?? du catalyseur peuvent ??tre ajust??es de telle sorte qu'un produit d'??nantiom??re est produit.
M??canisme de la r??action
En raison de sa pertinence technologique, "activation" catalys??e-m??tallique de H 2, a ??t?? l'objet de nombreuses ??tudes, en se concentrant sur la des m??canismes de r??action de m??taux qui m??dient par ces r??actions. Tout d'abord marquage isotopique utilisant deut??rium peut ??tre utilis?? pour d??terminer la r??giochimie de l'addition:
- RCH = CH 2 + D 2 → RCHDCH 2 D
Essentiellement, le m??tal se lie ?? deux composants pour donner un alc??ne-m??tallique interm??diaire (H) de deux complexes. La s??quence g??n??rale de r??actions est:
- la liaison de l'hydrog??ne pour donner un complexe de dihydrure ("addition oxydante"):
- L n M + H 2 → L n MH 2
- la liaison de l'alc??ne:
- L n M (η 2 H 2) + CH 2 = CHR → L n-1 MH 2 (CH 2 = CHR) L +
- transfert d'un atome d'hydrog??ne ?? partir du m??tal de carbone (insertion migratoire)
- L n-1 MH 2 (CH 2 = CHR) → L n-1 M (H) (CH 2 -CH 2 R)
- transfert du second atome d'hydrog??ne ?? partir du m??tal du groupe alkyle avec dissociation simultan??e de l'alcane (??d'??limination r??ductrice??)
- L n-1 M (H) (CH 2 -CH 2 R) → L n-1 M + CH 3 -CH 2 R
Pr??c??dant l'addition oxydative de H 2 est la formation d'une complexe dihydrog??ne.
Temp??ratures
La r??action est effectu??e ?? des temp??ratures et des pressions diff??rentes en fonction du substrat. L'hydrog??nation est fortement r??action exothermique. Lors de l'hydrog??nation d'huiles v??g??tales et d'acides gras, par exemple, la chaleur d??gag??e est d'environ 25 kcal par mole (105 kJ / mol), suffisante pour ??lever la temp??rature de l'huile de 1.6 ?? 1.7 ?? C par la chute de l'indice d'iode.
Port??e
Les alcynes peuvent ??tre convertis s??lectivement en alc??nes dans un h??mihydrog??nation dite, par exemple avec le compos?? 2-butynoate d'??thyle et un catalyseur palladium sur le sulfate de baryum et quinol??ine (ce qui d??sactive le catalyseur am??liorant chimios??lectivit??):
ou avec l'acide 4- (trim??thylsilyl) -3-butyne-1-ol:
- 4- (trim??thylsilyl) hydrog??nation -3-butyne-1-ol
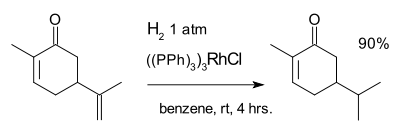
La r??action suivante avec carvone est un exemple de ce est ?? dire la catalyse homog??ne Le catalyseur de Wilkinson:
L'hydrog??nation est sensible ?? emp??chement st??rique expliquer la s??lectivit?? pour la r??action avec le double liaison exocyclique mais pas la double liaison interne.
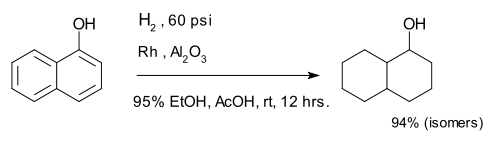
Le compos?? 1-naphtol est compl??tement r??duit ?? un m??lange de d??caline-ol isom??res.
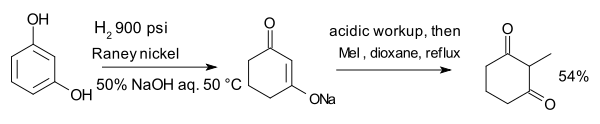
Le compos?? le r??sorcinol, hydrog??n?? avec Le nickel de Raney en pr??sence d'aqeous hydroxyde de sodium forme un ??nolate qui est alkyle avec l'iodure de m??thyle en 2-m??thyl-1,3-cyclohexandione:
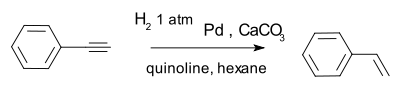
Un catalyseur efficace est le Catalyseur de Lindlar par exemple dans la conversion de ph??nylac??tyl??ne ?? le styr??ne.
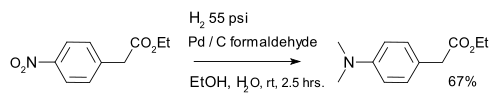
L'hydrog??nation est ??galement utilis?? dans r??duction organique de les compos??s nitro aromatiques, par exemple des compos??s nitr??s en combinaison avec le palladium sur du carbone et formald??hyde:
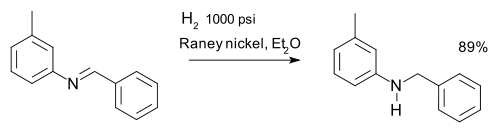
ou la r??duction du des imines, par exemple dans une synth??se de m-tolylbenzylamine:
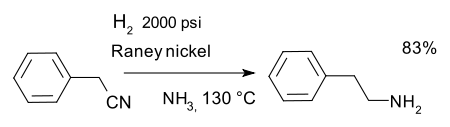
ou la r??duction du des nitriles, par exemple dans une synth??se de ph??n??thylamine avec Le nickel de Raney et l'ammoniac :
Dans l'industrie alimentaire
| Types de graisses dans les aliments |
|---|
|
| Voir ??galement |
|
L'hydrog??nation est largement appliqu??e au traitement des huiles v??g??tales et graisses. L'hydrog??nation compl??te convertit insatur??s des acides gras ?? ceux satur??s. En pratique, le proc??d?? ne est g??n??ralement pas r??alis??e ?? la fin. ??tant donn?? que les huiles d'origine contiennent g??n??ralement plus d'un double liaison par mol??cule (ce est ?? dire qu'ils sont le poly-insatur??s), le r??sultat est g??n??ralement d??crit comme une huile v??g??tale partiellement hydrog??n??e; ce est-?? certains, mais habituellement pas la totalit??, des doubles liaisons dans chaque mol??cule ont ??t?? r??duits. Ceci est r??alis?? en limitant la quantit?? d'hydrog??ne (ou agent r??ducteur) a laiss?? r??agir avec la mati??re grasse.
les r??sultats d'hydrog??nation dans la conversion des v??g??tale liquide huiles ?? graisses solides ou semi-solides, tels que ceux pr??sents dans margarine. Modification du degr?? de saturation de la graisse change certaines propri??t??s physiques importantes telles que le point de fusion, ce est pourquoi les huiles liquides deviennent semi-solide. Graisses semi-solides sont pr??f??r??s pour la cuisson parce que la fa??on la graisse se m??lange avec de la farine produit une texture plus souhaitable dans le produit cuit. Depuis les huiles v??g??tales partiellement hydrog??n??es sont moins chers que les graisses d'origine animale, sont disponibles dans une large gamme de consistances, et ont d'autres caract??ristiques souhaitables (par exemple, l'augmentation de stabilit?? ?? l'oxydation (dur??e de conservation)), ils sont les graisses pr??dominants utilis??s dans la plupart des produits de boulangerie commerciaux . M??langes de graisses formul??es ?? cet effet sont appel??s shortenings.
R??percussions sur la sant??
Un effet secondaire de hydrog??nation ayant des implications incompl??tes pour la sant?? humaine est le isom??risation des liaisons restantes insatur??s de carbone. Le configuration cis de ceux-ci doubles liaisons pr??domine dans les graisses non transform??s en sources de mati??res grasses les plus comestibles, mais hydrog??nation incompl??te convertit partiellement ces mol??cules isom??res trans, qui ont ??t?? impliqu??s dans des maladies du syst??me circulatoire, y compris maladie cardiaque (voir les acides gras trans). Le proc??d?? d'hydrog??nation catalytique favorise la conversion de cis liaisons trans parce que la configuration trans a une ??nergie inf??rieure ?? celle cis naturel. A l'??quilibre, le rapport des isom??res trans / cis est d'environ 2: 1. La l??gislation alimentaire aux ??tats-Unis et les codes de pratique dans l'UE exige depuis longtemps ??tiquettes d??clarant la teneur en gras des aliments dans le commerce de d??tail, et, plus r??cemment, ont ??galement exig?? la d??claration de la teneur en gras trans.
En 2006, New York City a adopt?? premi??re interdiction municipale majeure des Etats-Unis sur les gras trans artificiels dans les plus cuisson de restaurant.
Histoire
La premi??re est celle de l'hydrog??nation du platine catalys?? addition d'hydrog??ne ?? l'oxyg??ne dans le Briquet D??bereiner, un dispositif commercialis?? d??s 1823. Le chimiste fran??ais Paul Sabatier est consid??r?? comme le p??re du processus d'hydrog??nation. En 1897, il a d??couvert que l'introduction d'une trace de nickel comme un catalyseur facilit?? l'addition d'hydrog??ne aux mol??cules de compos??s de carbone gazeux dans ce qui est maintenant connu sous le nom Processus Sabatier. Pour ce travail Sabatier a remport?? la moiti?? des 1912 prix Nobel de chimie . Wilhelm Normann a obtenu un brevet en Allemagne en 1902 et en Grande-Bretagne en 1903 pour l'hydrog??nation des huiles liquides en utilisant de l'hydrog??ne gazeux, ce qui fut le d??but de ce qui est maintenant un tr??s grand monde de toute l'industrie. Le commercialement tr??s important Proc??d?? Haber-Bosch (ammoniac hydrog??nation) a ??t?? d??crite pour la premi??re en 1905 et moins Proc??d?? de Fischer-Tropsch (hydrog??nation du monoxyde de carbone) en 1922. Une autre application commerciale est la processus d'oxo (1938), un couplage d'hydrog??ne m??diation d'ald??hydes avec des alc??nes. Le catalyseur de Wilkinson est la premi??re catalyseur homog??ne mis au point dans les ann??es 1960 et Noyori hydrog??nation asym??trique (1987) l'une des premi??res applications en synth??se asym??trique. Un article de 2007 a pr??conis?? l'utilisation de plusieurs hydrog??nations dans les r??actions de couplage CC comme le processus oxo.
Hydrog??nation sans m??tal
Bien que, ?? toutes fins pratiques hydrog??nation n??cessite un catalyseur m??tallique, il existe certains syst??mes catalytiques sans m??tal qui sont ??tudi??s dans la recherche universitaire. Un tel syst??me pour la r??duction de c??tones se compose de le tert-butanol et tert-butylate de potassium et des temp??ratures tr??s ??lev??es. La r??action d??crite ci-dessous d??crit l'hydrog??nation de benzoph??none:
Un ??tude de cin??tique chimique trouv?? cette r??action est premier ordre dans les trois r??actifs sugg??rant une cyclique ?? 6 cha??nons ??tat de transition.
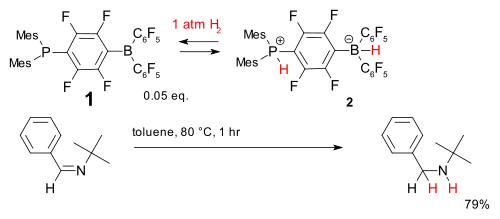
Un autre syst??me est bas?? sur la phosphine- compos?? borane (1). Il accepte dihydrog??nophosphate de mani??re r??versible ?? des temp??ratures relativement basses pour former le phosphonium borate 2 qui est capable de r??duire simple entrav?? imine.