
M??thanol
Saviez-vous ...
SOS Enfants produite ce site pour les ??coles ainsi que ce site de vid??o sur l'Afrique . Tous les enfants disponibles pour le parrainage de SOS Enfants des enfants sont pris en charge dans une maison de famille pr??s de la charit??. Lire la suite ...
| M??thanol | |
|---|---|
 |  |
 | |
m??thanol | |
Autres noms hydroxym??thane | |
| Identificateurs | |
| Num??ro CAS | 67-56-1 |
| Num??ro RTECS | PC1400000 |
| images de Jmol-3D | Image 1 |
SMILES
| |
| Propri??t??s | |
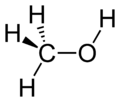
| Formule mol??culaire | CH 3 OH |
| Masse molaire | 32,04 g / mol |
| Apparence | liquide incolore |
| Densit?? | 0,7918 g / cm??, liquide |
| Point de fusion | -97 ?? C (176 K) |
| Point d'??bullition | 64,7 ?? C (337,8 K) |
| Solubilit?? dans l'eau | Pleinement miscible |
| Acidit?? (p K a) | ~ 15,5 |
| Viscosit?? | 0,59 mPa.s ?? 20 ?? C |
| Moment de dip??le | 1,69 D (gaz) |
| Risques | |
| FS | MSDS externe |
| Classification UE | Inflammable (F) Toxique (T) |
| Phrases-R | R11, R23 / 24/25, R39 / 23/24/25 |
| Phrases S | (S1 / 2), S7, S16, S36 / 37, S45 |
| NFPA 704 |  3 3 0 |
| Point d'??clair | 11 ?? C |
| Des compos??s apparent??s | |
| Connexes alcanols | ??thanol butanol |
| Des compos??s apparent??s | chlorom??thane m??thoxym??thane |
| Page de donn??es suppl??mentaire | |
| Structure et propri??t??s | n, ε r, etc. |
| Thermodynamique donn??es | comportement de phase Solide, liquide, gaz |
| Les donn??es spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
Le m??thanol, ??galement connu comme l'alcool m??thylique, carbinol, l'alcool de bois, le naphta ou de l'essence de bois de bois, est un compos?? chimique de formule chimique C H 3 OH (souvent abr??g?? MeOH). Il est le plus simple de l'alcool , et est une lumi??re, volatil, incolore , inflammable, toxique liquide avec une odeur caract??ristique qui est un peu plus doux et plus doux que l'??thanol ( alcool ??thylique ). A temp??rature ambiante, ce est un liquide polaire et est utilis?? comme un antigel, solvant , combustible, et en tant que d??naturant de l'alcool ??thylique . Il est ??galement utilis?? pour la production de biodiesel par r??action de transest??rification.
Le m??thanol est produit naturellement dans le ana??robie m??tabolisme de nombreuses vari??t??s de bact??ries. En cons??quence, il n'y a qu'une petite fraction de la vapeur de m??thanol dans l'atmosph??re. Au cours de plusieurs jours, le methanol est atmosph??rique oxyd?? par l'oxyg??ne ?? l'aide de la lumi??re du soleil ?? l'anhydride carbonique et de l'eau.
Le m??thanol br??le dans l'air formant le dioxyde de carbone et l'eau :
- 2 CH 3 OH + O 2 → 3 CO 2 + 4 H 2 O 2
Une flamme de m??thanol est presque incolore, provoquant un risque de s??curit?? suppl??mentaire autour de m??thanol flammes ouvertes.
En raison de ses propri??t??s toxiques, le m??thanol est fr??quemment utilis?? comme additif d??naturant pour l'??thanol fabriqu?? pour uses- industrielle cette addition d'un poison exempte ??conomique ??thanol industriel des imp??ts assez importantes ??d'alcool?? qui seraient par ailleurs pr??lev??s comme ce est l'essence de toute boissons alcooliques. Le m??thanol est souvent appel?? alcool de bois, car il a d??j?? ??t?? r??alis?? principalement comme sous-produit de la distillation destructive du bois. Il est d??sormais fabriqu??e synth??tiquement par un processus en plusieurs ??tapes: le gaz naturel et la vapeur sont r??form??s dans un four pour produire de l'hydrog??ne et de monoxyde de carbone; ensuite, les gaz hydrog??ne et monoxyde de carbone r??agissent sous pression en pr??sence d'un catalyseur.
Un ensemble ??conomie de m??thanol, sur la base de m??thanol comme un support de stockage d'??nergie primaire et de carburant, a ??t?? s??rieusement envisag??e.
Histoire
Dans leur processus de l'embaumement, le anciens ??gyptiens utilise un m??lange de substances, y compris le methanol, qui ont obtenu ?? partir de la pyrolyse du bois. M??thanol pur, cependant, a ??t?? isol?? pour la premi??re en 1661 par Robert Boyle , qui l'a appel?? esprit de bo??te, parce qu'il produit via la distillation de buis. Il devint plus tard connu comme l'esprit pyroxylic. En 1834, les fran??ais chimistes Jean-Baptiste Dumas et Eugene P??ligot d??termin?? sa composition ??l??mentaire. Ils ont ??galement introduit le mot m??thyl??ne ?? la chimie organique, formant ?? partir grec m??thyl = " vin "+ Hyle = bois (patch d'arbres). Son origine ??tait destin?? " alcool fabriqu?? ?? partir de bois (substance), "mais il comporte des erreurs de langue grecque. Le terme ??m??thyle?? a ??t?? d??riv?? vers 1840 par arri??re-formation de m??thyl??ne, et on a ensuite appliqu?? pour d??crire ??l'alcool m??thylique." Cela a ??t?? raccourcie ?? "m??thanol" en 1892 par la Conf??rence internationale sur la nomenclature chimique. Le suffixe -yl utilis?? dans la chimie organique pour former des noms radicaux, a ??t?? extrait du mot ??m??thyle."
En 1923, les allemands Matthias chimistes et Pier, travaillant pour BASF a d??velopp?? un moyen pour convertir gaz de synth??se (un m??lange de oxydes de carbone et hydrog??ne ) dans le methanol. Un brevet a ??t?? d??pos?? le 12 janvier 1926 (n ?? de r??f??rence. 1569775). Ce processus a utilis?? une chrome et mangan??se oxid catalyseur , ainsi que les conditions-pressions extr??mement vigoureuses allant de 50 ?? 220 atm), et des temp??ratures allant jusqu'?? 450 ?? C . Production de m??thanol moderne a ??t?? rendue plus efficace gr??ce ?? l'utilisation de catalyseurs (commun??ment cuivre ) capables de fonctionner ?? des pressions inf??rieures.
L'utilisation de m??thanol comme carburant a retenu l'attention pendant les crises p??troli??res des ann??es 1970 en raison de sa disponibilit?? et ?? faible co??t. Des probl??mes sont survenus t??t dans le d??veloppement des m??langes essence-m??thanol. En raison de son faible prix, certains distributeurs d'essence plus m??lang??. D'autres ont utilis?? des techniques de m??lange et une mauvaise manipulation.
En 2006 astronomes utilisant le MERLIN r??seau de t??lescopes radio ?? Observatoire de Jodrell Bank a d??couvert un grand nuage de m??thanol dans l'espace, ?? 300 miles ?? travers billion.
Production
Aujourd'hui, le gaz de synth??se est le plus souvent produit ?? partir du m??thane composant dans le gaz naturel plut??t que du charbon. Trois proc??d??s sont pratiqu??s dans le commerce. A des pressions mod??r??es de 1-2 MPa (10 ?? 20 atm) et des temp??ratures ??lev??es (environ 850 ?? C), le m??thane r??agit avec la vapeur sur un catalyseur au nickel pour produire gaz de synth??se selon la ??quation chimique:
Cette r??action, commun??ment appel?? vapeur reformage du m??thane ou SMR, est limites endothermiques et la place des limitations de transfert de chaleur sur la taille de et de la pression dans les r??acteurs catalytiques utilis??s. Le m??thane peut ??galement subir une oxydation partielle de l'oxyg??ne mol??culaire pour produire du gaz de synth??se, comme l'??quation suivante montre:
cette r??action est exothermique et la chaleur d??gag??e peut ??tre utilis?? in situ pour entra??ner la vapeur ?? la r??action de reformage de m??thane. Lorsque les deux proc??d??s sont combin??s, il est appel?? reformage autothermique. Le rapport de CO et de H 2 peut ??tre ajust??e dans une certaine mesure par la r??action de conversion eau-gaz,
?? fournir la stoechiom??trie appropri??e pour la synth??se du m??thanol.
Le monoxyde de carbone et l'hydrog??ne r??agissent ensuite sur un second catalyseur pour produire du m??thanol. Aujourd'hui, le catalyseur le plus couramment utilis?? est un m??lange de cuivre , l'oxyde de zinc et d'alumine utilis??es en premier ICI en 1966. A 10.5 MPa (50 ?? 100 atm) et 250 ?? C, il peut catalyser la production de m??thanol ?? partir de monoxyde de carbone et d'hydrog??ne avec une s??lectivit?? ??lev??e
Il est ?? noter que la production de gaz de synth??se ?? partir du m??thane produit 3 moles d'hydrog??ne pour chaque mole de monoxyde de carbone, tandis que la synth??se du m??thanol ne consomme que 2 moles d'hydrog??ne pour chaque mole de monoxyde de carbone. Une fa??on de faire face ?? l'exc??s d'hydrog??ne est d'injecter le dioxyde de carbone dans le r??acteur de synth??se du m??thanol, o?? elle aussi, r??agit pour former du methanol en fonction de la ??quation chimique
Bien que le gaz naturel est la mati??re premi??re la plus ??conomique et largement utilis?? pour la production de m??thanol, d'autres mati??res premi??res peuvent ??tre utilis??s. Lorsque le gaz naturel ne est pas disponible, la lumi??re p??troliers produits peuvent ??tre utilis??s ?? sa place.
Applications
Le m??thanol est un solvant de laboratoire commun. Il est particuli??rement utile pour HPLC et UV / VIS spectroscopie raison de ses faibles coupure UV.
Mati??res premi??res
La plus grande utilisation de m??thanol et de loin, est ?? faire d'autres produits chimiques. Environ 40% de methanol est converti en le formald??hyde, et de l?? dans des produits aussi divers que les mati??res plastiques , contre-plaqu??, peintures, explosifs, et infroissables textiles .
Toujours en d??but des ann??es 1970 Methanol to processus de l'essence a ??t?? d??velopp?? par Mobil, qui produit de l'essence pr??te ?? l'emploi dans les v??hicules. Une telle installation industrielle a ??t?? construit en Nouvelle-Z??lande dans les ann??es 1980. Dans les ann??es 1990, de grandes quantit??s de methanol ont ??t?? utilis??s dans le ??tats-Unis pour produire l'additif pour l'essence ??ther m??thyl-tert-butyle (MTBE), si la fuite a conduit ?? de nombreux Etats de l'interdire. En plus d'une utilisation directe en tant que combustible, du methanol (ou, moins fr??quemment, de l'??thanol ) est utilis?? comme composant dans la de transest??rification triglyc??rides pour donner une forme de biodiesel .
D'autres d??riv??s chimiques du methanol comprennent l'??ther dim??thylique, qui a remplac?? chlorofluorocarbures en tant que a??rosol propulseur, et l'acide ac??tique .
Le carburant automobile
Le m??thanol est utilis?? sur une base limit??e pour alimenter moteurs ?? combustion interne, principalement en vertu du fait qu'il ne est pas aussi inflammable que essence. M??thanol pur est requis par la r??gle ?? utiliser dans Champcars, USAC voitures de sprint (ainsi que Nains, modifieds, etc.), et d'autres s??ries de chemin de terre tels que World of Outlaws. Le methanol est ??galement utilis?? dans mod??le de radio contr??l??e avions (tenus dans le " moteurs bougie de pr??chauffage "qui alimentent surtout eux), les voitures et les camions. Faites glisser les coureurs et les coureurs de boue utilisent ??galement du m??thanol comme source de combustible primaire. Le m??thanol est requis avec un moteur suraliment?? dans un Top Alcohol Dragster et, jusqu'?? la fin de la saison 2005, tous les v??hicules dans le Indianapolis 500 a d?? courir m??thanol. coureurs de boue ont m??thanol m??lang?? ?? l'essence et l'oxyde nitreux pour produire plus de puissance que l'essence et seul l'oxyde nitreux.
L'un des inconv??nients de methanol en tant que combustible est sa corrosivit?? de certains m??taux, notamment l'aluminium . Le methanol, bien qu'un acide faible, attaque la couche d'oxyde qui prot??ge normalement la corrosion de l'aluminium:
- 6 CH 3 OH + Al 2 O 3 → 2 Al (OCH 3) 3 + 3 H 2 O
La r??sultante m??thoxyde sels sont solubles dans le methanol, ce qui entra??ne surface d'aluminium propre, qui est facilement oxyd?? par une dissolution de l'oxyg??ne . De plus, le methanol peut agir comme un oxydant:
- 6 CH 3 OH + 2 Al → 2 Al (OCH 3) 3 + 3 H 2
Ce processus r??ciproque effectivement les combustibles ?? la corrosion jusqu'?? ce que le m??tal est rong?? ou la concentration de CH 3 OH est n??gligeable.
Lorsqu'elle est produite ?? partir de bois ou d'autres mati??res organiques, le methanol organique r??sultante ( ?? base de p??trole bio-alcool) a ??t?? sugg??r??e comme carburants de remplacement ?? des hydrocarbures. Cependant, on ne peut pas utiliser m??thanol pur dans les voitures modernes p??troliers sans modification, en raison de dommages potentiels ?? la tuyauterie m??tallique et joints en caoutchouc.
D'autres applications
Le m??thanol est un d??naturant traditionnel de l'??thanol, ce qui donne l'expression alcool ?? br??ler.
Le m??thanol est aussi utilis?? comme solvant , et en tant que antigel dans pipelines et liquide lave-glace.
Dans certaines les stations d'??puration des eaux us??es, une petite quantit?? de methanol est ajout??e ?? eaux us??es pour fournir une source de carbone pour la nourriture des bact??ries d??nitrifiantes, qui convertissent les nitrates de l'azote .
Pendant la Seconde Guerre mondiale , le m??thanol a ??t?? utilis?? comme combustible dans plusieurs conceptions militaires allemands de roquettes, sous le nom M-Stoff, et en m??lange comme C-Stoff.
Le m??thanol est utilis?? comme un agent d??naturant en ??lectrophor??se sur gel de polyacrylamide.
Des piles ?? combustible m??thanol direct sont uniques en leur basse temp??rature, le fonctionnement de pression atmosph??rique, leur permettant d'??tre miniaturis??s ?? un degr?? sans pr??c??dent. Ceci, combin?? avec le stockage relativement facile et s??re et la manipulation de m??thanol peut ouvrir la possibilit?? de pile ?? combustible aliment?? ??lectronique grand public, tels que des ordinateurs portables.
La sant?? et la s??curit??
Le m??thanol est toxique par deux m??canismes. Tout d'abord, du methanol (se il p??n??tre dans l'organisme par ingestion, inhalation, ou absorption ?? travers l' peau) peut ??tre fatale en raison de sa D??presseurs du SNC propri??t??s de la m??me mani??re que l'??thanol empoisonnement. Deuxi??mement, il est toxique par son ??chec ( intoxication) par le enzyme alcool d??shydrog??nase dans le foie en formant de l'acide formique et formald??hyde qui cause permanente la c??cit?? par la destruction de la nerf optique. Les tissus f??taux ne tol??rera pas m??thanol. Doses dangereuses se accumulent si une personne est r??guli??rement expos?? ?? des vapeurs ou manipule liquide sans protection de la peau. Si m??thanol a ??t?? ing??r??e, un m??decin doit ??tre contact?? imm??diatement. La dose habituelle est fatale 100-125 ml (4 fl oz). Les effets toxiques prennent des heures pour commencer, et des antidotes efficaces peuvent souvent pr??venir des dommages permanents. Ce est trait?? en utilisant de l'??thanol ou fom??pizole. Chacune de ces m??dicaments agit pour ralentir l'action de l'alcool d??shydrog??nase de methanol au moyen de inhibition comp??titive, de sorte qu'il est excr??t?? par les reins plut??t que d'??tre transform?? en m??tabolites toxiques.
Les premiers sympt??mes de l'intoxication m??thanol sont ceux de syst??me nerveux central la d??pression: maux de t??te, ??tourdissements, naus??es, manque de coordination, confusion, somnolence, et suffisamment fortes doses, l'inconscience et la mort. Les sympt??mes initiaux de l'exposition au methanol sont g??n??ralement moins graves que les sympt??mes r??sultant de l'ingestion d'une quantit?? similaire de l'alcool ??thylique .
Une fois les premiers sympt??mes se sont ??coul??es, une deuxi??me s??rie de sympt??mes survient 10 ?? 30 heures apr??s l'exposition initiale au m??thanol: le flou ou la perte totale de la vision, avec acidose. Ces sympt??mes r??sultent de l'accumulation de niveaux toxiques d' formiate dans le sang, et peut ??voluer vers une mort par arr??t respiratoire. Le les d??riv??s d'ester de methanol ne partagent pas cette toxicit??.
L'??thanol est parfois d??natur?? (falsifi??), et ainsi rendu impropre ?? la consommation, par l'addition de methanol. Le r??sultat est connu en tant que alcool ou "meths" (usage au Royaume-Uni). (Ce dernier ne doit pas ??tre confondue avec la m??thamph??tamine, une abr??viation courante pour m??thamph??tamine).
M??thanol pur a ??t?? utilis?? dans course automobile ouverte de roue depuis le milieu des ann??es 1960. Contrairement incendies de p??trole, les feux de m??thanol peuvent ??tre ??teint ?? l'eau claire. Un incendie ?? base de m??thanol br??le invisible, contrairement ?? l'essence, qui br??le avec de la fum??e visible. Si un incendie se produit sur la piste, il n'y a pas de fum??e obstruer la vue des conducteurs qui approchent rapidement, mais cela peut aussi retarder la d??tection visuelle de l'incendie et l'initiation des actions de lutte contre les incendies. La d??cision de passer en permanence au m??thanol dans American IndyCar a ??t?? le r??sultat de l'accident d??vastateur et explosion ?? la 1964 Indianapolis 500 qui a tu?? pilotes Eddie Sachs et Dave MacDonald.
Une pr??occupation avec l'ajout de m??thanol pour carburants automobiles est mis en ??vidence par les impacts des eaux souterraines r??centes de l'additif pour carburant l'??ther m??thyl tert-butylique (MTBE). Fuites des r??servoirs d'essence souterrains cr????s panaches de MTBE dans les eaux souterraines qui a finalement contamin??s eau de puits. Solubilit?? ??lev??e de m??thanol dans l'eau soul??ve des inqui??tudes que la contamination similaire eau de puits pourrait d??couler de l'utilisation g??n??ralis??e de m??thanol comme carburant automobile.

