
Hydroxyde
Renseignements g??n??raux
SOS Enfants a fait cette s??lection Wikipedia aux c??t??s d'autres ??coles des ressources . Un lien rapide pour le parrainage d'enfants est http://www.sponsor-a-child.org.uk/
L'ion hydroxyde est un diatomic anion avec formule chimique OH -. Il est constitu?? d'un oxyg??ne et un hydrog??ne atome maintenues ensemble par un liaison covalente, et portant une n??gative charge ??lectrique . Ce est un constituant naturel de l'eau. Il agit comme un base vers un acide , ou en tant que ligand vers un m??tal, en donnant une, deux ou trois paires d'??lectrons pour des centres m??talliques. L'ion hydroxyde est pr??sent dans les hydroxydes de groupe 1 et groupe 2 ??l??ments, ?? l'??tat solide. Ces hydroxydes dissocient en solution aqueuse, lib??rant des ions hydroxyde solvat??es. L'hydroxyde de sodium est un de plusieurs millions de tonnes par an produit chimique. Un groupe attach?? ?? un hydroxyde fortement centre ??lectropositif peut se dissocier, lib??rant un ion d'hydrog??ne, ce qui rend le compos?? parent un acide .
En chimie organique de l'ion hydroxyde peut agir en tant que catalyseur ou en tant que r??actif nucl??ophile. Un groupe OH, connu sous le nom un groupe hydroxyle, est pr??sent en des alcools , ph??nols acides carboxyliques et connexes compos??s organiques .
Ion hydroxyde
L'ion hydroxyde est un constituant naturel de l'eau, en raison de la r??action d'auto-ionisation:
- H + + OH -
 H 2 O
H 2 O
Le constante d'??quilibre de cette r??action, d??fini comme
- K w = [H +] [OH -]
a une valeur proche de 10 -14 ?? 25 ?? C, de sorte que le la concentration d'ions hydroxyde dans l'eau pure est proche de 10 -7 mol dm -3, afin de satisfaire la contrainte de charge ??gale. Le pH d'une solution est ??gale ?? la d??cimale cologarithme de la concentration en ions hydrog??ne; le pH de l'eau pure est proche de 7 ?? temp??rature ambiante. La concentration d'ions hydroxydes peut ??tre exprim??e en termes de pOH, qui est proche de 14 - pH, de sorte pOH d'eau pure est ??galement proche de 7. Ajout d'une base ?? l'eau permettra de r??duire la concentration d'ions d'hydrog??ne et donc augmenter la concentration en ions hydroxyde (augmentation du pH, de diminuer pOH) m??me si le base ne se contient pas d'hydroxyde. Par exemple, l'ammoniac solutions ont un pH sup??rieur ?? 7 en raison de la r??action NH 3 + H + ![]() NH 4 +, ce qui entra??ne une diminution de la concentration en ions hydrog??ne et une augmentation de la concentration en ions hydroxyde. pOH peut ??tre maintenue ?? une valeur pratiquement constante avec diverses des solutions tampons.
NH 4 +, ce qui entra??ne une diminution de la concentration en ions hydrog??ne et une augmentation de la concentration en ions hydroxyde. pOH peut ??tre maintenue ?? une valeur pratiquement constante avec diverses des solutions tampons.
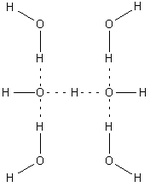
En la solution aqueuse d'hydroxyde ions est un base dans la Bronsted-Lowry sens car il peut accepter un proton d'un acide de Br??nsted-Lowry pour former une mol??cule d'eau. Il peut ??galement agir en tant que Base de Lewis faisant don d'une paire d'??lectrons ?? un acide de Lewis. En solution aqueuse ?? la fois de l'hydrog??ne et des ions hydroxyde sont fortement solvat??s, avec des liaisons hydrog??ne entre les atomes d'oxyg??ne et d'hydrog??ne. En effet, l'ion bihydroxide, H 3 O 2 -, a ??t?? caract??ris??e ?? l'??tat solide. Ce compos?? est centrosym??trique et a une liaison hydrog??ne tr??s courte (114,5 pm) qui est similaire ?? la longueur dans la ions bifluorure, HF 2 - (114 h). En solution aqueuse, l'ion hydroxyde forme des liaisons hydrog??ne fortes avec des mol??cules d'eau. Une cons??quence de ceci est que les solutions concentr??es d'hydroxyde de sodium ont une grande viscosit?? due ?? la formation d'un r??seau ??tendu de liaisons hydrog??ne comme dans des solutions de fluorure d'hydrog??ne.
En solution, l'ion hydroxyde r??agit rapidement avec l'atmosph??re de dioxyde de carbone , en qualit?? d'un acide, pour former un premier temps, la ion bicarbonate.
- OH - + CO 2
 HCO 3 -
HCO 3 -
La constante d'??quilibre de cette r??action peut ??tre sp??cifi??e soit par r??action avec du dioxyde de carbone dissous ou comme une r??action avec du gaz de dioxyde de carbone (voir l'acide carbonique pour les valeurs et les d??tails). A pH neutre ou acide, la r??action est lente, mais est catalys??e par la enzyme anhydrase carbonique qui cr??e effectivement hydroxyde ions au niveau du site actif.
Les solutions contenant de l'hydroxyde attaque d'ions verre . Dans ce cas, la silicates en verre agissent comme des acides. Des hydroxydes de base, si les mati??res solides ou en solution, sont stock??s dans contenants de plastique herm??tiques.
L'ion hydroxyde peut fonctionner comme un type donneur de paire d'??lectrons ligand, en formant de tels complexes que [Al (OH) 4] -. Il est ??galement souvent trouv?? dans des complexes mixtes-ligand de type [ML x (OH) y] z +, o?? L est un ligand. L'ion hydroxyde sert souvent ligand de pontage, en donnant une paire d'??lectrons pour chacun des atomes ??tant pont??. Comme illustr?? par [Pb 2 (OH)] 3+, hydroxydes m??talliques sont souvent ??crits dans un format simplifi??. Il peut m??me servir de trois donneur de paire d'??lectrons, comme dans le t??tram??re [PtMe 3 OH] 4).
Lorsqu'il est li?? ?? un centre m??tallique fortement ??lectro-attracteur, hydroxyde ligands ont tendance ?? ionise en ligands d'oxyde. Par exemple, l'ion dichromate, ??crit sous la forme [HCrO 4] -, se dissocie selon la
- [O 3 Cro-H] -
 [CrO 4] 2- + H +
[CrO 4] 2- + H +
avec un pKa d'environ 5,9.
Les spectres de vibration
Le Les spectres infrarouges de compos??s contenant le groupe OH ont de fortes bandes d'absorption dans la r??gion centr??e autour de 3500 cm -1. La haute fr??quence est un cons??quence de la faible masse de l'atome d'hydrog??ne par rapport ?? la masse de l'atome d'oxyg??ne, ce qui rend la d??tection de groupes hydroxyle par spectroscopie infrarouge relativement faciles en raison d'un groupe un groupe OH a tendance ?? ??tre forte. Cependant, la largeur de la bande augmente lorsque le groupe OH est impliqu?? dans la liaison hydrog??ne. Une mol??cule d'eau a une HOH mode de flexion ?? environ 1600 cm -1, de sorte que l'absence de cette bande peut ??tre utilis??e pour distinguer un groupe OH d'une mol??cule d'eau.
Lorsque le groupe OH est li?? ?? un ion m??tallique dans un complexe de coordination, un mode de flexion M-OH peut ??tre observ??e. Par exemple, dans [Sn (OH) 6] 2-, il se produit ?? 1065 cm -1. Le mode de flexion d'un hydroxyde de pontage a tendance ?? ??tre ?? une fr??quence plus basse que dans [( bipyridine) Cu (OH) 2 Cu ( bipyridine)] 2+ (955 cm -1). vibrations de M-OH ??tirement se produisent en dessous d'environ 600 cm -1. Par exemple, la t??tra??drique ion [Zn (OH) 4] 2- a des bandes ?? 470 cm -1 ( Raman-actif, polaris??e) et 420 cm -1 (infrarouge). La m??me ion a un (OH) Zn (OH) vibration de flexion ?? 300 cm -1.
Applications
hydroxyde de sodium solutions, aussi connu comme la lessive et de soude caustique, sont utilis??s dans la fabrication de p??tes et papier, textiles , l'eau potable , des savons et les d??tergents, et en tant que d??bouchage. La production mondiale en 2004 ??tait d'environ 60 millions de tonnes. La principale m??thode de fabrication est le processus de chlore-alcali.
Les solutions contenant l'ion hydroxyde sont g??n??r??s quand un sel d'un acide faible est dissous dans l'eau. Le carbonate de sodium est utilis?? comme un alcali, par exemple, en raison de la r??action d'hydrolyse
- CO 3 2- + H 2 O
 HCO 3 - OH + -; ( pK a2 = 10,33 ?? 25 ?? C et z??ro force ionique)
HCO 3 - OH + -; ( pK a2 = 10,33 ?? 25 ?? C et z??ro force ionique)
Bien que la force de la base de solutions de carbonate de sodium est inf??rieure ?? une solution d'hydroxyde de sodium concentr??, il a l'avantage d'??tre un solide. Il est ??galement fabriqu??e ?? grande ??chelle (42 millions de tonnes en 2005) par le Proc??d?? Solvay. Un exemple de l'utilisation de carbonate de sodium ?? titre d'alcali est quand cristaux de soude (un autre nom pour le carbonate de sodium) agit sur les esters insolubles, tels que triglyc??rides, commun??ment appel??es mati??res grasses, de les hydrolyser et de les rendre solubles.
Bauxite, un hydroxyde basique de l'aluminium , est le principal minerai ?? partir duquel le m??tal est fabriqu??. De m??me, goethite (α-FeO (OH)) et l??pidocrocite (γ-FeO (OH)), les hydroxydes de base de fer , sont parmi les principaux minerais utilis??s pour la fabrication de fer m??tallique. De nombreuses autres utilisations peuvent ??tre trouv??es dans les articles sur les hydroxydes individuels.
Des hydroxydes inorganiques
M??taux alcalins
Mis ?? part NaOH et KOH, qui b??n??ficient de tr??s grandes applications ?? grande ??chelle, les hydroxydes des m??taux alcalins autres sont ??galement utiles. L'hydroxyde de lithium est une base faible, avec pK b de 0,2. L'hydroxyde de lithium est utilis?? en respiration syst??mes de purification de gaz pour vaisseau spatial, sous-marins , et recycleurs pour ??liminer le dioxyde de carbone du gaz expir??.
- LiOH 2 + CO 2 → Li 2 CO 3 + H 2 O
L'hydroxyde de lithium est pr??f??r?? ?? celui du sodium en raison de sa faible masse. L'hydroxyde de sodium , l'hydroxyde de potassium et les hydroxydes des autres m??taux alcalins sont bases fortes.
M??taux alcalino-terreux
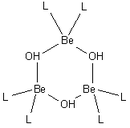
Les mol??cules d'eau sont attach??s ?? ??tre omis
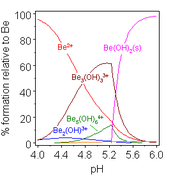
L'hydroxyde de b??ryllium, Be (OH) 2, est amphot??re. L'hydroxyde lui-m??me est insoluble dans l'eau, avec une produit de solubilit??, log K * sp, de -11,7. L'addition d'acide donne soluble produits d'hydrolyse, y compris l'ion trim??rique [3 Be (OH) 3 (H 2 O) 6] 3+, qui pr??sente des groupes OH de transition entre des paires d'ions de b??ryllium font un cycle ?? 6 cha??nons. A un pH tr??s faible de l'ion aqua [Be (H 2 O) 4] 2+ est form??. Addition d'hydroxyde de Be (OH) 2 donne la tetrahydroxo soluble anion [Be (OH) 4] 2-.
La solubilit?? dans l'eau des autres hydroxydes de ce groupe augmente avec le nombre atomique . L'hydroxyde de magn??sium, Mg (OH) 2, est une base faible mais l'hydroxyde de calcium est une base forte comme le sont les hydroxydes des m??taux alcalino-terreux lourds, l'hydroxyde de strontium et l'hydroxyde de baryum. Une solution / suspension d'hydroxyde de calcium est connu comme l'eau de chaux et peut ??tre utilis?? pour tester la faible de dioxyde de carbone de l'acide. La r??action Ca (OH) 2 + CO 2 ![]() Ca2 + [HCO 3] - + OH - illustre la forte basicit?? de l'hydroxyde de calcium. La chaux sod??e, ce qui est un m??lange de NaOH et Ca (OH) 2 est utilis?? comme un absorbeur de CO 2.
Ca2 + [HCO 3] - + OH - illustre la forte basicit?? de l'hydroxyde de calcium. La chaux sod??e, ce qui est un m??lange de NaOH et Ca (OH) 2 est utilis?? comme un absorbeur de CO 2.
??l??ments du groupe bore
L'hydroxyde simple de bore, B (OH) 3, connu sous le nom l'acide borique, est un acide. A la diff??rence des hydroxydes des hydroxydes alcalins et alcalino-terreux, il ne se dissocie pas en solution aqueuse. Au lieu de cela, il r??agit avec les mol??cules d'eau agissant comme un acide de Lewis, en lib??rant des protons.
- B (OH) 3 + H 2 O
 [B (OH) 4] - + H +
[B (OH) 4] - + H +
Une vari??t?? de oxyanions de bore sont connus, qui, dans la forme proton??e, contiennent des groupes hydroxydes.
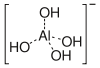
ion aluminate
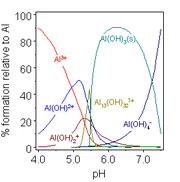
L'hydroxyde d'aluminium, Al (OH) 3 est amphot??re et se dissout dans une solution alcaline.
- Al (OH) 3 (solide) + OH - (aq)
 [Al (OH) 4] - (aq)
[Al (OH) 4] - (aq)
Dans le Proc??d?? Bayer pour la production d'oxyde d'aluminium pur ?? partir de min??raux de bauxite cet ??quilibre est manipul?? par un contr??le minutieux de la temp??rature et la concentration de base. Dans la premi??re phase, de l'aluminium dissout dans une solution alcaline chaude que [Al (OH) 4] - mais d'autres hydroxydes habituellement pr??sents dans le min??ral, tels que les hydroxydes de fer, ne se dissolvent pas, car ils ne sont pas amphot??re. Apr??s ??limination des mati??res insolubles, le soi-disant les boues rouges, de l'hydroxyde d'aluminium pur est fabriqu?? ?? pr??cipiter par abaissement de la temp??rature et l'addition d'eau ?? l'extrait, ce qui, par dilution de la substance alcaline, abaisse le pH de la solution. L'hydroxyde d'aluminium basique, AlO (OH), qui peut ??tre pr??sente dans la bauxite est ??galement amphot??re.
Dans les solutions l??g??rement acides des complexes hydroxo form?? par l'aluminium sont un peu diff??rentes de celles de bore, ce qui refl??te la plus grande taille de Al (III) par rapport ?? B (III). La concentration de l'esp??ce [13 Al (OH) 32] 7+ est tr??s d??pendante de la concentration totale en aluminium. Diverses autres complexes hydroxo se trouvent dans des compos??s cristallins. Peut-??tre le plus important est l'hydroxyde basique, AlO (OH), un mat??riau polym??re connu sous le nom des formes min??rales boehmite ou diaspore, en fonction de la structure cristalline. l'hydroxyde de gallium, l'hydroxyde d'indium et thallium hydroxydes (III) sont ??galement amphot??re. Le thallium (I) de l'hydroxyde est une base forte.
??l??ments du groupe du carbone
formes de carbone aucun hydroxydes simples. Le compos?? hypoth??tique C (OH) 4 est instable en solution aqueuse:
- C (OH) 4 → HCO 3 - + H 3 O +
- HCO 3 - + H +
 H 2 CO 3
H 2 CO 3
Le dioxyde de carbone est ??galement connu que l'anhydride carbonique, ce qui signifie qu'il se forme par d??shydratation de l'acide carbonique, H 2 CO 3 (OC (OH) 2).
L'acide silicique est le nom donn?? ?? une vari??t?? de compos??s ayant une formule g??n??rale [SiO x (OH) 4-2x] n. Acide orthosilicique ont ??t?? identifi??s dans une solution aqueuse tr??s dilu??e. Ce est un acide faible avec PK a1 = 9,84, pK a2 = 13,2 ?? 25 ?? C. Il est g??n??ralement ??crit comme H 4 SiO 4, mais la formule SiO 2 (OH) 2 est g??n??ralement accept??e. D'autres acides tels que l'acide silicique m??tasilicique (H 2 SiO 3), l'acide disilicic (H 2 Si 2 O 5), et de l'acide pyrosilicic (H 6 Si 2 O 7) ont ??t?? caract??ris??s. Ces acides ont des groupes hydroxyde ??galement attach??s au silicium; les formules sugg??rent que ces acides sont des formes proton??es de poly oxyanions.
Peu de complexes hydroxo de germanium ont ??t?? caract??ris??s. ??tain (II) un hydroxyde, Sn (OH) 2, a ??t?? pr??par?? dans un milieu anhydre. Quand l'oxyde d'??tain (II) est trait?? avec un alcali du complexe hydroxo pyramidal Sn (OH) 3 - est form??. Lorsque des solutions contenant des ions ce sont acidifi??s l'ion [3 Sn (OH) 4] 2+ est form??e avec des complexes hydroxo de base. La structure de la [3 Sn (OH) 4] 2+ a un triangle d'atomes d'??tain reli??s par des groupes de pontage hydroxyde. ??tain (IV) est inconnue, mais l'hydroxyde peut ??tre consid??r??e comme l'acide hypoth??tique ?? partir de laquelle les stannates, avec une formule [Sn (OH) 6] 2-, sont d??riv??s par r??action avec le (Lewis) ion hydroxyde basique.
L'hydrolyse du Pb 2+ en solution aqueuse est accompagn??e par la formation de diff??rents complexes hydroxo contenant, dont certains sont insolubles. Le complexe hydroxo base [Pb 6 O (OH) 6] 4+ est un groupe de six centres de plomb avec des liaisons m??tal-m??tal entourant un ion d'oxyde central. Les six groupes hydroxyde se trouvent sur les visages des deux externe Pb quatre t??tra??dres. Dans les solutions fortement alcalines solubles plombate ions sont form??s, y compris [Pb (OH) 6] 2-.
Autres ??l??ments principal groupe
 |  | 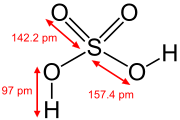 | 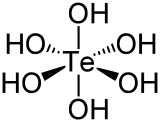 | 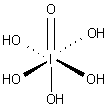 |
| L'acide de phosphore | L'acide phosphorique | Acide sulfurique | Acide tellurique | ortho acide p??riodique |
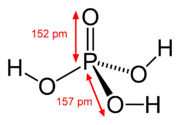
Dans les ??tats d'oxydation sup??rieurs des ??l??ments dans les groupes 5, 6 et 7, il ya oxacides dont l'atome central est fix?? ?? ions oxyde et des ions hydroxyde. Des exemples comprennent l'acide phosphorique , H 3 PO 4 et de l'acide sulfurique , H 2 SO 4. Dans ces compos??s, un ou plusieurs groupes hydroxyde peut dissocier avec la lib??ration d'ions hydrog??ne comme dans une norme L'acide de Br??nsted-Lowry. Beaucoup oxoacides de soufre sont connus et sont toutes dot??es groupes OH qui peuvent se dissocier.
Acide tellurique est souvent ??crit ?? la formule H 2 TeO 4 ?? 2H 2 O, mais est mieux d??crite comme structurellement Te (OH) 6.
L'acide -periodic Ortho peut perdre tous ses protons, pour finalement former l'ion periodate, [IO 4] -. Il peut ??galement ??tre proton?? dans des conditions fortement acides pour donner l'ion octa??drique [I (OH) 6] +, remplissant la s??rie iso??lectronique, [E (OH) 6] z, E = Sn, Sb, Te, I; z = -2, -1, 0, +1. D'autres acides de l'iode (VII) qui contiennent des groupes hydroxydes sont connus, en particulier en des sels tels que l'ion periodate m??so qui se produit dans K 4 [I 2 O 8 (OH) 2] ?? 8H 2 O.
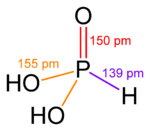
Comme il est courant en dehors des m??taux alcalins, les hydroxydes des ??l??ments dans les ??tats d'oxydation inf??rieurs sont compliqu??es. Par exemple, l'acide phosphoreux, H 3 PO 3, a principalement la structure OP (H) (OH) 2, en ??quilibre avec une petite quantit?? de P (OH) 3.
Les oxacides de chlore , brome et iode ont la formule O (n-1) / 2 A (OH) o?? n est le nombre d'oxydation, 1, 3 ou 5, et A = Cl, Br ou I. La seule oxacide de fluor est F (OH). Lorsque ces acides sont neutralis??s l'atome d'hydrog??ne est retir?? du groupe de l'hydroxyde.
Les m??taux de transition et post-transition
Les hydroxydes des m??taux de transition et m??taux post-transition ont g??n??ralement du m??tal dans le 2 (M = Mn, Fe, Co, Ni, Co, Zn) ou 3 (M = Fe, Ru, Rh, Ir) ??tat d'oxydation. Aucun ne est soluble dans l'eau, et beaucoup sont mal d??finis. Hydroxydes de m??taux ?? l'??tat d'oxydation +1 sont ??galement mal d??fnie ou instable. Par exemple, hydroxyde d'argent, Ag (OH), se d??compose spontan??ment en l'oxyde (Ag 2 O). Le cuivre (I) et d'or (I) sont les hydroxydes similaire instable, bien que des produits d'addition stables du CuOH et AuOH sont connus. Les compos??s polym??res M (OH) 2 et M (OH) 3 sont g??n??ralement pr??par??s en augmentant le pH d'une solution aqueuse de cations m??talliques correspondants jusqu'?? ce que l'hydroxyde pr??cipite dans la solution. A l'inverse, les hydroxydes se dissolvent dans une solution acide. l'hydroxyde de zinc, Zn (OH) 2, est amphot??re, formant le ion zincate, Zn (OH) 4 2- en solution fortement alcaline.
De nombreux complexes de ligands mixtes de ces m??taux avec l'ion hydroxyde en existe, en fait, ce sont g??n??ralement mieux d??finis que les d??riv??s simples. Beaucoup peut ??tre fait en provoquant la dissociation d'une mol??cule d'eau coordonn??e.
- L n M (OH) 2 + B
 L n M (OH) + BH + (L = ligand, B = base)
L n M (OH) + BH + (L = ligand, B = base)
Acide vanadique, H 3 VO 4, pr??sente des similitudes avec l'acide phosphorique, H 3 PO 4, mais il a une beaucoup plus complexe oxoanion chimie. L'acide chromique, H 2 CrO 4, pr??sente des similitudes avec l'acide sulfurique, H 2 SO 4; par exemple, tant sur la forme sels acides, A + [HMO 4] -. Certains m??taux, par exemple V, Cr, Nb, Ta, Mo, W, ont tendance ?? exister dans des ??tats d'oxydation ??lev??s. Plut??t que de former des hydroxydes en solution aqueuse, ils sont convertis en groupes oxo par le proc??d?? de olation, formant polyoxom??talates.
Les sels basiques contenant de l'hydroxyde
Dans certains cas, les produits d'hydrolyse partielle des ions m??talliques, d??crits ci-dessus, peut ??tre trouv??e dans les compos??s cristallins. Un exemple frappant est trouv?? avec le zirconium (IV). En raison de l'??tat d'oxydation ??lev??, sels de Zr 4+ sont largement hydrolys?? dans l'eau, m??me ?? faible pH. Le compos?? initialement formul??e comme ZrOCl 2 ?? 8H 2 O se est r??v??l?? ??tre le sel de chlorure d'un cation t??tram??rique, [4 Zr (OH) 8 (H 2 O) 16] 8+ dans lequel il est un carr?? d'ions Zr 4+ avec deux groupes hydroxyde pontage entre atomes Zr de chaque c??t?? de la place et avec quatre mol??cules d'eau attach??s chaque atome de Zr.
Le min??ral malachite est un exemple typique d'un carbonate basique. La formule, Cu 2 CO 3 (OH) 2 montre qu'il est conceptuellement mi-chemin entre le carbonate de cuivre et l'hydroxyde de cuivre. En effet, dans le pass??, la formule a ??t?? ??crit comme CuCO 3 ?? Cu (OH) 2. Le structure cristalline est constitu??e de cuivre, le carbonate et des ions hydroxyde. Le min??ral atacamite est un exemple d'un chlorure basique. Il a la formule, Cu 2 Cl (OH) 3. Dans ce cas, la composition est plus proche de celle de l'hydroxyde de celle du chlorure, CuCl 2 ?? 3Cu (OH) 2. formes en cuivre de phosphate (hydroxy libethenite), ars??niate ( OLIVENITE), sulfate ( brochantite) et les compos??s de nitrate. La c??ruse est une base de plomb carbonate, (PbCO 3) 2 ?? Pb (OH) 2 qui a ??t?? utilis?? en tant que pigment blanc en raison de sa qualit?? opaque, bien que son utilisation est actuellement limit??e, car il peut ??tre une source de empoisonnement au plomb.
Chimie structurale
L'ion hydroxyde semble tourner librement dans les cristaux des hydroxydes de m??taux alcalins lourds ?? des temp??ratures plus ??lev??es de fa??on ?? se pr??senter comme un ion sph??rique, avec une rayon ionique d'environ 153 heures. Ainsi, les formes ?? haute temp??rature de KOH et NaOH ont le chlorure de sodium structure qui bloque progressivement dans une structure de chlorure de sodium monocinically d??form?? ?? des temp??ratures inf??rieures ?? environ 300 ?? C. Les groupes OH tournent toujours, m??me ?? la temp??rature ambiante autour de leurs axes de sym??trie et donc ne peuvent pas ??tre d??tect??s par Diffraction aux rayons X. La forme de NaOH ?? temp??rature ambiante a le Structure de l'iodure de thallium. LiOH, cependant, a une structure en couches, compos??e de t??tra??dres Li (OH) 4 et (OH) Li 4 unit??s. Cela est compatible avec le caract??re faiblement basique dans une solution de LiOH, ce qui indique que la liaison Li-OH a beaucoup de caract??re covalent.
Les ions d'hydroxyde affiche sym??trie cylindrique en hydroxydes de m??taux divalents de Ca, Cd, Mn, Fe, et Co. Par exemple, l'hydroxyde de magn??sium, Mg (OH) 2 ( brucite) cristallise avec le structure de la couche de cadmium de l'iodure, avec une sorte de gros emballage des ions magn??sium et hydroxyde.
L'hydroxyde amphot??re Al (OH) 3 a quatre formes cristallines majeures: gibbsite (le plus stable), bayerite, nordstrandite et doyleite. Toutes ces formes polymorphes sont constitu??es de doubles couches d'ions hydroxydes - les atomes d'aluminium sur les deux tiers des trous octa??driques entre les deux couches - et ne diff??rent que dans la s??quence d'empilement des couches. Les structures sont similaires ?? la structure de la brucite. Cependant, alors que la structure de la brucite peut ??tre d??crit comme une structure tr??s condens??e dans gibbsite les groupes OH sur la face inf??rieure d'une couche de repos sur les groupes de la couche inf??rieure. Cette disposition conduit ?? la suggestion que des liaisons directionnelles entre groupes OH dans les couches adjacentes. Ce est une forme inhabituelle de la liaison hydrog??ne depuis deux ions hydroxyde impliqu?? pourrait se attendre ?? pointer l'un de l'autre. Les atomes d'hydrog??ne ont ??t?? localis??s par exp??riences de diffraction de neutrons sur αAlO (OH) ( diaspore). La distance OHO est tr??s courte, ?? 265 heures; l'hydrog??ne ne est pas ?? ??gale distance entre les atomes d'oxyg??ne et la liaison courte OH fait un angle de 12 ?? avec la ligne de OO. Un type de liaison hydrog??ne similaire a ??t?? propos?? pour d'autres hydroxydes amphot??res, y compris Be (OH) 2, Zn (OH) 2 et de Fe (OH) 3
Un certain nombre d'hydroxydes mixtes sont connus avec stoechiom??trie A 3 M III (OH) 6, A 2 M IV (OH) 6 V et AM (OH) 6. Comme la formule sugg??re que ces substances contiennent M (OH) 6 unit??s structurelles octa??driques. Hydroxydes doubles stratifi??s peuvent ??tre repr??sent??s par la formule [M z + 1-x M 3+ x (OH) 2] q + (n-X) q / n ?? y H 2 O. Le plus souvent, z = 2, et M 2+ = Ca 2+, Mg 2+, Mn 2+, Fe 2+, Co 2+, Ni 2+, Cu 2+ ou Zn 2+; donc q = x.
Dans les r??actions organiques
L'hydroxyde de potassium et de l'hydroxyde de sodium sont deux bien connus r??actifs dans la chimie organique .
Base de catalyse
L'ion hydroxyde peut agir comme un catalyseur base. La base abstraction d'un proton d'un acide faible pour donner un interm??diaire qui passe ?? r??agir avec un autre r??actif. Substrats communs pour l'abstraction protons sont des alcools , des ph??nols , des amines et des acides de carbone. Le pK une valeur pour la dissociation d'une liaison CH est extr??mement ??lev??, mais le pKa hydrog??nes en alpha d'un compos?? carbonyle sont d'environ 3 unit??s logarithmiques inf??rieur. Valeurs a pK typiques sont 16,7 pour l'ac??tald??hyde et de 19 l'ac??tone . La dissociation peut se produire en pr??sence d'une base convenable.
- RC (O) CH 2 R '+ B
 RC (O) CH - R '+ BH +
RC (O) CH - R '+ BH +
La base doit avoir un pKa d'au moins environ 4 unit??s log ou plus petit de l'??quilibre se situera presque compl??tement vers la gauche.
L'ion hydroxyde par elle-m??me ne est pas une base suffisamment forte, mais elle peut ??tre convertie en une par addition d'hydroxyde de sodium ?? l'??thanol
- OH - + EtOH
 EtO - + H 2 O
EtO - + H 2 O
pour produire le ions ??thylate. Le pK un pour l'auto-dissociation de l'??thanol est d'environ 16 de sorte que le ion alcoolate est une base suffisamment forte L'addition d'un alcool en un ald??hyde pour former un h??miac??tal est un exemple d'une r??action qui peut ??tre catalys??e par la pr??sence d'hydroxyde. Hydroxyde peut aussi agir comme un catalyseur de Lewis-base.
En tant que r??actif nucl??ophile
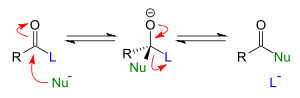
L'ion hydroxyde est l'interm??diaire dans entre la nucl??ophilie ion fluorure, F -, et la ion amide, NH 2 -. L'hydrolyse d'un ester,
- R 1 C (O) OR 2 + H 2 O
 R 1 C (O) OH + HOR 2
R 1 C (O) OH + HOR 2
aussi connu sous saponification est un exemple d'un substitution nucl??ophile avec l'action d'ions hydroxyde comme nucl??ophile. Dans ce cas, le groupe partant est un ion alcoolate, ce qui supprime imm??diatement un proton d'une mol??cule d'eau pour former un alcool . Dans la fabrication de savon, le chlorure de sodium est ajout?? ?? le sel de sel de sodium de l'acide carboxylique; ce est un exemple de l'application de la effet de l'ion commun.
Autres cas o?? l'hydroxyde peut agir comme un r??actif nucl??ophile sont amide hydrolyse, la R??action de Cannizzaro, substitution nucl??ophile aliphatique , une substitution aromatique nucl??ophile et r??actions d'??limination. Le milieu r??actionnel pour KOH et NaOH est g??n??ralement de l'eau mais avec une l'anion hydroxyde catalyseur de transfert de phase peut ??tre la navette dans un solvant organique et, par exemple dans la production de dichlorocarb??ne.
Les groupes hydroxy dans les compos??s organiques
Compos??s organiques tels que des alcools , les ph??nols et les acides carboxyliques contiennent des groupes hydroxyle. Chaque classe de compos??s subit des r??actions sp??cifiques ?? cette cat??gorie.
