Substitution nucl??ophile
Renseignements g??n??raux
Enfants SOS ont produit une s??lection d'articles de wikipedia pour les ??coles depuis 2005. Une bonne fa??on d'aider d'autres enfants est de parrainer un enfant
En organique et chimie inorganique , substitution nucl??ophile est une classe fondamentale de r??actions dans lesquelles un ??lectron nucl??ophile obligations s??lectivement avec ou attaques la charge positive ou partiellement positive d'un atome ou un groupe d'atomes appel?? groupe partant; l'atome ou partiellement positif positif est appel?? un ??lectrophile.
La forme la plus g??n??rale ?? la r??action peut ??tre donn??e quant
- Nuc: + R-LG → R-Nuc + LG:
La paire d'??lectrons (:) ?? partir du nucl??ophile (Nuc) attaque le substrat (R-LG), formant une nouvelle liaison, tandis que le groupe partant (LG) se ??carte avec une paire d'??lectrons. Le produit principal dans ce cas est R-Nuc. Le nucl??ophile peut ??tre ??lectriquement neutre ou charg?? n??gativement, tandis que le substrat est g??n??ralement neutre ou charg?? positivement.
Un exemple de substitution nucl??ophile est le l'hydrolyse d'un alkyl bromure, R -Br, dans des conditions alcalines, o?? le nucl??ophile est l'attaque OH - et la groupe partant est Br -.
- R-Br + OH - → R-OH + Br -
R??actions de substitution nucl??ophile sont monnaie courante en chimie organique, et ils peuvent ??tre class??s comme ayant lieu ?? un satur?? carbone aliphatique ou (moins souvent) un cycle satur?? centre aromatique carbon?? non satur?? ou d'un autre.
Substitution nucl??ophile dans les centres de carbone satur??s
S N 1 et N 2 S r??actions
En 1935, Edward D. Hughes et Sir Christopher Ingold a ??tudi?? les r??actions de substitution nucl??ophiles de des halog??nures d'alkyle et des compos??s apparent??s. Ils ont propos?? qu'il y avait deux principaux m??canismes ?? l'??uvre, tous les deux en concurrence avec l'autre. Les deux principaux m??canismes sont les S 1 N et la r??action N 2 S r??action. S signifie la substitution chimique, N signifie nucl??ophile, et le nombre repr??sente la Afin cin??tique de la r??action.
Dans la r??action de N 2 S, l'addition de l'agent nucl??ophile et l'??limination du groupe partant ont lieu simultan??ment. N 2 S se produit lorsque l'atome de carbone central est facilement accessible pour le nucl??ophile. En revanche, le S N 1 r??action implique deux ??tapes. S N 1 r??actions ont tendance ?? ??tre importante lorsque l'atome de carbone central du substrat est entour?? de groupes volumineux, ?? la fois parce que ces groupes interf??rent st??riquement avec la r??action de S 2 N (discut?? ci-dessus) et il se forme en raison de carbone substitu??s une tr??s stables carbocation.
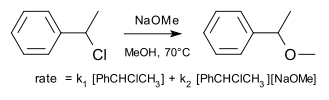
Un exemple d'une r??action de substitution qui se d??roule par un m??canisme dit borderline comme ??tudi?? l'origine par Hughes et Ingold est la r??action de chlorure de 1-ph??nyl??thyle avec m??thoxyde de sodium dans du methanol.
La vitesse de r??action se trouve ?? la somme de S N 1 et N 2 S composants avec 61% (3,5 M, 70 ?? C) qui se d??roulent par ce dernier.
| Substitution nucl??ophile sur le carbone | |
|---|---|
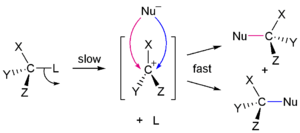 | 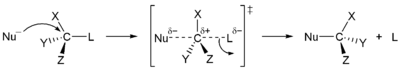 |
| 1 S N m??canisme | N 2 S m??canisme |
| Tableau 1. substitutions nucl??ophiles sur RX (une halog??nures d'alkyle ou ??quivalent) | |||||||
|---|---|---|---|---|---|---|---|
| Facteur | S N 1 | S N 2 | Commentaires | ||||
| Cin??tique | Taux = k [RX] | Taux = k [RX] [Noy] | |||||
| Un groupe alkyle primaire | Jamais moins que des groupes suppl??mentaires de stabilisation pr??sente | Bon ?? moins un nucl??ophile ?? emp??chement st??rique est utilis?? | |||||
| Un groupe alkyle secondaire | Mod??r?? | Mod??r?? | |||||
| Alkyle tertiaire | Excellent | Jamais | ??limination probable si chauff?? ou si la base forte utilis??e | ||||
| Groupe partant | Important | Important | Pour les halog??nes, I> Br> Cl >> F | ||||
| Nucl??ophilie | Sans importance | Important | |||||
| Preferred solvant | Polaire protique | Polaire aprotique | |||||
| St??r??ochimie | Rac??misation (+ partielle inversion possible) | Inversion | |||||
| R??arrangements | Commun | Rare | r??action secondaire | ||||
| ??liminations | Commune, en particulier avec des nucl??ophiles de base | Seulement avec chaleur et base nucl??ophiles | r??action secondaire esp. si chauff?? | ||||
Des r??actions de substitution nucl??ophiles
Il ya de nombreuses r??actions en chimie organique qui impliquent ce type de m??canisme. Les exemples communs incluent
- R??ductions organiques avec des hydrures, par exemple
- r??actions d'hydrolyse tels que
- R-Br + OH - → R-OH + Br - (S N 2) ou
- R-Br + H 2 O → R-OH + HBr (S N 1)
- Synth??se de Williamson
- R-Br + OR '- → R-OR ' + Br - (S N 2)
- Le Synth??se Wenker, une r??action d'aminoalcools anneau de fermeture.
- Le R??action de Finkelstein, une r??action d'??change d'halog??ne. Nucl??ophiles phosphore apparaissent dans le Et la r??action Perkow R??action de Michaelis-Arbuzov.
- Le La synth??se de Kolbe nitrile, la r??action d'halog??nures d'alkyle avec des cyanures.
Autres m??canismes
Outre S N 1 et N 2 S, d'autres m??canismes sont connus, m??me se ils sont moins fr??quents. Le S N i m??canisme est observ??e dans des r??actions de le chlorure de thionyle avec des alcools , et il est similaire ?? S N 1, sauf que le nucl??ophile est d??livr?? ?? partir du m??me c??t?? que le groupe partant.
Substitutions nucl??ophiles peuvent ??tre accompagn??s d'un r??arrangement allylique comme on le voit dans les r??actions telles que la R??arrangement Ferrier. Ce type de m??canisme est appel?? S N 1 'S ou N 2' r??action (en fonction de la cin??tique). Avec des halog??nures ou sulfonates allyliques, par exemple, le nucl??ophile peut attaquer l'atome de carbone insatur?? ?? γ ?? la place de l'atome de carbone portant le groupe partant. Ceci peut ??tre vu dans la r??action de 1-chloro-2-but??ne avec de l'hydroxyde de sodium pour donner un m??lange de 2-but??ne-1-ol et 1-but??ne-3-ol:
- CH 3 CH = CH-CH 2 -Cl → CH 3 CH = CH-CH 2 -OH + CH 3 CH (OH) -CH = CH 2
Le M??canisme Sn1CB appara??t dans la chimie inorganique . M??canismes concurrents existent.
Substitution nucl??ophile dans les centres de carbone insatur??s
Substitution nucl??ophile via le m??canisme 2 S N 1 ou N S ne se produisent g??n??ralement avec vinyle ou aryle halog??nures ou des compos??s apparent??s. Dans certaines conditions, des substitutions nucl??ophiles peuvent se produire, par l'interm??diaire d'autres m??canismes tels que ceux d??crits dans le article nucl??ophile de substitution aromatique.
Lorsque la substitution se produit ?? la un groupe carbonyle, le groupe acyle peut subir substitution nucl??ophile. Ce est le mode normal de substitution avec des acides carboxyliques d??riv??s tels que les chlorures d'acyle, esters et amides.