
Zirconium
Saviez-vous ...
SOS Enfants produite ce site pour les ??coles ainsi que ce site de vid??o sur l'Afrique . Visitez le site Web d'enfants SOS au http://www.soschildren.org/
| Zirconium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
40 Zr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
blanc argent??  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | zirconium, Zr, 40 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / z ər k oʊ n Je ə m / zər- KOH de-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cat??gorie Metallic | m??tal de transition | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | 4, 5, r?? | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 91,224 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Kr ] 5s 2 4d 2 2, 8, 18, 10, 2 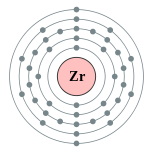 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Martin Heinrich Klaproth (1789) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | J??ns Jakob Berzelius (1824) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 6,52 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 5,8 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 2128 K , 1855 ?? C, 3371 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 4682 K, 4409 ?? C, 7968 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 14 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 573 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 25,36 J ?? mol -1 .K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 4, 3, 2, 1 ( l'oxyde amphot??re) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 1,33 (??chelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1er: 640,1 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 1270 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 2218 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 160 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 175 ?? 19 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | (20 ?? C) 421 nΩ ?? m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 22,6 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ?? C) de 5,7 um ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 3,800 m ?? s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 88 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 33 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 91,1 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,34 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Mohs | 5.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Vickers | 903 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Brinell | 650 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-67-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes du zirconium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le zirconium est un ??l??ment chimique avec le symbole Zr, de num??ro atomique 40 et de masse atomique 91,224. Le nom de zirconium est extrait de la mati??re min??rale zircon, la source la plus importante de zirconium. Ce est un gris-blanc, brillant solide m??tal de transition qui ressemble titane . Le zirconium est utilis?? principalement comme r??fractaire et opacifiant, m??me se il est utilis?? en petites quantit??s comme agent d'alliage pour sa forte r??sistance ?? la corrosion. Zirconium forme une vari??t?? de min??ral et des compos??s organom??talliques tels que le dioxyde de zirconium et le dichlorure de zirconoc??ne, respectivement. Cinq isotopes se produisent naturellement, dont trois sont stables. compos??s de zirconium ont pas connu r??le biologique.
Caract??ristiques
Le zirconium est un brillant, blanc gris??tre, mou, et ductile m??tal mall??able qui est solide ?? temp??rature ambiante, mais il devient dur et fragile ?? des puret??s inf??rieures. Sous forme de poudre, de zirconium est hautement inflammable, mais la forme solide est beaucoup moins sujettes ?? l'inflammation. Le zirconium est hautement r??sistant ?? la corrosion par les acides, les alcalis, de l'eau sal??e et d'autres agents. Cependant, il se dissoudra dans chlorhydrique et l'acide sulfurique , en particulier lorsque du fluor est pr??sent. Alliages avec le zinc deviennent magn??tique en dessous de 35 K.
Le point de fusion de zirconium est 1855 ?? C (3371 ?? F), et son point d'??bullition est 4371 ?? C (7900 ?? F). Le zirconium a un ??lectron??gativit?? de 1,33 sur l'??chelle de Pauling. Parmi les ??l??ments ?? l'int??rieur D-Block, zirconium a l'??lectron??gativit?? quatri??me plus bas apr??s l'yttrium , lut??tium et de hafnium .
A temp??rature ambiante zirconium pr??sente une structure cristalline hexagonale tr??s compacte, α-Zr, qui change de β-Zr une structure cristalline cubique centr??e ?? 863 ?? C. Zirconium existe dans la phase β jusqu'?? ce que le point de fusion.
ZrZn 2 est une des deux seules substances pour exposer la supraconductivit?? et ferromagn??tisme simultan??ment, l'autre ??tant UGE 2.
Isotopes

Naturellement zirconium survenant est compos?? de cinq isotopes. 90 Zr, 91 Zr, 92 Zr et 94 Zr sont stables. 94 Zr peut subir la double d??sint??gration b??ta (non observ?? exp??rimentalement) avec une demi-vie de plus de 1,10 ?? 10 17 ans. 96 Zr a une demi-vie de 2,4 ?? 10 19 ann??es, ce qui rend le radio-isotope plus longue dur??e de zirconium. Parmi ces isotopes naturels, 90 Zr est la plus courante, repr??sentant 51,45% de l'ensemble de zirconium. 96 Zr est le moins commun, comprenant seulement 2,80% de zirconium.
Vingt-huit isotopes artificiels de zirconium ont ??t?? synth??tis??s, allant de la masse atomique de 78 ?? 110. 93 Zr est l'isotope artificielle la plus longue dur??e, avec une demi-vie de 1,53 ?? 10 6 ann??es. 110 Zr, le plus lourd isotope du zirconium, est aussi la plus courte dur??e de vie, avec une demi-vie estim??e de seulement 30 millisecondes. Les isotopes radioactifs ?? ou au-dessus nombre de masse 93 d??sint??gration par β -, tandis que ceux ?? ou en dessous de 89 d??sint??gration par β +. La seule exception est 88 Zr, qui se d??sint??gre par ε.
Cinq isotopes de zirconium existent ??galement en tant que isom??res m??tastables: 83m Zr, 85m Zr, 89m Zr, 90M1 Zr, 90m2 Zr et 91m Zr. Parmi ceux-ci, 90m2 Zr a la demi-vie plus courte ?? 131 nanosecondes. 89m Zr est le plus long v??cu avec une demi-vie de 4,161 minutes.
Occurrence

Le zirconium a une concentration d'environ 130 mg / kg au sein de la La cro??te terrestre et environ 0,026 mg / L dans l'eau de mer . Il ne est pas trouv?? dans la nature en tant que m??tal natif, refl??tant son instabilit?? intrins??que par rapport ?? l'eau. La principale source commerciale de zirconium est le silicate min??ral, zircon (ZrSiO 4), qui se trouve principalement en Australie, le Br??sil, l'Inde, la Russie, l'Afrique du Sud et les ??tats-Unis, ainsi que dans les petits gisements dans le monde entier. 80% des mines de zircon se produit en Australie et en Afrique du Sud. ressources Zircon d??passer 60 millions de tonnes dans le monde entier et la production annuelle de zirconium dans le monde entier est d'environ 900 000 tonnes m??triques. Zirconium se produit ??galement dans plus de 140 autres min??raux, y compris les minerais commercialement utiles baddeleyite et kosnarite.
Zr est relativement abondant dans S-Type ??toiles, et il a ??t?? d??tect?? dans le soleil et dans les m??t??orites. ??chantillons de roches lunaires ramen??s de plusieurs Missions du programme Apollo vers la lune ont une zirconium assez ??lev?? teneur en oxyde par rapport ?? roches terrestres.
Production

Le zirconium est un sous-produit de l'extraction et du traitement des titane min??raux ilm??nite et rutile, ainsi que de l'??tain mini??re. De 2003 ?? 2007, les prix de zircon ont cess?? d'augmenter de 360 $ ?? 840 $ par tonne.
Apr??s avoir ??t?? captur??s dans les eaux c??ti??res, de sable contenant zircon est purifi?? par concentrateurs spirale pour enlever des mat??riaux plus l??gers, qui sont ensuite plac??es dans l'eau en toute s??curit??, car ils sont tous les composants naturels de sable de la plage. Utilisation s??paration magn??tique, les minerais de titane ilm??nite et rutile sont enlev??s.
La plupart zircon est utilis?? directement dans des applications commerciales, mais quelques pour cent est converti en le m??tal. La plupart des m??taux Zr est produit par la r??duction du zirconium (IV) avec le chlorure de magn??sium dans le m??tal Proc??d?? Kroll. Zirconium de qualit?? commerciale pour la plupart des usages a encore une teneur de 1% ?? 3% de hafnium. Ce contaminant ne est pas important sauf dans des applications nucl??aires. Le m??tal obtenu est fritt?? jusqu'?? ductile suffisamment pour le travail des m??taux.
La s??paration du zirconium et de l'hafnium
Zirconium m??tallique du commerce contient habituellement de 1 ?? 2,5% de hafnium , qui ne est pas un probl??me parce que les propri??t??s chimiques de l'hafnium et le zirconium sont assez similaires. Leurs propri??t??s neutrophages diff??rent fortement, cependant, ce qui n??cessite la s??paration du hafnium de zirconium pour les applications impliquant des r??acteurs nucl??aires. Plusieurs dispositifs de s??paration sont en cours d'utilisation. Le extraction liquide-liquide de la d??riv??s thiocyanate-oxyde, exploite les l??g??rement plus grande solubilit?? du d??riv?? de hafnium m??thylisobutylc??tone vs eau. Cette m??thode est utilis??e principalement dans Etats-Unis. Zr et Hf peuvent ??galement ??tre s??par??s par cristallisation fractionn??e de l'hexafluorozirconate de potassium (K 2 ZrF 6), qui est moins soluble dans l'eau que le d??riv?? d'hafnium analogue. La distillation fractionn??e des t??trachlorures, ??galement appel??e distillation extractive, est utilis?? principalement en Europe. Une ACV (fusion ?? l'arc sous vide) processus quadruple, combin??e avec l'extrusion ?? chaud et les applications de roulement est durcie en utilisant diff??rents gaz haute pression ?? haute temp??rature autoclavage, r??sultant en zirconium de qualit?? r??acteur qui est environ 10 fois plus cher que le grade commercial hafnium contamin??s. Le hafnium s??par?? peut ??tre utilis?? pour tiges du r??acteur de commande. La s??paration du hafnium est particuli??rement important pour les applications nucl??aires depuis Hf a tr??s haute absorption des neutrons coupe, 600 fois plus ??lev?? que le zirconium, et doit donc ??tre pr??sente pour des applications de r??acteurs.
Compos??s
Comme d'autres m??taux de transition , le zirconium forme une large gamme de compos??s inorganiques et des complexes de coordination. En g??n??ral, ces compos??s sont des solides diamagn??tiques incolores dans lequel Zr a l' ??tat d'oxydation IV +. Beaucoup moins de Zr (III) les compos??s sont connus, et Zr (II) est tr??s rare.
Oxydes, nitrures et les carbures
L'oxyde le plus commun est le dioxyde de zirconium, ZrO 2, ??galement appel??e zircone. Ce solide incolore a exceptionnelle t??nacit?? ?? la rupture et la r??sistance chimique, en particulier dans sa forme cubique. Ces propri??t??s font de zircone utile en tant que rev??tement de barri??re thermique, mais ce est aussi un courant de diamant substitut. Zirconium tungstate est une substance inhabituel en ce qu'il se r??tracte dans toutes les directions lorsqu'il est chauff??, tandis que la plupart des autres substances ??largir lorsqu'il est chauff??. Le chlorure de zirconyle est un complexe de zirconium soluble dans l'eau rare, il r??pond ?? la formule relativement complexe [4 Zr (OH) 12 (H 2 O) 16] Cl 8.
Le carbure de zirconium et le nitrure de zirconium sont des solides r??fractaires. Le carbure est utilis?? pour fabriquer des outils de forage et tranchants. Zirconium (II) d'hydrure est ??galement connue.
Halog??nures et pseudohalog??nures
Tous les quatre halog??nures communes sont connus, ZrF4, ZrCl 4, 4 et ZrBr ZRI 4. Tous ont des structures polym??res et sont beaucoup moins volatils que les t??trahalog??nures de titane monom??res correspondants. Tous ont tendance ?? hydrolyser pour donner les soi-disant oxyhalog??nures et dioxydes. Le t??tra correspondant les alcoxydes sont ??galement connus. A la diff??rence des halog??nures, des alcoolates se dissolvent dans des solvants non polaires.
D??riv??s organiques

Organozirconium chimie est l'??tude des compos??s contenant un carbone liaison zirconium. Le premier est compos?? zirconoc??ne dibromure ((C 5 H 5) 2 ZrBr 2), rapport?? en 1952 par Birmingham et Wilkinson. R??actif de Schwartz, pr??par?? en 1970 par PC Wailes et H. Weigold, est un m??talloc??ne utilis?? dans synth??se organique pour les transformations de alc??nes et alcynes. Le zirconium est ??galement un composant d'une partie Les catalyseurs de Ziegler-Natta, utilis??s pour produire polypropylene. Cette application exploite la capacit?? de zirconium pour former r??versible obligations au carbone. La plupart des complexes de Zr (II) sont des d??riv??s de zirconacene, un exemple ??tant (C 5 Me 5) 2 Zr (CO) 2.
Histoire
Le min??ral contenant du zirconium zircon et min??raux connexes ( jargoon, jacinthe, hyacinthe, ligure) ont ??t?? mentionn??s dans les ??crits bibliques. Le min??ral ne ??tait pas connu pour contenir un ??l??ment nouveau jusqu'en 1789, lorsque Klaproth a analys?? un jargoon de l'??le de Ceylan (aujourd'hui Sri Lanka). Il a nomm?? le nouvel ??l??ment Zirkonerde (zircone). Humphry Davy a tent?? d'isoler cet ??l??ment nouveau en 1808 par ??lectrolyse, mais a ??chou??. Zirconium m??tallique a ??t?? obtenu dans une forme impure en 1824 par Berzelius en chauffant un m??lange de potassium et le fluorure de zirconium dans un tube de fer.
Le processus de barre de cristal (aussi connu comme le processus d'iodure), d??couvert par Eduard van Arkel et Jan Hendrik de Boer en 1925, a ??t?? le premier proc??d?? industriel pour la production commerciale de zirconium m??tallique. Le proc??d?? implique la formation et la d??composition thermique subs??quente de zirconium t??traiodure. Cette m??thode a ??t?? remplac?? en 1945 par le beaucoup moins cher Kroll processus d??velopp?? par William Justin Kroll, dans lequel le t??trachlorure de zirconium est r??duite de magn??sium:
- ZrCl 4 + 2 → Mg Zr + 2 MgCl2
Applications
Environ 900 000 tonnes de minerais Zr ont ??t?? produites dans le commerce en 1995, principalement en zircon.
Compos??s
La grande majorit?? de zircon est utilis?? directement dans une vari??t?? d'applications ?? haute temp??rature. Ce mat??riau est dur et r??fractaire, ainsi que r??sistant ?? l'attaque chimique. En raison de ces propri??t??s, le zircon trouve de nombreuses applications, dont quelques-uns sont tr??s m??diatis??s. Son utilisation principale est comme opacifiant, conf??rant un aspect blanc opaque aux mat??riaux c??ramiques. En raison de sa r??sistance chimique, le zircon est ??galement utilis?? dans des environnements agressifs, tels que les moules pour les m??taux en fusion. Le dioxyde de zirconium (ZrO 2) est utilis?? dans des creusets de laboratoire, des fours m??tallurgiques, en tant que mat??riau r??fractaire, et il peut ??tre fritter dans un couteau en c??ramique. Zircon (ZrSiO 4) est coup?? en pierres pr??cieuses pour une utilisation dans les bijoux .
M??tal
Une petite fraction du zircon est converti en m??tal, qui trouve diverses applications de niche. Parce que d'une excellente r??sistance ?? la corrosion du zirconium, il est souvent utilis?? comme agent d'alliage dans les mat??riaux qui sont expos??s ?? des environnements agressifs, tels que les appareils chirurgicaux, des filaments de lumi??re et bo??tiers de montres. La forte r??activit?? du zirconium vers oxyg??ne, apparente seulement ?? des temp??ratures ??lev??es, est la base de certaines applications sp??cialis??es comme amorces explosives et que getters dans des tubes ?? vide. Le m??me comportement est probablement la base de l'utilisation de Zr comme nanoparticules mati??re pyrophorique des armes explosives comme le BLU-97 / B Effets combin??s Bombe pour effet incendiaire.
Les applications nucl??aires
Rev??tement pour les combustibles des r??acteurs nucl??aires consomme environ 1% de l'approvisionnement de zirconium. A cet effet, il est principalement utilis?? sous la forme de zircaloys. Les avantages de Zr est leur faible capture de neutrons la section transversale et une bonne r??sistance ?? la corrosion dans des conditions normales de service. Le d??veloppement de proc??d??s efficaces pour la s??paration du zirconium de l'hafnium est n??cessaire pour cette application.
L'un des inconv??nients des alliages de zirconium est leur r??activit?? ?? l'??gard de l'eau ?? des temp??ratures ??lev??es conduit ?? la formation d' hydrog??ne gazeux et ?? la d??gradation acc??l??r??e du carburant gaine de la barre:
- Zr + 2 H 2 O → ZrO 2 + 2 H 2
Cette r??action exothermique est tr??s lente en dessous de 100 ?? C, mais ?? une temp??rature sup??rieure ?? 900 ?? C la r??action est rapide. La plupart des m??taux subissent des r??actions similaires. La r??action d'oxydo-r??duction est pertinente ?? l'instabilit?? de les assemblages de combustible ?? haute temp??rature. Cette r??action ??tait responsable d'une petite explosion d'hydrog??ne observ??e pour la premi??re ?? l'int??rieur du b??timent du r??acteur de Three Mile Island centrale nucl??aire en 1979, mais ensuite, l'enceinte de confinement n'a pas ??t?? endommag??. La m??me r??action a eu lieu dans les r??acteurs 1, 2 et 3 de la Fukushima centrale nucl??aire (Japon) apr??s le refroidissement des r??acteurs a ??t?? interrompu par la tremblement de terre et le tsunami du 11 Mars 2011, conduisant ?? la Accidents nucl??aires de Fukushima I. Apr??s ??vacuation de l'hydrog??ne dans le hall de l'entretien de ces trois r??acteurs, le m??lange explosif d'hydrog??ne avec de l'air en oxyg??ne a explos??, endommageant gravement les installations et au moins l'un des b??timents de confinement. Pour ??viter l'explosion, l'??vacuation directe de l'hydrog??ne dans l'atmosph??re ouverte aurait ??t?? une option de conception pr??f??r??. Maintenant, pour ??viter le risque d'explosion dans de nombreux r??acteur ?? eau pressuris??e (PWR) enceintes de confinement, un catalyseur ?? base de recombineur est install?? pour convertir rapidement hydrog??ne et d'oxyg??ne dans de l'eau ?? la temp??rature ambiante avant que la limite d'explosivit?? est atteinte.
industries spatiales et a??ronautiques
Mat??riaux fabriqu??s ?? partir de zirconium m??tallique et son oxyde (ZrO 2) sont utilis??s dans les pi??ces de v??hicules espace pour leur r??sistance ?? la chaleur. La zircone est ??galement un composant dans certaines abrasifs, comme meules et papier de verre.
Pi??ces ?? haute temp??rature tels que chambres de combustion, les lames et aubes dans les moteurs ?? r??action et fixe turbines ?? gaz sont dans une mesure croissante ??tant prot??g??s par mince couches de c??ramique. Ces couches de c??ramique sont g??n??ralement compos??es d'un m??lange de zircone et l'oxyde d'yttrium.
Tomographie par ??mission de cam??ras de tomographie
L'isotope 89 Zr a r??cemment ??t?? appliqu??e au suivi et la quantification des anticorps mol??culaires avec tomographie par ??mission de positrons (PET) des cam??ras (une m??thode appel??e "immuno-PET"). Immuno-PET a atteint sa maturit?? en termes de d??veloppement technique et est maintenant dans la phase d'applications cliniques ?? grande ??chelle. Jusqu'?? r??cemment, le radiomarquage avec 89 Zr est une proc??dure complexe qui n??cessite plusieurs ??tapes. En 2001-2003 une proc??dure en plusieurs ??tapes am??lior??e a ??t?? d??velopp??e en utilisant un d??riv?? succinyl?? de desferrioxamine B (N-sucDf) comme bifonctionnel ch??late, et une meilleure fa??on de se lier 89 Zr ?? mAb a ??t?? signal?? en 2009. La nouvelle m??thode est rapide, se compose de deux ??tapes seulement, et utilise deux ingr??dients largement disponibles: 89 Zr et le ch??late appropri??e.
Applications d??funtes
carbonate de zirconium (3ZrO 2 ?? CO 2 ?? H 2 O) a ??t?? utilis?? dans les lotions pour le traitement sumac v??n??neux, mais a ??t?? arr??t?? parce qu'il faisait parfois des r??actions cutan??es.
S??curit??
Zirconium a pas connu r??le biologique, et des compos??s de zirconium sont de faible toxicit??. Le corps humain contient, en moyenne, seulement 1 milligramme de zirconium, et la dose journali??re est d'environ 50 ug par jour. la teneur en zirconium dans le sang humain est aussi faible que 10 parties par milliard. Les plantes aquatiques prennent facilement de zirconium soluble, mais il est rare dans les plantes terrestres. Soixante-dix pour cent des plantes ne ont pas de teneur en zirconium d??tectable, et ceux qui ne ont aussi peu que 5 parties par milliard.
L'exposition ?? court terme ?? la poudre de zirconium peut causer une irritation, mais seulement contact avec les yeux n??cessite une attention m??dicale. L'inhalation des compos??s de zirconium peut causer la peau et du poumon granulomes. a??rosols de zirconium peuvent causer granulomes pulmonaires. Une exposition persistante ?? t??trachlorure de zirconium a entra??n?? une mortalit?? accrue chez des rats et des cobayes et une diminution de sang h??moglobine et des globules rouges chez les chiens. Les ??.U S??curit?? au travail et de la sant?? recommande l'administration de 5 mg / m 3 pond??r?? dans le temps limite moyenne et ?? 10 mg / m 3 limite d'exposition ?? court terme pour la poussi??re de l'air.
