
Rubidium
Contexte des ??coles Wikip??dia
Enfants SOS b??n??voles ont aid?? ?? choisir des articles et faites autre mat??riel de programme de parrainage d'enfants SOS est cool!
| Rubidium | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
37 Rb | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||
blanc gris  | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | rubidium, Rb, 37 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / r ʉ b ɪ r?? Je ə m / BID roo- -ee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | m??tal alcalin | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | (1) des m??taux alcalins , 5, s | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 85,4678 (3) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Kr ] 5s 1 2, 8, 18, 8, 1  | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Robert Bunsen et Gustav Kirchhoff (1861) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | George de Hevesy | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 1,532 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 1,46 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 312,46 K , 39,31 ?? C, 102,76 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 961 K, 688 ?? C, 1270 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Point critique | (Extrapol??) 2093 K, 16 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 2,19 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 75,77 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 31,060 J ?? mol -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 1 (Fortement oxyde de base) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 0,82 (??chelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1e: 403 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 2632,1 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 3859,4 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 248 h | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 220 ?? 21 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 303 h | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique centr??  | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | |||||||||||||||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | (20 ?? C) 128 nΩ ?? m | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 58,2 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 1,300 m ?? s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 2,4 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 2,5 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Mohs | 0,3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Brinell | 0,216 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-17-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes du rubidium | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Rubidium est un ??l??ment chimique avec le symbole Rb et le num??ro atomique 37. Rubidium est un doux, blanc argent?? m??tallique ??l??ment du m??tal alcalin groupe, avec une masse atomique de 85,4678. Rubidium ??l??mentaire est tr??s r??actif, avec des propri??t??s similaires ?? celles des autres ??l??ments dans le groupe 1 , tels que les tr??s rapide oxydation dans l'air . Rubidium n'a qu'un seul isotope stable, 85 Rb, avec l'isotope 87 Rb, qui compose pr??s de 28% de rubidium naturellement, ??tant l??g??rement radioactives avec une demi-vie de 49 milliards d'ann??es de plus de trois fois plus que le montant estim?? ??ge de l'univers .
Chimistes allemands Robert Bunsen et Gustav Kirchhoff d??couvert rubidium en 1861 par la m??thode de nouvellement d??velopp?? spectroscopie flamme.
Les compos??s de rubidium ont diverses applications chimiques et ??lectroniques. Rubidium m??tal est facilement vaporis?? et dispose d'une gamme d'absorption spectrale pratique, ce qui en fait une cible fr??quente pour laser manipulation des atomes .
Le rubidium ne est pas connu pour ??tre n??cessaire pour des organismes vivants . Cependant, comme le c??sium , les ions rubidium sont g??r??es par des organismes d'une mani??re similaire ?? la vie de potassium ions, ??tant activement absorb??s par les plantes et par des cellules animales .
Caract??ristiques
Rubidium est un tr??s doux, ductile, blanc argent??. Ce est la deuxi??me plus ??lectropositif des m??taux alcalins non radioactifs et fond ?? une temp??rature de 39,3 ?? C (102,7 ?? F). Semblable ?? d'autres m??taux alcalins, le rubidium m??tal r??agit violemment avec l'eau, formes amalgames de mercure et alliages avec l'or , le fer , le c??sium , le sodium et le potassium , mais pas lithium (en d??pit du fait que le rubidium et le lithium sont dans le m??me groupe). Comme potassium (ce qui est un peu moins r??actif) et le c??sium (qui est l??g??rement plus r??actif), la r??action de rubidium avec de l'eau est g??n??ralement assez vigoureuse pour enflammer l' hydrog??ne gazeux, il lib??re. Le rubidium a ??galement ??t?? rapport??e pour enflammer spontan??ment ?? l'air. Le rubidium a une tr??s faible ??nergie d'ionisation de seulement 406 kJ / mol. Rubidium et potassium montrent une couleur pourpre tr??s similaire dans le essai ?? la flamme, ce qui rend les m??thodes de spectroscopie n??cessaire de distinguer les deux ??l??ments.
Compos??s
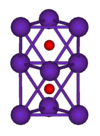
chlorure de rubidium (RbCl) est probablement le compos?? le plus utilis?? de rubidium; il est utilis?? dans la biochimie pour induire des cellules de reprendre l'ADN , et en tant que biomarqueur, car il est facilement absorb?? ?? remplacer le potassium, et est pr??sent en petites quantit??s dans les organismes vivants. D'autres compos??s de rubidium commune sont les corrosive l'hydroxyde de rubidium (RbOH), le mat??riau de d??part pour la plupart des proc??d??s chimiques ?? base de rubidium; le carbonate de rubidium (Rb 2 CO 3), qui est utilis?? dans des verres optiques, et de sulfate de cuivre de rubidium, Rb 2 SO 4 ?? CuSO 4 ?? 6H 2 O. L'iodure de rubidium d'argent (RbAg 4 I 5) a le plus haut temp??rature ambiante conductivit?? connue de toute cristal ionique, une propri??t?? qui est exploit??e dans le film mince batteries et autres applications.
Le rubidium a un certain nombre de oxydes, y compris le rubidium monoxyde (Rb 2 O), Rb et Rb 6 O 9 O 2, qui forment si le rubidium m??tal est expos?? ?? l'air; rubidium en exc??s d'oxyg??ne donne le superoxyde RBO 2. Rubidium forme des sels avec des halog??nures, rendant le fluorure de rubidium, le chlorure de rubidium, le bromure de rubidium, et iodure de rubidium.
Isotopes
Bien que le rubidium est monoisotopique, le rubidium naturel est compos?? de deux isotopes: le Rb stable 85 (72,2%) et le radioactive 87 Rb (27,8%). Rubidium naturel est radioactif ayant une activit?? sp??cifique d'environ 670 Bq / g, suffisamment pour exposer de mani??re significative une film photographique dans 110 jours. Mis ?? part 85 et 87 Rb Rb, un autre 24 isotopes ou rubidium produits par synth??se sont connus, avec des temps de demi de moins de 3 mois; la plupart de ceux-ci sont hautement radioactifs et ont quelques utilisations.
Rubidium-87 a une demi-vie de 48,8 ?? 10 9 ans, ce qui est plus de trois fois l' ??ge de l'univers de 13,75 ?? 0,11 ?? 10 9 ann??es, ce qui en fait un nucl??ide primordial. Il remplace facilement pour le potassium dans les min??raux , et est donc assez r??pandue. Rb a ??t?? largement utilis?? dans datation des roches; 87 Rb se d??sint??gre ?? stable 87 Sr par ??mission d'un n??gatif particules b??ta. Pendant cristallisation fractionn??e, Sr tend ?? se concentrer dans plagioclase, laissant Rb dans la phase liquide. Par cons??quent, le / Sr Rb dans r??siduelle magma peut augmenter au fil du temps, r??sultant dans les roches avec ??lev??es Rb / Sr due ?? progresser diff??renciation. Les ratios les plus ??lev??s (10 ou plus) se produisent dans pegmatites. Si le montant initial de Sr est connue ou peut ??tre extrapol??e, puis l'??ge peut ??tre d??termin??e par la mesure de la Rb et Sr concentrations et du rapport Sr 87 Sr / 86. Les dates indiquent l'??ge v??ritable des min??raux que si les rochers ne ont pas ??t?? modifi??es par la suite (voir datant de rubidium-strontium).
Rubidium-82, l'un des isotopes non naturels de l'??l??ment, est produite par capture d'??lectrons d??croissance de strontium 82 dont la demi-vie de 25,36 jours. La d??sint??gration ult??rieure de rubidium-82 avec une demi-vie de 76 secondes ?? stable krypton-82 produit par la tomographie par ??mission.
Occurrence
Rubidium est la vingt-troisi??me ??l??ment le plus abondant dans la cro??te terrestre, ?? peu pr??s aussi abondante que le zinc et plut??t plus commun que le cuivre . Il se produit naturellement dans les minerais leucite, pollucite, carnallite, et zinnwaldite, qui contient jusqu'?? 1% de son oxyde. L??pidolite contient entre 0,3% et 3,5% de rubidium, et est la source commerciale de l'??l??ment. Certains potassium et de min??raux les chlorures de potassium contiennent ??galement l'??l??ment en des quantit??s commercialement significatives.
L'eau de mer contient en moyenne 125 mg / L de rubidium par rapport ?? la valeur beaucoup plus ??lev??e de potassium de 408 mg / L et la valeur beaucoup plus faible de 0,3 ug / L pour le c??sium
En raison de sa grande rayon ionique, le rubidium est l'un des " ??l??ments incompatibles. ??Pendant magma cristallisation, le rubidium est concentr?? avec son plus lourd c??sium analogique en phase liquide et cristallise dernier. Par cons??quent, les plus grands gisements de rubidium et le c??sium sont zone corps min??ralis??s pegmatite form??s par ce processus d'enrichissement. Parce que substituts de rubidium pour potassium dans la cristallisation du magma, l'enrichissement est beaucoup moins efficace que dans le cas du c??sium. gisements de pegmatite de la zone contenant des quantit??s exploitables de c??sium pollucite ou les min??raux de lithium l??pidolite sont ??galement une source de rubidium en tant que sous-produit.
Deux sources notables de rubidium sont les riches gisements de pollucite au Bernic Lake, Manitoba, Canada , et de la rubicline ((Rb, K) AlSi 3 O 8) trouv?? sous forme d'impuret??s dans pollucite sur l' italien ??le de Elbe, avec une teneur en rubidium de 17,5%. Ces deux d??p??ts sont aussi des sources de c??sium .
Production
Bien que le rubidium est plus abondant dans la cro??te terrestre que le c??sium, les applications limit??es et le manque d'un min??ral riche en rubidium limite la production de compos??s de rubidium ?? 2-4 tonnes par an. Plusieurs m??thodes sont disponibles pour la s??paration de potassium, le rubidium, et le c??sium. Le la cristallisation fractionn??e d'un alun de rubidium et le c??sium (Cs, Rb) Al (SO 4) 2 ?? 12H 2 O rendements apr??s 30 ??tapes ult??rieures pur alun de rubidium. Deux autres m??thodes sont rapport??es, le processus de chlorostannate et le processus de ferrocyanure.
Depuis plusieurs ann??es, dans les ann??es 1950 et 1960, un sous-produit de la production de potassium appel?? Alkarb ??tait une source principale pour le rubidium. Alkarb contenait 21% de rubidium, avec le reste ??tant du potassium et d'une petite fraction de c??sium. Aujourd'hui, les plus grands producteurs de c??sium, comme le Mine Tanco, Manitoba, Canada, produire rubidium comme sous-produit de pollucite.

Histoire

Rubidium a ??t?? d??couvert en 1861 par Robert Bunsen et Gustav Kirchhoff, ?? Heidelberg, en Allemagne, dans le min??ral l??pidolite par l'utilisation d'un spectroscope. Parce que des lignes rouges lumineuses dans son spectre d'??mission, ils ont choisi un nom d??riv?? du latin mot rubidus, ce qui signifie "rouge fonc??".
Rubidium est pr??sent comme composant mineur dans l??pidolite. Kirchhoff et Bunsen trait??es 150 kg d'un l??pidolite ne contenant que 0,24% d'oxyde de rubidium (Rb 2 O). Les deux potassium et de rubidium forment des sels insolubles avec chloroplatinique l'acide, mais ces sels montrent une l??g??re diff??rence de solubilit?? dans l'eau chaude. Par cons??quent, le rubidium moins soluble hexachloroplatinate (Rb 2 PtCl 6) peut ??tre obtenu par cristallisation fractionn??e. Apr??s r??duction avec de l'hexachloroplatinate d'hydrog??ne . Ce processus a donn?? 0,51 g de le chlorure de rubidium pour des ??tudes ult??rieures. Le premier grand isolement ??chelle de compos??s de c??sium et de rubidium, effectu??e ?? partir de 44 000 litres d'eau min??rale par Bunsen et Kirchhoff, a donn??, outre 7,3 grammes de le chlorure de c??sium, ??galement 9,2 g de le chlorure de rubidium. Rubidium ??tait le deuxi??me ??l??ment, peu de temps apr??s le c??sium, ?? d??couvrir par spectroscopie , un an seulement apr??s l'invention de la spectroscope par Bunsen et Kirchhoff.
Les deux scientifiques ont utilis?? le chlorure de rubidium ainsi obtenu pour estimer la poids atomique du nouvel ??l??ment que 85,36 (la valeur actuellement accept??e est 85,47). Ils ont essay?? de g??n??rer des rubidium ??l??mentaire par ??lectrolyse de fusion chlorure de rubidium, mais au lieu d'un m??tal, ils ont obtenu une substance homog??ne bleue qui "ni sous l'??il nu, ni au microscope a montr?? la moindre trace de substance m??tallique." Ils ont assign?? comme un protochlorure (Rb 2 Cl); Cependant, le produit ??tait probablement un m??lange collo??dal du m??tal et du chlorure de rubidium. Dans une deuxi??me tentative pour produire le rubidium m??tallique, Bunsen a pu r??duire le rubidium par chauffage carbonis?? rubidium tartrate. Bien que le rubidium a ??t?? distill??e pyrophorique, il a ??t?? possible de d??terminer la densit?? et le point de fusion de rubidium. La qualit?? de la recherche effectu??e dans les ann??es 1860 peut ??tre ??valu?? par le fait que leur densit?? d??termin??e diff??re moins de 0,1 g / cm 3 et le point de fusion de moins de 1 ?? C ?? partir des valeurs actuellement accept??es.
La l??g??re radioactivit?? de rubidium a ??t?? d??couvert en 1908, mais avant que la th??orie d'isotopes a ??t?? cr???? dans les ann??es 1910 et la faible activit?? en raison de la longue demi-vie de plus de 10 dix ann??es faites interpr??tation compliqu??. La d??croissance maintenant prouv?? de 87 Rb ?? stable 87 Sr travers d??sint??gration b??ta ??tait encore en discussion ?? la fin des ann??es 1940.
Rubidium avait valeur industrielle minimale avant les ann??es 1920. Depuis lors, l'utilisation la plus importante de rubidium a ??t?? dans la recherche et le d??veloppement, principalement dans des applications chimiques et ??lectroniques. En 1995, a ??t?? utilis?? rubidium-87 pour produire un Condensat de Bose-Einstein, pour lesquels les d??couvreurs, Eric Cornell, Carl Wieman et Edwin Wolfgang Ketterle, a remport?? le 2001 Prix Nobel de Physique .
Applications

compos??s de rubidium sont parfois utilis??s dans feux d'artifice pour leur donner une couleur pourpre. Rubidium a ??galement ??t?? pris en consid??ration pour une utilisation dans un ?? l'aide du g??n??rateur thermo??lectrique principe magn??tohydrodynamique, o?? les ions rubidium sont form??es par la chaleur ?? haute temp??rature et pass??s ?? travers un champ magn??tique. Ce comportement de l'??lectricit?? et d'agir comme un induit d'un g??n??rateur g??n??rant de ce fait un courant ??lectrique. Le rubidium, en particulier vaporis?? 87 Rb, est l'une des esp??ces atomiques les plus couramment utilis??s pour employ??s refroidissement du laser et Condensation de Bose-Einstein. Ses caract??ristiques souhaitables pour cette application comprennent la disponibilit?? de bon march?? diode laser ?? la pertinente longueur d'onde, et les temp??ratures mod??r??es n??cessaires pour obtenir des pressions de vapeur importantes.
Le rubidium a ??t?? utilis?? pour polariser 3 Il, les volumes de production de gaz magn??tis?? 3 Il, avec les spins nucl??aires align??s dans une direction particuli??re dans l'espace, plut??t qu'au hasard.
vapeur de rubidium est pomp?? optiquement par un laser et la Rb polaris??e polarise 3 Il travers le interaction hyperfine.
Tel cellules 3 He polaris?? en spin sont de plus populaire pour les mesures de polarisation de neutrons et pour produire des faisceaux de neutrons polaris??s ?? d'autres fins.
L'??l??ment r??sonnant dans horloges atomiques utilise les structure hyperfine des niveaux d'??nergie de rubidium, rendant le rubidium utile pour la synchronisation de haute pr??cision, et est utilis?? comme composant principal des fr??quences de r??f??rence secondaires (oscillateurs de rubidium) pour maintenir la pr??cision de fr??quence dans les ??metteurs de site cellulaire et autres transmission ??lectronique, le r??seautage et l'??quipement d'essai. Ces les normes de rubidium sont souvent utilis??s avec GPS pour produire un "??talon primaire de fr??quence" qui a une plus grande pr??cision et est moins cher que les normes de c??sium. Ces normes de rubidium sont souvent produites en masse pour la t??l??communication industrie.
Autres usages potentiels ou actuels de rubidium comprennent un fluide de travail dans les turbines ?? vapeur, comme un dans getter les tubes ?? vide, et en tant que composant de la cellule photo??lectrique. Rubidium est ??galement utilis?? comme ingr??dient dans des types particuliers de verre, dans la production de superoxyde par combustion dans l'oxyg??ne , dans l'??tude de potassium canaux ioniques en biologie, et que la vapeur pour faire atomique magn??tom??tres. En particulier, 87 Rb est actuellement utilis??, avec d'autres m??taux alcalins, dans le d??veloppement de relaxation spin-??change sans (SERF) magn??tom??tres.
Rubidium-82 est utilis?? pour tomographie par ??mission de positrons. Rubidium est tr??s similaire au tissu potassium et donc ?? forte teneur en potassium va ??galement se accumuler le rubidium radioactifs. L'une des principales utilisations est dans imagerie de perfusion myocardique. La demi-vie tr??s courte de 76 secondes, il est n??cessaire pour produire le rubidium-82 de la d??sint??gration de strontium-82 ?? proximit?? du patient. ?? la suite de changements dans la barri??re h??mato-enc??phalique dans les tumeurs c??r??brales, le rubidium recueille plus dans les tumeurs c??r??brales que le tissu c??r??bral normal, ce qui permet l'utilisation de radio-isotope de rubidium-82 dans m??decine nucl??aire de localiser et de l'image des tumeurs c??r??brales.
Rubidium a ??t?? test?? pour l'influence sur la maniaco-d??pression et la d??pression. Les patients dialys??s souffrant de d??pression montrent une diminution dans le rubidium et donc une suppl??mentation peut aider pendant la d??pression. Dans certains essais, le rubidium a ??t?? administr?? sous forme de chlorure de rubidium avec un maximum de 720 mg par jour pendant 60 jours.
Pr??cautions et effets biologiques
Rubidium r??agit violemment avec l'eau et peut provoquer des incendies. Pour assurer la s??curit?? et la puret??, ce m??tal est g??n??ralement maintenu sous une s??che une huile min??rale ou scell??e dans des ampoules de verre dans une atmosph??re inerte. formes de rubidium peroxydes sur l'exposition, m??me ?? petite quantit?? de diffuseur d'air dans l'huile, et est donc soumis ?? des pr??cautions de peroxyde similaires que le stockage de mat??riaux m??talliques potassium .
Rubidium, comme le sodium et le potassium, a presque toujours une ??tat d'oxydation dissous dans l'eau, y compris sa pr??sence dans tous les syst??mes biologiques. Le corps humain tend ?? traiter ions Rb + comme se ils ??taient des ions potassium, rubidium et se concentre par cons??quent dans le corps de liquide intracellulaire (ce est ?? dire, l'int??rieur des cellules). Les ions sont pas particuli??rement toxique; une personne de 70 kg contient en moyenne 0,36 g de rubidium, et une augmentation de cette valeur de 50 ?? 100 fois ne ont pas montr?? d'effets n??gatifs chez les personnes de test. Le demi-vie biologique de rubidium chez les humains a ??t?? mesur??e en 31 ?? 46 jours. Bien qu'une substitution partielle du potassium par du rubidium est possible, les rats ayant plus de 50% de leur potassium substitu?? dans le tissu musculaire sont morts.

