
Osmium
Contexte des ??coles Wikip??dia
SOS Enfants, qui se d??roule pr??s de 200 sos ??coles dans le monde en d??veloppement, a organis?? cette s??lection. Voir http://www.soschildren.org/sponsor-a-child pour conna??tre le parrainage d'enfants.
| Osmium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
76 Os | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
teinte argent??e, bleue  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | osmium, Os, 76 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / ɒ z m Je ə m / -Əm de OZ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | m??tal de transition | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | 8, 6, r?? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 190,23 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Xe ] 4f 14 5d 6 6s 2 2, 8, 18, 32, 14, 2 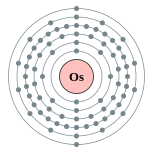 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Smithson Tennant (1803) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Smithson Tennant (1803) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 22,59 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 20 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 3306 K , 3033 ?? C, 5491 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 5285 K, 5012 ?? C, 9054 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 57,85 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 738 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 24,7 J ?? mol -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 8, 7, 6, 5, 4, 3, 2, 1, 0, -1, -2 (L??g??rement acide oxyde) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 2,2 (??chelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1e: 840 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 1600 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 135 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 144 ?? 16 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | (0 ?? C) 81,2 nΩ ?? m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 87,6 W ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ?? C) 5,1 pm ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 4,940 m ?? s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 222 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 462 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Mohs | 7.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Brinell | 3920 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-04-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Les isotopes d'osmium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Osmium est un ??l??ment chimique avec le symbole Os et de num??ro atomique 76. Ce est un dur, cassant, blanc bleut?? m??tal de transition dans le la famille du platine et est l'??l??ment le plus dense d'origine naturelle, avec une densit?? de 22,59 g / cm 3. On le trouve dans la nature sous forme d'alliage, principalement dans les minerais de platine; son alliages avec le platine , l'iridium et d'autres m??taux du groupe du platine sont utilis??s en conseils de fontaine stylo, contacts ??lectriques, et d'autres applications o?? la durabilit?? extr??me et la duret?? sont n??cessaires.
Caract??ristiques
Propri??t??s physiques

Osmium a une teinte bleu-gris et est la plus dense ??l??ment stable, l??g??rement plus dense que l' iridium . Calculs de la densit?? de la Les donn??es de diffraction des rayons X peuvent produire les donn??es les plus fiables pour ces ??l??ments, ce qui donne une valeur de 22,562 ?? 0,009 g / cm 3 pour l'iridium par rapport ?? 22,587 ?? 0,009 g / cm 3 pour l'osmium. La densit?? ??lev??e de l'osmium est une cons??quence de la contraction lanthanide.
Osmium est un dur mais fragile m??tal qui reste lustr?? m??me ?? des temp??ratures ??lev??es. Il a une tr??s faible compressibilit??. En cons??quence, son module de masse est extr??mement ??lev??, a rapport?? entre 395 et 462 GPa, qui rivalise avec celle de diamant (443 GPa). La duret?? de l'osmium est mod??r??ment ??lev?? ?? 4 GPa. En raison de sa la duret??, la fragilit??, la faible pression de vapeur (le plus bas des m??taux du groupe du platine), et le point de fusion tr??s ??lev?? (le quatri??me rang de tous les ??l??ments), l'osmium solide est difficile ?? usiner, la forme ou au travail.
Propri??t??s chimiques
| ??tats d'oxydation de l'osmium | |
|---|---|
| -2 | Na 2 [Os (CO) 4] |
| -1 | Na 2 [Os 4 (CO) 13] |
| 0 | Os 3 (CO) 12 |
| 1 | OSI |
| 2 | OSI 2 |
| 3 | OSBR 3 |
| 4 | OSO 2, OsCl 4 |
| 5 | OsF 5 |
| 6 | OsF 6 |
| 7 | OSOF 5, 7 OsF |
| 8 | OsO 4, Os (NCH 3) 4 |
Osmium forme des compos??s avec des ??tats d'oxydation allant de -2 ?? 8. Les ??tats d'oxydation les plus courants sont 2, 3, 4 et 8. L'??tat d'oxydation 8 est connu pour ??tre le plus haut atteint par un ??l??ment chimique, et en dehors de l'osmium, ne se rencontre que dans le x??non , le ruth??nium , hassium , l'iridium et le plutonium (instable). Les ??tats d'oxydation -1 et -2 repr??sent??s par les deux compos??s r??actifs Na 2 [Os 4 (CO) 13] et Na 2 [Os (CO) 4] sont utilis??s dans la synth??se de l'osmium compos??s munitions.
Le compos?? le plus commun pr??sentant l'??tat d'oxydation est 8 t??troxyde d'osmium. Ce compos?? toxique est form?? lorsque l'osmium en poudre est expos??e ?? l'air, et est un solide avec une forte odeur cristallin tr??s volatile, soluble dans l'eau, jaune p??le,. poudre de Osmium a l'odeur caract??ristique de t??troxyde d'osmium. Osmium formes de t??troxyde osmates rouges OsO 4 (OH) 2-
2 par r??action avec une base. Avec de l'ammoniac, il forme les nitrido-osmates OSO 3 N -. Le t??troxyde d'osmium bout ?? 130 ?? C et est un puissant agent oxydant. Par contre, le dioxyde d'osmium (OSO 2) est noir, non-volatile, et beaucoup moins r??actif et toxique.
Seuls deux compos??s d'osmium ont des applications majeures: t??troxyde d'osmium pour tissus coloration dans microscopie ??lectronique et pour l'oxydation d' alc??nes en synth??se organique, et les osmates non volatile pour r??actions d'oxydation organiques.
Osmium heptafluorure (OSF 7) et le pentafluorure d'osmium (OsF 5) sont connus, mais trifluorure osmium (OsF 3) n'a pas encore ??t?? synth??tis??s. Les ??tats d'oxydation inf??rieurs sont stabilis??s par les halog??nes plus grandes, de sorte que le trichlorure, le tribromure, le triiodure, et m??me le diiodure sont connus. L'??tat d'oxydation 1 est connue seulement pour l'osmium iodure (OSI), alors que plusieurs complexes carbonyles de l'osmium, comme Dod??cacarbonyle de triosmium (Os 3 (CO) 12), repr??sente l'??tat d'oxydation 0.
En g??n??ral, les ??tats d'oxydation inf??rieurs d'osmium sont stabilis??s par ligands qui sont de bons σ-donateurs (tels que des amines ) et π-accepteurs ( des h??t??rocycles contenant de l'azote ). Les ??tats d'oxydation sup??rieurs sont stabilis??es par une forte σ- et π-bailleurs de fonds, tels que O 2 et N 3.
Isotopes
Osmium a sept naturellement isotopes , dont six sont stables: 184 Os, Os 187, 188 Os, Os 189, 190 Os, et (le plus abondant) 192 186 Os Os subit. d??sint??gration alpha avec une telle une longue demi-vie ((2,0 ?? 1,1) ?? 10 15 ann??es) que pour des raisons pratiques, il peut ??tre consid??r?? comme stable. D??sint??gration alpha est pr??vue pour tous les sept isotopes naturels, mais en raison de tr??s longues demi-vies, il a ??t?? observ?? que pour 186 Os. Il est pr??vu que 184 192 OS et OS peut subir la double d??sint??gration b??ta, mais cette radioactivit?? n'a pas encore ??t?? observ??.
187 S est la fille de 187 Re (demi-vie 4,56 ?? 10 10 ann??es) et est largement utilis?? dans la datation terrestre ainsi que m??t??oriques roches (voir datant de rh??nium-osmium). Il a ??galement ??t?? utilis?? pour mesurer l'intensit?? de l'alt??ration continentale cours des temps g??ologiques et de fixer un ??ge minimum pour la stabilisation de la racines manteau de Continental cratons . Cette d??croissance est une raison pour laquelle les min??raux de rh??nium riche sont anormalement riche en 187 Os. Cependant, l'application la plus notable de Os dans la datation a ??t?? en conjonction avec l'iridium, d'analyser la couche de quartz choqu?? le long de la Cr??tac??-Pal??og??ne fronti??re qui marque l'extinction des dinosaures il ya 65 millions d'ann??es.
Histoire
Osmium (du grec osme (ὀσμή) signifie ??odeur??) a ??t?? d??couvert en 1803 par Smithson Tennant et William Hyde Wollaston dans Londres , Angleterre . La d??couverte de l'osmium est intimement li??e ?? celle du platine et les autres m??taux de la groupe du platine. Platinum a atteint l'Europe comme le platine (??petit argent??), d'abord rencontr?? dans la fin du 17e si??cle dans les mines d'argent ?? travers le Le d??partement du Choc??, en Colombie . La d??couverte que ce m??tal ne ??tait pas un alliage, mais un nouvel ??l??ment distinct, a ??t?? publi?? en 1748. Les chimistes qui ont ??tudi?? le platine dissous dans eau r??gale (m??lange d' chlorhydrique et l'acide nitrique ) pour cr??er des sels solubles. Ils ont toujours observ?? une petite quantit?? d'un r??sidu insoluble sombre. Joseph Louis Proust pensait que le r??sidu ??tait graphite. Victor Collet-Descotils, Antoine-Fran??ois Fourcroy, et Louis Nicolas Vauquelin a ??galement observ?? le r??sidu noir en 1803, mais n'a pas obtenu suffisamment de mat??riel pour d'autres exp??riences.
En 1803, Smithson Tennant a analys?? le r??sidu insoluble et a conclu qu'il doit contenir un nouveau m??tal. Vauquelin trait?? la poudre en alternance avec alcalins et acides et a obtenu un nouveau oxyde volatil, qu'il croyait ??tre qu'il nomma ptene, du mot grec πτηνος (pt??nos) pour cette nouvelle ailes laquelle le m??tal. Cependant, Tennant, qui avait l'avantage d'une plus grande quantit?? de r??sidus, a poursuivi ses recherches et a identifi?? deux ??l??ments pr??c??demment non d??couvertes dans le r??sidu noir, l'iridium et l'osmium. Il a obtenu une solution jaune (probablement de cis - [Os (OH) 2 O 4] 2-) par des r??actions avec de l'hydroxyde de sodium ?? feu rouge. Apr??s acidification il ??tait capable de distiller le OsO form?? quatre. Il a nomm?? l'osmium apr??s grecque sens de osme "une odeur", ?? cause de l'odeur de cendre et de fum??e de la volatile t??troxyde d'osmium. D??couverte des nouveaux ??l??ments a ??t?? document??e dans une lettre ?? la Royal Society le 21 Juin, 1804.
Uranium et l'osmium ont ??t?? les premiers catalyseurs de succ??s dans le Proc??d?? Haber, la fixation de l'azote r??action de l'azote et de l'hydrog??ne pour produire de l'ammoniac , donnant assez de rendement pour rendre le proc??d?? ??conomiquement r??ussie. ?? l'??poque, un groupe au Dirig?? par BASF Carl Bosch a achet?? la plupart de l'approvisionnement mondial de l'osmium ?? utiliser comme un catalyseur. Peu de temps apr??s, en 1908, moins co??teux catalyseurs ?? base de fer et oxydes de fer ont ??t?? introduits par le m??me groupe pour les premi??res installations pilotes, supprimant la n??cessit?? pour l'osmium co??teux et rares.
Aujourd'hui l'osmium est obtenue principalement de la transformation de platine et de nickel de minerais.
Occurrence

L'osmium est le moins abondante dans ??l??ment stable de la Terre la cro??te avec une fraction de la masse moyenne de 0,05 ppb dans la cro??te continentale .
L'osmium est pr??sent dans la nature en tant qu'??l??ment non combin?? ou dans naturel alliages; en particulier les alliages d'iridium osmium, osmiridium (osmium riche), et iridiosmium (iridium riche). Dans les nickel et cuivre d??p??ts, des m??taux du groupe du platine se produisent en tant que sulfures (ce est ?? dire, (Pt, Pd) S)), tellurures (par exemple, PtBiTe), antimoniures (par exemple, PDSB), et ars??niures (par exemple, 2 PTAS); dans tous ces compos??s du platine est ??chang??e par une petite quantit?? d'iridium et l'osmium. Comme avec tous les m??taux du groupe du platine, de l'osmium peut ??tre naturellement pr??sent dans les alliages de nickel ou cuivre.
Dans la cro??te de la Terre, l'osmium, comme l'iridium, se trouve ?? des concentrations plus ??lev??es dans trois types de structure g??ologique: d??p??ts ign??es (intrusions de la cro??te de ci-dessous), des crat??res d'impact, et les d??p??ts remani??s de l'une des anciennes structures. Les plus grandes r??serves connues primaires sont dans le Complexe ign?? du Bushveld en Afrique du Sud , bien que les grands gisements de cuivre-nickel pr??s de Norilsk en Russie , et de la Bassin de Sudbury dans le Canada sont ??galement des sources importantes de l'osmium. Les petites r??serves peuvent ??tre trouv??s dans les ??tats-Unis. Le alluvions utilis??s par les pr??-colombiennes dans le Le d??partement du Choc??, en Colombie sont toujours une source pour les m??taux du groupe du platine. Le deuxi??me grand d??p??t alluvial a ??t?? trouv?? dans le Oural, la Russie, qui est encore min??es.
Production

Osmium est obtenu dans le commerce comme un sous-produit de nickel et de cuivre extraction et de traitement. Pendant ??lectroraffinage du cuivre et du nickel, des m??taux nobles tels que l'argent, l'or et les m??taux du groupe du platine, ainsi que des ??l??ments non m??talliques tels que le s??l??nium et le tellure se d??posent au fond de la cellule sous forme de boue d'anode, qui forme la mati??re de d??part pour leur extraction. Pour s??parer les m??taux, ils doivent d'abord ??tre mis en solution. Plusieurs m??thodes sont disponibles selon le proc??d?? de s??paration et la composition du m??lange; deux proc??d??s repr??sentatifs sont fusion avec le peroxyde de sodium, puis par dissolution dans l'eau r??gale, et la dissolution dans un m??lange de chlore avec de l'acide chlorhydrique . L'osmium, le ruth??nium, le rhodium et l'iridium peuvent ??tre s??par??s du platine, de l'or et les m??taux de base par leur insolubilit?? dans l'eau r??gale, laissant un r??sidu solide. Le rhodium peut ??tre s??par?? du r??sidu fondu par traitement avec le bisulfate de sodium. Le r??sidu insoluble, contenant Ru, Os et Ir, est trait??e avec oxyde de sodium, dans lequel est insoluble Ir, Ru et Os produire des sels solubles dans l'eau. Apr??s oxydation des oxydes volatils, RuO 4 est s??par??e de OsO 4 par pr??cipitation de (NH 4) 3 RuCl 6 avec du chlorure d'ammonium.
Apr??s dissolution, de l'osmium est s??par?? des autres m??taux du groupe du platine par distillation ou extraction avec des solvants organiques du t??troxyde d'osmium volatil. La premi??re m??thode est similaire ?? la proc??dure utilis??e par Tennant et Wollaston. Les deux m??thodes sont adapt??s ?? la production industrielle ?? grande ??chelle. Dans les deux cas, le produit est r??duit avec de l'hydrog??ne, ce qui donne la forme d'une poudre m??tallique ou une ??ponge qui peut ??tre trait?? en utilisant des techniques de m??tallurgie des poudres.
Ni les producteurs, ni l'United States Geological Survey publi??s les montants de production pour l'osmium. Les estimations de la date de la consommation aux ??tats-Unis publi?? de 1971, qui donne une consommation aux ??tats-Unis 2000 onces troy (62 kg), donne ?? penser que la production est toujours inf??rieure ?? 1 tonne par an.
Applications
En raison de la volatilit?? et de la toxicit?? extr??me de son oxyde, l'osmium est rarement utilis?? ?? l'??tat pur, et est plut??t souvent alli?? avec d'autres m??taux. Ces alliages sont utilis??s dans les applications de haute usure. Alliages tels que l'osmium osmiridium sont tr??s dur et, avec d'autres m??taux du groupe du platine, sont utilis??s dans les conseils de stylos, pivots de l'instrument, et des contacts ??lectriques, car ils peuvent r??sister ?? l'usure du fonctionnement fr??quent. Ils ont ??galement ??t?? utilis??s pour les conseils de phonographe stylets ?? la fin du 78 rpm et au d??but " LP "et" 45 ????re enregistrement, circa 1945 ?? 1955. Bien que tr??s durable par rapport aux points de l'acier et de chrome aiguilles, pointes en alliage d'osmium portait sur beaucoup plus rapidement que la concurrence, mais plus co??teux saphir et diamants conseils et ont ??t?? abandonn??es.
Le t??troxyde d'osmium est utilis?? en d??tection d'empreinte digitale et dans la coloration tissus adipeux pour optique et microscopie ??lectronique. Comme un oxydant puissant, il r??ticule les lipides principalement par r??action avec des liaisons carbone-carbone insatur??s, et ainsi les deux corrections des membranes biologiques en place dans des ??chantillons de tissus et simultan??ment les taches. Parce que les atomes d'osmium sont extr??mement denses aux ??lectrons, l'osmium coloration am??liore grandement contraste de l'image en La microscopie ??lectronique ?? transmission (TEM) des ??tudes de mat??riaux biologiques. Ces mat??riaux de carbone ont par ailleurs tr??s faible contraste de TEM (voir image). Un autre compos?? de l'osmium, de l'osmium ferricyanure (OsFeCN), pr??sente fixation similaire et l'action de coloration.
Le t??troxyde et un compos?? apparent??, osmate de potassium, sont des oxydants importants pour la synth??se chimique, en d??pit d'??tre tr??s toxique. Pour le Dihydroxylation asym??trique de Sharpless d', qui utilise osmiate pour la conversion d'un double liaison dans un vicinal diol, K. Barry Sharpless a remport?? le prix Nobel de chimie en 2001. Apparemment, OsO 4 est tr??s cher pour cette utilisation, afin KMnO 4 est souvent utilis?? ?? la place, m??me si les rendements sont moins pour ce r??actif chimique moins cher.
En 1898, un chimiste autrichien, Auer von Welsbach, a d??velopp?? le Oslamp avec un filament fait d'osmium, qu'il introduit commercialement en 1902. Apr??s seulement quelques ann??es, l'osmium a ??t?? remplac?? par le m??tal plus stable de tungst??ne . Le tungst??ne a le point de fusion le plus ??lev?? de tous les m??taux, et de l'utiliser dans les ampoules ??lectriques augmente l'efficacit?? lumineuse et la vie des lampes ?? incandescence.
Le fabricant d'ampoules Osram (fond??e en 1906, lorsque trois entreprises allemandes, Auer-Gesellschaft, AEG et Siemens & Halske, ont combin?? leurs installations de production de la lampe) tire son nom des ??l??ments de prime os et Wolf RAM (ce dernier est allemand pour le tungst??ne).
Comme le palladium, l'osmium poudre absorbe efficacement des atomes d'hydrog??ne. Cela pourrait faire osmium un candidat potentiel ?? une ??lectrode de la batterie ?? hydrure m??tallique. Cependant, l'osmium est co??teux et r??agirait avec de l'hydroxyde de potassium, l'??lectrolyte de la batterie la plus courante.
Osmium a une r??flectivit?? ??lev??e dans l' ultraviolet de la plage spectre ??lectromagn??tique; par exemple, ?? 600 ?? osmium a une r??flectivit?? de deux fois celle de l'or. Cette r??flectivit?? ??lev??e est souhaitable dans l'espace base- spectrom??tres UV qui ont r??duit la taille des miroirs en raison du manque d'espace. miroirs de Osmium enduit ont ??t?? transport??s dans plusieurs missions spatiales ?? bord du Navette spatiale, mais il est vite devenu ??vident que les radicaux d'oxyg??ne dans le orbite basse sont assez abondantes pour d??t??riorer sensiblement la couche d'osmium.
L'utilisation clinique seulement connu d'osmium semble ??tre pour synovectomie chez les patients arthritiques en Scandinavie. Il se agit de l'administration locale de t??troxyde d'osmium (OsO 4) qui est un compos?? hautement toxique. L'absence de rapports d'effets secondaires ?? long terme sugg??rent que l'osmium lui-m??me peut ??tre biocompatible, bien que cela d??pende du compos?? d'osmium administr??. En 2011, l'osmium (VI) et l'osmium (II) compos??s ont ??t?? signal??s ?? montrer une activit?? anticanc??reuse in vivo, il a indiqu?? un avenir prometteur pour l'utilisation de compos??s d'osmium comme m??dicaments anticanc??reux.

Au microscope ??lectronique (organique) tissus de la plante sans (en haut) et (bas) OsO 4 coloration

La dihydroxylation Sharpless:
R L = la plus grande substituant; R M = substituant de taille moyenne; R S = petit substituant
Apr??s le vol apparition de miroirs Os, Ag et Au du panneau arri??re de la navette spatiale avant (images de gauche) et. Noircissement r??v??le l'oxydation due ?? l'irradiation par des atomes d'oxyg??ne.
Pr??cautions
Osmium m??tallique finement divis??e est pyrophore. Osmium r??agit avec l'oxyg??ne ?? temp??rature ambiante formant le t??troxyde d'osmium volatil. Certains compos??s d'osmium sont ??galement convertis en t??troxyde si l'oxyg??ne est pr??sent. Cela rend le t??troxyde d'osmium la source principale de contact avec l'environnement.
T??troxyde d'osmium est tr??s volatil et p??n??tre la peau facilement, et est tr??s toxique par inhalation, ingestion et contact avec la peau. De faibles concentrations atmosph??riques de vapeur osmium t??troxyde peuvent causer congestion pulmonaire et peau ou l??sions oculaires, et doit donc ??tre utilis?? dans une hotte. Le t??troxyde d'osmium est rapidement r??duite ?? des compos??s relativement inertes par des huiles v??g??tales polyinsatur??es telles que l'huile de ma??s .
Prix
L'osmium est g??n??ralement vendu sous forme de poudre pure ?? 99%. Comme d'autres m??taux pr??cieux, elle est mesur??e par poids troy et en g. Son prix en 2010 ??tait d'environ 400 $ l'once troy (ou environ 13 $ le gramme), en fonction de la quantit?? et son fournisseur.
