
Yttrium
?? propos de ce ??coles s??lection Wikipedia
Les articles de cette s??lection ??coles ont ??t?? organis??s par sujet du programme d'??tudes gr??ce aux b??n??voles d'enfants SOS. Une bonne fa??on d'aider d'autres enfants est de parrainer un enfant
| Yttrium | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
39 Y | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||
blanc argent??  | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | yttrium, Y, 39 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / ɪ t r Je ə m / IT -ree-əm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Cat??gorie Metallic | m??tal de transition | ||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | 3, 5, r?? | ||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 88,90585 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Kr ] 4d 1 5s 2 2, 8, 18, 9, 2 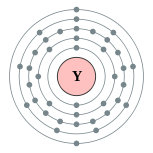 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Johan Gadolin (1794) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Carl Gustav Mosander (1840) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 4,472 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 4,24 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1799 K , 1526 ?? C, 2779 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 3609 K, 3336 ?? C, 6037 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 11,42 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 365 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 26,53 J ?? mol -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 3, 2, 1 (oxyde faiblement basique) | ||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 1,22 (??chelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1e: 600 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 1180 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 1980 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 180 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 190 ?? 19 heures | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | |||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | ||||||||||||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | ( rt) (α, poly) 596 nΩ ?? m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 17,2 W ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (α, le poly) 10,6 um / (m ?? K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 3,300 m ?? s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 63,5 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 25,6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 41,2 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,243 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Brinell | 589 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-65-5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes d'yttrium | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
L'yttrium est un ??l??ment chimique avec le symbole Y et le num??ro atomique 39. Ce est un argent?? m??tallique m??tal de transition chimiquement similaire ?? les lanthanides et il a souvent ??t?? class?? comme un " ??l??ment des terres rares ". L'yttrium est presque toujours trouv?? combin?? avec des lanthanides dans min??raux de terres rares et ne sont jamais trouv??s dans la nature comme un ??l??ment libre. Son seul stable isotope , 89 Y, est ??galement ses isotopes naturels seulement.
En 1787, Carl Axel Arrhenius a trouv?? un nouveau min??ral proximit?? Ytterby en Su??de et l'a nomm?? ytterbite, apr??s le village. Johan Gadolin d??couvert l'oxyde d'yttrium de dans l'??chantillon d'Arrhenius en 1789, et Anders Gustaf Ekeberg nomm?? la nouvelle oxyde l'oxyde d'yttrium. Yttrium ??l??mentaire a ??t?? isol?? pour la premi??re en 1828 par Friedrich W??hler.
L'utilisation la plus importante de l'yttrium est dans la prise phosphores, tels que les rouges utilis??es dans le jeu de la t??l??vision ?? tube cathodique (CRT) et affiche en LED. D'autres utilisations comprennent la production de ??lectrodes, ??lectrolytes, filtres ??lectroniques, lasers et supraconducteurs ; diverses applications m??dicales; et comme traces dans divers mat??riaux pour am??liorer leurs propri??t??s. Yttrium a pas connu r??le biologique, et l'exposition ?? des compos??s d'yttrium peut causer les maladies pulmonaires chez les humains.
Caract??ristiques
Propri??t??s
Yttrium est une, argent m??tallis?? doux, brillant et tr??s cristallin m??tal de transition en le groupe 3. Comme pr??vu par tendances p??riodiques, il est moins ??lectron??gatif que son pr??d??cesseur dans le groupe, le scandium , plus ??lectron??gatif que son successeur dans le groupe, le lanthane , et moins ??lectron??gatif que le membre de 5 p??riode, le zirconium . L'yttrium est le premier ??l??ment d-bloc dans la cinqui??me p??riode.
L'??l??ment pur est relativement stable dans l'air en vrac, en raison de passivation r??sultant de la formation d'un oxyde protecteur (Y 2 O 3) d'un film sur sa surface. Ce film peut atteindre une ??paisseur de 10 um lorsque l'yttrium est chauff??e ?? 750 ?? C dans de la vapeur d'eau . Lorsque finement divis??e, cependant, l'yttrium est tr??s instable dans l'air; copeaux ou tournures de m??tal peuvent se enflammer ?? l'air ?? des temp??ratures sup??rieures ?? 400 ?? C. du nitrure d'yttrium (YN) est form?? lorsque le m??tal est chauff?? ?? 1000 ?? C dans l'azote .
Similitude avec les lanthanides
Les similitudes de l'yttrium ?? les lanthanides sont si fortes que l'??l??ment a ??t?? historiquement regroup??s avec eux comme un ??l??ment des terres rares, et est toujours trouv?? dans la nature ensemble avec eux dans min??raux de terres rares.
Chimiquement, ces ??l??ments yttrium ressemble plus ??troitement que son voisin dans le tableau p??riodique, du scandium , et si ses propri??t??s physiques ont ??t?? trac??es en fonction de num??ro atomique alors qu'il aurait un nombre apparent de 64,5 ?? 67,5, en la pla??ant entre les lanthanides gadolinium et l'erbium .
Il tombe souvent aussi dans la m??me gamme de l'ordre de r??action, qui ressemble le terbium et le dysprosium dans sa r??activit?? chimique. L'yttrium est si proche de la taille de la soi-disant ??groupe de l'yttrium 'd'ions de lanthanides lourds en solution, il se comporte comme si elle ??tait une d'entre elles. M??me si les lanthanides sont une rang??e plus loin sur la table p??riodique de l'yttrium, la similitude de rayon atomique peut ??tre attribu??e ?? la contraction lanthanide.
L'un des quelques diff??rences notables entre la chimie de l'yttrium et des lanthanides qui est que l'yttrium est presque exclusivement trivalent , tandis que la moiti?? environ des lanthanides peut avoir des valences autres que trois.
Les compos??s et r??actions
En tant que m??tal de transition trivalent, d'yttrium forme de divers compos??s min??raux , g??n??ralement ?? l'??tat d'oxydation de +3, en abandonnant ses trois ??lectrons de valence. Un bon exemple est yttrium (III) oxyde (Y 2 O 3), ??galement connu sous le nom d'oxyde d'yttrium, un six coordonner solide blanc.
Yttrium forme un insoluble dans l'eau- fluorure, hydroxyde , et oxalate, mais son bromure, chlorure, iodure, nitrate et sulfate sont tous solubles dans l'eau. Y de l' ion de la solution est incolore en raison de l'absence d'??lectrons dans le d et f coquilles d'??lectrons.
L'eau r??agit facilement avec l'yttrium et ses compos??s pour former Y 2 O 3. Concentr?? nitrique et acides fluorhydrique ne attaquent pas rapidement yttrium, mais d'autres acides forts font.
Avec halog??nes , des formes d'yttrium tels que des trihalog??nures yttrium (III) fluorure (YF 3), yttrium (III) chlorure (YCl 3), et yttrium (III) bromure (ybr 3) ?? des temp??ratures sup??rieures ?? environ 200 ?? C. De m??me, le carbone , le phosphore , le s??l??nium , le silicium et le soufre toute forme compos??s binaires avec l'yttrium ?? des temp??ratures ??lev??es.
Organoyttrium chimie est l'??tude des compos??s contenant des liaisons carbone-yttrium. Quelques-uns d'entre eux sont connus pour avoir l'yttrium dans l'??tat d'oxydation 0. (L'??tat 2 a ??t?? observ??e dans fond de chlorure, et une en grappes d'oxyde dans la phase gazeuse). Certains Les r??actions de trim??risation ont ??t?? observ??s en utilisant des compos??s de organoyttrium comme catalyseurs. Ces compos??s servent YCl 3 comme mati??re de d??part, qui est ?? son tour obtenu ?? partir de Y 2 O 3 et concentr??e d'acide chlorhydrique et chlorure d'ammonium.
Hapticit?? est ainsi qu'un groupe d'atomes contigus d'un ligand est coordonn?? ?? un atome central; il est indiqu?? par l'ETA de caract??re grec, η. complexes yttrium ont ??t?? les premiers exemples de complexes o?? ligands carboranyle ??taient tenus de 0 annonce centre -m??tal travers un -hapticity η 7. La vaporisation du Compos??s d'intercalation du graphite graphite ou graphite-Y Y 2 O 3 conduit ?? la formation de fuller??nes endoh??driques tels que Y @ C 82. ??tudes de r??sonance de spin ??lectronique indique la formation de Y 3+ et (C 82) 3- paires d'ions. Le carbures Y 3 C, Y 2 C, et YC 2 peuvent chacun hydrolyser pour former des hydrocarbures.
Nucl??osynth??se et des isotopes
Yttrium dans le syst??me solaire a ??t?? cr???? par nucl??osynth??se stellaire, principalement par le s-processus (≈72%), mais aussi par la r-processus (≈28%). La r-proc??d?? consiste rapide capture de neutrons d'??l??ments plus l??gers au cours de supernovae explosions. Le s-processus est lent neutrons capture d'??l??ments plus l??gers ?? l'int??rieur pulsations g??antes rouges ??toiles.

isotopes de l'yttrium sont parmi les produits les plus courants de la fission nucl??aire de l'uranium se produisant dans des explosions nucl??aires et des r??acteurs nucl??aires. Sur le plan de gestion des d??chets nucl??aires, les isotopes les plus importants de l'yttrium sont 91 Y et Y 90, avec des demi-vies de 58,51 jours et 64 heures, respectivement. Bien que 90 Y a la demi-vie courte, il existe dans ??quilibre s??culaire avec son isotope parent ?? long terme, le strontium 90 (90 Sr) avec une demi-vie de 29 ans.
Tous les groupes de trois ??l??ments ont un ??trange num??ro atomique , et donc ils ont peu stables isotopes . scandium a un isotope stable , et l'yttrium lui-m??me a un seul isotope stable, 89 Y, qui est aussi son seul naturellement une. Cependant, la terres rares lanthanides contiennent des ??l??ments de nombre pair atomique et de nombreux isotopes stables. Yttrium-89 est pens?? pour ??tre plus abondant que ne le serait autrement, en partie ?? cause du processus s, ce qui laisse suffisamment de temps pour les isotopes cr????s par d'autres processus pour se d??sint??grer par ??mission d'??lectrons (→ neutrons ?? protons). Un tel processus lent tend ?? favoriser les isotopes avec les nombres de masse atomique (A = protons + neutrons) autour de 90, 138 et 208, qui sont exceptionnellement stables noyaux atomiques avec 50, 82 et 126 neutrons, respectivement. 89 Y a un nombre de masse voisine de 90 et poss??de 50 neutrons dans son noyau .
Au moins 32 isotopes synth??tiques d'yttrium ont ??t?? observ??s, et ceux-ci varient en num??ro de masse atomique de 76 ?? 108. L'moins stable de ceux-ci est de 106 Y avec une demi-vie de> 150 ns (76 Y a une demi-vie de> 200 ns) et la plus stable est 88 Y, avec une demi-vie de 106,626 jours. Outre les isotopes 91 Y, 87 Y et 90 Y, avec une demi-vie de 58,51 jours, 79,8 heures et 64 heures, respectivement, tous les autres isotopes avoir une demi-vie de moins d'une journ??e et la plupart de ceux avoir demi vie de moins d'une heure.
Yttrium isotopes avec des nombres de masse ??gale ou inf??rieure ?? 88 d??sint??gration principalement par ??mission de positons (protons → de neutrons) pour former le strontium ( Z = 38) des isotopes. isotopes de l'yttrium avec des nombres de masse ??gale ou sup??rieure ?? 90 d??sint??gration principalement par ??mission d'??lectrons (→ neutrons ?? protons) pour former zirconium (Z = 40) des isotopes. Les isotopes avec des nombres de masse ??gale ou sup??rieure ?? 97 sont ??galement connus pour avoir des chemins de d??sint??gration β- mineures de retard ??mission de neutrons.
Yttrium a au moins 20 isom??res m??tastables ou excit??s allant dans nombre de masse de 78 ?? 102. Plusieurs ??tats d'excitation ont ??t?? observ??s pour les 80 et 97 Y Y. Alors que la plupart des isom??res de l'yttrium devraient ??tre moins stables que leur ??tat fondamental, 78m Y, Y 84m, 85m Y, Y 96m, 98m1 Y, Y 100m, 102m et Y ont des demi-vies plus longues que leurs ??tats fondamentaux, car ces isom??res d??croissance par d??sint??gration b??ta plut??t que transition isom??rique.
Histoire
En 1787, lieutenant de l'arm??e et ?? temps partiel chimiste Carl Axel Arrhenius trouv?? une roche noire lourde dans une ancienne carri??re pr??s du village su??dois de Ytterby (maintenant partie de la Archipel de Stockholm). Pensant que ce ??tait un min??ral inconnu contenant l'??l??ment nouvellement d??couvert de tungst??ne , il l'a nomm?? ytterbite et envoy?? des ??chantillons ?? divers chimistes pour une analyse ult??rieure.

Johan Gadolin au Universit?? de ??bo identifi?? une nouvelle oxyde ou " terre "dans l'??chantillon d'Arrhenius en 1789, et publi?? son analyse achev??e en 1794. Anders Gustaf Ekeberg confirm?? en 1797 et nomm?? les nouveaux yttrium d'oxyde. Dans les d??cennies qui ont suivi Antoine Lavoisier d??velopp?? la premi??re d??finition moderne de ??l??ments chimiques , on a cru que les terres pourraient ??tre r??duits ?? leurs ??l??ments, ce qui signifie que la d??couverte d'une nouvelle terre ??tait ??quivalente ?? la d??couverte de l'??l??ment au sein, qui dans ce cas serait ont ??t?? yttrium.
En 1843, Carl Gustaf Mosander trouv?? que des ??chantillons de l'oxyde d'yttrium contenaient trois oxydes: blanc l'oxyde d'yttrium (yttria), jaune oxyde de terbium (confusion, cela se appelait ??erbia '?? l'??poque) et rose l'oxyde d'erbium (appel?? ??terbia '?? l'??poque). Un quatri??me oxyde, oxyde d'ytterbium, a ??t?? isol?? en 1878 par Jean Charles Galissard de Marignac. De nouveaux ??l??ments seraient plus tard isol??s de chacun de ces oxydes, et chaque ??l??ment a ??t?? nomm??, en quelque sorte, apr??s Ytterby, village pr??s de la carri??re o?? ils ont ??t?? trouv??s (voir l'ytterbium , le terbium et l'erbium ). Dans les d??cennies suivantes, sept autres nouveaux m??taux ont ??t?? d??couverts dans "l'oxyde d'yttrium de Gadolin". Depuis l'oxyde d'yttrium est un min??ral apr??s tout, et pas un oxyde, Martin Heinrich Klaproth rebaptis?? gadolinite en l'honneur du Gadolin.
Yttrium m??tal a ??t?? isol?? pour la premi??re en 1828 lorsque Friedrich W??hler anhydre chauff?? yttrium (III) avec du chlorure de potassium :
- YCl 3 + 3 K → 3 KCl + Y
Jusqu'au d??but des ann??es 1920, le symbole chimique Yt a ??t?? utilis?? pour l'??l??ment, apr??s avoir entr?? Y en usage commun.
En 1987, l'oxyde d'yttrium de baryum cuivre a ??t?? trouv?? pour obtenir supraconductivit?? ?? haute temp??rature. Ce ??tait seulement la deuxi??me mat??riau connu pour pr??senter cette propri??t??, et il a ??t?? le premier mat??riau connu pour atteindre la supraconductivit?? au-dessus du (??conomiquement important) point de l'azote d'??bullition.
Occurrence

Abondance
Yttrium se trouve dans la plupart min??raux de terres rares, ainsi que certains uranium minerais, mais ne est jamais trouv??s dans la nature comme un ??l??ment libre. Environ 31 ppm de la cro??te de la Terre est l'yttrium, ce qui en fait l'??l??ment le plus abondant 28 l??, et 400 fois plus fr??quente que l'argent . L'yttrium est pr??sent dans le sol ?? une concentration comprise entre 10 et 150 ppm (en poids sec moyen de 23 ppm) et en eau de mer ?? 9 ppt. ??chantillons de roches lunaires collect??es au cours de la am??ricaine Apollo Project ont une teneur relativement ??lev??e de l'yttrium.
Yttrium n'a pas de r??le biologique connue, bien qu'elle se trouve dans la plupart, sinon la totalit??, des organismes et a tendance ?? se concentrer dans le foie, les reins, la rate, les poumons et les os de l'??tre humain. Il est normalement aussi peu que 0,5 milligrammes trouv??s dans tout le corps humain; humain le lait maternel contient 4 ppm. Yttrium peut ??tre trouv?? dans les plantes comestibles ?? des concentrations comprises entre 20 ppm et 100 ppm (poids frais), avec le chou ayant la plus grande quantit??. Avec jusqu'?? 700 ppm, les graines de plantes ligneuses ont les concentrations les plus ??lev??es connues.
Production
La similarit?? chimique avec de l'yttrium les lanthanides elle conduit ?? ??tre enrichi par les m??mes proc??d??s et finit dans les minerais contenant des lanthanides, en formant min??raux de terres rares. Une l??g??re s??paration est reconnu entre la lumi??re (terres rares l??g??res) et les ??l??ments de terres rares lourdes (ROIS), mais cette s??paration ne est jamais compl??te. L'yttrium est concentr??e dans le groupe de terres rares lourdes du fait de sa taille ionique, m??me si elle a une faible masse atomique.

Il ya quatre principales sources de terres rares:
- Minerais de carbonate et de fluorure contenant tels que les terres rares l??g??res bastn??site ([(Ce, La, etc.) (CO 3) F]) contient une moyenne de 0,1% d'yttrium par rapport ?? 99,9% pour les 16 autres terres rares. La principale source de bastn??site partir des ann??es 1960 aux ann??es 1990 ??tait le Mine de Mountain Pass en Californie, rendant aux ??tats-Unis le plus grand producteur de terres rares pendant cette p??riode.
- Monazite ([( Ce , La , etc.) PO 4]), qui est principalement du phosphate, est un placer d??p??t de sable qui est cr???? par le transport et la s??paration par gravit?? de granit ??rod??. Monazite comme un minerai de terres rares l??g??res contient 2% (soit 3%) de l'yttrium. Les plus grands gisements ont ??t?? trouv??s dans l'Inde et le Br??sil dans le d??but du 20??me si??cle, faisant de ces deux pays, les plus grands producteurs d'yttrium dans la premi??re moiti?? de ce si??cle.
- Xenotime, un phosphate de terres rares, est le minerai de terres rares lourdes principale contenant jusqu'?? 60% de l'yttrium en tant que phosphate d'yttrium (YPO 4). La plus grande mine de ce min??ral est le Bayan Obo d??p??t en Chine, faisant de la Chine le plus grand exportateur de terres rares lourdes depuis la fermeture de la mine de Mountain Pass dans les ann??es 1990.
- Argiles d'absorption d'ions ou des argiles Lognan sont les produits d'alt??ration de granit et ne contiennent que 1% des terres rares. Le concentr?? de minerai finale peut contenir jusqu'?? 8% d'yttrium. Argiles d'absorption d'ions sont principalement exploit??s dans le sud de la Chine. L'yttrium est ??galement trouv?? dans samarskite et fergusonite.
Une m??thode pour obtenir de l'yttrium pur ?? partir de minerais d'oxyde mixte est de dissoudre l'oxyde dans l'acide sulfurique et fractionner par ??change d'ions chromatographie . Avec l'ajout de l'acide oxalique, l'oxalate d'yttrium pr??cipite. L'oxalate est converti en oxyde par chauffage sous oxyg??ne. En faisant r??agir l'oxyde d'yttrium r??sultante avec fluorure d'hydrog??ne, fluorure d'yttrium est obtenue. Utilisation de sels d'ammonium quaternaire comme agents d'extraction, l'yttrium souhaite rester dans la phase aqueuse: lorsque le contre-ion est le nitrate, les lanthanides l??gers sont retir??s, mais lorsque le contre-ion est le thiocyanate, les lanthanides lourds sont ??limin??s. sels de Yttrium de 99,999% de puret?? sont obtenus. Dans la situation normale, o?? l'yttrium est de deux tiers d'un m??lange-lanthanide lourd, il est avantageux de le sortir du syst??me le plus rapidement possible, afin de faciliter la s??paration des ??l??ments restants.
La production annuelle mondiale d'oxyde d'yttrium avait atteint 600 tonnes par 2001, avec des r??serves estim??es ?? 9 millions de tonnes. Seuls quelques tonnes d'yttrium m??tallique sont produites chaque ann??e en r??duisant yttrium fluorure pour une ??ponge m??tallique avec calcium magn??sium alliage. La temp??rature d'un four ?? arc au-dessus de 1600 ?? C est suffisante pour faire fondre le yttrium.
Applications
Consommateur

L'oxyde d'yttrium (Y 2 O 3) peut servir de r??seau h??te pour dopage avec Eu 3+ cations ainsi que r??actif pour gagner dop?? yttrium Y orthovanadate VO 4: Eu 3+ ou de l'oxyde d'yttrium Y 2 O sulfure 2 S: Eu 3+ luminophores qui donnent la couleur rouge dans tubes cathodiques de t??l??vision couleur, si la couleur rouge se est effectivement ??mise par l'europium tandis que l'yttrium recueille l'??nergie ?? partir de la pistolet ??lectronique et passe au phosphore. compos??s d'yttrium peuvent servir de r??seaux d'accueil pour le dopage avec diff??rents lanthanides cations. Outre Eu 3+ ??galement Tb 3+ peut ??tre utilis?? en tant qu'agent de dopage de premier plan au vert luminescence. L'oxyde d'yttrium est aussi utilis?? comme un additif de frittage pour la production de poreux nitrure de silicium et comme mati??re de d??part commun ?? la fois pour la science des mat??riaux et pour produire d'autres compos??s de l'yttrium.
des compos??s contenant de l'yttrium sont utilis??s comme catalyseur pour l'??thyl??ne polym??risation. En tant que m??tal, il est utilis?? sur les ??lectrodes de certaines hautes performances bougies d'allumage. L'yttrium est ??galement utilis?? dans la fabrication de manteaux de gaz pour le propane lanternes comme un remplacement pour le thorium , qui est radioactifs.
D??veloppement utilisations comprennent la zircone stabilis??e ?? l'yttrium, en particulier en tant qu'??lectrolyte solide et comme un capteur d'oxyg??ne dans les syst??mes d'??chappement d'automobiles.
Grenats

L'yttrium est utilis?? dans la production d'une grande vari??t?? de grenats synth??tiques, et d'oxyde d'yttrium est utilis?? pour faire grenats d'yttrium de fer (Y 3 Fe 5 O 12 ou YIG), qui sont tr??s efficaces micro-onde filtres. Yttrium, le fer , l'aluminium , et gadolinium grenats (par exemple Y 3 (Fe, Al) 5 O 12 et Y 3 (Fe, Ga) 5 O 12) ont d'importantes magn??tiques propri??t??s. YIG est ??galement tr??s efficace comme un ??metteur d'??nergie acoustique et le transducteur. Grenat d'aluminium et yttrium (Y 3 Al 5 O 12 ou YAG) a une duret?? de 8,5 et est ??galement utilis?? en tant que pierres pr??cieuses dans les bijoux (simul?? diamant .) c??rium dop?? grenat d'yttrium aluminium (YAG: Ce) cristaux sont utilis??s comme luminophores ?? faire blanc LED.
YAG, l'oxyde d'yttrium, le fluorure de lithium yttrium (LiYF 4), et orthovanadate d'yttrium (YVO 4) sont utilis??s en combinaison avec des dopants tels que le n??odyme , l'erbium , l'ytterbium en quasi infrarouge lasers . YAG ont la capacit?? de fonctionner ?? puissance ??lev??e et sont utilis??s pour le forage dans et coupage du m??tal. Les monocristaux de YAG dop?? sont normalement produites par le processus de Czochralski.
Activateur Mat??riel
De petites quantit??s d'yttrium (0,1 ?? 0,2%) ont ??t?? utilis??es pour r??duire les tailles de grains de chrome , molybd??ne , titane et zirconium . Il est ??galement utilis?? pour augmenter la force de l'aluminium et de magn??sium alliages. L'addition d'yttrium ?? des alliages am??liore g??n??ralement la maniabilit??, la r??sistance ?? la recristallisation ajoute ?? temp??rature ??lev??e et am??liore consid??rablement la r??sistance ?? haute temp??rature oxydation (voir graphite discussion nodule ci-dessous).
L'yttrium peut ??tre utilis?? pour d??soxyder vanadium et d'autres les m??taux non ferreux. L'oxyde d'yttrium est utilis?? pour stabiliser le forme cubique de la zircone pour une utilisation dans les bijoux.
Yttrium a ??t?? ??tudi?? pour une utilisation possible comme nodulizer ?? faire fonte nodulaire, qui a augment?? ductilit?? (le formes de graphite nodules compacts au lieu de flocons pour former fonte nodulaire). L'oxyde d'yttrium peut ??galement ??tre utilis?? dans c??ramique et verre formules, car il a une haute temp??rature de fusion et donne r??sistance aux chocs et bas caract??ristiques de dilatation thermique. Il est donc utilis?? dans lentilles de cam??ra.
M??dical
L'isotope radioactif yttrium-90 est utilis??e dans des m??dicaments tels que Yttrium Y 90-DOTA-Tyr3-octr??otide et Yttrium Y ibritumomab tiux??tan 90 pour le traitement de divers cancers , y compris lymphome, cancers de la leuc??mie, de l'ovaire, colorectal, du pancr??as, et des os. Il fonctionne en adh??rant ?? anticorps monoclonaux, qui ?? son tour se lient aux cellules canc??reuses et les tuer par l'interm??diaire intense β-rayonnement de l'yttrium-90 (voir Une th??rapie par anticorps monoclonaux).
Aiguilles en yttrium-90, qui peut couper plus pr??cis??ment que scalpels, ont ??t?? utilis??s pour couper la douleur de transmission nerfs dans le la moelle ??pini??re et l'yttrium-90 est ??galement utilis?? pour r??aliser des radionucl??ides synovectomie dans le traitement de l'inflammation des articulations, en particulier dans les genoux, les personnes souffrant de maladies telles que la polyarthrite rhumato??de.
Un laser ?? yttrium-aluminium-grenat dop?? au n??odyme a ??t?? utilis?? dans un radical exp??rimental, assist??e par robot prostatectomie chez le chien dans une tentative de r??duire nerf collat??ral et des l??sions tissulaires, tandis que celles dop??es ?? l'erbium commencent ?? ??tre utilis??s dans les produits cosm??tiques resurfa??age de la peau.
Supraconducteurs

L'yttrium est utilis?? dans le yttrium oxyde de cuivre de baryum (YBa 2 Cu 3 O 7, aka "YBCO?? ou ??1-2-3??) supraconducteur ??labor??s au Universit?? de l'Alabama et de la Universit?? de Houston en 1987. Cette supraconducteur fonctionne ?? 93 K, remarquable parce que ce est au-dessus le point d'??bullition de l'azote liquide (77,1 K). Comme le prix de l'azote liquide est inf??rieur ?? celui de l'h??lium liquide, qui doit ??tre utilis?? pour les supraconducteurs m??talliques, les co??ts d'exploitation diminueraient.
Le mat??riau supraconducteur r??el est souvent ??crit que YBa 2 Cu 3 O 7-d, o?? d doit ??tre inf??rieure ?? 0,7 pour le mat??riau de supraconducteur. La raison en est pas encore clair, mais on sait que les vacances se produisent seulement dans certains endroits dans le cristal, les plans d'oxyde de cuivre et de cha??nes, donnant lieu ?? un ??tat d'oxydation particulier des atomes de cuivre, ce qui conduit en quelque sorte ?? l'supraconducteur comportement.
La th??orie de la supraconductivit?? ?? faible temp??rature a ??t?? bien compris depuis le La th??orie BCS a ??t?? pr??sent?? en 1957. Il est bas?? sur une particularit?? de l'interaction entre deux ??lectrons dans un r??seau cristallin. Cependant, la th??orie BCS ne explique pas la supraconductivit?? ?? haute temp??rature, et son m??canisme pr??cis est encore un myst??re. On sait que la composition des mat??riaux d'oxyde de cuivre doit ??tre contr??l??e avec pr??cision si la supraconductivit?? est de se produire.
Le mat??riel cr???? ??tait un multi-cristal, plusieurs phases min??ral noir et vert. Les chercheurs ??tudient une classe de mat??riaux appel??s p??rovskites qui sont alternatives m??langes de ces ??l??ments, dans l'espoir, ?? terme, d??velopper une pratique Supraconducteur ?? haute temp??rature.
Pr??cautions
des compos??s solubles dans l'eau d'yttrium sont consid??r??s comme l??g??rement toxique, tandis que ses compos??s insolubles ne sont pas toxiques. Dans les exp??riences sur les animaux, l'yttrium et ses compos??s caus??s poumons et le foie des dommages, si la toxicit?? varie selon les diff??rents compos??s d'yttrium. Chez le rat, l'inhalation de l'yttrium citrate caus?? un oed??me pulmonaire et dyspn??e, tandis que l'inhalation de le chlorure d'yttrium ??d??me caus?? du foie, ??panchements pleuraux et hyper??mie pulmonaire.
L'exposition ?? des compos??s d'yttrium les humains peut causer des maladies pulmonaires. Les travailleurs expos??s ?? l'air yttrium et d'europium vanadate poussi??re connu yeux doux, la peau et les voies respiratoires sup??rieures irritations si cela peut avoir ??t?? caus?? par le vanadium contenu plut??t que le yttrium. L'exposition aigu?? ?? des compos??s d'yttrium peut provoquer un essoufflement, une toux, des douleurs thoraciques, et cyanose. NIOSH recommande une pond??r??e dans le temps limite moyenne de 1 mg / m 3 et une DIVS de 500 mg / m 3. poussi??re d'yttrium est inflammable.
