
Europium
Renseignements g??n??raux
Enfants SOS ont produit une s??lection d'articles de wikipedia pour les ??coles depuis 2005. Cliquez ici pour plus d'informations sur les enfants SOS.
| Europium | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
63 Eu | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||
blanc argent??, mais rarement vu sans oxyde d??coloration  | ||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | europium, Eu, 63 | |||||||||||||||||||||||||||||||||
| Prononciation | / j ʊ r oʊ p Je ə m / Ewing ROH -pee-əm | |||||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | lanthanides | |||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | n / a, 6, fa | |||||||||||||||||||||||||||||||||
| Poids atomique standard | 151,964 | |||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Xe ] 4f 7 6s 2 2, 8, 18, 25, 8, 2 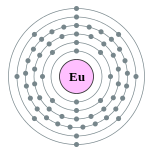 | |||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||
| D??couverte | Eug??ne Anatole Demar??ay (1896) | |||||||||||||||||||||||||||||||||
| Premier isolement | Eug??ne Anatole Demar??ay (1901) | |||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 5,264 g ?? cm -3 | |||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 5,13 g ?? cm -3 | |||||||||||||||||||||||||||||||||
| Point de fusion | 1099 K , 826 ?? C, 1519 ?? F | |||||||||||||||||||||||||||||||||
| Point d'??bullition | 1802 K, 1529 ?? C, 2784 ?? F | |||||||||||||||||||||||||||||||||
| La chaleur de fusion | 9,21 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 176 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 27,66 J ?? mol -1 ?? K -1 | |||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 3, 2, 1 (L??g??rement oxyde de base) | |||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | ? 1,2 (??chelle de Pauling) | |||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1er: 547,1 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||
| 2??me: 1085 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||
| 3??me: 2404 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||
| Rayon atomique | 180 h | |||||||||||||||||||||||||||||||||
| Rayon covalente | 198 ?? 18 heures | |||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||
| Crystal structure | cubique centr??  | |||||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | |||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | ( rt) (poly) 0,900 μΩ ?? m | |||||||||||||||||||||||||||||||||
| Conductivit?? thermique | est. 13,9 W ?? m -1 K -1 | |||||||||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (poly) 35,0 um / (m ?? K) | |||||||||||||||||||||||||||||||||
| Le module d'Young | 18,2 GPa | |||||||||||||||||||||||||||||||||
| Module de cisaillement | 7,9 GPa | |||||||||||||||||||||||||||||||||
| Module Bulk | 8,3 GPa | |||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,152 | |||||||||||||||||||||||||||||||||
| Duret?? Vickers | 167 MPa | |||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-53-1 | |||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de l'europium | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
Europium est un ??l??ment chimique avec le symbole Eu et de num??ro atomique 63. Il est nomm?? d'apr??s le continent de l'Europe . Ce est un argent?? mod??r??ment dure m??tal qui se oxyde facilement dans l'air et l'eau . ??tre un membre typique de la lanthanides s??rie, l'europium assume g??n??ralement le degr?? d'oxydation 3, mais l'??tat d'oxydation 2 est ??galement fr??quent: tous les compos??s d'europium avec l'??tat d'oxydation 2 sont l??g??rement r??ducteur. Europium n'a pas de r??le biologique important et est relativement non toxique par rapport ?? d'autres m??taux lourds. La plupart des applications de l'europium exploitent la phosphorescence de compos??s d'europium.
Caract??ristiques
Propri??t??s physiques


L'europium est un m??tal ductile d'une duret?? similaire ?? celle du plomb . Il cristallise dans un corps-r??seau cubique centr??. Certaines propri??t??s de l'europium sont fortement influenc??es par sa demi-remplie shell ??lectrons. Europium a le point de fusion plus bas et le deuxi??me plus faible densit?? de tous les lanthanides.
L'europium est un supraconducteur lorsqu'il est refroidi en dessous de 1,8 K et comprim?? ?? plus de 80 GPa. Ce est parce que l'europium divalent est ?? l'??tat m??tallique, et est convertie en l'??tat trivalent par la pression appliqu??e. Dans l'??tat divalent, le fort moment magn??tique local (J = 7/2) supprime la supraconductivit??, qui est induite par l'??limination de ce moment local (J = 0 dans Eu 3+).
Propri??t??s chimiques
L'europium est le plus r??actif ??l??ment des terres rares. Il se oxyde rapidement dans l'air, de sorte que l'oxydation de la masse d'un ??chantillon de taille centim??trique se produit en quelques jours. Sa r??activit?? avec l'eau est comparable ?? celle de calcium , et le m??lange r??actionnel est
- 2 Eu + 6 H 2 O → 2 Eu (OH) 3 + 3 H 2
En raison de la forte r??activit??, des ??chantillons de l'europium solide ont rarement l'aspect brillant du m??tal frais, m??me lorsque rev??tue d'une couche protectrice d'huile min??rale. L'europium se enflamme ?? l'air ?? 150 ?? 180 ?? C pour former l'europium (III) de l'oxyde:
- 4 Eu + 3 O 2 → 2 Eu 2 O 3
Europium se dissout facilement dans dilu??e de l'acide sulfurique pour former des solutions de roses p??les de l'UE (III) hydrat??, qui existe en tant que nonahydrate:
- Eu 2 + 3 H 2 SO 4 + 18 H 2 O 2 → [Eu (H 2 O) 9] 3+ + 3 SO 2-
4 + 3 H 2
Eu (II) par rapport ?? Eu (III)
Bien que g??n??ralement trivalent, l'europium forme facilement des compos??s bivalents. Ce comportement est inhabituel pour la plupart des lanthanides , qui forment presque exclusivement compos??s avec un ??tat d'oxydation de +3. L'Etat a un 2 configuration ??lectronique 4 f 7 parce que la demi-rempli f -shell donne plus de stabilit??. En termes de taille et de nombre de coordination, l'europium (II) et de baryum (II) sont similaires. Par exemple, les sulfates de baryum et deux europium (II) sont ??galement fortement insoluble dans l'eau. L'europium divalent est un agent r??ducteur doux, l'oxydation dans l'air pour former des compos??s Eu (III). Dans ana??robie et des conditions particuli??rement g??othermiques, la forme bivalent est suffisamment stable qu'elle tend ?? ??tre incorpor?? dans les min??raux de calcium et les autres terres alcalines. Ce processus d'??change d'ions est la base de la "europium anomalie n??gative", la faible teneur en europium dans de nombreux min??raux lanthanides tels que la monazite, par rapport ?? la chondritique abondance. Bastn??site tend ?? montrer moins d'une anomalie de l'europium n??gative que ne le fait la monazite, et est la principale source de l'europium aujourd'hui donc. Le d??veloppement de m??thodes faciles ?? s??parer l'europium des autres lanthanides trivalents fait l'europium accessible, m??me lorsqu'il est pr??sent en faible concentration, comme ce est g??n??ralement.
Isotopes
Naturellement l'europium survenant est compos?? de deux isotopes , 151 et 153 Eu Eu, avec 153 Eu ??tant plus abondante (52,2% du abondance naturelle). Alors que 153 Eu est stable, 151 Eu a ??t?? r??cemment jug??e instable pour d??sint??gration alpha avec une demi-vie de 5 11
18 ?? 10 -3 ann??e, ce qui donne environ 1 d??sint??gration alpha par deux minutes dans chaque kilogramme de l'europium naturel. Cette valeur est en accord raisonnable avec les pr??dictions th??oriques. Outre le radio-isotope naturel 151 Eu, 35 radio-isotopes artificiels ont ??t?? caract??ris??s, le plus stable ??tant de 150 Eu avec une demi-vie de 36,9 ann??es, 152 Eu avec une demi-vie de 13,516 ann??es, et 154 Eu avec une demi-vie de 8,593 ann??es. Tout le reste isotopes radioactifs ont une demi-vie de moins de 4,7612 ann??es, et la majorit?? d'entre eux ont des demi-vies plus courtes que 12,2 secondes. Cet ??l??ment a ??galement huit ??tats m??ta, avec l'??tre le plus stable 150m Eu (T ?? = 12,8 heures), 152m1 Eu (T ?? = 9,3116 heures) et 152m2 Eu (T ?? = 96 minutes).
Le primaire mode de d??sint??gration des isotopes plus l??ger que 153 Eu est capture d'??lectrons, et le principal mode d'isotopes plus lourds est d??sint??gration b??ta moins. Le primaire produits de d??sint??gration avant 153 Eu sont des isotopes de samarium (Sm) et les produits primaires apr??s sont des isotopes du gadolinium (Gd).
L'europium en tant que produit de la fission nucl??aire
| Isotope | 151 Eu | 152 Eu | 153 Eu | 154 Eu | 155 Eu |
|---|---|---|---|---|---|
| Rendement | ~ 10 | faible | 1580 | > 2,5 | 330 |
| Barns | 5900 | 12800 | 312 | 1340 | 3950 |
| Prop: Unit??: | t ?? une | Rendement % | Q * keV | βγ * |
|---|---|---|---|---|
| 155 Eu | 4,76 | 0,0803 | 252 | βγ |
| 85 Kr | 10,76 | 0,2180 | 687 | βγ |
| 113m Cd | 14,1 | 0,0008 | 316 | β |
| 90 Sr | 28,9 | 4,505 | 2826 | β |
| 137 Cs | 30,23 | 6,337 | 1176 | β γ |
| 121m Sn | 43,9 | 0,00005 | 390 | βγ |
| 151 Sm | 90 | 0,5314 | 77 | β |
| Hover soulign??: plus d'info | ||||
Europium est produit par la fission nucl??aire, mais le rendements de produits de fission d'isotopes d'europium sont faibles pr??s du haut de la gamme des masses produits de fission.
Comme d'autres lanthanides , de nombreux isotopes, en particulier des isotopes avec des num??ros impairs de masse et isotopes de neutrons pauvres comme 152 Eu, avoir une grande pour des sections transversales capture de neutrons, souvent assez haut pour ??tre poisons neutroniques.
151 Eu est le produit de d??sint??gration b??ta de samarium-151, mais depuis cela a une longue d??croissance demi-vie et peu de temps moyen ?? l'absorption de neutrons, plus 151 Sm se termine ?? la place comme 152 Sm.
152 Eu (demi-vie 13,516 ann??es) et 154 Eu (demi-vie 8,593 ann??es) ne peuvent pas ??tre des produits de d??sint??gration b??ta, car 152 154 Sm et Sm sont non-radioactifs, mais 154 Eu est le seul long v??cu "blind??" nucl??ide, ?? l'exception 134 Cs, d'avoir un rendement de fission de plus de 2,5 parties par million de fissions. Une plus grande quantit?? de 154 Eu est produit par activation des neutrons d'une partie importante de la non-radioactif 153 Eu; Cependant, une grande partie est en outre converti en 155 Eu.
155 Eu (demi-vie 4,7612 ann??es) a un rendement de fission de 330 parties par million (ppm) pour uranium-235 et les neutrons thermiques; de plus il est transmut?? de non-radioactif et non absorbant gadolinium-156 ?? la fin de carburant br??ler.
Dans l'ensemble, l'europium est ??clips?? par le c??sium-137 et strontium-90 comme un danger de rayonnement, et par le samarium et d'autres comme un poison de neutrons.
Occurrence

L'europium est pas trouv?? dans la nature comme un ??l??ment libre. De nombreux min??raux contiennent europium, avec les sources les plus importantes ??tant bastn??site, monazite, x??notime et loparite.
L'appauvrissement ou enrichissement en min??raux de l'europium par rapport aux autres ??l??ments de terres rares est connue comme la europium anomalie. Europium est commun??ment inclus dans les ??tudes d'oligo-??l??ments dans g??ochimie et p??trologie de comprendre les processus qui forment les roches ign??es (de roches qui se sont refroidies de magma ou la lave ). La nature de l'anomalie europium trouv?? aide ?? reconstruire les relations au sein d'une suite de roches ign??es.
Europium divalent (Eu 2+) en petites quantit??s est l'activateur du bleu vif fluorescence de certains ??chantillons de la mati??re min??rale fluorite (CaF 2). La r??duction de Eu 3+ de Eu 2+ est induite par irradiation avec des particules ??nerg??tiques. Les exemples les plus remarquables de cette origine autour Weardale et les parties adjacentes du nord de l'Angleterre; ce ??tait la fluorite trouv?? ici que fluorescence a ??t?? nomm?? d'apr??s, m??me si ce ne est que beaucoup plus tard que l'europium a ??t?? d??termin??e comme ??tant la cause.
Production
L'europium est associ??e ?? l'autre ??l??ments de terre rare et est donc extrait avec eux. La s??paration des ??l??ments des terres rares est une ??tape dans le traitement ult??rieur. ??l??ments de terres rares sont pr??sents dans les min??raux bastn??site, loparite, x??notime, et monazite en quantit??s exploitables. Les deux premiers sont des min??raux orthophosphates LnPO 4 (Ln d??signe un m??lange de tous les lanthanides sauf promethium ), et le troisi??me est un fluorocarbonate LNCO 3 F. Monazite contient ??galement du thorium et de l'yttrium , ce qui complique la manipulation parce que le thorium et ses produits de d??sint??gration sont radioactifs. Pour l'extraction du minerai et l'isolement des lanthanides individuelles, plusieurs m??thodes ont ??t?? d??velopp??es. Le choix de la m??thode est bas??e sur la concentration et la composition du minerai et de la distribution des lanthanides individuels dans le concentr?? r??sultant. Torr??faction du minerai et la lixiviation acide et basique ult??rieure est utilis?? principalement pour produire un concentr?? de lanthanides. Si le lanthanide est le c??rium dominante, puis elle est convertie ?? partir de c??rium (III) en c??rium (IV) et ensuite pr??cipit??. En outre s??paration par extractions par solvant ou Chromatographie d'??change d'ions donne une fraction qui est enrichie en europium. Cette fraction est r??duite avec du zinc, zinc / amalgame, l'??lectrolyse ou d'autres proc??d??s de conversion de l'europium (III) en europium (II). L'europium (II) r??agit d'une mani??re similaire ?? celle de m??taux alcalino-terreux et par cons??quent, il peut ??tre pr??cipit?? sous forme de carbonate ou est co-pr??cipit?? avec du sulfate de baryum. Europium m??tal est disponible par l'??lectrolyse d'un m??lange fondu de EuCl 3 et NaCl (ou CaCl 2) dans une cellule de graphite, qui sert de cathode, en utilisant du graphite comme anode. L'autre produit est le chlore gazeux.
Quelques grands d??p??ts produisent ou ont produit une quantit?? significative de la production mondiale. Le Bayan Obo gisement de minerai de fer contient des quantit??s importantes de bastn??site et monazite et est, avec environ 36 millions de tonnes de rares oxydes d'??l??ments de la terre, le plus grand gisement connu. Les op??rations mini??res du gisement Bayan Obo fait de la Chine le plus grand fournisseur d'??l??ments de terres rares dans les ann??es 1990. Seulement 0,2% de la teneur en ??l??ment des terres rares est l'europium. La seconde source importante de m??taux des terres rares entre 1965 et sa fermeture ?? la fin des ann??es 1990 est la Mountain Pass mine de terres rares. Le bastn??site extrait il est particuli??rement riche en ??l??ments des terres rares l??g??res (La-Gd, Sc et Y) et ne contient que 0,1% de l'europium. Une autre grande source pour les ??l??ments des terres rares est le loparite trouve sur la p??ninsule de Kola. Il contient plus de niobium, le tantale et le titane jusqu'?? 30% des ??l??ments de terres rares et est la plus grande source de ces ??l??ments en Russie.
Compos??s


Halog??nures
Europium m??tal r??agit avec tous les atomes d'halog??ne:
- Eu + 3 2 2 X → 2 EuX 3 (X = F, Cl, Br, I)
Cette route donne l'europium blanc (III) fluorure (FUE 3), jaune europium (III) chlorure (EuCl 3), l'europium gris (III) du bromure (EuBr 3), et l'europium incolore (III) d'iodure (EUI 3). Europium forme ??galement les dihalog??nures correspondant: l'europium jaune-vert (II) de fluorure (FUE 2), l'europium incolore (II) chlorure (EuCl 2), l'europium incolore (II) du bromure (EuBr 2), et l'europium vert (II) d'iodure ( Eui 2).
Chalcogenides et pnictures
Europium forme des compos??s stables avec tous les chalcog??nes, mais les chalcog??nes lourds stabiliser l'??tat d'oxydation inf??rieur. Trois oxydes sont connus: l'oxyde d'europium (II) (EuO), l'europium (III) oxyde (Eu 2 O 3), et l'oxyde mixte (Eu 3 O 4). Sinon, les principales chalcog??nures sont europium (II) de sulfure (EUS), l'europium (II) s??l??niure (euse) et l'europium (II) tellurure (EuTe): tous les trois d'entre eux sont solides noir. EuS est pr??par?? par la sulfuration de l'oxyde ?? des temp??ratures suffisamment ??lev??es pour d??composer l'Eu 2 O 3:
- Eu 2 O 3 + 3 H 2 S → 2 + 3 EuS H 2 O + S
Le principal nitrure est l'europium (III) nitrure (EUN).
Histoire
Bien que l'europium est pr??sent dans la plupart des min??raux contenant les autres ??l??ments rares, en raison des difficult??s ?? s??parer les ??l??ments, il ne ??tait pas jusqu'?? la fin des ann??es 1800 que l'??l??ment a ??t?? isol??. William Crookes observ?? les spectres phosphorescente des ??l??ments rares et observer raies spectrales tard affect??s ?? l'europium.
Europium a ??t?? trouv??e par Paul ??mile Lecoq de Boisbaudran en 1890, qui a obtenu des fractions de base ?? partir de concentr??s de samarium-gadolinium qui avaient raies spectrales non comptabilis??s par le samarium ou le gadolinium . Cependant, la d??couverte de l'europium est g??n??ralement cr??dit??e au fran??ais chimiste Eug??ne Anatole Demar??ay, qui soup??onnait des ??chantillons de l'??l??ment samarium r??cemment d??couvert ??taient contamin??s par un ??l??ment inconnu en 1896 et qui a r??ussi ?? l'isoler en 1901; puis il a nomm?? l'europium.
Lorsque la dop?? ?? l'europium yttrium orthovanadate phosphore rouge a ??t?? d??couvert au d??but des ann??es 1960, et entend sur le point de provoquer une r??volution dans l'industrie de la t??l??vision couleur, il y avait une lutte pour l'offre limit??e de l'europium en main parmi les processeurs de monazite, que le contenu typique d'europium dans monazite est d'environ 0,05%. Cependant, le Molycorp d??p??t bastn??site au Mine de Mountain Pass, en Californie , dont les lanthanides avait une teneur anormalement ??lev??e d'europium de 0,1%, ??tait sur le point de venir en ligne et de fournir l'europium suffisante pour soutenir l'industrie. Avant l'europium, la couleur TV phosphore rouge ??tait tr??s faible, et les autres couleurs de phosphore a d?? ??tre coup??, pour maintenir l'??quilibre des couleurs. Avec le rouge brillant europium phosphore, il ne ??tait plus n??cessaire de couper les autres couleurs, et une image beaucoup plus lumineux TV couleur ??tait le r??sultat. Europium a continu?? en usage dans l'industrie de la t??l??vision depuis, et, bien s??r, aussi dans les ??crans d'ordinateur. Bastn??site californienne fait maintenant face ?? la rude concurrence des Bayan Obo, en Chine, avec un m??me plus ??riche?? teneur en europium de 0,2%.
Frank Spedding, c??l??br?? pour son d??veloppement de la technologie d'??change d'ions qui a r??volutionn?? l'industrie de terre rare dans le milieu des ann??es 1950 une fois racont?? l'histoire de comment il enseignait sur les terres rares dans les ann??es 1930 quand un vieux monsieur se approcha de lui avec une offre de un don de plusieurs livres d'oxyde d'europium. Ce ??tait une quantit?? inou??e ?? l'??poque, et Spedding n'a pas pris au s??rieux l'homme. Cependant, un paquet d??ment arriv?? par la poste, contenant plusieurs kilos de v??ritable oxyde d'europium. Le vieux monsieur avait av??r?? ??tre Herbert Newby McCoy qui avait d??velopp?? une m??thode c??l??bre de la purification de l'europium impliquant la chimie redox.
Applications

Par rapport ?? la plupart des autres ??l??ments, des applications commerciales pour l'europium sont peu nombreux et assez sp??cialis??. Presque invariablement, ils exploitent la phosphorescence, soit ?? l'??tat oxydation +2 ou +3.
C'est un dopant dans certains types de verre dans les lasers et autres dispositifs opto??lectroniques. l'oxyde d'europium (Eu 2 O 3) est largement utilis?? comme un rouge phosphore dans t??l??viseurs et les lampes fluorescentes, et en tant qu'activateur pour yttrium -based luminophores. Couleur ??crans de t??l??vision contiennent entre 0,5 et 1 g d'europium. Consid??rant que l'europium trivalent donne luminophores rouges, la luminescence de l'europium divalent d??pend du r??seau h??te, mais a tendance ?? ??tre sur le c??t?? bleu. Les deux classes de phosphore ?? base de l'europium (rouge et bleu), combin??es avec les jaune / vert terbium luminophores donnent lumi??re ??blanche??, la temp??rature de couleur qui peut ??tre modifi??e en modifiant la proportion ou la composition sp??cifique des luminophores individuels. Ce syst??me de phosphore est g??n??ralement rencontr?? dans les ampoules h??lico??daux fluorescents. En combinant les trois m??mes classes est une fa??on de rendre les syst??mes trichromatiques dans les ??crans de t??l??vision et d'ordinateur. L'europium est ??galement utilis?? dans la fabrication du verre fluorescent. Un des luminophores persistants apr??s-??clat plus connus en plus de cuivre dop?? sulfure de zinc est dop?? europium aluminate de strontium. fluorescence europium est utilis?? pour interroger interactions biomol??culaires dans les ??crans de d??couverte de m??dicaments. Il est ??galement utilis?? dans les luminophores anti-contrefa??on ?? Euro billets de banque.
Une demande qui a presque tomb?? en d??su??tude avec l'introduction de supraconducteurs abordables aimants est l'utilisation de complexes d'europium, comme Eu (fod) 3, comme r??actifs de d??placement dans Spectroscopie RMN. R??actifs de d??placement chiraux, tels que Eu (hfc) 3 sont encore utilis??s pour d??terminer puret?? ??nantiom??rique.
Pr??cautions
Il n'y a pas d'indications claires que l'europium est particuli??rement toxique par rapport ?? d'autres m??taux lourds. Europium nitrate de chlorure et d'oxyde ont ??t?? test??s pour la toxicit??: chlorure d'europium montre un intrap??riton??ale DL 50 aigu?? de toxicit?? de 550 mg / kg et la DL 50 orale toxicit?? aigu?? est 5000 mg / kg. nitrate d'europium montre un peu plus ??lev?? intraperitoneale toxicit?? DL 50 de 320 mg / kg, tandis que la toxicit?? orale est sup??rieure ?? 5000 mg / kg. La poussi??re de m??tal pr??sente un risque d'incendie et d'explosion.
