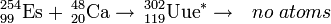Einsteinium
Saviez-vous ...
SOS Enfants, qui se d??roule pr??s de 200 sos ??coles dans le monde en d??veloppement, a organis?? cette s??lection. Cliquez ici pour en savoir plus sur le parrainage d'enfants.
| Einsteinium | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
99 Es | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||
argent??  | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | einsteinium, Es, 99 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / aɪ n s t aɪ n Je ə m / STY eyen- -neE-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Cat??gorie Metallic | actinides | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | n / a, 7, fa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | (252) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Rn ] 5f 11 7s 2 2, 8, 18, 32, 29, 8, 2 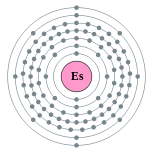 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Lawrence Berkeley National Laboratory (1952) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 8,84 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1133 K , 860 ?? C, 1580 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 2, 3, 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 1,3 (??chelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1e: 619 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique ?? faces centr??es  | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7429-92-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Les isotopes d'einsteinium | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Einsteinium est un ??l??ment synth??tique avec le symbole Es et de num??ro atomique 99. Ce est la septi??me ??l??ment transuranien et un actinides .
Einsteinium a ??t?? d??couvert en tant que composante des d??bris de la premi??re bombe hydrog??ne explosion en 1952, et nomm?? d'apr??s Albert Einstein . Son plus courante isotopes einsteinium-253 (demi-vie 20,47 jours) est produit artificiellement ?? partir de la d??composition de californium-253 dans quelques haute puissance d??di?? r??acteurs nucl??aires avec un rendement total de l'ordre de un milligramme par ann??e. La synth??se du r??acteur est suivie d'une proc??dure complexe de s??paration einsteinium-253 des autres actinides et les produits de leur d??composition. D'autres isotopes sont synth??tis??es dans diff??rents laboratoires, mais en quantit??s beaucoup plus faibles, en bombardant des actinides lourds avec des ions l??gers. En raison des petites quantit??s de produit einsteinium et la demi-vie courte de son isotope le plus facile ?? produire, il ya actuellement presque aucune des applications pratiques pour l'ext??rieur de la recherche scientifique de base. En particulier, einsteinium a ??t?? utilis?? pour synth??tiser, pour la premi??re fois, 17 atomes de l'??l??ment nouveau mendelevium en 1955.
Einsteinium est un doux, argent??, paramagn??tique m??tallique . Sa composition chimique est typique de la fin des actinides, avec une pr??pond??rance de la 3 ??tat d'oxydation ; l'??tat d'oxydation +2 est ??galement accessible, notamment dans les solides. La radioactivit?? ??lev?? de einsteinium-253 produit une lueur visible et rapide dommages son r??seau de m??tal cristallin, avec chaleur d??gag??e d'environ 1000 watts par gramme. Difficult?? dans l'??tude de ses propri??t??s est due ?? Einsteinium-253 ?? la conversion de Berkelium puis californium ?? un taux d'environ 3% par jour. L'isotope de einsteinium avec la plus longue demi-vie, einsteinium-252 (demi-vie 471,7 jours) serait plus appropri?? pour l'??tude des propri??t??s physiques, mais il se est av??r?? beaucoup plus difficile ?? produire et est disponible uniquement en quantit??s infimes, et non en vrac . Einsteinium est l'??l??ment avec le num??ro atomique plus ??lev?? qui a ??t?? observ?? dans des quantit??s macroscopiques dans sa forme pure, et ce est l'isotope de courte dur??e commune einsteinium-253.
Comme tous synth??tique transuraniens, isotopes de einsteinium sont extr??mement radioactifs et sont consid??r??s comme tr??s dangereux pour la sant?? en cas d'ingestion.
Histoire


Einsteinium ??tait d'abord identifi?? en D??cembre 1952 par Albert Ghiorso et co-travailleurs de la Universit?? de Californie, Berkeley en collaboration avec le Argonne et Los Alamos National Laboratories, dans les retomb??es de la Ivy Mike test nucl??aire. Le test a ??t?? effectu?? le 1er Novembre 1952, ?? Enewetak Atoll dans le Oc??an Pacifique et ??tait le premier essai r??ussi d'un bombe ?? hydrog??ne. L'examen initial des d??bris de l'explosion a montr?? la production d'une nouvelle isotope de plutonium , 244
94 Pu, qui ne pouvait ??tre form?? par l'absorption des six neutrons par un l'uranium-238 noyau suivie de deux d??sint??grations b??ta.
?? l'??poque, l'absorption de neutrons multiple a ??t?? pens?? pour ??tre un processus extr??mement rare, mais l'identification des 244
94 Pu a indiqu?? que toujours plus de neutrons auraient ??t?? captur??s par les noyaux d'uranium, produisant ainsi de nouveaux ??l??ments plus lourds que californium .
Ghiorso et ses coll??gues ont analys?? des papiers-filtres qui avait ??t?? vol?? ?? travers le nuage de l'explosion ?? bord des avions (la m??me technique d'??chantillonnage qui avait ??t?? utilis?? pour d??couvrir 244
94 Pu). De plus grandes quantit??s de mati??res radioactives ont ensuite ??t?? isol??s ?? partir de d??bris de coraux de l'atoll, qui ont ??t?? livr??s aux ??tats-Unis La s??paration de nouveaux ??l??ments suspects a ??t?? r??alis??e en pr??sence d'un acide citrique / ammonium solution tampon dans un milieu faiblement acide ( pH ≈ 3,5), en utilisant ??change d'ions ?? des temp??ratures ??lev??es; moins de 200 atomes de einsteinium ont ??t?? r??cup??r??s ?? la fin. N??anmoins, l'??l??ment 99 (einsteinium), ?? savoir sa 253 Es isotopes, a pu ??tre d??tect??e via sa haute ??nergie caract??ristique d??sint??gration alpha ?? 6,6 MeV. Il a ??t?? produit par la 15 capture de neutrons par uranium-238 suivi de sept noyaux b??ta-d??sint??grations, et avait une demi-vie de 20,5 jours. Cette absorption de neutrons multiple a ??t?? rendue possible par la densit?? de flux de neutrons au cours de la d??tonation, de sorte que les isotopes lourds nouvellement g??n??r??es avaient beaucoup de neutrons disponibles pour absorber avant qu'ils ne puissent se d??sint??grer en ??l??ments plus l??gers. Capture de neutrons d'abord soulev?? la nombre de masse sans changer le num??ro atomique du nucl??ide et les d??sint??grations b??ta-concomitants ont entra??n?? une augmentation progressive du nombre atomique:
Quelques 238 atomes U, cependant, pourraient absorber deux autres neutrons (pour un total de 17), r??sultant en 255 Es, ainsi que dans le 255 Fm isotope d'un autre ??l??ment nouveau, fermium . La d??couverte de nouveaux ??l??ments et les nouvelles donn??es associ??es sur la capture de neutrons multiples ont d'abord ??t?? gard?? secret sur les ordres de l'arm??e am??ricaine jusqu'en 1955 en raison de la guerre froide tensions et de la concurrence avec l'Union sovi??tique dans les technologies nucl??aires. Cependant, la prise rapide de tant de neutrons fournirait n??cessaires confirmation exp??rimentale directe de la dite r-processus neutrons multiples absorption n??cessaire pour expliquer le cosmique nucl??osynth??se (production) de certains ??l??ments chimiques lourds (plus lourds que le nickel) en supernova explosions, avant d??sint??gration b??ta. Un tel processus est n??cessaire pour expliquer l'existence de nombreux ??l??ments stables dans l'univers.
Pendant ce temps, les isotopes de l'??l??ment 99 (ainsi que du nouvel ??l??ment 100, fermium ) ont ??t?? produites dans les laboratoires Berkeley et Argonne, dans un r??action nucl??aire entre l'azote et -14 uranium 238, et plus tard par irradiation intense de neutron du plutonium ou de californium :
Ces r??sultats ont ??t?? publi??s dans plusieurs articles en 1954 avec l'avertissement que ce ne ??taient pas les premi??res ??tudes qui ont ??t?? men??es sur les ??l??ments. L'??quipe de Berkeley a ??galement signal?? quelques r??sultats sur les propri??t??s chimiques de einsteinium et fermium. Les r??sultats Ivy Mike ont ??t?? d??classifi??s et publi??s en 1955.
Dans leur d??couverte des ??l??ments 99 et 100, les ??quipes am??ricaines avaient particip?? avec un groupe au Institut Nobel de physique, Stockholm , Su??de . ?? la fin de 1953 - d??but 1954, le groupe su??dois a r??ussi ?? la synth??se des isotopes l??gers de l'??l??ment 100, en particulier 250 Fm, en bombardant l'uranium avec des noyaux d'oxyg??ne. Ces r??sultats ont ??galement ??t?? publi??s en 1954. N??anmoins, la priorit?? de l'??quipe de Berkeley a ??t?? g??n??ralement reconnu, que ses publications pr??c??d?? l'article su??dois, et ils ont ??t?? bas??es sur les r??sultats pr??c??demment non divulgu??s de l'explosion thermonucl??aire 1952; donc l'??quipe de Berkeley a eu le privil??ge de nommer les nouveaux ??l??ments. Comme l'effort qui avait conduit ?? la conception de Ivy Mike ??tait le nom de code du projet PANDA, ??l??ment 99 avait ??t?? en plaisantant surnomm?? "Pandamonium", mais les noms officiels sugg??r?? par le groupe de Berkeley d??riv?? de deux ??minents scientifiques et r??cemment d??c??d??s, Albert Einstein (d??c??d?? le 18 Avril 1955) et Enrico Fermi (d??c??d?? le 28 Novembre 1954): ??Nous sugg??rons le nom de l'??l??ment de num??ro atomique 99, einsteinium (symbole E) apr??s Albert Einstein et le nom de l'??l??ment de num??ro atomique 100, fermium (symbole Fm), apr??s Enrico Fermi. " La d??couverte de ces nouveaux ??l??ments a ??t?? annonc?? par Albert Ghiorso ?? la premi??re Conf??rence de Gen??ve atomique tenue le 8-20 Ao??t 1955. Le symbole pour einsteinium a ??t?? donn?? comme E et plus tard r??affect?? ?? Es.
Caract??ristiques
Physique

Einsteinium est un synth??tique, blanc argent??, m??tal radioactif. Dans le tableau p??riodique , il est situ?? ?? droite de l'actinide californium , ?? la gauche de l'actinide fermium et en dessous du lanthanide holmium avec lequel il partage de nombreuses similitudes dans les propri??t??s physiques et chimiques. Sa densit?? de 8,84 g / cm 3 est inf??rieur ?? celui de californium (15,1 g / cm 3) et est ?? peu pr??s la m??me que celle de l'holmium (8,79 g / cm 3), en d??pit einsteinium atomique ??tant beaucoup plus lourd que l'holmium. Le point de einsteinium (860 ?? C) de fusion est ??galement relativement faible - ci-dessous californium (900 ?? C), fermium (1527 ?? C) et holmium (1461 ?? C). Einsteinium est un m??tal mou, avec le module de masse de seulement 15 GPa, dont la valeur est l'un des plus bas parmi les non m??taux alcalins .
Contrairement aux actinides l??gers californium, Berkelium, curium et am??ricium qui cristallisent dans un double structure hexagonale dans les conditions ambiantes, einsteinium est cens?? avoir un cube (fcc) sym??trie ?? faces centr??es avec le groupe d'espace Fm 3 m et la constante de r??seau a = 575 h. Cependant, il existe un rapport de la temp??rature ambiante einsteinium m??tal hexagonal avec a = 398 pm et 650 pm = c, qui converti ?? la phase fcc lors d'un chauffage ?? 300 ?? C.
L'auto-dommages induits par la radioactivit?? de einsteinium est si forte qu'elle d??truit rapidement le r??seau cristallin, et la lib??ration d'??nergie lors de ce processus, 1000 watts par gramme de 253 Es, induit une lueur visible. Ces processus peuvent contribuer ?? la relativement faible point de fusion densit?? et einsteinium. En outre, en raison de la petite taille des ??chantillons disponibles, le point de fusion de einsteinium a souvent ??t?? d??duite en observant l'??chantillon est chauff?? ?? l'int??rieur d'un microscope ??lectronique. Ainsi, les effets de surface dans de petits ??chantillons pourraient r??duire la valeur point de fusion.
Le m??tal est divalent et a une forte volatilit?? nettement. Afin de r??duire les dommages auto-rayonnement, la plupart des mesures de einsteinium solide et ses compos??s sont effectu??es juste apr??s recuit thermique. En outre, certains des compos??s sont ??tudi??s sous l'atmosph??re du gaz r??ducteur, par exemple H 2 O + HCl pour EsOCl sorte que l'??chantillon est partiellement reconstruite ?? pendant sa d??composition.
En dehors de l'auto-destruction de einsteinium solide et ses compos??s, d'autres difficult??s intrins??ques ?? ??tudier cet ??l??ment inclure la raret?? - la 253 Es isotope le plus commun est disponible seulement une fois ou deux fois par an dans des quantit??s inf??rieures au milligramme - et l'auto-contamination due ?? la rapide conversion de einsteinium ?? Berkelium puis de californium ?? un taux d'environ 3,3% par jour:
Ainsi, la plupart des ??chantillons de einsteinium sont contamin??s, et de leurs propri??t??s intrins??ques sont souvent d??duites par extrapolation des donn??es exp??rimentales accumul??es retour dans le temps. D'autres techniques exp??rimentales pour contourner le probl??me de la contamination comprennent une excitation optique s??lective d'ions einsteinium par un laser accordable, comme dans l'??tude de ses propri??t??s de luminescence.
Propri??t??s magn??tiques ont ??t?? ??tudi??s pour einsteinium m??tal, son oxyde et de fluorure. Les trois mat??riaux ont montr?? Curie-Weiss comportement paramagn??tique de l'h??lium liquide jusqu'?? la temp??rature ambiante. Les moments magn??tiques effectifs ont ??t?? d??duites de 10,4 ?? 0,3 μ B pour Es 2 O 3 et de 11,4 ?? 0,3 μ B pour le FSE 3, qui sont les valeurs les plus ??lev??es parmi les actinides, et le correspondant Temp??ratures de Curie sont 53 et 37 K.
Chimique
Comme tous les actinides, einsteinium est plut??t r??active. Son trivalent ??tat d'oxydation est plus stable dans les solides et une solution aqueuse o?? elle induit couleur rose p??le. L'existence d'divalent einsteinium est fermement ??tablie, en particulier en phase solide; tels deux Etat ne est pas observ??e dans de nombreux autres actinides, dont le protactinium , l'uranium , le neptunium , le plutonium, le curium et berkelium. Einsteinium (II) compos??s peuvent ??tre obtenus, par exemple, en r??duisant einsteinium (III) avec samarium (II). L'??tat d'oxydation +4 a ??t?? postul?? ?? partir d'??tudes de vapeur et est encore incertain.
Isotopes
Dix-neuf et trois nucl??ides isom??res nucl??aires sont connus pour einsteinium avec des poids atomiques allant de 240 ?? 258. Tous sont radioactifs et le nucl??ide plus stable, Es 252, a une demi-vie de 471,7 jours. Suivant isotopes les plus stables sont 254 Es (demi-vie 275,7 jours), 255 Es (39,8 jours) et 253 (Es 20,47 jours). Tous les isotopes restants ont des demi-vies plus courtes que 40 heures, et la plupart d'entre eux d??croissance en moins de 30 minutes. Parmi les trois isom??res nucl??aires, le plus stable est 254 m es avec une demi-vie de 39,3 heures.
Fission nucl??aire
Einsteinium a un taux ??lev?? de fission nucl??aire qui r??sulte en une faible masse critique pour un soutenue r??action nucl??aire en cha??ne. Cette masse est de 9,89 kg ?? nu une sph??re de 254 Es isotope, et peut ??tre abaiss?? ?? 2,9 ou m??me 2,26 kg, respectivement, par addition d'un acier d'une ??paisseur de 30 cm d'eau ou d'un r??flecteur. Cependant, m??me cette petite masse critique d??passe largement le montant total de einsteinium isol?? jusqu'?? pr??sent, en particulier des rares 254 Es isotopes.
Occurrence naturelle
En raison de la courte demi-vie de tous les isotopes d'einsteinium, toutes einsteinium primordial, ce est-einsteinium qui pourraient ??tre pr??sents sur la Terre lors de sa formation, est d??sint??gr??e par l'entreprise. Synth??se des actinides einsteinium de l'uranium et du thorium naturel dans la cro??te terrestre n??cessite multiple capture de neutrons, ce qui est un cas extr??mement improbable. Par cons??quent, la plupart einsteinium est produite sur Terre dans les laboratoires scientifiques, les r??acteurs nucl??aires de forte puissance, ou dans essais d'armes nucl??aires, et ne est pr??sent que dans quelques ann??es, ?? partir du moment de la synth??se. Einsteinium et fermium fait se produire naturellement dans le naturelle r??acteur de fission nucl??aire ?? Oklo, mais ne est plus le faire.
Synth??se et extraction

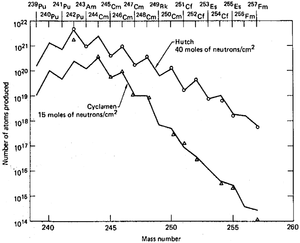
Einsteinium est produite en quantit??s infimes en bombardant actinides l??gers avec des neutrons en haute flux d??di?? les r??acteurs nucl??aires. Sources d'irradiation grands du monde sont de 85 m??gawatts ?? haut flux Isotope Reactor (HFIR) au Oak Ridge National Laboratory, dans le Tennessee, ??tats-Unis, et le r??acteur SM-2 ?? la boucle Institut de recherche des r??acteurs atomiques (NIIAR) dans Dimitrovgrad, la Russie, qui sont ?? la fois d??di??e ?? la production de transcurium (Z> 96) ??l??ments. Ces installations ont des niveaux de puissance et de flux similaires, et on se attend ?? avoir des capacit??s de production comparables pour les ??l??ments de transcurium, bien que les quantit??s produites au NIIAR ne sont pas largement rapport??. Dans une "campagne de traitement typique?? ?? Oak Ridge, des dizaines de grammes de curium sont irradi??s pour produire des quantit??s de decigramme de californium , les quantit??s de milligrammes de berkelium (249 Bk) et les quantit??s de einsteinium et picogrammes fermium .
Le premier ??chantillon microscopique de 253 Es ??chantillon pesant environ 10 nanogrammes a ??t?? pr??par?? en 1961 au HFIR. Un ??quilibre magn??tique sp??cial a ??t?? con??u pour estimer son poids. Des lots plus importants ont ??t?? produites plus tard ?? partir de plusieurs kilogrammes de plutonium avec les rendements de la plupart (253 einsteinium Es) de 0,48 milligrammes 1967-1970, 3,2 milligrammes en 1971-1973, suivie par la production r??guli??re d'environ 3 milligrammes par ann??e entre 1974 et 1978. Ces quantit??s toutefois se r??f??rent au montant int??gral dans la cible juste apr??s l'irradiation. Proc??dures de s??paration ult??rieure r??duit la quantit?? de einsteinium isotope pur ?? peu pr??s dix fois.
synth??se de laboratoire
Lourd irradiation neutronique des r??sultats de plutonium dans les quatre principaux isotopes de einsteinium: 253 Es (α-??metteur avec une demi-vie de 20,03 jours et avec une demi-vie de fission spontan??e de 7 ?? 10 5 ann??es); 254 m Es (β-??metteur avec demi-vie de 38,5 heures), 254 Es (α-??metteur avec une demi-vie d'environ 276 jours) et 255 (Es β-??metteur avec une demi-vie de 24 jours). Une autre voie consiste ?? bombardement de l'uranium-238 ?? haute intensit?? d'azote ou ions d'oxyg??ne poutres.
Einsteinium-247 (demi-vie 4,55 minutes) a ??t?? produit par irradiation de l'am??ricium-241 avec du carbone ou de l'uranium 238 avec des ions d'azote. La derni??re r??action a ??t?? r??alis??e en 1967 ?? Dubna, en Russie, et les scientifiques impliqu??s ont re??u le Prix Komsomol.
L'isotope 248 Es a ??t?? produit par irradiation avec 249 Cf ions deut??rium. Il se d??sint??gre principalement par ??mission d'??lectrons ?? 248 Cf avec une demi-vie de 25 (?? 5) minutes, mais lib??re ??galement des particules d'α-6,87 MeV d'??nergie, le rapport des ??lectrons de α-particules d'environ 400.
Les isotopes plus lourds, 250 249 Es Es, Es 251 et 252 Es ont ??t?? obtenus en bombardant 249 Bk avec α-particules. Un ?? quatre neutrons sont lib??r??s dans ce proc??d?? permettant la formation de quatre isotopes diff??rents dans une r??action.
Einsteinium-253 a ??t?? produite par l'irradiation d'un milligramme 0,1-0,2 252 Cf cible avec une flux de neutrons thermiques de (2-5) ?? 10 14 neutrons ?? cm -2 s -1 ?? pour 500-900 heures:
Synth??se des explosions nucl??aires
L'analyse des d??bris ?? la 10- m??gatonnes Ivy Mike essai nucl??aire ??tait une partie de projet ?? long terme. L'un des objectifs qui a ??t?? ??tudient l'efficacit?? de la production d'??l??ments transuraniens dans les explosions nucl??aires ?? haute puissance. La motivation pour ces exp??riences est que la synth??se de ces ??l??ments de l'uranium n??cessite capture de neutrons multiple. La probabilit?? de tels ??v??nements augmente avec la flux de neutrons, et les explosions nucl??aires sont des sources de neutrons les synth??tiques plus puissantes, fournissant des densit??s de l'ordre de 10 23 neutrons / cm?? dans une microseconde, soit environ 10 29 neutrons / (cm?? ?? s). En comparaison, le flux du r??acteur est HFIR 5 x 10 15 neutrons / (cm?? ?? s). Un laboratoire sp??cialis?? a ??t?? mis en place ?? droite au Enewetak Atoll pour l'analyse pr??liminaire des d??bris, comme certains isotopes auraient pourri au moment o?? les ??chantillons de d??bris a atteint le continent am??ricain Le laboratoire recevait ??chantillons pour analyse d??s que possible, ?? partir d'avions ??quip??s de filtres en papier qui ont survol?? l'atoll apr??s les essais . Consid??rant qu'il esp??rait d??couvrir de nouveaux ??l??ments chimiques plus lourds que fermium, aucune de ces n'a ??t?? trouv??e, m??me apr??s une s??rie d'explosions de m??gatonnes men??e entre 1954 et 1956 sur l'atoll.
Les r??sultats atmosph??riques ont ??t?? compl??t??es par les donn??es de test souterraines accumul??es dans les ann??es 1960 ?? la Nevada Test Site, car il est ?? esp??rer que de puissantes explosions men??es dans un espace confin?? peut aboutir ?? des rendements am??lior??s et des isotopes plus lourds. Outre les accusations traditionnelles d'uranium, combinaisons d'uranium avec l'am??ricium et le thorium ont ??t?? ??prouv??es, ainsi que des frais de plutonium neptunium mixte, mais ils ??taient moins de succ??s en termes de rendement et a ??t?? attribu?? ?? des pertes plus fortes d'isotopes lourds en raison de l'am??lioration des taux de fission des charges ??l??ments lourds. l'isolement de produit ??tait probl??matique, car les explosions se r??pandaient d??bris ?? travers la fusion et vaporisation des roches environnantes ?? des profondeurs de 300 ?? 600 m??tres. Les forages ?? ces profondeurs pour extraire les produits ??tait ?? la fois lent et inefficace en termes de volumes collect??s.
Parmi les neuf essais souterrains qui ont ??t?? r??alis??es entre 1962 et 1969, la derni??re ??tait la plus puissante et avait le meilleur rendement des ??l??ments transuraniens. Milligrammes de einsteinium qui seraient normalement prendre un an de l'irradiation dans un r??acteur de grande puissance, ont ??t?? produites dans une microseconde. Toutefois, le principal probl??me pratique de la totalit?? de la proposition a ??t?? recueille les d??bris radioactifs dispers??s par le souffle puissant. filtres d'a??ronefs adsorb??es seulement environ 4 ?? 10 -14 du montant total, et la collecte de tonnes de coraux ?? Enewetak Atoll augment?? cette fraction par seulement deux ordres de grandeur. Extraction d'environ 500 kg de roches souterraines 60 jours apr??s l'explosion Hutch r??cup??r?? seulement environ 1 ?? 10 -7 de la charge totale. La quantit?? d'??l??ments transuraniens de ce lot de 500 kg ne ??tait que de 30 fois plus ??lev?? que dans un 0,4 kg de roche ramass?? sept jours apr??s le test qui a d??montr?? la d??pendance fortement non-lin??aire de la transuraniens donnent sur le montant de la roche radioactive r??cup??r??e. Arbres ont ??t?? for??s sur le site avant le test afin d'acc??l??rer la collecte de l'??chantillon apr??s l'explosion, de sorte que l'explosion serait expulser mati??res radioactives de l'??picentre ?? travers les arbres et ?? la collecte de volumes pr??s de la surface. Cette m??thode a ??t?? jug?? dans deux essais et instantan??ment fourni des centaines de kilogrammes de mat??riel, mais avec une concentration des actinides trois fois plus faible que dans les ??chantillons obtenus apr??s le forage. Consid??rant que cette m??thode aurait pu ??tre efficace dans des ??tudes scientifiques d'isotopes de courte dur??e, il ne pouvait pas am??liorer l'efficacit?? globale de la collecte des actinides produits.
Bien qu'aucune de nouveaux ??l??ments (?? l'exception de einsteinium et fermium) pourraient ??tre d??tect??s dans les d??bris des essais nucl??aires, et les rendements totaux des transuraniens ??taient d??cevants, ces tests ne fournissent des quantit??s significativement plus ??lev??es d'isotopes lourds rares qu'auparavant disponibles dans les laboratoires.
S??paration
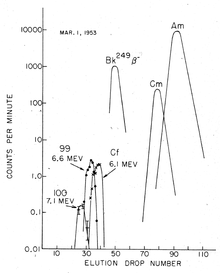
proc??dure de s??paration de einsteinium d??pend de la m??thode de synth??se. Dans le cas d'un bombardement ionique ?? l'int??rieur de la lumi??re d'un cyclotron, la cible des ions lourds est fix??e ?? une feuille mince, et le einsteinium g??n??r??e est simplement lav?? la feuille apr??s l'irradiation. Toutefois, les quantit??s produites dans ces exp??riences sont relativement faibles. Les rendements sont nettement plus ??lev??s pour l'irradiation du r??acteur, mais il n'y a, le produit est un m??lange de divers isotopes d'actinides, de lanthanides ainsi que de produits dans la fission nucl??aire se d??sint??gre. Dans ce cas, l'isolement de einsteinium est une proc??dure fastidieuse qui implique plusieurs ??tapes r??p??titives d'??change de cations, ?? temp??rature et pression ??lev??es, et la Chromatographie. La s??paration d'avec berkelium est important, parce que l'isotope le plus commun de einsteinium produite dans les r??acteurs nucl??aires, 253 Es, se d??sint??gre avec une demi-vie de seulement 20 jours ?? 249 Bk, qui est rapide sur le calendrier de la plupart des exp??riences. Cette s??paration se appuie sur le fait que berkelium oxyde facilement ?? l'??tat solide et 4 pr??cipite, tandis que d'autres actinides, y compris einsteinium, restent dans leur ??tat 3 dans les solutions.
La s??paration des actinides trivalents provenant des produits de fission lanthanide peut se faire par une colonne de r??sine ??changeuse de cations en utilisant une solution d'??thanol ?? l'eau / 10% ?? 90%, satur?? avec de l'acide chlorhydrique (HCl) en tant que ??luant. Elle est g??n??ralement suivie d'une Chromatographie d'??change d'anions en utilisant 6 HCl molaire comme ??luant. Une colonne de r??sine ??changeuse de cations (colonne Dowex-50 ??change) trait?? avec des sels d'ammonium est ensuite utilis?? pour des fractions s??par??es contenant des ??l??ments 99, 100 et 101. Ces ??l??ments peuvent ??tre ensuite identifi??s simplement en fonction de leur position d'??lution / heure, en utilisant α-hydroxyisobutyrate solution (α-HIB), par exemple, comme ??luant.
La s??paration des actinides 3+ peut ??galement ??tre r??alis??e par Chromatographie d'extraction par solvant, en utilisant du bis- (2-??thylhexyl) phosphorique (HDEHP en abr??g??) comme phase stationnaire organique, et de l'acide nitrique en tant que phase aqueuse mobile. La s??quence actinide d'??lution est invers?? ?? partir de celle de la colonne de r??sine ??changeuse de cations. L'einsteinium s??par??s par cette m??thode a l'avantage d'??tre exempt d'agent complexant organique, par rapport ?? la s??paration en utilisant une colonne de r??sine.
Pr??paration du m??tal
Einsteinium est tr??s r??actif et donc les agents r??ducteurs forts sont n??cessaires pour obtenir le m??tal pur de ses compos??s. Ceci peut ??tre obtenu par r??duction d'einsteinium (III) avec du fluorure m??tallique de lithium :
- EsF 3 + 3 Li → Es + 3 LiF
Toutefois, en raison de son faible point de fusion et le taux ??lev?? de dommage auto-rayonnement, einsteinium a une pression de vapeur ??lev??e, qui est sup??rieure ?? celle du fluorure de lithium. Cela rend cette r??action de r??duction plut??t inefficace. Il a ??t?? jug?? dans les tentatives de pr??paration d??but et rapidement abandonn??e au profit de la r??duction des einsteinium (III) oxyde avec le lanthane m??tal:
- Es 2 O 3 + La 2 → ES + La 2 O 3
Les compos??s chimiques
| Compos?? | Couleur | Sym??trie | Groupe d'espace | Aucun | Symbole de Pearson | un ( h) | b (h) | c (h) |
|---|---|---|---|---|---|---|---|---|
| Es 2 O 3 | Incolore | Cubique | Ia 3 | 206 | cI80 | 1076,6 | ||
| Es 2 O 3 | Incolore | Monoclinique | C2 / m | 12 | MS30 | 1411 | 359 | 880 |
| Es 2 O 3 | Incolore | Hexagonal | P 3 m1 | 164 | HP5 | 370 | 600 | |
| EsF 3 | Hexagonal | |||||||
| EsF 4 | Monoclinique | C2 / c | 15 | MS60 | ||||
| ESCL 3 | Orange | Hexagonal | C6 3 / m | HP8 | 727 | 410 | ||
| ESBR 3 | Jaune | Monoclinique | C2 / m | 12 | MS16 | 727 | 1259 | 681 |
| ESI 3 | Ambre | Hexagonal | R 3 | 148 | HR24 | 753 | 2084 | |
| EsOCl | Quadrilat??re | P4 / nmm | 394,8 | 670,2 |
Oxydes
Einsteinium (III) oxyde (Es 2 O 3) a ??t?? obtenue par la combustion einsteinium (III) nitrate. Il forme des cristaux incolores cubes, qui ont d'abord ??t?? caract??ris??es ?? partir d'??chantillons de microgramme dimensionn??s environ 30 nanom??tres. Deux autres phases, monoclinique et hexagonale, sont connus pour cet oxyde. La formation d'une certaine phase Es 2 O 3 d??pend de l'histoire de la technique de pr??paration et de l'??chantillon, et il n'y a pas de diagramme de phase claire. Les interconversions entre les trois phases peuvent se produire spontan??ment, ?? la suite de l'auto-irradiation ou auto-??chauffement. La phase hexagonale est isotypique avec lanthane (III) oxyde o?? l'ion Es est entour?? par un groupe 6-coordonn??e des ions O 2.
Halog??nures

Einsteinium halog??nures sont connus pour les ??tats d'oxydation 2 et 3. L'??tat le plus stable est 3 pour tous les halog??nures de fluorure ?? l'iodure.
Einsteinium (III) fluorure (FSE 3) peut ??tre pr??cipit?? ?? partir d'einsteinium (iii) des solutions de chlorure par r??action avec ions fluorure. Une proc??dure de pr??paration alternative est ?? l'exposition einsteinium (III) oxyde pour le trifluorure de chlore (ClF 3) ou F 2 gazeux ?? une pression de 1-2 atmosph??res et une temp??rature comprise entre 300 et 400 ?? C. La structure EsF 3 de cristal est hexagonale, comme dans californium (III) fluorure (CFF 3) o?? les ions Es 3+ sont 8 fois coordonn??s par des ions de fluor dans un bicouronn?? Agencement de prisme trigone.
Einsteinium (III) chlorure (ESCL 3) peut ??tre pr??par?? par einsteinium (III) de l'oxyde recuit dans l'atmosph??re de vapeurs s??ches de chlorure d'hydrog??ne ?? environ 500 ?? C pendant environ 20 minutes. Il cristallise lors du refroidissement ?? environ 425 ?? C en un solide orange avec un structure hexagonale de Type UCl3, o?? les atomes de einsteinium sont neuf fois coordonn??s par des atomes de chlore dans une g??om??trie du prisme trigonal tricapped. Einsteinium (III) du bromure (ESBR 3) est un solide jaune p??le avec un de structure monoclinique de type AlCl 3 , o?? les atomes de einsteinium sont octa??driquement coordonn?? par le brome (nombre de coordination 6).
Les compos??s divalents de einsteinium sont obtenus par r??duction des halog??nures trivalents avec de l'hydrog??ne :
- 2 ESX 3 + H 2 → 2 ESX 2 + 2 HX, X = F, Cl, Br, I
Einsteinium (II) chlorure (ESCL 2), einsteinium (II) du bromure (ESBR 2), et einsteinium (II) d'iodure (ESI 2) ont ??t?? produites et caract??ris?? par absorption optique, sans aucune information structurelle encore disponible.
Oxyhalog??nures connus de einsteinium comprennent EsOCl, EsOBr et EsOI. Ils sont synth??tis??s par traitement d'un trihalog??nure d'un m??lange de vapeur d'eau et de l'halog??nure d'hydrog??ne correspondant: par exemple, ESCL 3 + H 2 O / HCl pour obtenir EsOCl.
Compos??s Organoeinsteinium
La radioactivit?? ??lev?? de einsteinium a une utilisation potentielle dans la radioth??rapie, et des complexes organom??talliques ont ??t?? synth??tis??s afin de fournir des atomes de einsteinium ?? un organe appropri?? dans le corps. Des exp??riences ont ??t?? r??alis??es sur l'injection einsteinium citrate (ainsi que les compos??s de fermium) ?? des chiens. Einsteinium (III) a ??galement ??t?? incorpor?? dans b??ta-dic??tone complexes ch??late, depuis complexes analogues avec lanthanides pr??c??demment ont montr?? la plus forte UV excit?? parmi les compos??s organom??talliques luminescence. Lors de la pr??paration einsteinium complexes, les ions Es 3+ ??taient 1000 fois dilu?? avec des ions Gd 3+. Cela a permis ?? la r??duction des dommages de rayonnement de sorte que les compos??s ne se d??sint??grent pas pendant la p??riode de 20 minutes requis pour les mesures. La luminescence r??sultant de Es 3+ est beaucoup trop faible pour ??tre d??tect??e. Cela a ??t?? expliqu?? par les ??nergies relatives d??favorables des constituants individuels du compos?? qui entravaient transfert d'??nergie efficace de la matrice de ch??late aux ions Es 3+. Conclusion similaire a ??t?? ??labor?? pour d'autres actinides am??ricium, berkelium et fermium.
La luminescence des ions 3+ Es a cependant ??t?? observ?? dans les solutions d'acide chlorhydrique inorganiques ainsi que dans la solution organique avec du di (2-??thylhexyle), l'acide orthophosphorique. Il montre un pic large ?? environ 1064 nanom??tres (demi-largeur d'environ 100 nm) qui peuvent ??tre excit??s par r??sonance lumi??re verte (environ 495 nm de longueur d'onde). La luminescence a une dur??e de vie de quelques microsecondes et le rendement quantique inf??rieur ?? 0,1%. La relativement ??lev??, par rapport ?? lanthanides, les taux de d??sint??gration non radiatives ?? Es 3+ ont ??t?? associ??s ?? l'interaction forte du f-??lectrons avec les ??lectrons 3+ Es int??rieures.
Applications
Il est presque inutile pour tout isotope de l'einsteinium dehors de la recherche scientifique de base visant ?? la production de plus transuraniens et transactinides.
En 1955, mendelevium a ??t?? synth??tis?? par irradiation d'une cible constitu??e d'environ 10 atomes de 9 253 Es dans le cyclotron de 60 pouces ?? Berkeley Laboratory. Les 253 Es r??sultant (α, n) 256 Md r??action ont donn?? 17 atomes de l'??l??ment nouveau avec le num??ro atomique 101.
L'isotope rare einsteinium-254 est favoris??e pour la production de ultraheavy ??l??ments en raison de sa grande masse, relativement longue demi-vie de 270 jours, et la disponibilit?? en quantit??s significatives de plusieurs microgrammes. Ainsi einsteinium-254 a ??t?? utilis?? comme cible dans la tentative de synth??se Ununennium (??l??ment 119) en 1985 en le bombardant de calcium-48 ions au superHILAC acc??l??rateur lin??aire ?? Berkeley, en Californie. Aucun atomes ont ??t?? identifi??s, fixation d'une limite sup??rieure pour la section transversale de cette r??action ?? 300 nanobarns.
Einsteinium-254 a ??t?? utilis?? comme marqueur de calibrage dans le spectrom??tre d'analyse chimique (" Analyseur de surface ") de la dispersion alpha- Surveyor 5 sonde lunaire. La grande masse de cet isotope a r??duit le chevauchement spectral entre les signaux de la borne et les ??l??ments plus l??gers ??tudi??s de la surface lunaire.
S??curit??
La plupart des donn??es de toxicit?? de einsteinium disponibles proviennent de recherches sur les animaux. Lors de l'ingestion par des rats, seulement environ 0,01% einsteinium se termine dans le flux sanguin. De l??, environ 65% va ?? l'os, o?? il reste pendant environ 50 ann??es, 25% dans les poumons (demi-vie biologique d'environ 20 ans, bien que cela soit rendue sans objet par les demi-vies courtes d'isotopes d'einsteinium), 0,035 % aux testicules ou 0,01% aux ovaires - o?? einsteinium reste ind??finiment. Environ 10% de la quantit?? ing??r??e est excr??t??e. La r??partition des einsteinium sur les surfaces osseuses est uniforme et est similaire ?? celle du plutonium.

![\ Mathrm {^ {238} _ {\ 92} U \ \ xrightarrow [-2 \ \ beta ^ -] {+ \ 6 \ (n, \ gamma)} \ ^ {244} _ {\ 94}} Pu](../../images/1516/151667.png)
![\ Mathrm {^ {238} _ {\ 92} U \ \ xrightarrow [6 \ beta ^ -] {+ \ 15 n} \ ^ {253} _ {\} 98 Cf \ \ xrightarrow {\ beta ^ -} \ ^ {253} _ {\ 99}} Es](../../images/1516/151668.png)
![\ Mathrm {^ {252} _ {\} 98 Cf \ \ xrightarrow {(n, \ gamma)} \ ^ {253} _ {\} 98 Cf \ \ xrightarrow [17,81 \ d] {\ beta ^ -} \ ^ {253} _ {\ 99} Es \ \ xrightarrow {(n, \ gamma)} \ ^ {254} _ {\ 99} Es \ \ xrightarrow [] {\ beta ^ -} \ ^ {254} {_ 100}} Fm](../../images/1516/151669.png)
![\ Mathrm {^ {253} _ {\ 99} Es \ \ xrightarrow [20 \ d] {\ alpha} \ ^ {249} _ {\ 97} Bk \ \ xrightarrow [314 \ d] {\ beta ^ -} \ ^ {249} _ {\ 98}} Cf](../../images/1516/151674.png)
![\ Mathrm {^ {249} _ {\} 98 Cf \ + \ ^ _ {2} {1} D \ \ longrightarrow \ ^ {248} _ {\ 99} Es \ + \ 3 \ ^ {1} {_ 0} n \ quad (^ {248} _ {\ 99} Es \ \ xrightarrow [27 \ min] {\ epsilon} \ ^ {248} _ {\} 98 Cf)}](../../images/1516/151679.png)

![\ Mathrm {^ {252} _ {\} 98 Cf \ \ xrightarrow {(n, \ gamma)} \ ^ {253} _ {\} 98 Cf \ \ xrightarrow [17,81 \ d] {\ beta ^ -} \ ^ {253} _ {\ 99}} Es](../../images/1516/151681.png)