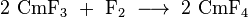Curium
Renseignements g??n??raux
Cette s??lection se fait pour les ??coles par la charit?? pour enfants lire la suite . Avec enfants SOS vous pouvez choisir de parrainer des enfants dans plus de cent pays
| Curium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
96 cm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
argent??  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | curium, cm, 96 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / k jʊər Je ə m / KEWR -ee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | actinides | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | n / a, 7, fa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | (247) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Rn ] 5f 7 6d 1 7s 2 2, 8, 18, 32, 25, 9, 2  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Glenn T. Seaborg, Ralph A. James, Albert Ghiorso (1944) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 13,51 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1613 K , 1340 ?? C, 2444 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 3383 K, 3110 ?? C, 5630 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | ? 15 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 4, 3 ( l'oxyde amphot??re) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 1,3 (??chelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1e: 581 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 174 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 169 ?? 15 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | antiferromagn??tique transition → paramagn??tique ?? 52 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | 1,25 μΩ ?? m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-51-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de curium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Curium est un transuraniens radioactive ??l??ment chimique avec le symbole Cm et de num??ro atomique 96. Cet ??l??ment de la actinides s??rie a ??t?? nomm??e d'apr??s Marie Sklodowska-Curie et son mari Pierre Curie - deux ??taient connus pour leurs recherches sur la radioactivit??. Curium a ??t?? produit intentionnellement et identifi?? en Juillet 1944 par le groupe de Glenn T. Seaborg au Universit?? de Californie, Berkeley. La d??couverte a ??t?? gard?? secret et ne rendu public en Novembre 1945. La plupart curium est obtenu en bombardant de l'uranium ou du plutonium avec des neutrons dans - une r??acteurs nucl??aires tonne de pass?? combustible nucl??aire contient environ 20 grammes de curium.
Curium est un, dense, m??tal argent?? dur avec un point de fusion relativement ??lev?? et le point d'??bullition pour une actinides. Consid??rant qu'il est paramagn??tique les conditions ambiantes, il devient antiferromagn??tiques lors du refroidissement, et d'autres transitions magn??tiques sont ??galement observ??es pour de nombreux compos??s de curium. Dans les compos??s, curium pr??sente habituellement valence trois et parfois quatre, et la valence 3 est pr??dominante dans les solutions. Curium oxyde facilement, et ses oxydes sont une forme dominante de cet ??l??ment. Il forme fortement complexes fluorescents avec divers compos??s organiques, mais il n'y a aucune preuve de son incorporation dans les bact??ries et arch??es. Lorsqu'il est introduit dans le corps humain, le curium se accumule dans les os, les poumons et le foie, o?? il favorise le cancer .
Tous connus isotopes de curium sont radioactifs et ont un petit masse critique pour un soutenue r??action nucl??aire en cha??ne. Ils ??mettent principalement α-particules, et la chaleur d??gag??e dans ce processus peut potentiellement produire de l'??lectricit?? g??n??rateurs thermo??lectriques radio-isotopes. Cette application est entrav??e par la raret??, le co??t ??lev?? et la radioactivit?? des isotopes du curium. Curium est utilis?? dans la production des actinides plus lourds et du 238 Pu radionucl??ide pour les sources d'alimentation en stimulateurs cardiaques artificielles. Elle a servi de α-source dans le particules alpha spectrom??tres ?? rayons X install??s sur le Sojourner, Mars, Mars 96, Athena , Esprit et rovers Opportunity ainsi que le Mars Science Laboratory d'analyser la composition et la structure des roches sur la surface de Mars et de la Lune . Un tel spectrom??tre sera ??galement utilis?? par le Atterrisseur Philae de la Rosetta pour sonder la surface de la 67P / Churyumov-Gerasimenko com??te .
Histoire


Bien que le curium avait probablement ??t?? produit dans des exp??riences nucl??aires pr??c??dents, il ??tait premier intentionnellement synth??tis??, isol?? et identifi?? en 1944, ?? la Universit?? de Californie, Berkeley par Glenn T. Seaborg, Ralph A. James, et Albert Ghiorso. Dans leurs exp??riences, ils ont utilis?? un 60 pouces (150 cm) cyclotron.
Curium a ??t?? chimiquement identifi?? au laboratoire m??tallurgique (maintenant Argonne National Laboratory) au Universit?? de Chicago. Ce ??tait la troisi??me Transuranien ?? d??couvrir m??me si ce est le quatri??me de la s??rie - l'??l??ment l??ger am??ricium ??tait inconnue ?? l'??poque.
L'??chantillon a ??t?? pr??par?? comme suit: tout d'abord plutonium solution de nitrate a ??t?? appliqu??e sur une platine feuille d'environ 0,5 cm 2, la solution a ??t?? ??vapor??e et le r??sidu a ??t?? converti en dioxyde de plutonium (PuO 2) par recuit. ?? la suite de l'irradiation de cyclotron l'oxyde, le rev??tement a ??t?? dissous avec de l'acide nitrique , puis pr??cipit?? sous forme d'hydroxyde en utilisant aqueuse concentr??e une solution d'ammoniaque. Le r??sidu a ??t?? dissous dans l'acide perchlorique, et en outre la s??paration a ??t?? effectu??e par ??change d'ions pour donner un certain isotope du curium. La s??paration de l'am??ricium et le curium ??tait si laborieux que le groupe Berkeley initialement appel?? ces ??l??ments pand??monium (du grec pour tous les d??mons ou l'enfer) et d??lire (du latin pour la folie).
L'isotope le curium-242 a ??t?? produite en Juillet-Ao??t 1944 par bombardant avec 239 Pu α-particules pour produire le curium avec la sortie d'un neutron :
Curium-242 a ??t?? identifi?? sans ambigu??t?? par l'??nergie caract??ristique des α-particules ??mises lors de la d??sint??gration:
La demi-vie de cette d??sint??gration alpha a ??t?? mesur??e en 150 jours, puis corrig??e ?? 162,8 jours.
Un autre isotope 240 cm a ??t?? produite dans une r??action similaire en Mars 1945:
La demi-vie de la 240 cm α-decay a ??t?? correctement d??termin??e comme ??tant 26,7 jours.
La d??couverte de curium, ainsi que l'am??ricium, en 1944 a ??t?? ??troitement li??e ?? la Manhattan Project, les r??sultats ??taient confidentielles et ne d??classifi?? en 1945. Seaborg divulgu?? la synth??se des ??l??ments 95 et 96 sur l'??mission de radio des ??tats-Unis pour les enfants, les Quiz enfants, cinq jours avant la pr??sentation officielle ?? un R??union de l'American Chemical Society, le 11 Novembre 1945, lorsque l'un des auditeurs a demand?? si aucun ??l??ment nouveau de transuraniens c??t?? de plutonium et le neptunium avait ??t?? d??couvert pendant la guerre. La d??couverte de curium (242 cm et 240 cm), leur production et les compos??s ont ensuite ??t?? brevet?? liste ne Seaborg comme l'inventeur.
 |  | |
Marie et Pierre Curie | ||
Le nouvel ??l??ment a ??t?? nomm?? d'apr??s Marie Sklodowska-Curie et son mari Pierre Curie qui a not?? pour d??couvrir le radium et pour leur travail dans la radioactivit??. Il a suivi l'exemple du gadolinium , un lanthanides ??l??ment ci-dessus curium dans le tableau p??riodique, qui a ??t?? nomm?? d'apr??s l'explorateur de la ??l??ments des terres rares Johan Gadolin:
- "Comme son nom pour l'??l??ment de num??ro atomique 96, nous voudrions proposer" curium ", avec le symbole cm. La preuve indique que l'??l??ment 96 contient sept 5f ??lectrons et est donc analogue au gadolinium ??l??ment avec ses sept 4f ??lectrons dans la r??guli??re s??rie des terres rares. Sur cet ??l??ment de base 96 est nomm?? d'apr??s les Curie d'une mani??re analogue ?? la d??signation de gadolinium, dans lequel le chimiste Gadolin a ??t?? honor??. "
Les premiers ??chantillons de curium ??taient ?? peine visibles, et ont ??t?? identifi??s par leur radioactivit??. Louis Werner et Isadore Perlman a cr???? le premier ??chantillon substantielle de 30 ug curium-242 de l'hydroxyde ?? l'Universit?? de Californie en 1947 en bombardant l'am??ricium -241 avec des neutrons. Quantit??s macroscopiques de fluorure de curium ont ??t?? obtenus en 1950 par WWT Crane, JC Wallmann et BB Cunningham. Sa susceptibilit?? magn??tique ??tait tr??s proche de celle de GdF 3 fournir la premi??re preuve exp??rimentale pour la valence de 3 curium dans ses compos??s. M??tal curium a ??t?? produit seulement en 1951 par la r??duction de fluorure de curium avec le baryum .
Caract??ristiques
Physique


Un synth??tique, ??l??ment radioactif, le curium est un m??tal dur et dense avec l'aspect blanc argent?? et les propri??t??s physiques et chimiques ressemblant ?? ceux de gadolinium . Son point de 1340 ?? C de fusion est nettement sup??rieur ?? celui de la pr??c??dente ??l??ments transuraniens neptunium (637 ?? C), de plutonium (639 ?? C) et de l'am??ricium (1173 ?? C). En comparaison, le gadolinium fond ?? 1312 ?? C. Le point de curium d'??bullition est 3110 ?? C. Avec une densit?? de 13,52 g / cm 3, le curium est nettement plus l??ger que le neptunium (20,45 g / cm 3) et de plutonium (19,8 g / cm 3), mais est plus lourd que la plupart des autres m??taux. Entre deux formes cristallines du curium, l'α-Cm est plus stable dans les conditions ambiantes. Il a une sym??trie hexagonale, groupe spatial P6 3 / mmc, param??tres de maille a = 365 h et c = 1 182 heures, et quatre des unit??s de formule par cellule unitaire. Le cristal est constitu?? d'un double hexagonal emballage avec la succession de couches et donc ABAC est isotypique avec α-lanthane. A des pressions sup??rieures ?? 23 GPa, ?? la temp??rature ambiante, α-β transforme en Cm-Cm, qui a un cubique ?? faces centr??es sym??trie, groupe d'espace Fm 3 m et la constante de r??seau a = 493 h. Apr??s une nouvelle compression ?? 43 GPa, se transforme en un curium orthorhombique γ-Cm structure similaire ?? celle des α-uranium, sans autres transitions observ??es jusqu'?? 52 GPa. Ces trois phases de curium sont ??galement appel??s Cm I, II et III.
Curium a des propri??t??s magn??tiques particuli??res. Alors que son ??l??ment voisin actinium ne montre aucun ??cart par rapport ?? Curie-Weiss paramagn??tisme dans toute la plage de temp??rature, α-Cm transforme ?? un ??tat antiferromagn??tique lors du refroidissement ?? 65-52 K et β-cm pr??sente une ferrimagn??tique transition ?? environ 205 K. Pendant ce temps, pnictures de curium montrer transitions ferromagn??tiques lors du refroidissement: 244 244 CMN et les RMR ?? 109 K, 248 K CMP ?? 73 et 248 ?? 162 CMSB K. De m??me, l'analogue des lanthanides de curium, le gadolinium, ainsi que ses pnictures montrent ??galement transitions magn??tiques lors du refroidissement, mais le caract??re de transition est quelque peu diff??rente: D.ieu et GdN deviennent ferromagn??tique, et le PIB, GDA et GdSb montrent ordre antiferromagn??tique.
Conform??ment ?? donn??es magn??tiques, la r??sistivit?? ??lectrique de curium augmente avec la temp??rature - environ deux fois entre 4 et 60 K - puis reste ?? peu pr??s constante jusqu'?? la temp??rature ambiante. Il existe une augmentation significative de la resistvity au fil du temps (environ 10 μOhm ?? cm / h) du fait de l'auto-endommagement du r??seau cristallin par un rayonnement alpha. Cela rend incertaine la valeur de r??sistivit?? pour curium absolu (environ 125 μΩ ?? cm). La r??sistivit?? du curium est similaire ?? celle du gadolinium et du plutonium et du neptunium actinides, mais est nettement sup??rieure ?? celle de l'am??ricium, l'uranium, le polonium et le thorium .
Sous un ??clairage ultraviolet, le curium (III) des ions pr??senter solide et stable jaune-orange fluorescence avec un maximum dans l'intervalle d'environ 590 ?? 640 nm en fonction de leur environnement. La fluorescence provient des transitions du premier ??tat excit?? 6 7/2 D et de l'??tat du sol 8 S 7/2. L'analyse de cette fluorescence permet des interactions entre de surveillance Cm (III) en ions complexes organiques et inorganiques.
Chimique
ions en solution Curium supposent l' ??tat d'oxydation de +3, qui est l'??tat d'oxydation le plus stable pour le curium. L'??tat d'oxydation +4 est observ??e que dans quelques phases solides, telles que CMO 2 et 4 CmF. comportement chimique de curium est diff??rent du actinides thorium et l'uranium, et est similaire ?? celui de l'am??ricium et de nombreux lanthanides . En solution aqueuse, le CM 3+ ions est incolore ?? vert p??le, et Cm de l'ion est jaune p??le. L'absorption optique d'ions cm 3+ contient trois pics bien d??finis ?? 375,4, 381,2 et 396,5 nanom??tres et leur force peut ??tre directement convertie en la concentration des ions. les ions sont Curium disques acides de Lewis et forment ainsi des complexes plus stables avec des bases dures. La liaison est essentiellement ionique, avec une petite composante covalente. Curium dans ses complexes pr??sente habituellement un environnement de coordination neuf fois, dans un tricapped g??om??trie prismatique trigonal.
Isotopes
| Neutrons thermiques des sections transversales ( granges) | ||||||
|---|---|---|---|---|---|---|
| 242 cm | 243 cm | 244 cm | 245 cm | 246 cm | 247 cm | |
| Fission | 5 | 617 | 1,04 | 2145 | 0,14 | 81,90 |
| Capture | 16 | 130 | 15,20 | 369 | 1,22 | 57 |
| C / F | 3,20 | 0,21 | 14,62 | 0,17 | 8,71 | 0,70 |
| LEU combustible us?? 20 ans apr??s 53 MWj / kg br??ler | ||||||
| 3 isotopes communs | 51 | 3700 | 390 | |||
| R??acteur rapide Combustible MOX (moy 5 ??chantillons, combustion 66-120GWd / t) | ||||||
| Curium total 3,09 ?? 10 -3% | 27,64% | 70,16% | 2,166% | 0,0376% | 0.000928% | |
| Isotope | 242 cm | 243 cm | 244 cm | 245 cm | 246 cm | 247 cm | 248 cm | 250 cm |
| Masse critique, en kg | 25 | 7,5 | 33 | 6,8 | 39 | 7 | 40,4 | 23,5 |
Environ 20 les radio-isotopes et 7 isom??res nucl??aires entre 233 cm et 252 cm sont connus pour le curium, et aucun stables isotopes . Les plus longues demi-vies ont ??t?? rapport??s pour 247 cm (15,6 millions d'ann??es) et 248 cm (348000 ann??es). D'autres isotopes ?? vie longue sont 245 cm (demi-vie 8500 ann??es), 250 cm (8300 ann??es) et 246 cm (4760 ann??es). Curium-250 est inhabituel par qu'il majoritairement (environ 86%) se d??sint??gre via fission spontan??e. Les isotopes de curium plus couramment utilis??s sont 242 cm et 244 cm avec les demi-vies de 162,8 jours et 18,1 ans, respectivement.

pourcentage de fission est montr?? moins 100 pourcentages.
Total du transmutation varie consid??rablement selon nucl??ide.
245 cm 248 cm sont ?? long v??cu avec d??croissance n??gligeable.
Tous les isotopes entre 242 cm et 248 cm, ainsi que 250 cm, subissent une auto-entretenue r??action nucl??aire en cha??ne, et donc, en principe, peut agir comme un le combustible nucl??aire dans un r??acteur. Comme dans la plupart des ??l??ments transuraniens, la fission nucl??aire section est particuli??rement ??lev?? pour le curium impair de masse des isotopes 243 cm, 245 cm et 247 cm. Ceux-ci peuvent ??tre utilis??s dans les r??acteurs ?? neutrons thermiques, tandis qu'un m??lange d'isotopes de curium ne convient que pour r??acteurs surg??n??rateurs rapides depuis les isotopes pairs de masse ne sont pas fissiles dans un r??acteur thermique et se accumulent avec l'augmentation du taux de combustion. Le combustible ?? oxydes mixtes (MOX), qui doit ??tre utilis?? dans les r??acteurs de puissance, devrait contenir peu ou pas parce que le curium activation neutronique de 248 cm cr??era californium . Ce est fort neutrons ??metteur et polluerait la fin du cycle de carburant et augmenter la dose au personnel du r??acteur. Par cons??quent, si le actinides mineurs doivent ??tre utilis??es comme combustible dans un r??acteur ?? neutrons thermiques, le curium doit ??tre exclu de la mise en carburant ou de combustible tiges sp??ciales o?? il est le seul actinides pr??sents.
Le tableau de droite indique le des masses critiques pour les isotopes de curium pour une sph??re, sans un mod??rateur et le r??flecteur. Avec un r??flecteur m??tallique (30 cm de l'acier), les masses critiques des isotopes impairs sont environ 4.3 kg. Lors de l'utilisation de l'eau (~ 20 ?? 30 cm d'??paisseur) en tant que r??flecteur, la masse critique peut ??tre aussi faible que 59 g pour 245 cm, 155 g pour 243 cm et 1,550 gramme pour 247 Cm. Il ya une incertitude significative de ces valeurs de masse critique. Consid??rant qu'il est habituellement de l'ordre de 20%, les valeurs de 242 cm et 246 cm ont ??t?? r??pertori??s comme grand que 371 kg et 70,1 kg, respectivement, par certains groupes de recherche.
Actuellement, le curium ne est pas utilis?? comme combustible nucl??aire en raison de sa faible disponibilit?? et le prix ??lev??. 245 cm et 247 cm ont une tr??s petite masse critique et pourraient donc ??tre utilis??s dans les portables armes nucl??aires , mais aucun n'a ??t?? rapport?? ?? ce jour. Curium-243 ne est pas adapt?? ?? cette fin en raison de sa courte demi-vie et l'??mission de α forte qui se traduirait par une chaleur excessive. Curium-247 serait tr??s appropri??, ayant une demi-vie 647 fois sup??rieure ?? celle de plutonium-239.
Occurrence

L'isotope plus longue dur??e de curium, 247 cm, a une demi-vie de 15,6 millions d'ann??es. Par cons??quent, toute curium primordiale, ce est le curium pr??sents sur la Terre lors de sa formation, aurait pourri maintenant. Curium est produite artificiellement, en petites quantit??s ?? des fins de recherche. En outre, il se produit dans d??pens?? combustible nucl??aire. Curium est pr??sent dans la nature dans certaines zones utilis??es pour l'atmosph??re essais d'armes nucl??aires, qui ont ??t?? men??es entre 1945 et 1980. Donc, l'analyse des d??bris sur le site d'essai de la premi??re US bombe ?? hydrog??ne, Ivy Mike, (1 Novembre 1952, Enewetak Atoll), ?? c??t?? einsteinium , fermium , le plutonium et l'am??ricium a ??galement r??v??l?? isotopes de berkelium, californium et le curium, en particulier 245 cm, 246 cm et de petites quantit??s de 247 cm, 248 cm et 249 cm. Pour des raisons de secret militaire, ce r??sultat a ??t?? publi?? seulement en 1956.
Curium compos??s atmosph??riques sont peu solubles dans les solvants courants et surtout adh??rent aux particules du sol. L'analyse du sol a r??v??l?? une concentration d'environ 4000 fois plus ??lev??e de curium les particules du sol de sable que dans l'eau pr??sente dans les pores du sol. Un rapport encore plus ??lev?? d'environ 18 000 a ??t?? mesur??e dans les sols limoneux.
Quelques atomes de curium peuvent ??tre produits par r??actions de capture de neutrons et d??sint??gration b??ta en tr??s fortement concentr??es uranium d??p??ts -bearing.
Synth??se
pr??paration d'isotopes
Curium est produit en petites quantit??s dans r??acteurs nucl??aires, et par plus que kg de celui-ci ont ??t?? accumul??s pour le 242 cm et 244 cm et grammes ou m??me milligrammes pour des isotopes plus lourds. Ce qui explique le prix ??lev?? du curium, qui a ??t?? cit?? ?? ??tre de 160 ?? 185 USD par milligramme, avec une estimation plus r??cente ?? 2000 USD / g pour 242 cm et 170 USD / g pour 244 cm. Dans les r??acteurs nucl??aires, le curium est form??e ?? partir de 238 U d'une s??rie de r??actions nucl??aires. Dans la premi??re cha??ne, 238 U capture un neutron et se transforme en U 239, qui par l'interm??diaire de β - d??croissance se transforme en 239 Np et 239 Pu.
![\ Mathrm {^ {238} _ {\ 92} U \ \ xrightarrow {(n, \ gamma)} \ ^ {239} _ {\ 92} U \ \ xrightarrow [23,5 \ min] {\ beta ^ -} \ ^ {239} _ {\ 93} Np \ \ xrightarrow [2,3565 \ d] {\ beta ^ -} \ ^ {239} _ {\ 94}} Pu](../../images/1281/128135.png) (Les temps sont des demi-vies ).
(Les temps sont des demi-vies ).
En outre capture de neutrons suivie par β - -decay produit l'isotope 241 Am de l'am??ricium qui convertit plus loin dans 242 cm:
![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {2 (n, \ gamma)} \ ^ {241} _ {\ 94} Pu \ \ xrightarrow [14,35 \ an] {\ beta ^ -} \ ^ {241} _ {\ 95} Am \ \ xrightarrow {(n, \ gamma)} \ ^ {242} _ {\ 95} Am \ \ xrightarrow [16,02 \ h] {\ beta ^ -} \ ^ { 242} _ {\} 96 cm}](../../images/2302/230202.png) .
.
?? des fins de recherche, le curium est obtenu en irradiant pas uranium plutonium, mais, ce qui est disponible en grandes quantit??s ?? partir de combustible nucl??aire us??. Beaucoup plus ??lev?? de flux de neutrons est utilis?? pour l'irradiation qui r??sulte en une cha??ne de r??action diff??rents et formation de 244 cm:
Curium-244 se d??sint??gre en 240 Pu par ??mission de particule alpha, mais elle absorbe ??galement neutrons r??sultant dans une petite quantit?? d'isotopes lourds de curium. Parmi ceux-ci, 247 cm et 248 cm sont populaires dans la recherche scientifique en raison de leurs longues demi-vies. Cependant, le taux de production de 247 cm dans les r??acteurs ?? neutrons thermiques est relativement faible en raison de elle est sujette ?? subir une fission induite par des neutrons thermiques. Synth??se de l'interm??diaire 250 cm absorption de neutrons est ??galement peu probable en raison de la courte demi-vie du produit interm??diaire 249 cm (64 min), qui convertit par β - d??sint??gration ?? l' berkelium isotope 249 Bk.
 (A = 244 ?? 248)
(A = 244 ?? 248)
La cascade de dessus (n, γ) des r??actions produit un m??lange de diff??rents isotopes de curium. Leur s??paration post-synth??se est encombrant, et donc une synth??se s??lective est d??sir??e. Curium-248 est favoris??e ?? des fins de recherche en raison de sa longue demi-vie. La m??thode de pr??paration la plus efficace de cet isotope est par l'interm??diaire d'α-d??sint??gration de la californium isotope 252 Cf, qui est disponible en quantit??s relativement importantes en raison de sa longue demi-vie (2,65 ann??es). A propos de 35 ?? 50 mg de 248 cm est produit par ce proc??d?? chaque ann??e. La r??action associ?? produit 248 cm avec la puret?? isotopique de 97%.
Un autre ??l??ment int??ressant pour les isotopes de recherche 245 cm peut ??tre obtenu ?? partir de l'α-d??sint??gration de 249 Cf, et ce dernier isotope est produit en quantit??s infimes de la β - -decay du berkelium isotope 249 Bk.
Pr??paration de m??tal

La plupart des routines de synth??se produisent un m??lange de diff??rents isotopes d'actinides comme oxydes, ?? partir de laquelle un certain isotope de curium doit ??tre s??par??. Un exemple de proc??dure pourrait ??tre de dissoudre combustible us?? du r??acteur (par exemple, Combustible MOX) dans l'acide nitrique , et de supprimer la majeure partie de l'uranium et du plutonium en utilisant un PUREX (P lutonium - UR anium EX traction) taper extraction avec le phosphate de tributyle dans un hydrocarbure. Les lanthanides et les actinides restants sont ensuite s??par??es du r??sidu aqueux ( raffin??t) par une extraction ?? base de diamide-pour donner, apr??s le d??capage, un m??lange des actinides et lanthanides trivalents. Compos?? de curium est ensuite extrait en utilisant de fa??on s??lective ?? plusieurs ??tapes chromatographiques et des techniques de centrifugation avec un r??actif appropri??. Bis -triazinyl complexe bipyridine a r??cemment ??t?? propos?? en tant que tel r??actif qui est hautement s??lectif pour le curium. La s??paration de l'am??ricium ?? partir d'une curium tr??s similaire peut ??galement ??tre obtenue par traitement d'une suspension de leurs hydroxydes dans une solution aqueuse du bicarbonate de sodium avec de l'ozone ?? temp??rature ??lev??e. Les deux am??ricium et le curium sont pr??sents dans la plupart des solutions ?? l'??tat de valence 3; alors am??ricium oxyde ?? la forme soluble Am (IV) complexes, curium reste inchang?? et peuvent donc ??tre isol??es par centrifugation r??p??t??e.
Curium m??tallique est obtenu par r??duction de ses compos??s. Initialement, le curium (III) le fluorure a ??t?? utilis?? ?? cette fin. La r??action a ??t?? effectu??e dans le milieu exempt d'eau et d'oxyg??ne, dans l'appareil en le tantale et le tungst??ne , en utilisant ??l??mentaire baryum ou de lithium comme agents r??ducteurs.
Une autre possibilit?? est la r??duction du curium (IV) oxyde de magn??sium en utilisant un alliage de zinc dans une masse fondue de chlorure de magn??sium et le fluorure de magn??sium.
Les compos??s et r??actions
Oxydes
Curium r??agit facilement avec l'oxyg??ne formant essentiellement cm 2 O 3 et OCM deux oxydes, mais l'OCM d'oxyde bivalent est ??galement connu. Noir OCM 2 peut ??tre obtenue par la combustion du curium oxalate (cm 2 (C 2 O 4) 3), nitrate (Cm (NO 3) 3) ou d'hydroxyde dans l'oxyg??ne pur. Lors d'un chauffage ?? 600-650 ?? C sous vide (environ 0,01 Pa), il se transforme en Cm blanch??tre 2 O 3:
 .
.
Alternativement, Cm 2 O 3 peut ??tre obtenue en r??duisant OCM 2 avec mol??culaire hydrog??ne :
En outre, un certain nombre d'oxydes ternaires de type M (II) sont connus OCM 3, o?? M reste pendant un m??tal divalent, tel que le baryum.
Halog??nures
Le curium incolore (III) fluorure (CMF 3) peut ??tre produit en introduisant des ions fluorures dans le curium (III) contenant des solutions. Le brun t??travalent curium (IV) fluorure (CMF 4) d'autre part ne est obtenu par r??action curium (III) avec le fluorure mol??culaire fluor :
Une s??rie de fluorures ternaires sont connus de la forme A 7 cm 6 F 31, o?? A repr??sente un m??tal alcalin .
La incolore curium (III) chlorure (CMCl 3) est produit dans la r??action de curium (III) hydroxyde (Cm (OH) 3) anhydre avec gaz de chlorure d'hydrog??ne. Il peut en outre ??tre converti en d'autres halog??nures, tels que le curium (III) bromure (incolore au vert clair) et curium (III) d'iodure (incolore), en le faisant r??agir avec l' ammoniac le sel d'halog??nure correspondant ?? une temp??rature ??lev??e d'environ 400 450 ?? C:
Un autre mode op??ratoire est le chauffage de l'oxyde de curium ?? environ 600 ?? C avec de l'acide correspondant (tel que bromhydrique pour le bromure de curium). Phase vapeur hydrolyse de curium (III) R??sultats de chlorure dans le curium oxychlorure:
Chalcogenides et pnictures
Sulfures, des s??l??niures et des tellurures de curium ont ??t?? obtenus par traitement de curium gazeux avec du soufre , du s??l??nium ou du tellure sous vide ?? temp??rature ??lev??e. Le pnictures de curium du type CMX sont connus pour les ??l??ments azote , phosphore , arsenic et antimoine . Ils peuvent ??tre pr??par??s en faisant r??agir soit le curium (III) d'hydrure (CMH 3) ou curium m??tallique avec ces ??l??ments ?? des temp??ratures ??lev??es.
Compos??s Organocurium et aspects biologiques

Complexes organom??talliques analogue ?? Uranoc??ne sont connus aussi pour d'autres actinides, tels que le thorium, le protactinium, le neptunium, le plutonium et l'am??ricium. Th??orie des orbitales mol??culaires pr??dit une "curocene" stable complexe (η 8 ?? C 8 H 8) 2 cm, mais il n'a pas encore ??t?? signal?? exp??rimentalement.
La formation des complexes du type Cm (nC 3 H 7 -BTP) 3, o?? BTP repr??sente 2,6-di (1,2,4-triazine-3-yl) pyridine, dans des solutions contenant nC 3 H 7 - ions BTP et Cm 3+ a ??t?? confirm??e par EXAFS. Certains de ces complexes de type BTP interagissent s??lectivement avec curium et sont donc utiles dans la s??paration s??lective de lanthanides et les actinides autre. Ions cm 3+ dissous se lient avec de nombreux compos??s organiques, tels que l'acide hydroxamique, l'ur??e , fluoresc??ine et l'ad??nosine triphosphate . Beaucoup de ces compos??s sont li??s ?? l'activit?? biologique de divers micro-organismes. Les complexes r??sultants pr??sentent une forte ??mission jaune-orange sous excitation par la lumi??re UV, ce qui est pratique, non seulement pour leur d??tection, mais aussi pour l'??tude des interactions entre l'ion cm 3+ et des ligands par l'interm??diaire de variations de la demi-vie (de l'ordre ~ 0,1 ms) et le spectre de la fluorescence.
Curium n'a pas de signification biologique. Il ya peu de rapports sur biosorption de Cm 3+ par les bact??ries et arch??es, cependant aucune preuve pour l'incorporation de curium en eux.
Applications
Radionucl??ides
Curium est l'un des ??l??ments les plus radioactifs isolables. Ses deux isotopes les plus communs 242 cm et 244 cm sont ??metteurs alpha fortes (??nergie 6 MeV); ils sont relativement courtes demi-vies de 162,8 jours et 18,1 ann??es, et produisent autant que 120 W / g et 3 W / g de l'??nergie thermique, respectivement. Par cons??quent, le curium peut ??tre utilis?? dans sa forme oxyde commune g??n??rateurs thermo??lectriques radio-isotopiques comme ceux dans les vaisseaux spatiaux. Cette application a ??t?? ??tudi?? pour l'isotope 244 cm, tandis que 242 cm a ??t?? abandonn?? en raison de son prix prohibitif d'environ 2000 USD / g. Curium-243 avec un ~ 30 ann??es demi-vie et un bon rendement ??nerg??tique de ~ 1,6 W / g pourrait faire pour un carburant appropri??, mais il produit des quantit??s importantes de nuisibles gamma et rayonnement b??ta ?? partir de produits de d??sint??gration radioactive. Bien que l'α-??metteur, 244 cm n??cessite une protection beaucoup plus mince blindage de rayonnement, il a un taux de fission spontan??e ??lev??e, et donc le taux de rayonnement neutronique et gamma sont relativement forte. Par rapport ?? un concurrent isotope du g??n??rateur thermo??lectrique tel que 238 Pu, 244 cm ??met une heure 500 plus grande fluence de neutrons, et son ??mission gamma plus ??lev??e n??cessite un bouclier qui est 20 fois plus ??paisse - environ 2 pouces de plomb pour une source de 1 kW, comme par rapport ?? 0,1 pour 238 en Pu. Par cons??quent, cette application de curium est actuellement consid??r?? comme impraticable.
Une application plus prometteur de 242 cm est de produire 238 Pu, un radio-isotope plus appropri?? pour les g??n??rateurs thermo??lectriques tels que dans les stimulateurs cardiaques. Les itin??raires alternatifs pour Pu 238 utilisent le (n, γ) r??action de 237 Np, ou deuteron bombardement de l'uranium, qui ?? la fois produisent toujours 236 Pu comme un sous-produit ind??sirable - puisque ce dernier se d??sint??gre en 208 Tl avec une forte ??mission gamma.
Curium est ??galement une mati??re de d??part commun pour la production ult??rieure de transuraniens et transactinides. Ainsi, le bombardement de 248 cm avec l'oxyg??ne (18 O) ou de magn??sium (26 mg) a donn?? certains isotopes de seaborgium (265 Sg) et hassium (269 HS et 270 HS). Californium a ??t?? d??couvert quand une cible microgrammes taille du curium-242 a ??t?? irradi?? avec 35 MeV particules alpha en utilisant le cyclotron de 60 pouces (150 cm) ?? Berkeley:
- 242
96 cm + 4
2 Il → 245
98 Cf + 1
0 n
Seulement environ 5000 atomes de californium ont ??t?? produits dans cette exp??rience.

Spectrom??tre ?? rayons X
L'application la plus pratique de 244 cm - mais un peu limit?? en volume totale - est en tant que source α-particules dans le particules alpha spectrom??tres ?? rayons X (APXS). Ces instruments ont ??t?? install??s sur la Sojourner, Mars, Mars 96, Esprit, Athena et rovers Opportunity, ainsi que le Mars Science Laboratory d'analyser la composition et la structure des roches sur la surface de la plan??te Mars . APXS a ??galement ??t?? utilis?? dans le SURVEYOR 5-7 sondes de lune mais avec une source de 242 cm.
Une configuration APXS ??labor?? est ??quip?? d'une t??te de capteur contenant six sources de curium ayant le taux de d??sint??gration radioactive total de plusieurs dizaines de millicuries (environ un gigabecquerel). Les sources sont collimat??s sur l'??chantillon, et les spectres d'??nergie des particules alpha et des protons dispers??s ?? partir de l'??chantillon sont analys??s (l'analyse de protons est mis en oeuvre que dans certains spectrom??tres). Ces spectres contiennent des informations quantitatives sur tous les principaux ??l??ments dans les ??chantillons ?? l'exception de l'hydrog??ne, l'h??lium et le lithium. Un APXS sera ??galement utilis?? par le Atterrisseur Philae de la Rosetta pour sonder la surface de la 67P / Churyumov-Gerasimenko com??te .
S??curit??
En raison de sa forte radioactivit??, le curium et ses compos??s doit ??tre manipul?? dans des laboratoires, selon des modalit??s particuli??res. Consid??rant que le curium se HPS α-particules qui sont absorb??s par des couches minces de mat??riaux communs, certains de ses produits de d??sint??gration ??mettent fractions importantes de rayonnements b??ta et gamma, qui n??cessitent une protection plus ??labor??e. Si consomm??, le curium est excr??t?? dans quelques jours et seulement 0,05% est absorb?? dans le sang. De l??, environ 45% va ?? la foie, 45% pour les os, et les 10% restants sont excr??t??s. Dans l'os, curium se accumule ?? l'int??rieur des interfaces avec le la moelle osseuse et ne redistribue pas de mani??re significative avec le temps; ses d??truit de rayonnement arr??ts de la moelle osseuse et donc rouge cr??ation de cellules sanguines. Le demi-vie biologique de curium est d'environ 20 ans dans le foie et 50 ann??es dans les os. Curium est absorb?? dans le corps beaucoup plus fortement par inhalation, et la dose totale autoris??e de 244 cm sous forme soluble est 0,3 μ C. injection intraveineuse de 242 cm et 244 cm contenant des solutions ?? des rats a augment?? l'incidence des tumeur osseuse, et l'inhalation promus pulmonaire et cancer du foie.
isotopes de Curium sont in??vitablement pr??sents dans le combustible nucl??aire us?? avec une concentration d'environ 20 g / tonne. Parmi eux, les 245 cm 248 cm isotopes ont des temps de d??sint??gration des milliers d'ann??es et doivent ??tre enlev??s pour neutraliser le carburant pour l'??limination. La proc??dure associ??e comporte plusieurs ??tapes, o?? le curium est d'abord s??par?? et ensuite converti par bombardement neutronique dans des r??acteurs sp??ciaux de nucl??ides de courte dur??e. Cette proc??dure, transmutation nucl??aire, tout bien document?? pour d'autres ??l??ments, est toujours en cours d'??laboration pour le curium.



![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {4 (n, \ gamma)} \ ^ {243} _ {\ 94} Pu \ \ xrightarrow [4956 \ h] {\ beta ^ -} \ ^ {243} _ {\ 95} Am \ \ xrightarrow {(n, \ gamma)} \ ^ {244} _ {\ 95} Am \ \ xrightarrow [10.1 \ h] {\ beta ^ -} \ ^ { 244} _ {\} 96 cm}](../../images/2302/230203.png)
![\ Mathrm {^ {244} _ {\ 96 cm} \ \ xrightarrow [18,11 \ an] {\ alpha} \ ^ {240} _ {\ 94}} Pu](../../images/2302/230204.png)
![\ Mathrm {^ {252} _ {\} 98 Cf \ \ xrightarrow [2,645 \ an] {\ alpha} \ ^ {248} _ {\} 96 cm}](../../images/2302/230206.png)
![\ Mathrm {^ {249} _ {\ 97} Bk \ \ xrightarrow [330 \ d] {\ beta ^ -} \ ^ {249} _ {\} 98 Cf \ \ xrightarrow [351 \ an] {\ alpha} \ ^ {245} _ {\} 96 cm}](../../images/2302/230207.png)