
Astate
?? propos de ce ??coles s??lection Wikipedia
Cette s??lection Wikipedia est d??connect?? disponibles ?? partir enfants SOS pour la distribution dans le monde en d??veloppement. Voulez-vous savoir sur le parrainage? Voir www.sponsorachild.org.uk
| Astate | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
85 A | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||
| inconnue, mais probablement un noir solide; ??ventuellement en apparence m??tallique | ||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | astate, A, 85 | |||||||||||||||||||||||||||||||||
| Prononciation | / ?? s t ə t Je n / AS -tə-teen ou / ?? s t ə t ɪ n / AS -tə-??tain | |||||||||||||||||||||||||||||||||
| Cat??gorie Metallic | halog??ne parfois class??e comme une m??tallo??de (contest??e) | |||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | (17) les halog??nes , 6, p | |||||||||||||||||||||||||||||||||
| Poids atomique standard | (210) | |||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Xe ] 4f 14 5d 10 6s 6p 2 5 2, 8, 18, 32, 18, 7 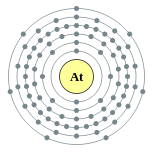 | |||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||
| D??couverte | Dale R. Corson, Kenneth Ross MacKenzie, Emilio Segr?? (1940) | |||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||
| Point de fusion | 575 K , 302 ?? C, 576 ?? F | |||||||||||||||||||||||||||||||||
| Point d'??bullition | 610 K, 337 ?? C, 639 ?? F | |||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | (A 2) 54,39 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | -1, 1, 3, 5, 7 | |||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 2,2 (??chelle de Pauling) | |||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1er: 887,7 ?? 38,59 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||
| Rayon covalente | 150 h | |||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 202 h | |||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||
| Ordre magn??tique | pas de donn??es | |||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 1,7 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-68-8 | |||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de l'astate | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
L'astate est un radioactive ??l??ment chimique avec le symbole chimique Au et de num??ro atomique 85. Il se produit sur Terre que comme le r??sultat de la d??sint??gration radioactive de certains ??l??ments plus lourds. Toutes ses isotopes sont de courte dur??e; le plus stable est l'astate-210, avec une demi-vie de 8,1 heures. En cons??quence, on sait beaucoup moins sur les astatine que la plupart des autres ??l??ments. Les propri??t??s observ??es sont coh??rentes avec elle ??tant un analogue plus lourd de l'iode ; de nombreuses autres propri??t??s ont ??t?? estim??es sur la base de cette ressemblance.
Astate ??l??mentaire n'a jamais ??t?? vu, car une masse suffisamment grande pour ??tre consid??r??e (par l'??il humain nu) serait imm??diatement vaporis?? par la chaleur g??n??r??e par son propre radioactivit??. L'astate peut ??tre sombre, ou il peut avoir un aspect m??tallique et un semi-conducteur, ou il peut m??me ??tre un m??tal. Il est susceptible d'avoir un point de fusion beaucoup plus ??lev?? que ne l'iode, ?? ??galit?? avec ceux de bismuth et le polonium. Chimiquement, l'astate se comporte plus ou moins comme un atome d'halog??ne , ??tant pr??vu pour former astatides ioniques avec des m??taux alcalins ou alcalino-terreux des m??taux; il est connu de former des compos??s covalents avec les non-m??taux, y compris autres halog??nes. Il, cependant, ont aussi une chimie cationique remarquable qui le distingue parmi les halog??nes l??gers. Le deuxi??me plus longue dur??e de vie de l'isotope astate, astate-211, est le seul ?? avoir actuellement une application commerciale, ??tre employ?? en m??decine pour diagnostiquer et traiter certaines maladies via son ??mission de particules alpha (noyaux d'h??lium 4). Seuls les tr??s petites quantit??s sont utilis??es, cependant, en raison de sa radioactivit?? intense.
Le premier ??l??ment a ??t?? produit par Dale R. Corson, Kenneth Ross MacKenzie, et Emilio Segr?? au Universit?? de Californie, Berkeley en 1940. Ils ont appel?? l'??l??ment "astate", un nom venant de la grande instabilit?? de la mati??re synth??tis??e (la source mot grec αστατος (astatos) signifie ??instable??). Trois ans plus tard il a ??t?? trouv?? dans la nature, m??me si ce est l'??l??ment le moins abondant dans la cro??te de la Terre parmi les non- transuraniens, avec un montant total estim?? de moins de 28 grammes (1 once) ?? un moment donn??. Six isotopes de l'astate, avec nombres de masse de 214 ?? 219, sont pr??sents dans la nature comme les produits de diverses voies de d??sint??gration d'??l??ments plus lourds, mais ni l'isotope le plus stable de l'astate (avec un nombre de masse 210), ni astate-211 (qui est utilis?? en m??decine) est produit naturellement .
Caract??ristiques
Astate est un ??l??ment extr??mement radioactif; tous ses isotopes ont une demi-vie de moins de 12 heures, se d??sint??grant en bismuth , le polonium , le radon , ou d'autres isotopes astatine. Parmi les 101 premiers ??l??ments du tableau p??riodique, ne francium est moins stable.
Les propri??t??s en vrac de l'astate ne sont pas connus avec une grande certitude. La recherche est limit??e par sa courte demi-vie, ce qui emp??che la cr??ation de quantit??s pesables. Une pi??ce visible de astatine serait imm??diatement et compl??tement vaporis??e en raison de la chaleur g??n??r??e par sa radioactivit?? intense. Astate est g??n??ralement class?? comme un non-m??tal ou d'un m??tallo??de. Cependant, la formation de m??tal en phase condens??e astate a ??galement ??t?? sugg??r??e.
Physique
La plupart des propri??t??s physiques de l'astate ont ??t?? estim??s (par interpolation ou extrapolation), en utilisant diverses m??thodes th??oriquement la terre ou des donn??es empiriques. A titre d'exemple, les halog??nes plus lourds sont plus sombres que sont les halog??nes de poids atomique moindre - fluor est presque incolore, le chlore est vert clair, le brome est brun, et l'iode est gris fonc?? / violet. Astate est parfois d??crit comme ??tant un solide noir (en supposant qu'il suit cette tendance), ou comme ayant un aspect m??tallique (si ce est un m??tallo??de ou un m??tal). Les fusion et les points d'??bullition sont ??galement attendus de l'astate de suivre la tendance observ??e dans la s??rie des halog??nes, augmentant avec le nombre atomique . Sur cette base, les points de fusion et d'??bullition sont estim??s ?? 575 K (302 ?? C; 575 ?? F) et 610 K (337 ?? C; 638 ?? F), respectivement. Cependant, certains ??l??ments de preuve exp??rimentale sugg??re astatine peut avoir fusion et d'??bullition des points faibles que ceux anticip??s par la tendance d'halog??ne. sublime astatine moins facilement que ne le fait l'iode, ayant une faible la pression de vapeur. M??me ainsi, la moiti?? d'une quantit?? donn??e de astatine se vaporise en une heure si elles sont mises sur une surface de verre propre ?? la temp??rature ambiante.
La structure cristalline de l'astate solide est inconnue. Preuve pour (ou contre) l'existence de astatine diatomique (A 2) sont rares et peu concluantes. Certaines sources affirment que A 2 ne existe pas, ou du moins n'a jamais ??t?? observ??, tandis que d'autres sources affirment ou laissent entendre son existence. Malgr?? cette controverse, de nombreuses propri??t??s de l'astate diatomic ont ??t?? pr??dit.
Chimique
Beaucoup de propri??t??s chimiques de l'astate ont ??t?? d??termin??es en utilisant des ??tudes de suivi sur les solutions astatine tr??s dilu??es. Propri??t??s les plus connus - tels que la formation d'anions - sont en ligne avec d'autres halog??nes. Cependant, astate a quelques caract??ristiques m??talliques ainsi, comme ??talement sur une cathode, copr??cipitation des sulfures m??talliques dans de l'acide chlorhydrique, et la formation d'un cation dans des solutions acides forts.
L'astate a un ??lectron??gativit?? de 2,2 sur l'??chelle r??vis??e Pauling. Ceci est inf??rieure ?? celle de l'iode (2,66) et le m??me que celui de l'hydrog??ne. Toutefois, astatide d'hydrog??ne (THA) la charge n??gative est pr??vu pour ??tre sur l'atome d'hydrog??ne, ce qui implique que ce compos?? devrait plut??t ??tre appel?? astatine hydrure. Dans ce contexte, il est pertinent de noter que l'??lectron??gativit?? des astate sur la ??chelle Allred-Rochow (1,9) est inf??rieure ?? celle de l'hydrog??ne (2,2).
Compos??s
L'astate est le moins r??actif des halog??nes, ??tant moins r??actif que l'iode; Toutefois, plusieurs compos??s de l'astate ont ??t?? synth??tis??s en quantit??s microscopiques et ??tudi?? aussi intensivement que possible avant leur d??sint??gration radioactive in??vitable. Les r??actions mises en jeu sont g??n??ralement test??s avec des solutions dilu??es de l'astate m??lang?? avec de plus grandes quantit??s d'iode. L'iode agit comme un support, se assurer qu'il existe suffisamment de mat??riel pour les techniques de laboratoire (tels que la filtration et des pr??cipitations) pour fonctionner.

La formation d'un compos?? d'hydrog??ne avec l'astate - g??n??ralement appel??e astatide d'hydrog??ne - a ??t?? not?? par les pionniers de la chimie de l'astate. Comme mentionn?? pr??c??demment, il ya lieu de se r??f??rant ?? ce compos?? comme astatine hydrure place - astate est facilement oxyd??, l'acidification par (dilu??) l'acide nitrique donne l'A 0 ou A + formes, et l'ajout d'argent (I) pr??cipite alors astatine, seulement partiellement comme l'argent (I) astatide (AGAT) (ou pas du tout). L'iode, en revanche, ne est pas oxyd??, et pr??cipite facilement que argent (I) d'iodure.
Seuls quelques astatides m??talliques ont ??t?? rapport??s, y compris ceux de sodium, de palladium, d'argent et de plomb. Certaines propri??t??s caract??ristiques de astatide argent, et les astatides alcalins et alcalino-terreux connus et hypoth??tiques, ont ??t?? estim??s par extrapolation ?? partir d'autres halog??nures d'argent ou alcalins ou alcalines.

L'astate est connu pour r??agir avec ses homologues plus l??gers iode, le brome et le chlore ?? l'??tat de vapeur; ces r??actions produisent diatomique compos??s interhalog??n??s avec des formules Ati, AtBr et ATCL. Les deux premiers compos??s peuvent ??galement ??tre produits dans l'eau - l'astate r??agit avec l'iode / solution d'iodure pour former Ati, alors AtBr n??cessite (en dehors de l'astate) un atome d'iode / monobromure d'iode / solution de bromure. L'exc??s d'iodures ou bromures peut conduire ?? AtBr -
2 et ATI -
Deux ions, ou dans une solution de chlorure, ils peuvent produire des esp??ces comme ATCL -
2 ou AtBrCl - via des r??actions d'??quilibre ??quilibr?? avec les chlorures. Oxydation de l'??l??ment avec dichromate (dans une solution d'acide nitrique) a montr?? que l'addition de chlorure astate tourn?? dans une mol??cule susceptible d'??tre soit ATCL ou AtOCl. De m??me, AtOCl -
2 ou ATCL -
2 peuvent ??tre produits. Dans une source d'ions ?? plasma spectrom??tre de masse , les ions similaires [ATI] +, [AtBr] + et [ATCL] + ont ??t?? form??es en introduisant plus l??g??res vapeurs d'halog??ne en un h??lium -filled cellule contenant l'astate, soutenant l'existence de mol??cules neutres stables ?? l'??tat d'ions ?? plasma. Pas de fluorures astatine ont ??t?? d??couverts encore. Leur absence a ??t?? attribu?? sp??culativement ?? l'extr??me r??activit?? de ces compos??s, comprenant la r??action d'un fluorure d'abord form?? avec les parois du r??cipient en verre pour former un produit non volatil. Ainsi, bien que la synth??se d'un fluorure d'astate est consid??r?? comme possible, il peut exiger un solvant liquide de fluorure d'halog??ne, comme cela a d??j?? ??t?? utilis??e pour la caract??risation des fluorures de radon.
Avec de l'oxyg??ne, il existe des preuves de l'existence de l'esp??ce AtO -, ATO -
Et l'OAB + 2 en solution aqueuse, form??e par la r??action de l'astate avec un oxydant tel que du brome ??l??mentaire ou (dans le dernier cas) par le persulfate de sodium dans une solution d'acide perchlorique. L'ATO bien caract??ris?? -
3 anion peut ??tre obtenu, par exemple, l'oxydation de l'astate avec de l'hypochlorite de potassium dans une solution de l'hydroxyde de potassium. En outre l'oxydation, tel que par difluorure de x??non (dans une solution alcaline chaude) ou periodate (dans une solution neutre ou alcaline), on obtient l'ATO ionique perastatate -
4; cependant, ce ne est stable dans des solutions neutres ou alcalins. L'astate est ??galement consid??r?? comme capable de former des sels cationiques tels que des oxyanions iodate ou dichromate; ceci est bas?? sur l'observation que, dans des solutions acides, monovalent ou ??tats positifs interm??diaires de l'astate copr??cipiter avec les sels insolubles des cations de m??taux tels que l'argent (I) ou d'iodate de thallium (I) dichromate.
Astate peut former des liaisons ?? l'autre chalcog??nes; il se agit notamment S 7 A + et A (CSN) -
2 avec du soufre , une coordination compos?? s??l??nour??e avec le s??l??nium et un astatine- tellure collo??de avec le tellure. En outre, l'astate est connu pour se lier ?? l'azote , le plomb et le bore dans des conditions appropri??es.
tetraastatide de carbone (Cat 4) est connue. L'astate peut remplacer un atome d'hydrog??ne dans le benz??ne pour former C 6 H 5 A; ce peut ??tre oxyd?? en C 6 H 5 ATCL 2 par le chlore. En traitant ce compos?? avec une solution alcaline d'hypochlorite, C 6 H 5 AtO 2 peut ??tre produite.
Histoire

En 1869, lorsque Dmitri Mendele??ev a publi?? son tableau p??riodique , l'espace sous l'iode ??tait vide; apr??s Niels Bohr a ??tabli la base physique de la classification des ??l??ments chimiques, il a ??t?? sugg??r?? que le cinqui??me halog??ne il appartenait. Avant sa d??couverte officiellement reconnue, il a ??t?? appel?? ??eka-iode" (du sanscrit eka - "un") impliquer ce ??tait une espace sous iode (de la m??me mani??re que eka-silicium, Eka-bore, et autres). Les scientifiques ont essay?? de trouver dans la nature; compte tenu de sa raret??, ces tentatives ont abouti ?? un certain nombre de fausses d??couvertes.
La premi??re d??couverte revendiqu??e de eka-iode a ??t?? faite par Fred Allison et ses associ??s ?? l'Institut polytechnique de l'Alabama (maintenant ??l??ment 85 Auburn University) en 1931. Les d??couvreurs nomm?? "alabamine", et lui a donn?? le symbole Ab, d??signations qui ont ??t?? utilis??s pendant quelques ann??es apr??s. En 1934, cependant, HG MacPherson de Universit?? de Californie, Berkeley r??fut?? la m??thode de Allison et la validit?? de sa d??couverte. Cette d??couverte erron??e a ??t?? suivie par une autre revendication en 1937, par le chimiste Rajendralal De. Travailler dans Dhaka , Inde britannique (aujourd'hui le Bangladesh ), il a choisi le nom "Dakin" pour l'??l??ment 85, dont il a pr??tendu avoir isol?? le s??rie de thorium ??quivalent de Radium F (le polonium-210) dans le S??rie radium. Les propri??t??s se est pr??sent?? au Dakin ne correspondent pas ?? ceux de l'astate, et la v??ritable identit?? de Dakin ne est pas connue.

En 1940, le chimiste suisse Walter Minder a annonc?? la d??couverte de l'??l??ment 85 comme le produit beta de d??sint??gration du radium A (le polonium-218), le choix du nom "helvetium" (de l'Helv??tie, ??la Suisse??). Cependant, Berta Karlik et Traude Bernert ont pas r??ussi ?? reproduire ses exp??riences, et par la suite attribu??s les r??sultats de Minder ?? la contamination de son flux de radon (radon-222 est l'isotope parent du polonium-218). En 1942, Minder, en collaboration avec le scientifique anglais Alice Leigh-Smith, a annonc?? la d??couverte d'un autre isotope de l'??l??ment 85, est pr??sum?? ??tre le produit de thorium A (le polonium-216) d??sint??gration b??ta. Ils ont appel?? cette substance "anglo-helvetium??, mais Karlik et Bernert ??taient encore incapables de reproduire ces r??sultats.
En 1940, Dale R. Corson, Kenneth Ross MacKenzie, et Emilio Segr?? isole finalement l'??l??ment ?? l'Universit?? de Californie, Berkeley. Au lieu de chercher l'??l??ment dans la nature, les scientifiques ont cr????, il en bombardant bismuth-209 avec des particules alpha. Le nom "astate" vient du grec mot αστατος (astatos, ce qui signifie ??instable??), en raison de sa propension ?? d??sint??gration radioactive (plus tard, tous les isotopes de l'??l??ment ont ??t?? montr??s ?? ??tre instable), avec le "-ine" mettre fin, a trouv?? dans les noms des quatre halog??nes pr??c??demment d??couverts. Trois ans plus tard, astate a ??t?? trouv?? comme un produit de naturel cha??nes de d??sint??gration par Karlik et Bernert. Depuis lors, astate a ??t?? d??termin?? ?? ??tre dans trois des quatre cha??nes de d??sint??gration naturelles.
Isotopes
Il ya 32 isotopes connus de l'astate, avec des masses atomiques (num??ros de masse) de 191 et de 193 ?? 223. Aucune isotope astate stable, voire ?? long terme est connu, et aucune de ces isotopes est pr??vu d'exister.
Alpha caract??ristiques de d??sint??gration des isotopes pour l'??chantillon astatine Masse
nombreMasse
exc??sMasse
exc??s de
filleMoyenne
de l'??nergie
alpha
pourritureDemi-vie Probabilit??
de alpha
pourritureAlpha
demi-vie207 -13,243 MeV -19,116 MeV 5,873 MeV 1,80 h 8,6% 20,9 h 208 -12,491 MeV -18,243 MeV 5,752 MeV 1,63 h 0,55% 12.3 d 209 -12,880 MeV -18,638 MeV 5,758 MeV 5,41 h 4,1% 5.5 d 210 -11,972 MeV -17,604 MeV 5,632 MeV 8,1 h 0,175% 193 d 211 -11,647 MeV -17,630 MeV 5,983 MeV 7,21 h 41,8% 17,2 h 212 -8,621 MeV -16,436 MeV 7,825 MeV 0,31 s ≈100% 0,31 s 213 -6,579 MeV -15,834 MeV 9,255 MeV 125 ns 100% 125 ns 214 -3,380 MeV -12,366 MeV 8,986 MeV 558 ns 100% 558 ns 219 10,397 MeV 4,073 MeV 6,324 MeV 56 s 97% 58 s 220 14,350 MeV 8,298 MeV 6,052 MeV 3,71 min 8% 46,4 min 221 16,810 MeV 11,244 MeV 5,566 MeV 2,3 min exp??rimentalement
alpha stable∞
Astate a 23 isom??res nucl??aires, qui sont des noyaux avec une ou plus nucl??ons ( protons ou les neutrons ) dans un ??tat excit??. Un isom??re nucl??aire peut aussi ??tre appel?? un " m??ta-??tat ", signifie que le syst??me a plus ??nergie interne que le " ??tat fondamental "(l'??tat avec l'??nergie interne le plus bas possible), ce qui rend l'ancien susceptibles ?? la pourriture dans ce dernier. Il peut y avoir plus d'un isom??re pour chaque isotope. Le plus stable de ces isom??res nucl??aires est astate-202m1, qui a une demi-vie d'environ 3 minutes, plus longtemps que ceux de tous les Etats au sol sauf pour ceux d'isotopes 203 ?? 211 et 220. Le moins stable est une astate-214m1; sa demi-vie de 265 nanosecondes est plus courte que ceux de tous les ??tats de base, sauf celle de l'astate-213.
Astate de alpha ??nergies d??sint??gration suivent la m??me tendance que pour les autres ??l??ments lourds. Briquet isotopes astatine ont des ??nergies tr??s ??lev??es de la d??sint??gration alpha, qui deviennent plus faible que les noyaux deviennent plus lourds. L'astate-211, cependant, a une ??nergie sensiblement plus ??lev?? que l'isotope pr??c??dent, car il a un noyau 126 avec les neutrons, et 126 est un nombre magique correspondant ?? une enveloppe remplie de neutrons. Malgr?? ayant une demi-vie similaire ?? l'isotope pr??c??dente (8,1 heures pour astate-210 et 7,2 heures pour astate-211), la d??sint??gration alpha probabilit?? est beaucoup plus ??lev?? pour ce dernier: 41,81% contre seulement 0,18%. Les deux isotopes suivants lib??rent encore plus d'??nergie, avec l'astate-213 lib??rant la plus grande quantit?? d'??nergie de tous les isotopes astatine. Pour cette raison, il est l'isotope astate plus courte dur??e. M??me si plus lourds isotopes astatine lib??rent moins d'??nergie, isotope astate pas long v??cu existe, en raison du r??le croissant de d??sint??gration b??ta (d'??mission d'??lectrons). Ce mode de d??croissance est particuli??rement important pour l'astate; d??s 1950 il a ??t?? postul?? que l'??l??ment n'a pas isotopes b??ta-stable (c.-??-celles qui ne d??sint??gration b??ta du tout). Modes de d??sint??gration b??ta ont ??t?? trouv??es pour tous les isotopes astatine sauf astate-213, astate-214, astate-215, et astate-216m. Beta d'exposition Astate-210 et isotopes les plus l??gers, plus d??croissance ( tomographie par ??mission), exposition b??ta astate-216 et des isotopes plus lourds (moins) la pourriture, et astate-212 se d??sint??gre via les deux modes, tandis que astatine-211 subit capture d'??lectrons ?? la place.
L'isotope le plus stable est l'astate-210, qui a une demi-vie de 8,1 heures. Mode de d??sint??gration primaire de cet isotope est d??sint??gration b??ta plus ?? la vie relativement longue (par rapport aux isotopes astatine) ??metteur alpha le polonium-210. Au total, seulement cinq isotopes ont des demi-vies sup??rieures ?? une heure (ceux avec des nombres de masse entre 207 et 211). L'isotope stable moins de l'??tat fondamental est astate-213, avec une demi-vie de 125 nanosecondes. Il alpha se d??sint??gre ?? la tr??s longue dur??e de vie (en pratique, stable) de bismuth-209.
Occurrence naturelle
L'astate est l'??l??ment le plus rare d'origine naturelle qui ne est pas un ??l??ment transuranien, avec le montant total de la cro??te terrestre estim??e ?? moins de 28 grammes (1 once) ?? un moment donn??. Toute astatine qui ??tait pr??sent ?? la formation de la Terre a depuis longtemps pourri, et les montants de minutes de l'astate existant actuellement ont form?? par la d??sint??gration d'??l??ments plus lourds. Alors qu'il a ??t?? pens?? pour ??tre l'??l??ment le plus rare se produisant sur la Terre, astate a perdu ce statut ?? Berkelium , atomes qui peuvent ??tre produites par r??actions de capture de neutrons et la d??sint??gration b??ta en tr??s fortement concentr??es uranium d??p??ts -bearing.
Six astate isotopes sont pr??sents naturellement (astate-214 ?? l'astate-219). En raison de leur courte demi-vie , ils ne se trouvent que dans des traces. Il n'y a pas de donn??es indiquant que astatine se produit dans les ??toiles.

Quatre de ces isotopes (astate-215, astate-217, astate-218, et astate-219) se trouvent en raison de leur production naturelle majeure cha??nes de d??sint??gration. Francium-223, l'isotope de p??re de l'astate-219, l'alpha se d??sint??gre avec une probabilit?? de seulement 0,006%, ce qui en fait astatine isotope extr??mement rare, m??me par rapport aux autres isotopes astatine; ce est en d??pit de sa demi-vie est la plus longue des isotopes de l'astate naturel (56 secondes). Astate-219 se d??sint??gre en polonium-215, qui se d??sint??gre en beta astate-215 avec une probabilit?? encore plus faible de 0,00023%. L'ensemble de l'Am??rique du Nord et du Sud combin??e, consid??r?? jusqu'?? une profondeur de 16 kilom??tres (10 milles), contient seulement environ un billion atomes astate-215 ?? un moment donn??. Astate-218 se trouve dans la nature en raison de polonium-218 d??sint??gration b??ta; comme francium-223 et le polonium 215, se d??sint??grent en un isotope de l'astate ne est pas le mode de d??sint??gration primaire. Toutefois, l'isotope astate-217 a une cha??ne droite menant directement ?? astatine; son isotope p??re (francium-221) se d??sint??gre exclusivement ?? cette nucl??ide. ??tant donn?? que ses p??res, grands-p??res, et ainsi de suite chaque d??sint??gration exclusivement ?? un seul nucl??ide, cela donne une seule fa??on possible pour le nucl??ide ?? partir du s??rie neptunium ( neptunium -237) ?? la pourriture - via la production ??ventuelle de astate-217.
Les isotopes avec des nombres de masse 214 ?? 216 se trouvent ?? la suite de la d??sint??gration alpha triple de la pr??sente naturellement protactinium isotopes protactinium-226, protactinium-227, et le protactinium-228. Cependant, ces isotopes sont extr??mement rares, si bien qu'ils ne sont pas souvent cit??es comme isotopes astatine naturel.
Synth??se
Formation
Les r??actions possibles apr??s bombardant le bismuth 209 avec des particules alpha R??action L'??nergie de la particule alpha 209
83 Bi 4 +
2 Il → 211
Au 85 + 1 2
026 MeV 209
83 Bi 4 +
2 Il → 210
85 A 3 + 1
040 MeV 209
83 Bi 4 +
2 Il → 209
85 ?? + 4 1
060 MeV
Astate a ??t?? produit en bombardant du bismuth-209 avec des particules alpha ??nergiques, et ce est encore la principale voie utilis??e pour cr??er la vie relativement longue isotopes astate-209 gr??ce ?? l'astate-211. Astate est produit en quantit??s microscopiques, avec des techniques modernes permettant de pistes de production 2 tera becquerels (environ 25 microgrammes ).
L'isotope le plus important est l'astate-211, le seul ?? avoir actuellement un usage commercial. Pour produire la cible de bismuth, le m??tal est le pulv??ris??e sur un, le cuivre, ou de la surface d'aluminium d'or ?? 50 ?? 100 milligrammes par centim??tre carr??. La couche de bismuth, ou en variante l'oxyde de bismuth, de force est fusionn?? avec une plaque de cuivre. La cible est maintenue sous un azote chimiquement neutre atmosph??re, et est refroidi avec de l'eau pour emp??cher la vaporisation pr??matur??e astate. Dans un acc??l??rateur de particules, tel qu'un cyclotron, les particules alpha (noyaux d'h??lium 4) sont entr??s en collision avec le bismuth. M??me se il n'y a qu'un seul isotope de bismuth utilis?? (bismuth-209), la r??action peut se produire de trois fa??ons possibles, produisant astate-209, astatine-210, ou de l'astate-211. Afin d'??liminer les nucl??ides ind??sir??es, le maximum d'??nergie de l'acc??l??rateur de particules est r??gl?? ?? une valeur (par exemple 30 MeV) ci-dessus que, pour la r??action produisant de l'astate-211 (pour produire l'isotope d??sir??) et au-dessous de celle produisant l'astate-210 ( pour ??viter de produire d'autres isotopes astatine).
S??paration
Etant donn?? que l'??l??ment est le produit principal de la synth??se, apr??s sa formation, il ne doit ??tre s??par?? de la cible et des traces d'autres radio-isotopes. La cible contenant astate-est chauff?? ?? 270 ?? C (520 ?? F) pour vaporiser les traces de radio-isotopes volatils, apr??s quoi la temp??rature est port??e ?? 800 ?? C (1450 ?? F). Bien que 80% de l'astate peut se vaporiser ?? cette temp??rature, le bismuth commence ?? se vaporiser ainsi. La vaporisation de Astate ne se produit pas ?? un rythme suffisant ?? des temp??ratures inf??rieures ?? 600 ?? C (1100 ?? F), mais ?? des temp??ratures sup??rieures ?? 800 ?? C (1450 ?? F), la volatilit?? astatine d'une surface de bismuth augmente de fa??on significative. La vapeur condens??e ( distillat ) est collect??e sur une surface de platine refroidie ?? l'eau, qui est ensuite amen?? dans une forme de U en quartz r??cipient. Le r??cipient de r??cipient de quartz est chauff?? ?? 130 ?? C (270 ?? F) pour ??liminer d'autres traces d'impuret??s (g??n??ralement polonium) et ensuite ?? 500 ?? C (930 ?? F) pour ??liminer l'astate, que l'on recueille sur un doigt froid. L'??l??ment purifi??e est ensuite lav?? le doigt froid avec une faible solution d'acide nitrique. En utilisant cette technique, les rendements de l'astate allant jusqu'?? 30% peuvent ??tre atteints.
Usages et pr??cautions
Plusieurs A-211 contenant des mol??cules et leurs utilisations Agent Applications [211] ?? l'astate-tellure collo??des Tumeurs compartimentaux 6- [211 A] astato-2-m??thyl-1,4-diphosphate naphtaquinol Ad??nocarcinomes 211 ?? marqu?? de bleu de m??thyl??ne Les m??lanomes M??ta [211 A] astatobenzyl guanidine Les tumeurs neuroendocrines 5- [211 A] astato-2'-d??soxyuridine Divers 211 conjugu??s de biotine Au-??tiquet??s Divers pr??ciblage 211 ?? l'octr??otide marqu?? r??cepteur de la somatostatine MAb 211 et de fragments marqu??s A Divers 211 bisphosphonates Au-??tiquet??s Les m??tastases osseuses
L'astate-211 nouvellement form?? est important dans m??decine nucl??aire. Une fois produit, l'astate doit ??tre utilis?? rapidement, comme il se d??sint??gre avec une demi-vie de 7,2 heures; Ce est, cependant, assez long pour permettre des strat??gies d'??tiquetage en plusieurs ??tapes. L'astate-211 peut ??tre utilis?? pour la radioth??rapie cibl??e de particules alpha, car il se d??compose soit par ??mission d'une particule alpha (au bismuth-207), ou via capture d'??lectrons (?? un nucl??ide tr??s courte dur??e du polonium-211, qui se subit en outre la d??sint??gration alpha).
D'une mani??re similaire ?? l'iode, astate est de pr??f??rence concentr?? dans le glande thyro??de, bien que dans une moindre mesure. Toutefois, il a tendance ?? se concentrer dans la foie sous la forme d'un radiocollo??des se il est lib??r?? dans la circulation syst??mique. La principale diff??rence entre m??dicament astate-211 et l'iode-131 (un isotope de l'iode radioactif a ??galement utilis?? en m??decine) est que astate ne ??met pas de particules de haute ??nergie b??ta (??lectrons), de m??me que l'iode-131. Les particules b??ta ont consid??rablement plus grand pouvoir de p??n??tration dans les tissus que ne le font les particules alpha beaucoup plus lourdes. Bien que l'??nergie d'une particule alpha moyenne lib??r?? par la d??composition de l'astate-211 peut se d??placer jusqu'?? 70 um ?? travers les tissus environnants, une particule b??ta d'??nergie moyenne ??mis par l'iode-131 peut se d??placer pr??s de 30 fois plus loin, jusqu'?? environ 2 mm. Ainsi, en utilisant l'astate-211 ?? la place de l'iode-131 permet la thyro??de ?? doser de fa??on appropri??e, tandis que le voisin glande parathyro??de est ??pargn??. La courte demi-vie et le pouvoir de p??n??tration limit??e de son rayonnement ?? travers les tissus astate rend g??n??ralement pr??f??rable d'iode-131 lorsqu'il est utilis?? dans le diagnostic ainsi.
Des exp??riences sur des rats et des singes, cependant, sugg??rent que astatine cause beaucoup plus de dommages ?? la glande thyro??de que ne le fait l'iode-131, avec l'injection r??p??titif du nucl??ide entra??ne la n??crose et la cellule la dysplasie dans la glande. Ces exp??riences sugg??rent ??galement que astatine pourrait causer des dommages ?? la thyro??de de tout organisme. Les premi??res recherches a sugg??r?? que l'injection de quantit??s l??tales de astatine caus?? changements morphologiques dans le tissu mammaire (mais pas d'autres tissus); Toutefois, cette conclusion reste actuellement controvers??e.
