
Gallium
Renseignements g??n??raux
Enfants SOS ont produit une s??lection d'articles de wikipedia pour les ??coles depuis 2005. parrainage SOS enfant est cool!
| Gallium | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
31 Ga | |||||||||||||||||||
| |||||||||||||||||||
| Apparence | |||||||||||||||||||
blanc argent??  | |||||||||||||||||||
| Propri??t??s g??n??rales | |||||||||||||||||||
| Nom, symbole, nombre | gallium, Ga, 31 | ||||||||||||||||||
| Prononciation | / ɡ ?? l Je ə m / GAL--ee əm | ||||||||||||||||||
| ??l??ment Cat??gorie | post-m??tal de transition | ||||||||||||||||||
| Groupe, p??riode, bloc | 13, 4, p | ||||||||||||||||||
| Poids atomique standard | 69,723 (1) | ||||||||||||||||||
| Configuration ??lectronique | [ Ar ] 4s 2 4p 3d 10 1 2, 8, 18, 3 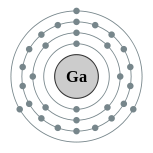 | ||||||||||||||||||
| Histoire | |||||||||||||||||||
| Pr??diction | Dmitri Mendeleev (1871) | ||||||||||||||||||
| D??couverte | Lecoq de Boisbaudran (1875) | ||||||||||||||||||
| Premier isolement | Lecoq de Boisbaudran (1875) | ||||||||||||||||||
| Propri??t??s physiques | |||||||||||||||||||
| Phase | solide | ||||||||||||||||||
| Densit?? (?? proximit?? rt) | 5,91 g ?? cm -3 | ||||||||||||||||||
| Liquid densit?? au mp | 6,095 g ?? cm -3 | ||||||||||||||||||
| Point de fusion | 302.9146 K , ?? C 29,7646, 85,5763 ?? F | ||||||||||||||||||
| Point d'??bullition | 2477 K, 2204 ?? C, 3999 ?? F | ||||||||||||||||||
| La chaleur de fusion | 5,59 kJ ?? mol -1 | ||||||||||||||||||
| Chaleur de vaporisation | 254 kJ ?? mol -1 | ||||||||||||||||||
| Capacit?? thermique molaire | 25,86 J ?? mol -1 ?? K -1 | ||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||
| |||||||||||||||||||
| Propri??t??s atomiques | |||||||||||||||||||
| ??tats d'oxydation | 3, 2, 1 ( l'oxyde amphot??re) | ||||||||||||||||||
| ??lectron??gativit?? | 1,81 (??chelle de Pauling) | ||||||||||||||||||
| ??nergies d'ionisation ( plus) | 1e: 578,8 kJ ?? mol -1 | ||||||||||||||||||
| 2??me: 1979,3 kJ ?? mol -1 | |||||||||||||||||||
| 3??me: 2963 kJ ?? mol -1 | |||||||||||||||||||
| Rayon atomique | 135 h | ||||||||||||||||||
| Rayon covalente | 122 ?? 15 heures | ||||||||||||||||||
| Rayon de Van der Waals | 187 h | ||||||||||||||||||
| Miscellan??es | |||||||||||||||||||
| Crystal structure | orthorhombique  | ||||||||||||||||||
| Ordre magn??tique | diamagn??tique | ||||||||||||||||||
| R??sistivit?? ??lectrique | (20 ?? C) 270 nΩ ?? m | ||||||||||||||||||
| Conductivit?? thermique | 40,6 W ?? m -1 ?? K -1 | ||||||||||||||||||
| Dilatation thermique | (25 ?? C) 18 um ?? m -1 ?? K -1 | ||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 2,740 m ?? s -1 | ||||||||||||||||||
| Le module d'Young | 9,8 GPa | ||||||||||||||||||
| Coefficient de Poisson | 0,47 | ||||||||||||||||||
| Duret?? Mohs | 1,5 | ||||||||||||||||||
| Duret?? Brinell | 60 MPa | ||||||||||||||||||
| Num??ro de registre CAS | 7440-55-3 | ||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||
| Article d??taill??: Isotopes du gallium | |||||||||||||||||||
| |||||||||||||||||||
Le gallium est un ??l??ment chimique avec le symbole Ga et de num??ro atomique 31. Gallium ??l??mentaire ne se produit pas dans la nature, mais que le gallium (III) compos??s ?? l'??tat de traces dans bauxite et de zinc minerais. Un m??tallique argent?? douce pauvre en m??taux, de gallium ??l??mentaire est un solide fragile ?? basse temp??rature. Tenue assez longtemps, le gallium va fondre dans la main comme il se liqu??fie ?? une temp??rature de 29,76 ?? C (85,57 ?? F) (l??g??rement au-dessus temp??rature ambiante). Son point de fusion est utilis?? comme point de r??f??rence de temp??rature. Alliage Galinstan (68,5% Ga, 21,5% En , 10% Sn ) a un point de fusion encore plus bas de -19 ?? C (-2 ?? F), bien en dessous du point de cong??lation de l'eau. De sa d??couverte en 1875 jusqu'?? l'??re des semi-conducteurs, le gallium a ??t?? utilis?? principalement comme un agent pour fabriquer des alliages bas point de fusion.
Aujourd'hui, la quasi-totalit?? de gallium est utilis?? pour la micro??lectronique. L'ars??niure de gallium, l'utilisation principale du gallium, est utilis?? dans un circuit ?? micro-ondes et applications infrarouges. Le nitrure de gallium et nitrure de gallium indium, minoritaire semi-conducteurs utilise, produire bleu et violet des diodes ??lectroluminescentes (LED) et des lasers ?? diode.
Gallium n'a aucun r??le connu en biologie. En raison de gallium (III) et ferriques sels comportent de mani??re similaire dans des syst??mes biologiques, des ions gallium imitent souvent des ions fer dans les applications m??dicales. Contenant du gallium produits pharmaceutiques et radiopharmaceutiques ont ??t?? d??velopp??s.
Propri??t??s physiques

Gallium ??l??mentaire ne est pas trouv?? dans la nature, mais il est facilement obtenu par fusion. Gallium m??tal tr??s pur a une couleur argent??e brillante et ses fractures m??talliques solides conchoidally comme verre . Le gallium m??tal se dilate de 3,1% quand il se solidifie, et par cons??quent dans des r??cipients de stockage soit de verre ou de m??tal est ??vit??e en raison de la possibilit?? de rupture de r??cipient de cong??lation. part de Gallium l'??tat liquide de haute densit?? avec seulement quelques mat??riaux comme le silicium , le germanium , de bismuth et de l'eau .
Gallium attaque la plupart des autres m??taux par diffuser dans leur m??tal treillis. Le gallium, par exemple, diffuse dans le joints de grains de Al / Zn alliages ou en acier , ce qui les rend tr??s fragiles. Alliages de gallium facilement avec de nombreux m??taux, et est utilis?? en petites quantit??s en tant que plutonium alliage de gallium dans le plutonium noyaux de bombes nucl??aires, pour aider ?? stabiliser la structure cristalline du plutonium.
Le point de fusion de 302.9146 K (29,7646 ?? C, 85,5763 ?? F) est la temp??rature ambiante ?? proximit??, sur les temp??ratures moyennes de l'heure d'??t??. Le point de fusion de Gallium (mp) est l'un des points de r??f??rence de temp??rature formelles dans le ??chelle internationale de temp??rature de 1990 (EIT-90) ??tablie par BIPM. Le point triple de gallium de 302.9166 K (29,7666 ?? C, 85,5799 ?? F), est utilis?? par NIST, de pr??f??rence ?? la temp??rature de fusion de gallium.
Le point de fusion unique de gallium permet de fondre dans sa main, puis recongeler en cas de renvoi. Ce m??tal a une forte tendance ?? supercool dessous de son point de fusion / point de cong??lation . Ensemencement avec un cristal aide ?? initier cong??lation. Le gallium est l'un des m??taux (avec le c??sium , le rubidium , le mercure et susceptibles francium ) qui sont liquides ?? la temp??rature ambiante ou proche de la normale, et peut donc ??tre utilis?? en m??tal, en verre ?? haute temp??rature thermom??tres. Il est ??galement remarquable pour avoir une des plus larges gammes de liquides pour un m??tal, et (contrairement ?? mercure) pour avoir un faible pression de vapeur ?? des temp??ratures ??lev??es. Le point d'??bullition de Gallium, 2477 K, est plus de huit fois plus ??lev?? que son point de fusion sur le ??chelle absolue , ce qui en fait le plus grand rapport entre le point de fusion et le point de tout ??l??ment d'??bullition. Contrairement ?? mercure, gallium m??tal liquide mouille le verre et la peau, ce qui rend m??caniquement plus difficile ?? manipuler (m??me si elle est beaucoup moins toxique et n??cessite beaucoup moins de pr??cautions). Pour cette raison, ainsi que les probl??mes de contamination m??tallique et la cong??lation extension, des ??chantillons de gallium m??tal sont g??n??ralement fournis dans des paquets de poly??thyl??ne ?? l'int??rieur d'autres conteneurs.
| Propri??t?? | une | b | c |
|---|---|---|---|
| α (~ 25 ?? C, um / m) | 16 | 11 | 31 |
| ρ (29,7 ?? C, nΩ ?? m) | 543 | 174 | 81 |
| ρ (0 ?? C, nΩ ?? m) | 480 | 154 | 71,6 |
| ρ (K 77, nΩ ?? m) | 101 | 30,8 | 14,3 |
| ρ (4,2 K, pΩ ?? m) | 13,8 | 6,8 | 1.6 |
Gallium ne pas cristalliser dans l'une quelconque des simples structures cristallines. La phase stable dans des conditions normales est orthorhombique avec 8 atomes dans le conventionnel cellule unitaire. Chaque atome a un seul voisin le plus proche (?? une distance de 244 h) et six autres voisins dans suppl??mentaire de 39 h. Beaucoup stable et On trouve phases m??tastables comme fonction de la temp??rature et de la pression.
La liaison entre les deux voisins les plus proches est covalente, d'o?? Ga 2 dim??res sont consid??r??s comme les ??l??ments constitutifs fondamentaux du cristal. Ceci explique la baisse du point de fusion par rapport ?? son voisin ??l??ments de l'aluminium et l'indium.
Les propri??t??s physiques de gallium sont fortement anisotrope, ce est ?? dire avoir des valeurs diff??rentes le long des trois axes majeurs cristallographique un (voir tableau), b et c; pour cette raison, il existe une diff??rence significative entre le lin??aire (α) et le volume des coefficients de dilatation thermique. Les propri??t??s de gallium sont ??galement fortement d??pendante de la temp??rature, en particulier pr??s du point de fusion. Par exemple, le coefficient de dilatation thermique augmente de plusieurs centaines de pour cent lors de la fusion.
Propri??t??s chimiques
Le gallium se trouve principalement dans les trois ??tat d'oxydation . L'oxydation 1 est ??galement attest??e dans certains compos??s, bien qu'ils tendent ?? disproportionn?? en gallium ??l??mentaire et des compos??s du gallium (III). Ce qui est parfois appel?? le gallium compos??s (II) sont en fait compos??s de l'Etat oxydation mixte contenant ?? la fois de gallium (I) et de gallium (III).
Compos??s chalcog??nes
A temp??rature ambiante, le gallium m??tal est non r??active envers l'air et l'eau en raison de la formation d'une couche d'oxyde passif, de protection. Aux temp??ratures plus ??lev??es, cependant, il r??agit avec l'oxyg??ne dans l'air pour former gallium (III), l'oxyde de Ga 2 O 3. La r??duction de Ga 2 O 3, de gallium ??l??mentaire sous vide ?? 500 ?? C ?? 700 ?? C donne le brun fonc?? gallium (I) oxyde, Ga 2 O. Ga 2 O est une tr??s forte agent r??ducteur capable de r??duire le H 2 SO 4 ?? H 2 S. Il dismutation ?? 800 ?? C retour au gallium et Ga 2 O 3.
Sulfure de gallium, Ga 2 S 3, a trois modifications possibles de cristal. Elle peut ??tre r??alis??e par la r??action avec de gallium l'hydrog??ne sulfur?? (H 2 S) ?? 950 ?? C. En variante, Ga (OH) 3 peut ??galement ??tre utilis?? ?? 747 ?? C:
- 2 Ga (OH) 3 + 3 H 2 S → Ga 2 S 3 + 6 H 2 O
La r??action d'un m??lange de carbonates de m??taux alcalins et de Ga 2 O 3 avec du H 2 S conduit ?? la formation de thiogallates contenant la [Ga 2 S 4] 2- anion. Les acides forts ces sels se d??composent, lib??rant H 2 S dans le processus. Le sel de mercure, HgGa 2 S 4, peut ??tre utilis?? comme un luminophore.
Gallium forme ??galement des sulfures dans les ??tats d'oxydation inf??rieurs, tels que gallium (II) le sulfure et le vert gallium (I) sulfure, ce dernier ??tant produit ?? partir de la premi??re par chauffage ?? 1000 ?? C sous un courant d'azote.
Les autres chalcog??nures binaires, Ga 2 Se 3 et Ga 2 Te 3, avoir la structure blende. Ils sont tous les semi-conducteurs, mais sont facilement hydrolyse, ce qui limite leur utilit??.
La chimie aqueuse
Les acides forts dissolvent gallium, formant gallium (III) tels que les sels Ga 2 (SO 4) 3 et Ga (NO 3) 3. Les solutions aqueuses de sels de gallium (III) contiennent l'ion gallium hydrat??, [Ga (H 2 O) 6] 3+. Gallium (III) hydroxyde, Ga (OH) 3, peut ??tre pr??cipit?? ?? partir de gallium (III) les solutions en ajoutant de l'ammoniac . La d??shydratation Ga (OH) 3 ?? 100 ?? C produit de l'hydroxyde de l'oxyde de gallium, Gao (OH).
Alcalines hydroxyde solutions dissoudre le gallium, le gallate de former des sels contenant du Ga (OH) -
4 anion. l'hydroxyde de gallium, qui est amphot??res, dissout aussi dans un alcali pour former des sels de gallate. Bien premiers travaux sugg??rent Ga (OH) 3-
6 comme un autre anion gallate possible, cette esp??ce n'a pas ??t?? trouv?? dans le travail plus tard.
Compos??s pnictog??ne
Le gallium r??agit avec l'ammoniac ?? 1050 ?? C pour former le nitrure de gallium, GaN. Gallium forme ??galement des compos??s binaires avec le phosphore , l'arsenic et l'antimoine : phosphure de gallium (GaP), l'ars??niure de gallium (GaAs), et antimoniure de gallium (GaSb). Ces compos??s ont la m??me structure que ZnS, et ont d'importantes semiconducteurs propri??t??s. GaP, GaAs, GaSb et peuvent ??tre synth??tis??s par la r??action directe de gallium avec du phosphore ??l??mentaire, de l'arsenic ou l'antimoine. Ils pr??sentent une conductivit?? ??lectrique plus ??lev??e que GaN. GaP peut ??galement ??tre synth??tis?? par la r??action de Ga 2 O avec du phosphore ?? basse temp??rature.
Gallium fait ??galement nitrures ternaires; par exemple:
- Li Ga 3 + N 2 → Li 3 GaN 2
Des compos??s similaires avec du phosphore et de l'arsenic existent ??galement: Li 3 GaP 2 et Li 2 3 GaAs. Ces compos??s sont facilement hydrolys??es par les acides dilu??s et l'eau.
Halog??nures
Gallium (III) l'oxyde r??agit avec des agents de fluoration tels que HF ou F 2 pour former gallium (III) de fluorure, GaF 3. Il se agit d'un compos?? ionique fortement insoluble dans l'eau. Toutefois, il ne se dissout en l'acide fluorhydrique, dans laquelle il forme un produit d'addition avec de l'eau, GaF 3 ?? 3H 2 O. Tenter de se d??shydrater ce produit d'addition forme au lieu GaF 2 OH ?? n H 2 O. Le produit d'addition r??agit avec l'ammoniac pour former GaF 3 ?? 3NH 3, qui peut alors ??tre chauff?? pour former GaF 3 anhydre.
Le trichlorure de gallium est form?? par la r??action de gallium m??tallique avec du chlore gazeux. Contrairement au trifluorure de gallium (III) chlorure existe sous forme de mol??cules dim??res, Ga 2 Cl 6, avec un point de 78 ?? C de fusion. Ce est ??galement le cas pour le bromure et l'iodure, Ga 2 Br 6 et Ga 2 I 6.
Comme l'autre groupe 13 trihalog??nures, de gallium (III) sont les halog??nures Les acides de Lewis, la r??action d'un halog??nure comme accepteurs d'halog??nures de m??taux alcalins pour former des sels contenant GAX -
4 anions, o?? X est un halog??ne. Ils r??agissent ??galement avec des halog??nures d'alkyle pour former carbocations et GAX -
4.
Lorsqu'il est chauff?? ?? une temp??rature ??lev??e, les halog??nures de gallium (III) r??agissent avec le gallium ??l??mentaire gallium pour former les halog??nures (I) respectifs. Par exemple, GaCl3 r??agit avec Ga pour former GaCl:
- 2 Ga + GaCl3
 GaCl 3 (g)
GaCl 3 (g)
A des temp??ratures inf??rieures, l'??quilibre se d??place vers la gauche et GaCl dismutation retour ?? gallium ??l??mentaire et GaCl3. GaCl peut ??galement ??tre r??alis??e par la r??action avec du HCl de Ga ?? 950 ?? C; il peut alors ??tre condens??e sous forme de solide rouge.
Gallium (I) les compos??s peuvent ??tre stabilis??s par formation d'adduits avec des acides de Lewis. Par exemple:
- GaCl + AlCl 3 → Ga + [AlCl 4] -
Les soi-disant "halog??nures de gallium (II)", GAX, 2 sont en fait des produits d'addition de gallium (I) avec le gallium halog??nures respectif (III) des halog??nures, ayant la structure Ga + [GAX 4] -. Par exemple:
- GaCl + GaCl3 → Ga + [GaCl 4] -
compos??s d'hydrog??ne
Comme l'aluminium , le gallium constitue ??galement un hydrure, GAH 3, connu sous le gallane, qui peut ??tre obtenu par la r??action d'gallanate de lithium (LiGaH 4) avec gallium (III) chlorure ?? -30 ?? C:
- 3 LiGaH 4 + GaCl 3 → 3 LiCl + 4 Gah 3
En pr??sence de dim??thyl ??ther comme solvant, Gah 3 polym??rise pour (Gah 3) n. Si aucun solvant ne est utilis??, le dim??re Ga 2 H 6 ( Digallane) est form?? en tant que gaz. Sa structure est similaire ?? le diborane, ayant deux atomes d'hydrog??ne reliant les deux centres de gallium, contrairement α- AlH 3, dans lequel l'aluminium a un nombre de coordination de 6.
Gallane est instable au-dessus de -10 ?? C, la d??composition de gallium ??l??mentaire et de l'hydrog??ne.
Histoire
En 1871, l'existence de gallium a ??t?? pr??dit par le chimiste russe Dmitri Mendele??ev , qui l'a nomm??e " eka-aluminium "sur la base de sa position dans son tableau p??riodique . Il a ??galement pr??dit plusieurs propri??t??s de l'??l??ment, qui correspondent ??troitement aux propri??t??s r??elles de gallium, tels que la densit?? , le point de fusion , le caract??re d'oxyde et de collage dans du chlorure.
Gallium a ??t?? d??couvert par spectroscopie par le chimiste fran??ais Paul ??mile Lecoq de Boisbaudran en 1875 par son spectre caract??ristique (deux lignes violettes) ?? l'examen d'un ??chantillon sphal??rite. Plus tard cette ann??e, Lecoq a obtenu le m??tal libre par ??lectrolyse de son hydroxyde de solution d'hydroxyde de potassium. Il a nomm?? l'??l??ment "Gallia", du latin sens Gallia Gaule, apr??s sa terre natale de la France. Il a ??t?? plus tard affirm?? que, dans un de ces multilingue calembours tant aim??e des hommes de science au 19??me si??cle, il avait ??galement appel?? le gallium apr??s lui-m??me, comme son nom, "Le coq", est le fran??ais pour "la coq ", et le latin pour "coq" est "gallus"; cependant, dans un article 1877 Lecoq a ni?? cette supposition (Cf. la d??signation de la. J / ψ meson et la plan??te naine Pluton .)
De sa d??couverte en 1875 jusqu'?? l'??re des semi-conducteurs, de ses usages principaux ??taient dans les applications thermom??triques ?? haute temp??rature et ?? la pr??paration des alliages de m??taux avec des propri??t??s inhabituelles de stabilit??, ou la facilit?? de la fusion; certains ??tant liquide ?? la temp??rature ambiante ou au-dessous. Le d??veloppement de l'ars??niure de gallium en tant que semi-conducteur ?? bande interdite directe dans les ann??es 1960 a marqu?? le d??but de la phase la plus importante dans les applications de gallium.
Occurrence
Gallium ne existe pas sous forme libre dans la nature, et les quelques min??raux de grande gallium tels que gallite (CuGaS 2) sont trop rares pour servir de source primaire de l'??l??ment ou de ses compos??s. Son abondance dans la cro??te de la Terre est d'environ 16,9 ppm. Le gallium est trouv??e et extraite en tant que composant de trace dans bauxite et dans une faible mesure ?? partir de sphal??rite. La quantit?? extraite du charbon , diaspore et germanite dans lequel le gallium est ??galement pr??sent est n??gligeable. Le United States Geological Survey ( USGS) estime les r??serves de gallium d??passer 1.000.000 tonnes, sur la base de 50 ppm de concentration en poids dans les r??serves connues de bauxite et de zinc minerais. Certains chemin??e On a montr?? que les poussi??res de la combustion du charbon pour contenir de petites quantit??s de gallium, typiquement inf??rieure ?? 1% en poids.
Production

Le gallium est un sous-produit de la production de l'aluminium et du zinc. Consid??rant que la sphal??rite pour la production de zinc est la source mineure. La plupart gallium est extrait de l'brut solution d'hydroxyde d'aluminium de la Proc??d?? Bayer pour la production de l'alumine et de l'aluminium. Une mercure cellule d'??lectrolyse et l'hydrolyse du l'amalgame avec de l'hydroxyde de sodium conduit ?? gallate de sodium. ??lectrolyse donne alors gallium m??tal. Pour semiconducteur utilisation, une purification suppl??mentaire est r??alis??e en utilisant fusion de zone, ou l'extraction de monocristal d'autre d'une fusion ( processus de Czochralski). Puret??s de 99,9999% sont r??guli??rement atteints et largement disponibles dans le commerce.
En 1986, la production a ??t?? estim??e ?? 40 tonnes. En 2007 la production de gallium ??tait de 184 tonnes de moins de 100 tonnes de l'exploitation mini??re et le reste du recyclage de la ferraille. En 2011 la production mondiale de gallium ??tait estim??e ?? 216 tonnes.
Applications
Les applications de semi-conducteurs dominent l'utilisation commerciale de gallium, qui repr??sente 98% des demandes. La prochaine grande application est pour des grenats de gadolinium gallium.
Semi-conducteurs

En raison de cette demande, de tr??s haute puret?? (+ 99,9999%) gallium est disponible dans le commerce. Ars??niure de gallium (GaAs) et le nitrure de gallium (GaN) utilis??e dans les composants ??lectroniques repr??sent??s sur 98% de la consommation de gallium aux Etats-Unis en 2007. Environ 66% de semi-conducteur de gallium est utilis?? aux Etats-Unis dans les circuits int??gr??s (en ars??niure principalement de gallium), tels que la fabrication des ultra -Dessiccateurs puces logiques de vitesse et MESFETs pour faible bruit pr??amplis micro-ondes dans les t??l??phones cellulaires. Environ 20% est utilis?? dans opto??lectronique. Dans le monde, l'ars??niure de gallium repr??sente 95% de la consommation mondiale annuelle de gallium.
L'ars??niure de gallium est utilis?? en opto??lectronique dans une vari??t?? d'applications infrarouges. ars??niure de gallium d'aluminium (AlGaAs) est utilis?? dans les diodes laser de grande puissance infrarouge. En tant que composante des semi-conducteurs le nitrure de gallium et d'indium et nitrure de gallium, le gallium est utilis?? pour produire des dispositifs opto??lectroniques bleus et violets, essentiellement les diodes laser et diodes ??mettrices de lumi??re. Par exemple, nitrure de gallium lasers ?? diode 405 nm sont utilis??es en tant que source de lumi??re violette ?? haute densit?? de stockage de donn??es de disque compact, dans la Blu-ray Disc standard.
Cellules photovolta??ques ?? jonctions multiples, d??velopp?? pour applications de puissance de satellite, sont prises par ??pitaxie par faisceau mol??culaire ou ??pitaxie organom??tallique en phase vapeur de des films minces de l'ars??niure de gallium, phosphure de gallium indium ou gallium indium arsenide.The Mars Exploration Rovers et plusieurs satellites utilisent jonction triple ars??niure de gallium sur les cellules germanium. Le gallium est ??galement un composant ?? compos??s photovolta??ques (tels que le sulfure de cuivre indium gallium s??l??nium ou de Cu (In, Ga) (Se, S) 2) pour une utilisation dans les panneaux solaires comme une alternative rentable ?? silicium cristallin.
Galinstan et d'autres alliages
Gallium facilement alliages avec la plupart des m??taux, et a ??t?? utilis?? en tant que composant alliages bas point de fusion. A pr??s alliage eutectique de gallium, d'indium et d'??tain est un liquide ?? temp??rature ambiante qui est disponible dans les thermom??tres m??dicaux. Cet alliage, avec le nom commercial Galinstan (avec le "-stan", se r??f??rant ?? l'??tain), a un bas point de cong??lation de -19 ?? C (-2,2 ?? C). Il a ??t?? sugg??r?? que cette famille d'alliages pourrait ??galement ??tre utilis??e pour refroidir les puces d'ordinateur ?? la place de l'eau. alliages de gallium ont ??t?? ??valu??s de remplacer le mercure amalgames dentaires, mais ces mat??riaux ne ont pas encore de voir une large acceptation.
Parce que le gallium mouille verre ou la porcelaine, le gallium peut ??tre utilis?? pour cr??er brillant miroirs. Lorsque l'action de mouillage de gallium-alliages ne est pas souhait??e (comme dans Galinstan Les thermom??tres en verre), le verre doit ??tre prot??g?? par une couche transparente de gallium (III) oxyde.
Le plutonium utilis?? dans fosses d'armes nucl??aires est usin??e par alliage de gallium pour stabiliser son la phase δ.
Le gallium ajout?? en quantit??s jusqu'?? 2% en commun soudures peuvent aider caract??ristiques de mouillage et d'??coulement.
Les alliages de Al et Ga ont ??t?? ??valu??s pour la production d'hydrog??ne.
Il est utilis?? comme ??l??ment d'alliage dans le alliage magn??tique ?? m??moire de forme Ni-Mn-Ga.
Applications biom??dicales
Bien que le gallium a aucun r??le connu en biologie, qu'il imite fer (III), l'ion gallium et se localise sur interagit avec de nombreux processus dans l'organisme dans lesquels le fer (III) est manipul??. Comme ces proc??d??s comprennent l'inflammation, qui est un marqueur de nombreux ??tats pathologiques, plusieurs sels de gallium sont utilis??s ou sont en d??veloppement, ?? la fois produits pharmaceutiques et radiopharmaceutiques en m??decine. Lorsque des ions gallium sont prises par erreur par des bact??ries telles que Pseudomonas, la capacit?? des bact??ries ?? respirer est entrav??e et de l'bact??ries meurent. Le m??canisme sous-jacente est que le fer est redox actif, ce qui permet le transfert d'??lectrons au cours de la respiration, mais gallium redox est inactif.
Nitrate de gallium (nom de marque Ganite) a ??t?? utilis?? comme un produit pharmaceutique par voie intraveineuse pour traiter hypercalc??mie associ??e ?? des tumeurs m??tastases aux os. Le gallium est pens?? pour interf??rer avec la fonction des ost??oclastes. Il peut ??tre efficace lorsque les autres traitements pour hypercalc??mie maligancy-associ?? ne sont pas.
- Gallium maltolate, absorbable par voie orale une forme de gallium (III) ion, est en essais cliniques et pr??cliniques en tant que traitement potentiel pour un certain nombre de types de cancer, les maladies infectieuses et les maladies inflammatoires.
Un complexe amine - ph??nol Ga (III) compos?? MR045 a ??t?? trouv?? pour ??tre s??lectivement toxique pour les parasites qui ont d??velopp?? une r??sistance ?? chloroquine, un m??dicament commun contre le paludisme . Tant le Ga (III) fait complexe et la chloroquine en inhibant la cristallisation de h??mozo??ne, un produit form?? d'??limination de la digestion de sang par les parasites.
Sels Radiogallium
Gallium-67 des sels tels que le gallium citrate de gallium et le nitrate sont utilis??s comme agents radiopharmaceutiques dans un m??decine nucl??aire proc??dure d'imagerie commun??ment appel??e scintigraphie au gallium. La forme ou le sel de gallium est sans importance. Pour ces applications, la isotope radioactif 67 Ga est utilis??. Le corps g??re Ga 3+ ?? bien des ??gards comme se il se agissait de fer, et par cons??quent il est li?? (et concentre) dans les zones d'inflammation, telles que l'infection, ainsi que les zones de division cellulaire rapide. Cela permet de tels sites ?? imager par des techniques d'analyse nucl??aires. Cette utilisation a ??t?? largement remplac??e par fluorod??soxyglucose (FDG) pour tomographie par ??mission de positons, "PET" scans de leucocytes marqu??s num??risation et l'indium-111. Cependant, la localisation de gallium dans le corps poss??de des propri??t??s qui le rendent unique dans certaines circonstances, de modalit??s concurrentes utilisant d'autres radio-isotopes.
Gallium-68, un ??metteur de positons avec une demi-vie de 68 min., Est maintenant utilis?? comme un radionucl??ide de diagnostic dans le PET-CT lorsqu'ils sont li??s ?? des pr??parations pharmaceutiques telles que DOTATOC, un analogue de la somatostatine utilis?? pour tumeurs neuroendocriniennes enqu??te, et DOTA-Tate, une plus r??cente, utilis?? pour neuroendocrine m??tastase et cancer neuroendocrine du poumon, tels que certains types de microcytoma. La pr??paration de Galium-68 comme produit pharmaceutique est chimique et le radionucl??ide est extrait par ??lution de germanium-68, un radio-isotope synth??tique de germanium , en gallium-68 g??n??rateurs.
D'autres utilisations
- Magn??sium gallate contenant des impuret??s (tels que Mn 2+), commence ?? ??tre utilis?? dans l'ultraviolet -activated poudre de phosphore.
- la d??tection des neutrinos. Peut-??tre la plus grande quantit?? de gallium pur jamais collect?? en un seul endroit est le t??lescope de neutrinos de gallium-Germanium utilis?? par le Exp??rience SAGE ?? l'Observatoire de neutrinos de Baksan en Russie. Ce d??tecteur contient de 55 ?? 57 tonnes de gallium liquide. Une autre exp??rience a ??t?? le D??tecteur de neutrinos GALLEX op??r?? au d??but des ann??es 1990 dans un tunnel de montagne italienne. Le d??tecteur contenait 12,2 tonnes de gallium-71 arros??. Neutrinos solaires caus?? quelques atomes de 71 Ga ?? devenir radioactifs 71 Ge , qui ont ??t?? d??tect??s. Le flux de neutrinos solaire d??duite est r??v??l?? avoir un d??ficit de 40% de la th??orie. Cela n'a pas ??t?? expliqu?? que de meilleurs d??tecteurs et des th??ories de neutrinos solaires ont ??t?? construites (voir SNO).
- Comme un Source d'ions ?? m??tal liquide pour un faisceau d'ions focalis??. Par exemple, un faisceau focalis??-gallium-ion a ??t?? utilis?? pour cr??er le plus petit livre du monde, Teeny Ted de Navet Ville.
- Dans une farce classique, les scientifiques fa??onner cuill??res de gallium et de servir le th?? aux clients peu m??fiants. Les cuill??res fondent dans le th?? chaud.
- Comme additif dans fart de glisse pour les skis, et d'autres mat??riaux de surface ?? faible friction. US 5069803, Sugimura, Kentaro; Shoji Hasimoto & Takayuki Ono, "Utilisation d'une composition de r??sine synth??tique contenant des particules de gallium dans le mat??riau de surface de glisse des skis et d'autres applications", publi?? 1995
Pr??cautions
L'ion Ga (III) de sels de gallium soluble a tendance ?? former de l'hydroxyde insoluble lorsqu'il est inject?? en grandes quantit??s, et chez les animaux de cette pr??cipitation a entra??n?? une toxicit?? r??nale. En doses plus faibles, le gallium soluble est bien tol??r??, et ne se accumule pas comme un poison.
Alors que le gallium m??tallique ne est pas consid??r?? comme toxique, les donn??es ne sont pas concluants. Certaines sources indiquent que cela peut causer dermatite d'une exposition prolong??e; d'autres tests ne ont pas provoqu?? une r??action positive. Comme la plupart des m??taux, le gallium finement divis??e perd son ??clat et le gallium poudre appara??t gris. Ainsi, lorsque le gallium est manipul?? ?? mains nues, la dispersion extr??mement fine de gouttelettes liquides de gallium, qui r??sulte de mouiller la peau avec le m??tal, peut appara??tre comme une tache grise de la peau.
