
Isotopes stables
Renseignements g??n??raux
Arrangeant une s??lection Wikipedia pour les ??coles dans le monde en d??veloppement sans internet ??tait une initiative de SOS Enfants. Visitez le site Web d'enfants SOS au http://www.soschildren.org/
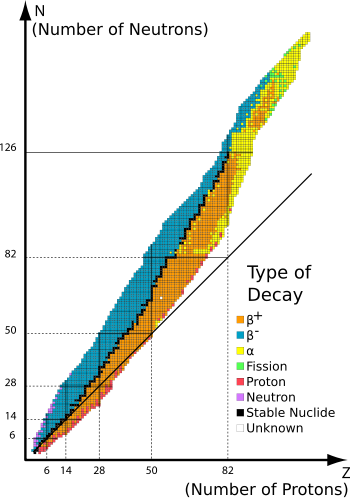
Les isotopes stables sont chimiques isotopes radioactifs qui ne sont pas - ce est, ils ne subissent pas spontan??ment d??sint??gration radioactive.
Seuls 90 nucl??ides des 40 premiers ??l??ments sont ??nerg??tiquement stables ?? tout type de d??sint??gration de sauvegarde la d??sint??gration du proton, en th??orie (voir liste des nucl??ides). Un montant suppl??mentaire de 164 sont th??oriquement instable pour les types connus de d??croissance, mais aucune preuve de la d??cadence n'a jamais ??t?? observ??, pour un total de 254 nucl??ides pour lesquels il ne existe aucune preuve de la radioactivit??. Selon cette d??finition, il ya 254 nucl??ides stables connus des ??l??ments 80 qui ont un ou plusieurs isotopes stables. Une liste de ces est donn??e ?? la fin de cet article.
Sur les 80 ??l??ments avec une ou des isotopes les plus stables, vingt-six ont un seul isotope stable, et sont donc appel??s monoisotopique, et le reste ont plus d'un isotope stable. Un ??l??ment ( ??tain ) a dix isotopes stables, le plus grand nombre connu d'un ??l??ment.
??tude des isotopes stables
Syst??mes d'isotopes stables couramment analys??es sont celles de l'oxyg??ne , carbone , azote , hydrog??ne et soufre . Ces syst??mes d'isotopes pour les ??l??ments plus l??gers qui pr??sentent plus d'un isotopes primordiale pour chaque ??l??ment, ont ??t?? mis en examen depuis de nombreuses ann??es afin d'??tudier les processus de fractionnement isotopique dans les syst??mes naturels. La longue histoire de l'??tude de ces ??l??ments est en partie parce que les proportions d'isotopes stables dans ces ??l??ments l??gers et volatils est relativement facile ?? mesurer. Cependant, les progr??s r??cents dans la spectrom??trie de masse (ce est ?? dire multiple collecteur plasma ?? couplage inductif spectrom??trie de masse) aujourd'hui permettent la mesure des rapports isotopiques en ??l??ments plus lourds stables, tels que le fer , le cuivre , le zinc , le molybd??ne , etc.
Les rapports isotopiques ont ??t?? utilis??es dans les enqu??tes biologiques botaniques et v??g??tales depuis de nombreuses ann??es, et des ??tudes de plus en plus ??cologiques et biologiques sont de trouver des isotopes stables (principalement du carbone, d'azote et d'oxyg??ne) ?? ??tre extr??mement utile. D'autres chercheurs ont utilis?? les rapports isotopiques de l'oxyg??ne pour reconstruire les temp??ratures atmosph??riques historiques, ce qui en fait des outils importants pour la recherche climatique. Les mesures des rapports de une origine naturelle des isotopes stables ?? une autre jouent un r??le important dans datation radiom??trique et g??ochimie isotopique, et ??galement utile pour d??terminer les mod??les de pr??cipitations et les mouvements d'??l??ments par les organismes vivants, en aidant ?? trier dynamique du r??seau trophique dans les ??cosyst??mes.
D??finition de la stabilit??, et la pr??sence isotopique naturelle
Survenant le plus naturellement nucl??ides sont stables (environ 254; voir liste ?? la fin de cet article); et environ 34 de plus (total de 288) sont connus radioactives avec suffisamment longues demi-vies (??galement connu) de se produire "primordialement." Si la demi-vie d'un nucl??ide est comparable, voire sup??rieure, ?? l'??ge de la Terre (4,5 milliards d'ann??es), une quantit?? importante aura surv??cu depuis le la formation du syst??me solaire, puis est dit primordiale. Il sera alors contribuer de cette fa??on ?? la composition isotopique naturelle d'un ??l??ment chimique. Primordialement radio-isotopes pr??sents sont facilement d??tect??s avec des demi-vies courtes que 700 millions d'ann??es (par exemple, 235 U), bien que certains isotopes primordiaux ont ??t?? d??tect??s avec des demi-vies aussi courtes que 80.000.000 ann??es (par exemple, 244 Pu). Cependant, ce est la limite actuelle de d??tection, en tant que nucl??ide avec la demi-vie plus courte de la prochaine ( niobium-92 avec demi-vie 34.700.000 ann??es) n'a pas encore ??t?? d??tect?? dans la nature.
Beaucoup de radio-isotopes naturels (un autre 51 ou plus, pour un total d'environ 339) pr??sentent encore plus courtes demi-vies de 80 millions d'ann??es, mais ils sont faits fra??chement, comme produits de filiation du processus de d??sint??gration de nucl??ides primordiaux (par exemple, le radium ?? partir de uranium) ou des r??actions ??nergiques en cours, tels que nucl??ides cosmog??niques produites par bombardement de la Terre pr??sente par les rayons cosmiques (par exemple, le carbone-14 fabriqu??s ?? partir de l'azote).
De nombreux isotopes qui sont class??s comme stable (ce est ?? dire pas de radioactivit?? a ??t?? observ??e pour eux) sont pr??vus d'avoir de tr??s longues demi-vies (parfois aussi ??lev??s que 10 18 ans ou plus). Si la demi-vie pr??vue tombe dans une gamme accessible exp??rimentalement, ces isotopes ont une chance de passer de la liste des nucl??ides stables ?? la cat??gorie radioactive, une fois leur activit?? est observ??e. De bons exemples sont le bismuth 209 et le tungst??ne-180 qui ??taient auparavant class??s comme stables, mais ont ??t?? r??cemment (2003) jug??e alpha-actif. Toutefois, ces nucl??ides ne changent pas leur statut primordiale quand ils se trouvent ??tre radioactifs.
La plupart des isotopes stables dans la terre sont soup??onn??s d'avoir ??t?? form?? dans les processus de nucl??osynth??se, soit dans le ?? Big Bang ??, ou dans les g??n??rations d'??toiles qui ont pr??c??d?? la formation du syst??me solaire. Cependant, certains isotopes stables montrent ??galement des variations d'abondance dans la terre ?? la suite de la d??sint??gration de nucl??ides radioactifs ?? vie longue. Ces d??sint??gration produits sont appel??s isotopes radiog??niques, afin de les distinguer de la groupe beaucoup plus important d'isotopes non radiog??niques ''.
Les domaines de recherche
La dite ??lot de stabilit?? peut r??v??ler un certain nombre d'atomes dur??e de vie longue ou m??me stables qui sont plus lourds (et avec plus de protons) que le plomb.
Les isotopes par ??l??ment
Parmi les ??l??ments chimiques connus, 80 les ??l??ments ont au moins un nucl??ide stable. Celles-ci comprennent les 82 premiers ??l??ments de l'hydrog??ne ?? conduire , avec le deux exceptions pr??s, le techn??tium (??l??ment 43) et le prom??thium (??l??ment 61), qui ne poss??de pas de nucl??ides stables. En D??cembre 2011, il y avait un total de 254 nucl??ides connus "stables". Dans cette d??finition, ??stable?? signifie un nucl??ide qui n'a jamais ??t?? observ?? ?? la pourriture dans le contexte naturel. Ainsi, ces ??l??ments ont des demi-vies trop long pour ??tre mesur??e par tout moyen, directs ou indirects.
Les isotopes stables:
- 1 ??l??ment ( ??tain ) a 10 isotopes stables
- 1 ??l??ment ( x??non ) comporte huit isotopes stables
- 4 ??l??ments ont chacun sept isotopes stables
- 8 ??l??ments ont chacun six isotopes stables
- 10 ??l??ments ont chacun cinq isotopes stables
- 9 ??l??ments ont chacun quatre isotopes stables
- 5 ??l??ments ont trois isotopes stables chacun
- 16 ??l??ments pr??sentent chacun deux isotopes stables
- 26 ??l??ments ont une seule isotope stable.
Ces derniers sont ainsi appel??s 26 monoisotopiques ??l??ments. Le nombre moyen d'isotopes stables pour les ??l??ments qui ont au moins un isotope stable est 254/80 = 3,2.
"Nombres magiques" et le nombre impair et pair proton et le neutron
Stabilit?? des isotopes est affect??e par le rapport entre les protons ?? des neutrons, et ??galement par la pr??sence de certains "nombres magiques" de neutrons ou de protons qui repr??sentent des coquilles ferm??es et remplies quantiques. Ces coquilles quantiques correspondent ?? un ensemble de niveaux d'??nergie ?? l'int??rieur de la mod??le enveloppe du noyau; coquilles remplies, telles que l'enveloppe remplie de 50 protons pour l'??tain, conf??re une stabilit?? inhabituelle sur le nucl??ide. Comme dans le cas de l'??tain, un nombre magique pour Z, le num??ro atomique, a tendance ?? augmenter le nombre d'isotopes stables de l'??l??ment.
Tout comme dans le cas des ??lectrons, qui ont l'??tat de plus basse ??nergie quand ils se produisent par paires dans un donn??es orbitales, nucl??ons (deux protons et neutrons) pr??sentent un ??tat d'??nergie plus faible lorsque leur nombre est m??me, plut??t que bizarre. Cette stabilit?? tend ?? emp??cher la d??sint??gration b??ta (en deux ??tapes) de nombreux nucl??ides m??me-m??me dans un autre, m??me-m??me nucl??ide du m??me nombre de masse, mais plus faible ??nergie (et bien s??r avec deux autres protons et deux neutrons) moins, parce d??croissance proc??dure une ??tape ?? la fois aurait ?? passer par un nucl??ide impair impair de plus haute ??nergie. Cela permet ?? un plus grand nombre de nucl??ides stables m??me-m??me, jusqu'?? trois pour certains nombres de masse, et jusqu'?? sept pour certains (protons) num??ros atomiques. Inversement, parmi les 254 nucl??ides stables connus, seulement cinq ont ?? la fois un nombre impair de protons et de nombre impair de neutrons: hydrog??ne-2 ( deuterium), lithium-6, bore-10, l'azote-14, et tantale 180m. En outre, seulement quatre d'origine naturelle, nucl??ides radioactifs impair impairs ont une demi-vie plus d'un milliard d'ann??es: potassium-40, vanadium-50, lanthane-138, et lut??tium-176. Odd-odd nucl??ides primordiaux sont rares car les noyaux les plus impair impairs sont tr??s instables par rapport ?? d??sint??gration b??ta, parce que les produits de d??sint??gration sont encore-m??me, et sont donc plus fortement li??s, en raison de effets d'appariement nucl??aires.
Pourtant, un autre effet de l'instabilit?? d'un nombre impair de chaque type de nucl??ons, est que les ??l??ments impaires ont tendance ?? avoir moins d'isotopes stables. Sur les 26 monoisotopiques ??l??ments qui ne ont qu'un seul isotope stable, tous sauf un ont un num??ro atomique impair - la seule exception ?? la fois aux r??gles ??tant b??ryllium. Tous ces ??l??ments ont ??galement un nombre pair de neutrons, ?? la seule exception ??tant nouveau b??ryllium.
Isom??res nucl??aires, y compris une une "stable"
Le nombre de 254 nucl??ides stables connus comprend tantale 180m, car m??me si son d??clin et l'instabilit?? est automatiquement impliqu??s par sa notation de ??m??tastable??, encore cela n'a pas encore ??t?? observ??. Tous les isotopes "stables" (stables par l'observation, pas la th??orie) sont les ??tats fondamentaux des noyaux, ?? l'exception de tantale 180m, qui est un isom??re nucl??aire ou ??tat excit?? (l'??tat de ce noyau de terre est radioactif avec une demi-vie tr??s courte de 8 heures); mais la d??sint??gration de l'isom??re nucl??aire excit?? est tr??s strictement interdit par les r??gles de s??lection spin-parit??. Il a ??t?? rapport?? exp??rimentalement par l'observation directe que la demi-vie de 180m ?? Ta d??sint??gration gamma doit ??tre plus de 10 de 15 ans. Autres modes possibles de 180m Ta d??sint??gration (d??sint??gration b??ta, capture d'??lectrons et de la d??sint??gration alpha) ont ??galement jamais ??t?? observ??.
D??croissance encore inaper??u

Il est pr??vu que certains l'am??lioration continue de la sensibilit?? exp??rimentale permettra d??couverte de la radioactivit?? tr??s doux (instabilit??) de certains isotopes qui sont consid??r??s ??tre stable aujourd'hui. Pour un exemple d'une d??couverte r??cente, ce ne est qu'en 2003 que le bismuth-209 (le seul isotope naturelle de bismuth) se est r??v??l?? ??tre tr??s faiblement radioactif. Cependant, il y avait aussi les pr??dictions th??oriques de la physique nucl??aire que le bismuth-209 se d??sint??grerait tr??s lentement par ??mission alpha. Ces calculs ont ??t?? confirm??es par les observations exp??rimentales en 2003.
Beaucoup de nucl??ides "stables" sont " dans la mesure o?? m??tastable ??comme ils lib??rent de l'??nergie si une d??sint??gration radioactive devait se produire, et sont, en fait, devraient subir des sortes de tr??s rares d??sint??gration radioactive, y compris double-??mission b??ta.
Quatre-vingt dix nucl??ides des 40 ??l??ments avec des num??ros atomiques de l'un ( l'hydrog??ne ) ?? travers 40 sont th??oriquement stable pour tout type de d??sint??gration nucl??aire, sauf la possibilit?? th??orique de la d??sint??gration du proton - qui n'a jamais ??t?? observ?? en d??pit des recherches approfondies pour elle.
Les nucl??ides ?? partir avec l' isotope niobium-93 et se ??tendant ?? l'ensemble sup??rieur num??ros de masse atomique, pourrait th??oriquement l'exp??rience fission spontan??e.
Pour les processus autres que la fission spontan??e, d'autres voies de d??sint??gration th??oriques pour des ??l??ments plus lourds comprennent:
- d??sint??gration alpha - 70 lourde (les deux nucl??ides sont le plus l??ger c??rium et -142 n??odyme -143)
- la double d??sint??gration b??ta (y compris ??lectron-positron conversion, et double d??sint??gration de positons) - 55 nucl??ides
- d??sint??gration b??ta - tantale -180m
- capture d'??lectrons - tellure -123, le tantale-180m
- Double capture ??lectronique
- transition isom??rique - tantale 180m
- carie cluster et fission spontan??e - les 56 nucl??ides lourds (de niobium ?? -93 dysprosium -164)
Ils comprennent tous les nucl??ides de masse 165 et plus. Argon-36 est actuellement le nucl??ide le plus l??ger connu "stable" qui est th??oriquement instable.
La positivit?? de lib??ration d'??nergie dans ces processus signifie qu'ils sont autoris??s cin??matique (ils ne violent pas la conservation de l'??nergie) et, donc, en principe, peut se produire. Ils ne sont pas respect??es en raison de la suppression forte mais non absolue, par des r??gles de s??lection spin-parit?? (pour la b??ta se d??sint??gre et les transitions isom??res) ou par l'??paisseur de la barri??re de potentiel (pour les d??sint??grations alpha et grappes et la fission spontan??e).
Tableau r??capitulatif pour les num??ros de chaque cat??gorie de nucl??ides
Ce est un tableau sommaire du Liste des nucl??ides. Notez que les num??ros ne sont pas exactes, et peuvent changer l??g??rement dans l'avenir, comme nucl??ides sont observ??es pour ??tre radioactifs, ou de nouveaux demi-vies sont d??termin??s ?? une certaine pr??cision. Notez que seul le 254 ont une revendication de la stabilit??, mais que seuls 90 nucl??ides des 40 premiers ??l??ments sont th??oriquement stable pour tout processus, mais la d??sint??gration du proton.
| Type de nucl??ide par classe de stabilit??. | Nombre de nucl??ides en classe (nombre exact peut changer). | Courir total de nucl??ides dans toutes les classes ?? ce point. | Remarques sur l'ex??cution totale. |
|---|---|---|---|
| Th??oriquement stable ?? tous, mais la d??sint??gration du proton. | 90 | 90 | Comprend 40 premiers ??l??ments. La d??sint??gration du proton encore ??tre observ??. |
| ??nerg??tiquement instable pour un ou plusieurs modes de d??sint??gration plus connus, mais pas encore vu la pourriture. Consid??r?? comme stable jusqu'?? la radioactivit?? confirm??. | 164 | 254 | Fission spontan??e possible pour nucl??ides ??stables??> niobium-93. D'autres m??canismes possibles pour nucl??ides lourds. Total est classiquement les nucl??ides stables |
| Radioactif nucl??ides primordiaux. | 34 | 288 | Total des primordiaux comprennent Bi, U, Th, Pu, ainsi que tous les nucl??ides stables. |
| Nonprimordial radioactifs, mais qui est pr??sente naturellement sur Terre. | ~ 51 | ~ 339 | Nucl??ides cosmog??niques de rayons cosmiques; filles de originels radioactifs tels que le francium , etc. |
Liste des isotopes stables observationnellement-
Dans la liste ci-dessous, 90 nucl??ides ont pas pr??dit le mode ??nerg??tiquement possible de d??croissance, sauf la d??sint??gration du proton. Ce sont banalis??e.
Autres pr??dit (mais pas encore observ??) modes de d??sint??gration radioactive sont not??s comme: A pour la d??sint??gration alpha, B pour la d??sint??gration b??ta, BB pour la double d??sint??gration b??ta, E pour la capture d'??lectrons, EE pour double capture d'??lectrons, et l'informatique pour la transition isom??rique. En raison de la courbe d'??nergie de liaison, tous les nucl??ides de Z = 41 (niobium) et au-del??, sont th??oriquement instable en ce qui concerne ?? la fission spontan??e SF (voir liste des nucl??ides pour les d??tails), et la plupart des nucl??ides lourds sont th??oriquement instable ?? d'autres processus ainsi.
- Hydrog??ne-1
- Hydrogen-2
- H??lium-3
- H??lium-4
- Lithium-6
- Lithium-7
- B??ryllium 9
- Bore-10
- Le bore-11
- Carbone-12
- Carbon-13
- L'azote-14
- L'azote-15
- Oxyg??ne-16
- Oxyg??ne 17
- Oxyg??ne-18
- Le fluor-19
- Neon-20
- Neon-21
- Neon-22
- Sodium-23
- Magn??sium-24
- Magn??sium-25
- Magn??sium-26
- Aluminium-27
- Silicon-28
- Silicon-29
- Silicon-30
- Phosphorus-31
- Sulfur-32
- Sulfur-33
- Sulfur-34
- Sulfur-36
- Chlore-35
- Chlore-37
- Argon-36 (EE)
- Argon-38
- Argon-40
- Potassium-39
- Potassium-41
- Calcium-40 (EE)
- Calcium-42
- Calcium-43
- Calcium-44
- Calcium-46 (BB)
- Scandium-45
- Titane-46
- Titane-47
- Titane-48
- Titane-49
- Titane-50
- Vanadium-51
- Chrome-50 (EE)
- 52 chrome
- 53 chrome
- 54 chrome
- Mangan??se-55
- Fer-54 (EE)
- Fer 56
- Fer-57
- Fer-58
- Cobalt-59
- Nickel-58 (EE)
- Nickel-60
- Nickel-61
- Nickel-62
- Nickel-64
- Cuivre-63
- Cuivre-65
- Zinc-64 (EE)
- Zinc-66
- Zinc-67
- Zinc-68
- Zinc-70 (BB)
- Gallium-69
- Gallium-71
- Germanium-70
- Germanium-72
- Germanium-73
- Germanium-74
- Arsenic-75
- Selenium-74 (EE)
- Le s??l??nium-76
- Le s??l??nium-77
- Le s??l??nium-78
- Le s??l??nium-80 (BB)
- Le brome-79
- Le brome-81
- Krypton-78 (EE)
- Krypton-80
- Krypton-82
- Krypton-83
- Krypton-84
- Krypton-86 (BB)
- Rubidium-85
- Strontium-84 (EE)
- Strontium-86
- Strontium-87
- Strontium-88
- L'yttrium-89
- Zirconium-90
- Zirconium-91
- Zirconium-92
- Zirconium-94 (BB)
- Niobium-93 (SF)
- Molybd??ne-92 (EE)
- Molybd??ne-94 (SF)
- Molybd??ne-95 (SF)
- Molybd??ne-96 (SF)
- Molybd??ne-97 (SF)
- Molybd??ne-98 (BB)
- Techn??tium - Aucun isotopes stables
- Ruth??nium 96 (EE)
- Ruth??nium-98 (SF)
- Ruth??nium-99 (SF)
- Ruth??nium 100 (SF)
- Ruth??nium 101 (SF)
- Ruth??nium 102 (SF)
- Ruth??nium 104 (BB)
- Rhodium-103 (SF)
- Palladium-102 (EE)
- Le palladium-104 (SF)
- Le palladium-105 (SF)
- Palladium-106 (SF)
- Le palladium-108 (SF)
- Le palladium-110 (BB)
- Silver-107 (SF)
- Silver-109 (SF)
- Cadmium-106 (EE)
- Cadmium-108 (EE)
- Le cadmium-110 (SF)
- Le cadmium-111 (SF)
- Le cadmium-112 (SF)
- Le cadmium-114 (BB)
- Indium-113 (SF)
- Tin-112 (EE)
- Tin-114 (SF)
- Tin-115 (SF)
- Tin-116 (SF)
- Tin-117 (SF)
- Tin-118 (SF)
- Tin-119 (SF)
- Tin-120 (SF)
- Tin-122 (BB)
- Tin-124 (BB)
- Antimoine-121 (SF)
- Antimoine-123 (SF)
- Tellure-120 (EE)
- Le tellure-122 (SF)
- Tellure-123 (E)
- Le tellure-124 (SF)
- Le tellure-125 (SF)
- Le tellure-126 (SF)
- L'iode-127 (SF)
- X??non-124 (EE)
- X??non-126 (EE)
- X??non-128 (SF)
- X??non-129 (SF)
- X??non-130 (SF)
- X??non-131 (SF)
- X??non-132 (SF)
- X??non-134 (BB)
- Le c??sium-133 (SF)
- Baryum-132 (EE)
- Baryum-134 (SF)
- Baryum-135 (SF)
- Baryum-136 (SF)
- Baryum-137 (SF)
- Baryum-138 (SF)
- Lanthane-139 (SF)
- C??rium-136 (EE)
- C??rium-138 (EE)
- C??rium-140 (SF)
- C??rium-142 (A, BB)
- Pras??odyme-141 (SF)
- N??odyme-142 (SF)
- N??odyme-143 (A)
- N??odyme-145 (A)
- N??odyme-146 (A, BB)
- N??odyme-148 (A, BB)
- Promethium - Aucun isotopes stables
- Samarium-144 (EE)
- Samarium-149 (A)
- Samarium-150 (A)
- Samarium-152 (A)
- Samarium-154 (BB)
- Europium-153 (A)
- Gadolinium-154 (A)
- Gadolinium-155 (A)
- Gadolinium-156 (SF)
- Gadolinium-157 (SF)
- Gadolinium-158 (SF)
- Gadolinium-160 (BB)
- Terbium-159 (SF)
- Dysprosium-156 (A, EE)
- Dysprosium-158 (A, EE)
- Dysprosium-160 (A)
- Dysprosium-161 (A)
- Dysprosium-162 (A)
- Dysprosium-163 (SF)
- Dysprosium-164 (SF)
- Holmium-165 (A)
- Erbium-162 (A, EE)
- Erbium-164 (A, EE)
- Erbium-166 (A)
- Erbium-167 (A)
- Erbium-168 (A)
- Erbium-170 (A, BB)
- Thulium-169 (A)
- Ytterbium 168 (A, EE)
- Ytterbium-170 (A)
- Ytterbium-171 (A)
- Ytterbium-172 (A)
- Ytterbium 173 (A)
- Ytterbium-174 (A)
- Ytterbium 176 (A, BB)
- Lut??cium-175 (A)
- Le hafnium-176 (A)
- Le hafnium-177 (A)
- Hafnium-178 (A)
- Hafnium-179 (A)
- Hafnium-180 (A)
- Tantale-180m (A, B, E, IT) *
- Tantale-181 (A)
- Tungst??ne-182 (A)
- Tungst??ne-183 (A)
- Tungst??ne-184 (A)
- Tungst??ne-186 (A, BB)
- Rh??nium-185 (A)
- Osmium-184 (A, EE)
- Osmium-187 (A)
- Osmium-188 (A)
- Osmium-189 (A)
- Osmium-190 (A)
- Osmium-192 (A, BB)
- Iridium-191 (A)
- Iridium-193 (A)
- Platinum-192 (A)
- Platinum-194 (A)
- Platinum-195 (A)
- Platinum-196 (A)
- Platinum-198 (A, BB)
- Or 197 (A)
- Mercury-196 (A, EE)
- Mercury-198 (A)
- Mercury-199 (A)
- Mercury-200 (A)
- Mercury-201 (A)
- Mercury-202 (A)
- Mercury-204 (A, BB)
- Thallium-203 (A)
- Thallium-205 (A)
- Plomb-204 (A)
- Plomb-206 (A)
- Plomb-207 (A)
- Plomb-208 (A)
Abr??viations:
A pour la d??sint??gration alpha, B pour la d??sint??gration b??ta, BB pour la double d??sint??gration b??ta, E pour la capture d'??lectrons, EE pour la capture d'??lectrons double, IT pour la transition isom??rique.
* Tantale-180m est un "isotope m??tastable" ce qui signifie que ce est un heureux isom??re nucl??aire de Ta-180. Voir isotopes de tantale. Cependant, la demi-vie de cette isom??re nucl??aire est si longue qu'il n'a jamais ??t?? observ?? ?? la pourriture, et il se produit donc comme un "observationnellement non radioactif" nucl??ide primordial, comme un isotope mineure de tantale. Ce est le seul cas d'un isom??re nucl??aire qui a une demi-vie si longtemps qu'il n'a jamais ??t?? observ?? ?? la pourriture. Il est donc inclus dans cette liste.
