
N??odyme
?? propos de ce ??coles s??lection Wikipedia
SOS Enfants produite ce site pour les ??coles ainsi que ce site de vid??o sur l'Afrique . Le parrainage d'enfants aide les enfants un par un http://www.sponsor-a-child.org.uk/ .
| N??odyme | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
60 Nd | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||
blanc argent??  | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s g??n??rales | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | le n??odyme, Nd, 60 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / ˌ n Je . ɵ r?? ɪ m Je ə m / NEE -O- DIM -ee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ??l??ment Cat??gorie | lanthanides | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, p??riode, bloc | n / a, 6, fa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 144.242 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration ??lectronique | [ Xe ] 4f 4 6s 2 2, 8, 18, 22, 8, 2 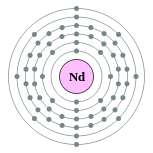 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| D??couverte | Carl Auer von Welsbach (1885) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Densit?? (?? proximit?? rt) | 7,01 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densit?? au mp | 6,89 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1297 K , 1024 ?? C, 1875 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'??bullition | 3347 K, 3074 ?? C, 5565 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 7,14 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 289 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacit?? thermique molaire | 27,45 J ?? mol -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propri??t??s atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ??tats d'oxydation | 3, 2, 1 (L??g??rement oxyde de base) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ??lectron??gativit?? | 1,14 (??chelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ??nergies d'ionisation | 1er: 533,1 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 2??me: 1040 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3??me: 2130 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 181 h | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 201 ?? 18 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellan??es | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonal  | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magn??tique | paramagn??tique, antiferromagn??tique en dessous de 20 K | |||||||||||||||||||||||||||||||||||||||||||||||||||
| R??sistivit?? ??lectrique | ( rt) (α, poly) 643 nΩ ?? m | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivit?? thermique | 16,5 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (α, poly) 9,6 um / (m ?? K) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ?? C) 2,330 m ?? s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | (Formulaire de α) 41,4 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | (Formulaire de α) 16,3 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | (Formulaire de α) 31,8 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | (Formulaire de α) 0,281 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Vickers | 343 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Duret?? Brinell | 265 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Num??ro de registre CAS | 7440-00-8 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article d??taill??: Isotopes de n??odyme | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Le n??odyme est un ??l??ment chimique avec le symbole Nd et de num??ro atomique 60. Ce est un m??tal argent?? doux ternit dans l'air. N??odyme a ??t?? d??couvert en 1885 par l'Autrichien chimiste Carl Auer von Welsbach. Il est pr??sent en quantit??s importantes dans les min??raux de minerai monazite et bastn??site. N??odyme ne est pas trouv?? naturellement sous forme m??tallique ou non m??lang??s avec d'autres lanthanides , et il est g??n??ralement raffin?? pour un usage g??n??ral. Bien que le n??odyme est consid??r?? comme un " terres rares ", ce est un ??l??ment assez commun, pas plus rare que le cobalt , le nickel et le cuivre du minerai, et est largement distribu?? dans de la Terre la cro??te . La plupart des n??odyme du monde est extrait en Chine.
compos??s de n??odyme ont d'abord ??t?? utilis??s comme colorants dans le commerce de verre en 1927, et ils restent un additif populaire dans des verres. La couleur de compos??s-Du?? n??odyme ?? Nd 3+ ions est souvent un violet rouge??tre, mais elle change avec le type d'??clairage, en raison des effets fluorescents. Certains verres dop??s au n??odyme sont aussi utilis??s dans les lasers qui ??mettent lumi??re infrarouge avec longueurs d'onde entre 1047 et 1062 nanom??tres. Ceux-ci ont ??t?? utilis??s dans des applications de puissance extr??mement ??lev??e, comme dans les exp??riences fusion par confinement inertiel.
Le n??odyme est ??galement utilis?? avec divers autres cristaux de substrats, tels que grenat d'yttrium aluminium dans le Nd: YAG. Ce laser ??met habituellement ondes infrarouges ?? une longueur d'onde d'environ 1064 nanom??tres. Le laser Nd: YAG est l'un des plus couramment utilis??s lasers ?? l'??tat solide.
Une autre utilisation chef de n??odyme est aussi l'??l??ment pur libre. Il est utilis?? comme composant dans les alliages utilis??s pour fabriquer ?? haute r??sistance - aimants en n??odyme puissants aimants permanents. Ces aimants sont largement utilis??s dans des produits tels que des microphones, des haut-parleurs professionnels, ??couteurs intra-auriculaires, et les disques durs d'ordinateur, lorsque faible masse de l'aimant ou le volume, ou des champs magn??tiques puissants sont n??cessaires. Grandes aimants en n??odyme sont utilis??s en haute puissance en fonction du poids des moteurs ??lectriques (par exemple en les voitures hybrides) et les g??n??rateurs (par exemple avions et ??olienne g??n??rateurs ??lectriques).
Caract??ristiques
Propri??t??s physiques
N??odyme, un terre rare m??tal , ??tait pr??sent dans le classique mischmetal ?? une concentration d'environ 18%. N??odyme m??tallique a un ??clat m??tallique brillant, argent??, mais comme l'un des plus r??actif lanthanides m??taux des terres rares, il se oxyde rapidement dans l'air ordinaire. La couche d'oxyde qui forme p??le puis se ??teint, ce qui l'expose le m??tal ?? l'oxydation. Ainsi, un ??chantillon d'un centim??tre de n??odyme oxyde compl??tement dans un an.
N??odyme existe couramment dans deux allotropiques formes, avec une transformation d'une double hexagonale ?? un corps-centr?? structure cubique qui aura lieu ?? environ 863 ?? C.
Propri??t??s chimiques
N??odyme m??tal ternit lentement ?? l'air et il br??le facilement ?? environ 150 ?? C pour former le n??odyme (III) de l'oxyde:
- 4 Nd + 3 O 2 → 2 Nd 2 O 3
Le n??odyme est un ??l??ment tr??s ??lectropositif, et il r??agit lentement avec de l'eau froide, mais assez rapidement avec de l'eau chaude pour former le n??odyme (III) hydroxyde:
- 2 Nd (s) + 6 H 2 O (l) → 2 Nd (OH) 3 (aq) + 3 H 2 (g)
N??odyme m??tal r??agit avec enthousiasme avec tous les halog??nes :
- Nd 2 (s) + 3 F 2 (g) → 2 NdF 3 (s) [une substance violet]
- 2 Nd (s) + 3 Cl 2 (g) → 2 NdCl3 (s) [une substance mauve]
- 2 Nd (s) + 3 Br 2 (g) → 2 NdBr 3 (s) [une substance violette]
- 2 Nd (s) + 3 I 2 (g) → 2 3 NDI (s) [une substance verte]
N??odyme dilu?? dissout facilement dans l'acide sulfurique pour former des solutions qui contiennent le lilas Nd (III) ion. Ceux-ci existent en tant que [Nd (OH 2) 9] 3+ complexes:
- 2 Nd (s) + 3 H 2 SO 4 (aq) → 2 Nd 3+ (aq) + 3 SO 2-
4 (aq) + 3 H 2 (g)
Compos??s
Compos??s comprennent n??odyme
- halog??nures: n??odyme (III) fluorure - NDF 3; n??odyme (III) chlorure - NdCl3; le n??odyme (III) de bromure - NdBr 3; n??odyme (III) d'iodure - Ndi 3
- oxydes: le n??odyme (III) de l'oxyde - Nd 2 O 3
- sulfures: n??odyme (II) de sulfure - NDS, le n??odyme (III) de sulfure - Nd 2 S 3
- nitrures: n??odyme (III) nitrure - NdN
- hydroxyde: le n??odyme (III) hydroxyde - Nd (OH) 3
- phosphure: n??odyme phosphure - NdP
- carbure: n??odyme (III) carbure - Nd 4 C 3
- nitrate: n??odyme (III) nitrate - Nd (NO 3) 3
- sulfate: le n??odyme (III) sulfate de sodium - Nd 2 (SO 4) 3
 N??odyme (III) -sulfate
N??odyme (III) -sulfate
Certains compos??s de n??odyme ont des couleurs qui varient en fonction du type d'??clairage.

Compos??s en n??odyme la lumi??re de tube fluorescent - de gauche ?? droite, le sulfate, nitrate, et le chlorure

Compos??s en n??odyme La lumi??re de la LCF

Compos??s de n??odyme dans la lumi??re du jour
Isotopes
Naturellement n??odyme se produise est un m??lange de cinq stables isotopes , 142 e, 143 Nd, 145 Nd, 146 e et 148 Nd, avec 142 Nd ??tant plus abondante (27,2% de la la abondance naturelle), et deux radio-isotopes, 144 e et 150 Nd. En tout, 31 radio-isotopes de n??odyme ont ??t?? d??tect??s ?? partir de 2010, avec les radio-isotopes les plus stables ??tant ceux d'origine naturelle: 144 Nd ( d??sint??gration alpha avec une demi-vie (T ??) de 2,29 ?? 10 15 ann??es) et 150 Nd ( la double d??sint??gration b??ta, T ?? = 7 ?? 10 de 18 ans, environ). Tout le reste isotopes radioactifs ont des demi-vies plus courtes que onze jours, et la majorit?? d'entre eux ont des demi-vies plus courtes que 70 secondes. Le n??odyme a ??galement 13 connue ??tats m??ta, avec le plus stable ??tant 139 m Nd (T ?? = 5,5 heures), 135 m Nd (T ?? = 5,5 minutes) et 133 m (1 Nd T ?? ~ 70 secondes).
Le primaire modes de d??sint??gration avant l'isotope stable le plus abondant, 142 Nd, sont capture d'??lectrons et la d??sint??gration de positons, et le mode primaire apr??s est- d??sint??gration b??ta moins. Le primaire produits de d??sint??gration avant 142 Nd sont des ??l??ments Pr ( pras??odyme ) isotopes et les produits primaires apr??s sont ??l??ment Pm ( Promethium ) isotopes.
Histoire
N??odyme a ??t?? d??couvert par le Baron Carl Auer von Welsbach, un Autrichien chimiste, ?? Vienne en 1885. Il a s??par?? le n??odyme, ainsi que l'??l??ment de pras??odyme , ?? partir d'un mat??riau connu sous le nom didyme au moyen d'une cristallisation fractionn??e des doubles t??trahydrates de nitrate d'ammonium de l'acide nitrique, tout en suivant la s??paration par spectroscopie d'analyse; cependant, il n'a pas ??t?? isol?? sous forme relativement pure jusqu'en 1925. Le nom n??odyme est d??riv?? des mots grecs (Neos de νέος), de nouvelles, et didymos (διδύμος), twin.
Double cristallisation de nitrate ??tait le moyen de purification de n??odyme commerciale jusqu'?? ce que les ann??es 1950. Chemical Division Lindsay a ??t?? le premier ?? commercialiser ?? grande ??chelle de purification par ??change d'ions de n??odyme. ?? partir des ann??es 1950, de haute puret?? (sup??rieure ?? 99%) a ??t?? principalement n??odyme obtenu par un processus ?? partir de l'??change d'ions monazite, un minerai riche en ??l??ments des terres rares. Le m??tal lui-m??me est obtenu par ??lectrolyse de son halog??nures sels. Actuellement, la plupart n??odyme est extrait de bastn??site, (Ce, La, Nd, Pr) CO 3 F, et purifi?? par extraction au solvant. Ion-purification par ??change est r??serv?? pour la pr??paration des plus hautes puret??s (typiquement> 99,99%). L'??volution de la technologie, l'am??lioration de la puret?? et disponible dans le commerce de l'oxyde de n??odyme, a ??t?? pris en compte dans l'apparition de verre au n??odyme qui r??side dans une collection aujourd'hui. Lunettes de n??odyme d??but faites dans les ann??es 1930 ont une teinte rouge??tre ou plus orange que les versions modernes qui sont plus proprement pourpre, en raison des difficult??s ?? ??liminer les derni??res traces de pras??odyme ?? l'??poque o?? la technologie de cristallisation fractionn??e devait ??tre invoqu??s.
Pr??sence et la production

N??odyme est jamais trouv?? dans la nature comme l'??l??ment libre, mais elle se produit dans des minerais tels que monazite et bastn??site, qui contiennent de petites quantit??s de tous les m??taux de terres rares. Les principales zones mini??res sont en Chine, aux ??tats-Unis, le Br??sil , l'Inde, le Sri Lanka , et en Australie. Les r??serves de n??odyme sont estim??es ?? environ huit millions de tonnes. Bien qu'appartenant ?? la m??taux de terres rares, le n??odyme ne est pas rare du tout. Son abondance dans la terre que la cro??te soit environ 38 mg / kg, ce qui est le deuxi??me plus ??lev?? parmi les ??l??ments des terres rares, ?? la suite de c??rium . La production du monde de n??odyme ??tait d'environ 7000 tonnes en 2004. La majeure partie de la production actuelle est de la Chine, dont le gouvernement a r??cemment impos?? le contr??le des mati??res strat??giques sur l'??l??ment, qui soul??ve des inqui??tudes dans les pays consommateurs et causant la flamb??e des prix de n??odyme et d'autres m??taux des terres rares. ?? la fin de 2011, 99 pour cent pur n??odyme a ??t?? ??chang?? sur les march??s mondiaux pour 300 $ US ?? 350 $ par kg, en baisse par rapport au pic de mi-2011 de 500 $ / kg.
Le n??odyme est g??n??ralement de 10% ?? 18% de la teneur en terre rare de d??p??ts commerciaux de la lumi??re rares min??raux d'??l??ments de terres bastnasite et monazite. Avec des compos??s de n??odyme ??tant le plus fortement color??s pour les lanthanides trivalents, ce pourcentage de n??odyme peut parfois dominer la coloration des min??raux-lors de terres rares chromophores concurrentes sont absentes. Il donne habituellement une coloration rose. Des exemples remarquables de cette comprennent cristaux monazite des ??tain d??p??ts dans Llallagua, la Bolivie , ancylite du Mont Saint-Hilaire, Qu??bec, ou lanthanite de la Saucon Valley, Pennsylvanie. Comme dans le cas des lunettes de n??odyme, de tels min??raux ?? changer leurs couleurs dans les conditions d'??clairage diff??rentes. Les bandes d'absorption de n??odyme interagissent avec le visible spectre d'??mission de vapeur de mercure, avec le non filtr??e ondes courtes de la lumi??re UV provoque des min??raux contenant n??odyme pour refl??ter une couleur verte. Ceci peut ??tre observ?? avec des sables contenant monazite-ou minerai contenant bastnasite.
Applications
- N??odyme a une exceptionnellement grande sp??cifique la capacit?? thermique ?? des temp??ratures de l'h??lium liquide, de sorte que est utile dans cryor??frig??rateurs
- Probablement en raison de similitudes avec Ca 2+, Nd 3+ a ??t?? rapport?? pour favoriser la croissance des plantes. Compos??s d'??l??ments de terres rares sont fr??quemment utilis??s en Chine comme engrais .
- Samarium-n??odyme datation est utile pour d??terminer les relations de l'??ge de roches et de m??t??orites.
- Taille et la force de l'??ruption volcanique peuvent ??tre pr??dits par balayage pour n??odyme isotopes . Petites et grandes ??ruptions volcaniques produisent lave avec une composition isotopique diff??rente n??odyme. De la composition des isotopes, les scientifiques pr??disent la taille de l'??ruption ?? venir sera, et utilisent cette information pour avertir les r??sidents de l'intensit?? de l'??ruption.
Aimants

aimants en n??odyme (en fait un alliage, Nd 2 Fe 14 B) sont les plus forts permanents aimants connus. Un aimant n??odyme de quelques grammes peut soulever mille fois son propre poids. Ces aimants sont moins chers, plus l??gers et plus forte que aimants samarium-cobalt. Cependant, ils ne sont pas sup??rieurs dans tous les aspects, comme des aimants ?? base de n??odyme perdent leur magn??tisme ?? des temp??ratures ??lev??es et ont tendance ?? la rouille, tout en samarium-cobalt aimants ne le font pas.
Aimants en n??odyme apparaissent dans des produits tels que microphones, professionnel haut-parleurs, in-ear ??couteurs, guitare et guitare basse pick-up et l'ordinateur disques durs o?? une faible masse, petit volume, ou des champs magn??tiques puissants sont n??cessaires. aimant de n??odyme moteurs ??lectriques ont ??galement ??t?? responsable du d??veloppement des avions de mod??le purement ??lectrique dans la premi??re d??cennie du 21??me si??cle, au point que ceux-ci sont d??placent mod??les combustion interne aliment??s ?? l'??chelle internationale. De m??me, en raison de cette capacit?? magn??tique ??lev??e par poids, le n??odyme est utilis?? dans les moteurs ??lectriques des voitures hybrides et ??lectriques, et dans les g??n??rateurs d'??lectricit?? de certains mod??les d'??oliennes commerciales (seulement ??oliennes avec "aimants permanents" g??n??rateurs utiliser n??odyme). Par exemple, les moteurs d'entra??nement ??lectriques de chaque Toyota Prius n??cessite un kilogramme (2,2 livres) de n??odyme par v??hicule.
Dop?? au n??odyme lasers

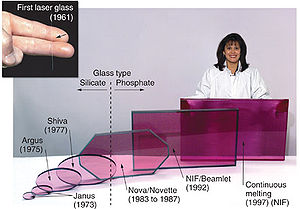
Certains mat??riaux transparents avec une faible concentration de n??odyme ions peuvent ??tre utilis??s dans les lasers comme support de gain pour les longueurs d'onde infrarouge (1054-1064 nm), par exemple, Nd: YAG (grenat d'yttrium aluminium), Nd: YLF (fluorure de lithium d'yttrium), Nd: YVO 4 (yttrium orthovanadate), et Nd: verre. cristaux de dop??s au n??odyme (Nd g??n??ralement: YVO 4) g??n??rer des faisceaux laser infrarouges de haute puissance qui sont convertis ?? la lumi??re laser vert commerciale Lasers portatifs et DPSS pointeurs laser.
Le laser actuelle au Royaume-Uni Atomic Weapons Establishment (AWE), le HELEN (High Energy Laser Embodying n??odyme) 1- t??rawatt laser n??odyme-verre, peut acc??der aux points m??dians des r??gions de pression et de temp??rature et est utilis?? pour acqu??rir des donn??es pour la mod??lisation sur la fa??on dont la densit??, de la temp??rature et la pression ?? l'int??rieur interagissent ogives. HELEN peut cr??er des plasmas de l'ordre de 10 6 K , dont l'opacit?? et la transmission de rayonnement sont mesur??es.
verre de n??odyme lasers ?? semi-conducteurs sont utilis??s en tr??s haute puissance ( ??chelle t??rawatt), haute ??nergie ( m??gajoules) Les syst??mes de faisceaux multiples pour fusion par confinement inertiel. Nd: laser de verre sont habituellement fr??quence tripl??e au troisi??me harmonique ?? 351 nm dans les dispositifs de fusion laser.
verre de n??odyme pour d'autres applications


N??odyme verre (Nd: verre) est produite par l'inclusion de oxyde de n??odyme (Nd 2 O 3) dans la masse fondue de verre. Habituellement, dans la lumi??re du jour ou verre de n??odyme de lumi??re incandescente appara??t lavande, mais il appara??t en bleu p??le sous ??clairage fluorescent. N??odyme peut ??tre utilis?? pour colorer le verre dans des tons d??licats allant du violet pur dans le vin rouge et gris chaud.
La premi??re utilisation commerciale de n??odyme purifi?? ??tait de coloration de verre, ?? partir des exp??riences de Leo Moser en Novembre 1927. Le verre r??sultant "Alexandrite" reste une couleur de signature de la verrerie Moser ?? ce jour. verre de n??odyme a ??t?? largement imit?? dans les ann??es 1930 par les serres am??ricaines, notamment Heisey, Fostoria ("glycines"), Cambridge ("Heatherbloom"), et Steuben ("glycines") et ailleurs (par exemple, Lalique, en France, ou Murano ). ??Le cr??puscule" de Tiffin rest?? dans la production d'environ 1950 ?? 1980. Les sources actuelles comprennent verriers en R??publique tch??que, aux ??tats-Unis, et la Chine.
Les bandes d'absorption nettes de n??odyme provoquent la couleur du verre de changer dans diff??rentes conditions d'??clairage, ??tant violet rouge??tre sous la lumi??re du jour ou jaune lumi??re incandescente, mais bleu sous blanche ??clairage fluorescent, ou verd??tre sous un ??clairage trichrome. Ce ph??nom??ne de changement de couleur est tr??s pris?? par les collectionneurs. En combinaison avec l'or ou le s??l??nium , de belles couleurs rouges r??sultent. Depuis n??odyme coloration d??pend " interdit "transitions ff profond de l'atome, il ya relativement peu d'influence sur la couleur de l'environnement chimique, de sorte que la couleur est imperm??able ?? l'histoire thermique du verre. Cependant, pour la meilleure couleur, fer contenant des impuret??s doivent ??tre minimis??s dans la silice utilis??e pour fabriquer du verre. La nature m??me de l'interdit ff transitions marques colorants terres rares moins intenses que celles pr??vues par la plupart des ??l??ments d-transition, donc plus doit ??tre utilis?? dans un verre d'atteindre l'intensit?? de couleur d??sir??e. La recette originale Moser utilis?? environ 5% d'oxyde de n??odyme dans la masse fondue de verre, une quantit?? suffisante de telle sorte que Moser mentionn?? ci comme ??tant ??dop??e aux terres rares" lunettes. ??tre une base forte, ce niveau de n??odyme aurait affect?? les propri??t??s de fusion du verre, et de la teneur en chaux du verre aurait d?? ??tre ajust?? en cons??quence.
La lumi??re transmise ?? travers des lunettes n??odyme montre inhabituellement forte bandes d'absorption; le verre est utilis?? dans les travaux astronomiques pour produire des bandes nettes par lequel raies spectrales peuvent ??tre calibr??s. N??odyme est ??galement utilis?? pour enlever la couleur verte caus??e par fer contaminants de verre. Le n??odyme est un composant de " didymium "(en r??f??rence ?? un m??lange de sels de n??odyme et de pras??odyme ) utilis?? pour le verre de colorant pour rendre soudeur les lunettes de souffleur de verre et de; les bandes d'absorption pointus oblit??rent l'??mission de sodium solide ?? 589 nm.
N??odyme et le verre de didyme sont utilis??s dans des filtres color??s am??lioration dans la photographie en int??rieur, en particulier dans la filtration des teintes jaunes de l'??clairage ?? incandescence.
De m??me, le verre de n??odyme est de plus en plus largement utilis?? directement les ampoules ?? incandescence. Ces lampes contiennent n??odyme dans le verre pour filtrer la lumi??re jaune, r??sultant en une lumi??re plus blanche qui ressemble plus ?? la lumi??re du soleil.
N??odyme a ??t?? brevet?? pour une utilisation dans l'automobile r??troviseurs, ?? r??duire l'??blouissement la nuit.
Similaire ?? son utilisation dans des verres, des sels de n??odyme sont utilis??s en tant que colorant pour ??maux.
Pr??cautions
La poussi??re de m??tal n??odyme est un risque de combustion et d'explosion. Compos??s n??odyme, comme avec tous les m??taux des terres rares, sont de toxicit?? faible ?? mod??r??e; Toutefois sa toxicit?? n'a pas ??t?? compl??tement ??tudi??es. la poussi??re et les sels de n??odyme sont tr??s irritantes pour les yeux et muqueuses, et mod??r??ment irritant pour la peau. Respirer la poussi??re peut causer des poumons embolies, et des dommages-int??r??ts d'exposition accumul??s le foie. N??odyme agit ??galement comme un anticoagulant, en particulier lorsqu'il est administr?? par voie intraveineuse.
Aimants en n??odyme ont ??t?? test??s pour des utilisations m??dicales telles que des accolades magn??tiques et la r??paration osseuse, mais questions de biocompatibilit?? ont emp??ch?? une application g??n??ralis??e. Aimants disponibles dans le commerce ?? base de n??odyme sont exceptionnellement forte, et peuvent se attirer mutuellement de grandes distances. Si ne est pas manipul?? avec soin, ils se r??unissent tr??s rapidement et avec force, causant des blessures. Par exemple, il ya au moins un cas document?? d'une personne de perdre un doigt lorsque deux aimants qu'il utilisait cass?? ensemble ?? partir de 50 cm.
Livres
- "La Chimie Industrielle de les lanthanides, l'yttrium, thorium et l'uranium", par RJ Callow, Pergamon Press 1967.
- Division Lindsay chimique, American Potash and Chemical Corporation, Liste des Prix 1960.
- ??La chimie des lanthanides", par RC Vickery, Butterworths 1953.
