Allotropy
?? propos de ce ??coles s??lection Wikipedia
SOS croit que l'??ducation donne une meilleure chance dans la vie des enfants dans le monde en d??veloppement aussi. Voulez-vous savoir sur le parrainage? Voir www.sponsorachild.org.uk

Allotropy est la propri??t?? de certains ??l??ments chimiques pour ??tre en mesure de prendre deux ou plusieurs formes diff??rentes, o?? les atomes sont dispos??s diff??remment par des liaisons chimiques . Les formes sont connus comme allotropes de cet ??l??ment. Le ph??nom??ne de allotropie est parfois aussi appel?? allotropism. Par exemple, le carbone a deux forme physico-chimique: diamant , o?? les atomes de carbone sont li??s ensemble dans un t??tra??drique agencement en treillis, et graphite, o?? les atomes de carbone sont li??s ensemble dans des feuilles d'un r??seau hexagonal.
Le mot vient de allotropie les grecs allos, qui signifie ??autres??, et tropos, ??mani??re??.
Allotropy se r??f??re uniquement ?? des formes diff??rentes d'un ??l??ment ?? l'int??rieur de la m??me phase ou ??tat de la mati??re (ce est ?? dire diff??rents solides , liquides ou gaz formes). Changements d'??tat (entre solides, liquides et gaz) ne sont pas consid??r??s allotropie. Certains ??l??ments ont allotropes qui persistent dans diff??rentes phases - par exemple, les deux allotropes de l'oxyg??ne ( dioxyg??ne, O 2 et l'ozone , O 3), peut exister ?? la fois dans le solide, le liquide et l'??tat gazeux. Autres ??l??ments maintenir allotropes distinctes que dans certaines phases - par exemple le phosphore a beaucoup allotropes solides, qui ont tous revenir ?? la m??me P 4 forme lorsqu'il est fondu ?? l'??tat liquide.
Histoire
Le concept de allotropie a ??t?? initialement propos?? en 1841 par le scientifique su??dois Baron Jons Jakob Berzelius (1779-1848) qui a offert aucune explication. Apr??s l'acceptation de L'hypoth??se d'Avogadro en 1860 il a ??t?? entendu que les ??l??ments pourraient exister en tant que mol??cules polyatomiques, et les deux allotropes d'oxyg??ne ont ??t?? reconnus comme O 2 et O 3. Au d??but du 20e si??cle, il a ??t?? reconnu que d'autres cas tels que le carbone ??taient dues ?? des diff??rences dans la structure cristalline.
En 1912, Ostwald a not?? que le allotropie d'??l??ments est qu'un cas particulier du ph??nom??ne de polymorphisme connu pour les compos??s, et a propos?? que les termes allotrope et allotropie ??tre abandonn??s et remplac??s par polymorphe et le polymorphisme. Bien que de nombreux autres chimistes ont r??p??t?? ce conseil, IUPAC et la plupart des textes de chimie favorisent encore l'utilisation de allotrope et allotropie pour les ??l??ments seulement.
Les diff??rences dans les propri??t??s des allotropes d'un ??l??ment
Allotropes existe diff??rentes formes structurelles d'un m??me ??l??ment et peuvent pr??senter des propri??t??s physiques tr??s diff??rentes et des comportements chimiques. Le changement entre les formes allotropiques est d??clench?? par les m??mes forces qui affectent d'autres structures, ce est- la pression, lumi??re et temp??rature . Par cons??quent la stabilit?? des formes allotropiques particulier d??pend des conditions particuli??res. Par exemple, le fer passe d'un structure cubique centr??e (Ferrite) ?? un structure cubique face centr??e ( aust??nite) au-dessus de 906 ?? C, et l'??tain subit une transformation dite l'??tain ?? partir d'un ravageur m??tallique de phase ?? un semi-conducteurs de phase ci-dessous 13,2 ?? C.
Liste des allotropes
Typiquement, des ??l??ments capables de variables nombre de coordination et / ou ??tats d'oxydation ont tendance ?? pr??senter un plus grand nombre de formes allotropiques. Un autre facteur est la capacit?? d'un ??l??ment de catenate. Allotropes sont g??n??ralement plus perceptible dans non-m??taux et m??tallo??des. N??anmoins, les m??taux ont tendance ?? avoir de nombreux allotropes.
Des exemples de allotropes comprennent:
Non-m??taux
Carbon:
- diamants -, un cristal transparent extr??mement difficile, avec les atomes de carbone dispos??s en un treillis t??tra??drique. Un mauvais conducteur ??lectrique. Un excellent conducteur thermique.
- graphite - un doux, noir, solide floconneux, un conducteur ??lectrique mod??r??e. Les atomes de carbone sont li??s en r??seaux hexagonaux plats, qui sont ensuite stratifi??s en feuilles.
- carbone amorphe
- fuller??nes, y compris " fuller??nes ", tels que C 60, et des nanotubes de carbone
Phosphore:
- Le phosphore blanc - P cristallin solide 4
- Le phosphore rouge - solide polym??re
- Phosphore Scarlet
- phosphore Violet
- Phosphore Noir - semi-conducteur, analogue ?? graphite
- Diphosphore
Oxyg??ne:
- dioxyg??ne, O 2 - incolore
- ozone , O 3 - bleu
- T??traoxyg??ne, O 4 - m??tastable
- octaoxygen, O 8 - rouge
Azote :
- diazote
- tetranitrogen
- trinitrogen
- deux formes solides: une hexagonale compacte et l'autre alpha cube
Soufre:
- Plastique (amorphe) de soufre - solide polym??re
- Le soufre rhombique - gros cristaux compos??s de S 8 mol??cules
- Soufre Monoclinique - cristaux fins comme des aiguilles
- D'autres mol??cules cycliques tels que la S 7 et S 12
- ??S??l??nium rouge??, cyclo-Se huit
- S??l??nium gris, Se polym??rique
- S??l??nium noir
M??tallo??des
- bore amorphe - poudre brune
- bore cristallin - noir, dur (9,3 sur l'??chelle de Mohs), et un conducteur faible ?? la temp??rature ambiante.
- silicium amorphe - poudre brune
- silicium nanocristallin - similaire au silicium amorphe
- silicium cristallin - a un ??clat m??tallique et une couleur gris??tre. Des monocristaux de silicium cristallin peuvent ??tre cultiv??es par un proc??d?? connu comme le proc??d?? Czochralski
Arsenic :
- Jaune arsenic - non m??tallique mol??culaire 4
- Arsenic Gray, Comme polym??re (m??tallo??de)
- Arsenic noir (m??tallo??de) et plusieurs autres semblables.
- antimoine bleu-blanc - la forme stable (m??tallo??de)
- antimoine jaune (non m??tallique)
- le noir d'antimoine (non m??tallique)
- (Un quart une trop)
Le polonium a deux allotropes m??talliques.
M??taux
- gris ??tain (alpha-??tain)
- ??tain blanc (beta ??tain)
- ??tain rhombique (gamma)
Fer
- ferrite (fer alpha) - formulaires ci-dessous 770 ?? C (le point de Curie, Tc); le fer devient magn??tique dans sa forme alpha; BCC
- b??ta - formulaires ci-dessous 912 ?? C (BCC)
- gamma - formulaires ci-dessous 1 401 ?? C; cube (FCC) structure cristalline centr??e visage
- delta - formes de refroidissement fer fondu ci-dessous 1 535 ?? C; a un (BCC) cubique structure cristalline centr??e sur le corps
Titanium a deux allotropes
Strontium a trois allotropes
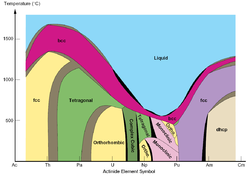
Lantanides et les actinides
- Le plutonium a six allotropes solides distinctes sous des pressions "normaux". Leurs densit??s varient dans un rapport d'environ 4: 3, ce qui complique consid??rablement toutes sortes de travaux avec le m??tal (en particulier le moulage, l'usinage et de stockage). Un plutonium septi??me allotrope existe ?? des pressions tr??s ??lev??es, ce qui ajoute de nouvelles difficult??s dans les applications exotiques.
- Ytterbium a trois allotropes
- Terbium a deux allotropes cristallines
- Promethium a deux formes allotropiques
- Curium a trois allotropes (??galement am??ricium , Berkelium , Californium faire)