
Le chlorure d'aluminium
Contexte des ??coles Wikip??dia
Cette s??lection ??coles a ??t?? choisi par SOS Enfants pour les ??coles dans le monde en d??veloppement ne ont pas acc??s ?? Internet. Il est disponible en t??l??chargement intranet. Voir http://www.soschildren.org/sponsor-a-child pour conna??tre le parrainage d'enfants.
| Le chlorure d'aluminium | |
|---|---|
 | |
 | |
Aluminium (III) chlorure | |
Autres noms le trichlorure d'aluminium | |
| Identificateurs | |
| Propri??t??s | |
| Formule mol??culaire | AlCl 3 |
| Masse molaire | 133,34 g mol -1 (anhydre) 241,432 g mol -1 (hexahydrate) |
| Apparence | Solide jaune p??le, hygroscopique. |
| Densit?? | 2,48 g cm -3 |
| Point de fusion | 190 ?? C 463 K ) |
| Point d'??bullition | 178 ?? C (451 K) ( subl) |
| Solubilit?? dans l'eau | 43,9 g / 100 ml (0 ?? C) 44,9 g / 100 ml (10 ?? C) 45,8 g / 100 ml (20 ?? C) 46,6 g / 100 ml (30 ?? C) 47,3 g / 100 ml (40 ?? C) 48,1 g / 100 ml (60 ?? C) 48,6 g / 100 ml (80 ?? C) 49 g / 100 ml (100 ?? C) |
| Structure | |
| Crystal structure | 6 coordonn??e r??seau de couche |
| Coordination g??om??trie | Octahedral (solide) T??tra??drique (liquide) |
| Forme mol??culaire | Trigonale plane ( vapeur monom??re) |
| Risques | |
| FS | MSDS externe |
| Classification UE | Corrosif (C) |
| Phrases-R | R34 |
| Phrases S | (S1 / 2), S7 / 8, S28, S45 |
| Des compos??s apparent??s | |
| D'autres anions | Le fluorure d'aluminium Bromure d'aluminium l'iodure d'aluminium |
| D'autres cations | Le trichlorure de bore Gallium (III) chlorure Indium (III) chlorure Le thallium (III) chlorure Le chlorure de magn??sium |
| Connexe Des acides de Lewis | De fer (III) chlorure Le trifluorure de bore |
| Page de donn??es suppl??mentaire | |
| Structure et propri??t??s | n, ε r, etc. |
| Thermodynamique donn??es | comportement de phase Solide, liquide, gaz |
| Les donn??es spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
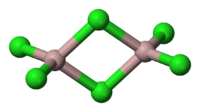
Le chlorure d'aluminium (de AlCl 3) est un compos?? de l'aluminium et le chlore . Le solide a une fusion et point d'??bullition bas, et est li?? de fa??on covalente. Il sublime ?? 178 ?? C . Molten AlCl3 effectue ??lectricit?? mal, ?? la diff??rence plus ionique les halog??nures tels que le chlorure de sodium . Il existe ?? l'??tat solide comme un r??seau de six coordonner couche.
AlCl 3 adopte la structure "YCl 3", mettant en vedette Al 3+ structure en couches pr??s emball?? cube. En revanche, AlBr3 a une structure mol??culaire plus, avec les Al 3+ centres occupant trous t??tra??driques adjacents du cadre de serr??e de Br - ions. Lors de la fusion AlCl 3 donne le dim??re Al 2 Cl 6, qui peut vaporiser. Au plus ??lev??s temp??ratures ce Al 2 Cl 6 dim??res se dissocie en trigonal plane AlCl 3, dont la structure est analogue ?? BF 3.

Le chlorure d'aluminium est hautement d??liquescent, et il peut exploser au contact brutal avec l'eau en raison de la forte chaleur hydratation. Aqueuses solutions d'AlCl3 sont ionique et ainsi conduire l'??lectricit?? ainsi. De telles solutions se av??rent acide , ce qui indique partielle l'hydrolyse de l'ion Al. Les r??actions peuvent ??tre d??crites (simplifi??) en tant que:
- [Al (H 2 O) 6] 3+ + H 2 O ⇌ [Al (OH) (H 2 O) 5] 2+ + H 3 O +
AlCl 3 est probablement le plus couramment utilis?? Acide de Lewis et aussi l'un des plus puissants. Elle trouve une application tr??s r??pandue dans le industrie chimique comme le classique catalyseur pour Friedel-Crafts, deux acylations et alkylations. Il trouve ??galement utiliser dans polym??risation et r??actions d'isom??risation de hydrocarbures. Aluminium forme ??galement une plus faible le chlorure d'aluminium (I) chlorure (AlCl), mais cela est tr??s instable et ne est connu dans la phase vapeur.
Propri??t??s chimiques
Le chlorure d'aluminium est un puissant Acide de Lewis, capable de former des produits d'addition stables Lewis acide-base avec encore faible Les bases de Lewis telles que benzoph??none ou m??sityl??ne. Il ne est pas surprenant forme AlCl 4 -, en pr??sence d' des ions chlorure.
Dans l'eau, les formes d'hydrolyse partielle HCl gazeux ou de H 3 O +, comme d??crit dans la description ci-dessus. Les solutions aqueuses se comportent de fa??on similaire ?? l'autre en aluminium sels hydrat??s contenant Al 3+ ions , donnant une g??latineuse pr??cipit?? de l'hydroxyde d'aluminium par r??action avec la quantit?? correcte de solution aqueuse d'hydroxyde de sodium :
AlCl 3 ( aq) + 3 NaOH (aq) → Al (OH) 3 ( s ) + 3 NaCl (aq)
Pr??paration
Le chlorure d'aluminium est fabriqu?? ?? grande ??chelle par le r??action exothermique de l'aluminium m??tallique avec du chlore ou du chlorure d'hydrog??ne.
- 2 Al + 3 Cl 2 → 2 AlCl 3
- 2 Al + 6 HCl → 2 AlCl 3 + 3 H 2
Les formes hydrat??es sont pr??par??es en dissolvant les oxydes d'aluminium avec de l'acide chlorhydrique.
Utilisations
Le R??action de Friedel-Crafts est l'utilisation importante de chlorure d'aluminium, par exemple dans la pr??paration de anthraquinone (par la industrie des colorants) de benz??ne et phosg??ne. En g??n??ral R??action de Friedel-Crafts, une chlorure d'acyle ou halog??nure d'alkyle r??agit avec un syst??me aromatique comme indiqu??:

Avec benz??ne d??riv??s , le produit principal est la para isom??re. La r??action d'alkylation a de nombreux probl??mes associ??s, tels que dans Friedel-Crafts, de sorte qu'il est moins utilis?? que la r??action d'acylation. Pour les deux r??actions, le chlorure d'aluminium, ainsi que d'autres mat??riaux et les ??quipements, doivent ??tre mod??r??ment sec, bien qu'une trace d'humidit?? est n??cessaire ?? la r??action de se d??rouler. Un probl??me g??n??ral avec la r??action de Friedel-Crafts est le chlorure d'aluminium que " catalyseur "doit ??tre pr??sent en grand en quantit??s stoechiom??triques pour la r??action afin d'aller ?? son terme, car il les complexes fortement avec les produits (voir propri??t??s chimiques ci-dessus). Cela rend tr??s difficile ?? recycler, donc il doit ??tre d??truit apr??s utilisation, g??n??rant une grande quantit?? de d??chets corrosifs. Pour cette raison, les chimistes ??tudient l'utilisation de plus catalyseurs respectueux de l'environnement tels que l'ytterbium (III) triflate ou le dysprosium (III) triflate, qui peut ??tre recycl?? .
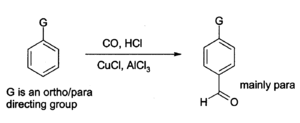
Le chlorure d'aluminium peut ??galement ??tre utilis?? pour introduire groupes ald??hyde ONTO des cycles aromatiques, par exemple via le R??action de Gatterman-Koch, qui utilise du monoxyde de carbone , du chlorure d'hydrog??ne et un cuivre (I) de chlorure co- catalyseur ):
Le chlorure d'aluminium trouve une grande vari??t?? d'autres applications dans la chimie organique . Par exemple, il peut catalyser la " r??action ??ne ", telles que l'addition de 3-but??ne-2-one (m??thyl vinyl c??tone) ?? carvone:

AlCl 3 est ??galement largement utilis?? pour polym??risation et r??actions d'isom??risation de des hydrocarbures. Des exemples importants comprennent la fabrication de ??thylbenz??ne, qui avait l'habitude de faire styr??ne et donc le polystyr??ne , ainsi que la production de dod??cylbenz??ne, qui est utilis?? pour la fabrication de d??tergents.
Le chlorure d'aluminium combin?? avec de l'aluminium en pr??sence d'un ar??ne peut ??tre utilis?? pour synth??tiser les bis (ar??ne) des complexes m??talliques, par exemple bis (benz??ne) chrome, ?? partir de certains halog??nures m??talliques via la dite Synth??se de Fischer-Hafner.
Le chlorure d'aluminium, souvent sous la forme de d??riv??s tels que chlorhydrate d'aluminium, est une composante commune dans antitranspirants ?? de faibles concentrations. souffrant d'hyperhidrose ont besoin d'une concentration beaucoup plus ??lev??e (15% ou plus), vendu sous les noms de marque comme Drysol??, Maxim??, ODABAN??, CertainDri??, B + et Drier?? Driclor??.
Pr??cautions
AlCl 3 anhydre r??agit vivement avec l'eau et bases, pr??cautions afin appropri??s sont n??cessaires. Sels hydrat??s sont moins probl??matiques.
