
Le cuivre (I) de chlorure
Saviez-vous ...
Enfants SOS offrent un chargement complet de la s??lection pour les ??coles pour une utilisation sur les intranets des ??coles. Le parrainage d'enfants aide les enfants un par un http://www.sponsor-a-child.org.uk/ .
| Le cuivre (I) de chlorure | |
|---|---|
 | |
 | |
Le cuivre (I) de chlorure | |
Autres noms Chlorure cuivreux | |
| Identificateurs | |
| Num??ro CAS | 7758-89-6 |
| Num??ro RTECS | GL6990000 |
| Propri??t??s | |
| Formule mol??culaire | CuCl |
| Masse molaire | 98,99 g / mol |
| Apparence | poudre blanche, l??g??rement vert d'impuret??s oxyd??es |
| Densit?? | 4,140 g / cm 3, solide |
| Point de fusion | 430 ?? C (703 K) |
| Point d'??bullition | 1490 ?? C (1760 K), |
| Solubilit?? dans l'eau | 0,0062 g / 100 ml (20 ?? C) |
| Structure | |
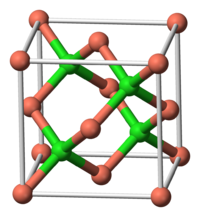
| Crystal structure | Tetrahedral Fermer emball??s ( Zinc structure blende) |
| Risques | |
| FS | ScienceLab.com |
| R / S d??claration | R: 22, 50, 53 S: 22, 60/61 |
| Principal dangers | Irritant |
| NFPA 704 |  0 3
0 |
| Des compos??s apparent??s | |
| D'autres anions | Le cuivre (I) de bromure Le cuivre (I) d'iodure |
| D'autres cations | Cuivre (II) chlorure Argent (I) de chlorure |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
Le cuivre (I) chlorure, commun??ment appel?? chlorure cuivreux, ce est la plus faible le chlorure de cuivre , de formule CuCl. Ce solide incolore est un pr??curseur polyvalent ?? d'autres compos??s de cuivre, dont certains ?? caract??re commercial. Il se produit naturellement que le min??ral rare nantokite. Contrairement ?? d'autres halog??nures de m??taux de transition de la premi??re rang??e, il forma une ??curie des complexes avec le monoxyde de carbone . Il cristallise dans un diamanto??de motif, ce qui refl??te la tendance de cuivre (I) pour former des complexes t??tra??driques.
Pr??paration
Le cuivre (I) de chlorure est produit industriellement par la chloration directe de cuivre:
- 2 Cu + Cl 2 → 2 CuCl
Au laboratoire, le cuivre (I) de chlorure peut ??tre pr??par?? par la r??duction de sels de cuivre (II) tels que CuSO 4 en utilisant le dioxyde de soufre, bisulfite de sodium (NaHSO 3), le m??tabisulfite de sodium, ou le cuivre m??tallique.
- 2 CuCl 2 + H 2 O + SO 3 2- → 2 CuCl + SO 4 2- + 2 Cl -
Les pr??cipit??s solides blancs ?? partir de la solution. Apr??s repos ?? l'air humide, des ??chantillons de CuCl deviennent verts due ?? la formation de chlorures de cuivre (II).
Propri??t??s chimiques
CuCl est plus accessible et moins toxiques que d'autres acides de Lewis gazeuses. En outre, le cuivre peut exister dans plusieurs ??tats redox, y compris I, II, et III. Cette combinaison de propri??t??s d??finir certaines des caract??ristiques utiles de cuivre (I) le chlorure. Il est un doux Lewis acide, class?? comme douce selon la Concept difficile-Soft acide-base. Ainsi, il a tendance ?? former stable complexes avec douce Les bases de Lewis telles que triph??nylphosphine:
- CuCl + P (C 6 H 5) 3 → [CuCl (P (C 6 H 5) 3)] 4
Bien que CuCl est insoluble dans l'eau, il se dissout dans des solutions aqueuses contenant des mol??cules donneurs appropri??s. Il forme des complexes avec des ions halog??nures, par exemple formant H 3 O + CuCl 2 - concentr?? avec de l'acide chlorhydrique . Il se dissout dans des solutions contenant aussi CN -, S 2 O 3 2-, et NH 3 pour donner des complexes.
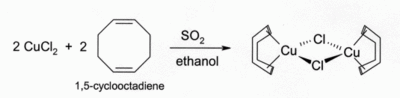
Solutions de CuCl dans HCl ou NH 3 absorber le monoxyde de carbone pour former des complexes incolores, tels que le dim??re de chlorure pont?? [CuCl (CO)] 2. Les m??mes solutions d'acide chlorhydrique r??agissent ??galement avec l'ac??tyl??ne gazeux pour former [CuCl (C 2 H 2)]. ammoniacales solutions de CuCl r??agissent avec des ac??tyl??nes pour former l'explosif cuivre (I) ac??tylure. Complexes de CuCl avec des alc??nes peuvent ??tre pr??par??s par r??duction de CuCl2 par le dioxyde de soufre en pr??sence de l'alc??ne en solution alcoolique. Complexes avec les di??nes tels que 1,5-cyclooctadi??ne sont particuli??rement stable:
Bien que seulement peu soluble dans l'eau, sa solution aqueuse sont instables par rapport ?? dismutation en Cu et CuCl 2 . En partie pour cette raison ??chantillons prennent une coloration verte (voir photo en haut ?? droite).
Utilisations
La principale utilisation de cuivre (I) est le chlorure en tant que pr??curseur de la oxychlorure de cuivre fongicide. Pour ce cuivre aqueuse de but (I) est g??n??r?? par le chlorure comproportionation puis air oxyd??:
- Cu + CuCl 2 → 2 CuCl
- 6 CuCl + 3/2 O 2 + 3 H 2 O → 2 Cu 3 Cl 2 (OH) 4 + CuCl2
Le cuivre (I) de chlorure catalyse de diverses r??actions organiques, comme discut?? ci-dessus. Son affinit?? pour le monoxyde de carbone en pr??sence de chlorure d'aluminium est exploit??e dans le processus COPure SM.
En synth??se organique
Dans le R??action de Sandmeyer. Le traitement d'un ar??nediazonium sel avec CuCl conduit ?? un chlorure d'aryle, par exemple:
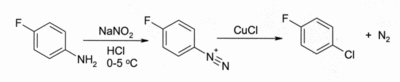 La r??action a une large port??e et donne g??n??ralement de bons rendements.
La r??action a une large port??e et donne g??n??ralement de bons rendements.
Les premiers chercheurs ont observ?? que le cuivre (I) halog??nures catalysent addition 1,4 de Des r??actifs de Grignard de c??tones alpha, b??ta-insatur??s ont conduit au d??veloppement de r??actifs organocuprate qui sont largement utilis??s aujourd'hui dans synth??se organique:
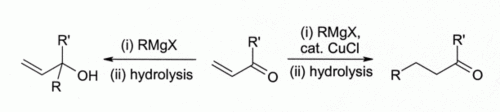 Ce constat a conduit au d??veloppement de la chimie organocuivre. Par exemple, r??agit avec CuCl m??thyllithium (CH 3 Li) pour former " Gilman r??actifs "tels que (CH 3) 2 CuLi, qui trouvent une large utilisation dans synth??se organique. Les r??actifs de Grignard r??agissent de mani??re similaire. Bien que le cuivre (I) d'autres compos??s tels que cuivre (I) iodure sont maintenant plus souvent utilis?? pour ces types de r??actions, de cuivre (I) le chlorure est toujours recommand??, dans certains cas:
Ce constat a conduit au d??veloppement de la chimie organocuivre. Par exemple, r??agit avec CuCl m??thyllithium (CH 3 Li) pour former " Gilman r??actifs "tels que (CH 3) 2 CuLi, qui trouvent une large utilisation dans synth??se organique. Les r??actifs de Grignard r??agissent de mani??re similaire. Bien que le cuivre (I) d'autres compos??s tels que cuivre (I) iodure sont maintenant plus souvent utilis?? pour ces types de r??actions, de cuivre (I) le chlorure est toujours recommand??, dans certains cas:
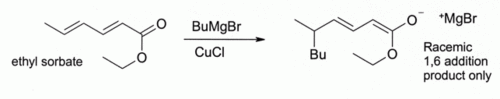 Ici, Bu d??signe un groupe n- un groupe butyle. Sans CuCl, le R??actif de Grignard seul donne un m??lange de 1,2- et de 1,4-produits d'addition (ce est ?? dire, le butyle ajoute au plus pr??s de la C = O).
Ici, Bu d??signe un groupe n- un groupe butyle. Sans CuCl, le R??actif de Grignard seul donne un m??lange de 1,2- et de 1,4-produits d'addition (ce est ?? dire, le butyle ajoute au plus pr??s de la C = O).
Dans la chimie des polym??res
Le cuivre (I) est ??galement un chlorure interm??diaire form?? ?? partir de cuivre (II) dans la Processus Wacker. CuCl est utilis?? comme catalyseur dans Atom Transfer Radical Polymerization (ATRP).
