Cuivre (II) chlorure
?? propos de ce ??coles s??lection Wikipedia
Enfants SOS b??n??voles ont aid?? ?? choisir des articles et faites autre mat??riel de programme Parrainer un enfant de faire une r??elle diff??rence.
| Cuivre (II) chlorure | |
|---|---|
 | |
 | |
 | |
Cuivre (II) chlorure | |
Autres noms Chlorure de cuivre | |
| Identificateurs | |
| Num??ro CAS | 7447-39-4 10125-13-0 (dihydrate) |
| PubChem | 169664 |
| ChemSpider | 148374 |
| UNII | P484053J2Y |
| Num??ro RTECS | GL7000000 |
| images de Jmol-3D | Image 1 Image 2 |
SMILES
| |
InChI
| |
| Propri??t??s | |
| Formule mol??culaire | CuCl 2 |
| Masse molaire | 134,45 g / mol (anhydre) 170,48 g / mol (dihydrate) |
| Apparence | solide jaune-brun (anhydre) solide bleu-vert (dihydrate) |
| Densit?? | 3,386 g / cm 3 (anhydre) 2,51 g / cm 3 (dihydrate) |
| Point de fusion | 498 ?? C (anhydre) |
| Point d'??bullition | 993 ?? C (anhydre, d??composition) |
| Solubilit?? dans l'eau | 70,6 g / 100 ml (0 ?? C) 75,7 g / 100 ml (25 ?? C) |
| Structure | |
| Crystal structure | d??form?? CdI 2 Structure |
| Coordination g??om??trie | Octahedral |
| Risques | |
| FS | Fischer Scientific |
| Classification UE | Non list?? |
| NFPA 704 |  0 2 1 |
| Point d'??clair | Ininflammable |
| Des compos??s apparent??s | |
| D'autres anions | Cuivre (II) de fluorure Bromure de cuivre (II) |
| D'autres cations | Le cuivre (I) de chlorure Chlorure d'argent Or (III) chlorure |
Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
Cuivre (II) est le chlorure de compos?? chimique avec la formule CuCl 2. Il se agit d'une substance solide brun clair, qui absorbe lentement l'humidit?? pour former un bleu-vert dihydrate. Le cuivre chlorures (II) sont parmi les plus courante de cuivre (II), compos??s apr??s le sulfate de cuivre.
Structure
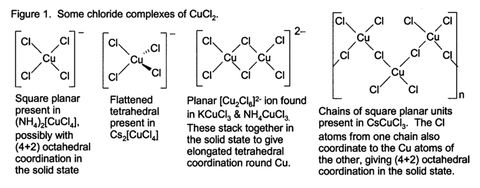
CuCl2 anhydre adopte une d??form?? Structure de l'iodure de cadmium. Dans ce motif, les centres de cuivre sont octa??drique. La plupart de cuivre (II) les compos??s pr??sentent des distorsions de la g??om??trie octa??drique id??alis??e en raison de la Effet Jahn-Teller, qui dans ce cas d??crit la localisation d'un ??lectron d dans un orbitale mol??culaire qui est fortement antiliante par rapport ?? une paire de ligands de chlorure. Dans CuCl 2 ?? 2H 2 O, le cuivre adopte de nouveau une g??om??trie octa??drique tr??s d??form??e, le Cu (II) ??tant entour?? par les centres de deux ligands d'eau et quatre ligands chlorure, qui combler asym??trique ?? d'autres centres de Cu.
Cuivre (II) chlorure est paramagn??tique. D'int??r??t historique, CuCl 2 ?? 2H 2 O a ??t?? utilis?? dans la premi??re ??lectrons mesures de r??sonance paramagn??tique par Ievgueni Zavo??ski en 1944.
Propri??t??s et r??actions

La solution aqueuse pr??par??e ?? partir de cuivre (II) contient une gamme de cuivre (II) selon la concentration, la temp??rature et la pr??sence d'ions chlorure suppl??mentaires. Ces esp??ces incluent la couleur bleue de [Cu (H 2 O) 6] 2+ et la couleur jaune ou rouge des complexes d'halog??nures de la formule [CuCl 2 + x] x.

Il se d??compose en CuCl et Cl 2 ?? 1000 ?? C:
- 2 CuCl 2 → 2 CuCl + Cl 2
Il r??agit avec HCl ou autre sources de chlorure pour former des ions complexes: l'CuCl rouge 3 -, et le jaune CuCl 4 2-.
- CuCl 2 + 2 Cl -
 CuCl -
CuCl -
3 + Cl - CuCl 2-
CuCl 2-
4
Certains de ces complexes peut ??tre cristallis?? ?? partir de solution aqueuse, et qu'ils adoptent une grande vari??t?? de types de structure (Fig. 1).
Cuivre (II) de l'hydroxyde pr??cipite lors du traitement de cuivre (II) avec des solutions de chlorure de base:
- CuCl 2 + 2 NaOH → Cu (OH) 2 + 2 NaCl
Cuivre (II) chlorure constitue ??galement une vari??t?? de des complexes de coordination avec des ligands tels que pyridine et l'oxyde de triph??nylphosphine:
- CuCl 2 + 2 C 5 H 5 N → [CuCl 2 (C 5 H 5 N) 2] (t??tragonale)
- CuCl 2 + 2 (C 6 H 5) 3 P = O → [CuCl 2 ((C 6 H 5) 3 P = O) 2] (t??tra??drique)
Cependant ligands ??douces?? telles que les phosphines (par exemple, triph??nylphosphine), iodure, cyanure et, ainsi que certains tertiaires amines motif r??duction pour donner cuivre (I) complexes. Pour convertir le cuivre (II) chlorure de cuivre (I) des d??riv??s, il est g??n??ralement plus commode de r??duire une solution aqueuse avec le dioxyde de soufre comme agent r??ducteur:
- 2 CuCl 2 + SO 2 + 2 H 2 O → 2 CuCl 2 + HCl + H 2 SO 4
L'hydrolyse donne l'oxychlorure de cuivre, Cu 2 Cl (OH) 3, un fongicide populaire.
Pr??paration
Cuivre (II) est pr??par?? dans le commerce chlorure par l'action de chloration du cuivre:
- Cu + Cl 2 + H 2 O → 2 CuCl 2 (H 2 O) 2
Il peut ??galement ??tre g??n??r?? par traitement de l'hydroxyde, l'oxyde, ou cuivre (II) avec du carbonate acide chlorhydrique. L'??lectrolyse de chlorure de sodium aqueux avec des ??lectrodes en cuivre produit (entre autres) d'une mousse vert-bleu qui peuvent ??tre collect??es et converti en l'hydrate.
CuCl2 anhydre peut ??tre pr??par?? directement par l'union des ??l??ments, le cuivre et le chlore .
CuCl 2 peut ??tre purifi?? par cristallisation ?? partir d'dilu??e chaude d'acide chlorhydrique , en refroidissant dans un CaCl2 bain de -Patins.
Occurrence naturelle
Cuivre (II) chlorure se produit naturellement comme la tolbachite min??ral tr??s rare et le dihydrate eriochalcite. Les deux se trouvent pr??s de fumerolles. Plus courantes sont oxyhydroxyde chlorures mixtes comme atacamite Cu 2 (OH) 3 Cl, surgissant parmi Cu lits de minerai zones d'oxydation en climat aride (??galement connu de quelques scories modifi??s).
Utilisations
Co-catalyseur dans le proc??d?? Wacker
Une application industrielle importante pour le cuivre (II) est le chlorure en tant que co-catalyseur avec palladium (II) dans le chlorure Processus Wacker. Dans ce proc??d??, l'??th??ne (ethylene) est converti en ??thanal (ac??tald??hyde) avec de l'eau et de l'air. Pendant la r??action, PdCl 2 est r??duit ?? Pd et le CuCl 2 sert ?? r??-oxyder ce retour ?? PdCl 2. Air peut alors oxyder la r??sultante CuCl retour ?? CuCl 2, compl??tant ainsi le cycle.
- C 2 H 4 + PdCl 2 + H 2 O → CH 3 CHO + Pd + 2 HCl
- Pd + 2 CuCl 2 → 2 CuCl + PdCl2
- CuCl 4 + 4 HCl + O 2 → 4 CuCl 2 + 2 H 2 O
L'ensemble du processus est:
- 2 C 2 H 4 + O 2 → 2 CH 3 CHO
Chlorations
Cuivre (II) chlorure catalyse la chloruration dans la production de chlorure de vinyle et dichloro??thane.
D'autres applications de synth??se organique
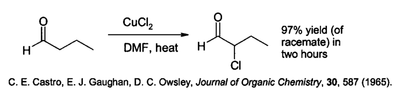
Cuivre (II) chlorure a une vari??t?? d'applications sp??cialis??es dans le synth??se de compos??s organiques. Il effectue chloration du hydrocarbons- aromatique ce est souvent r??alis??e en pr??sence d' oxyde d'aluminium . Il est capable de chlorer la position alpha de compos??s carbonyl??s:
Cette r??action est effectu??e dans un solvant polaire tel que le le dim??thylformamide (DMF), souvent en pr??sence de le chlorure de lithium, ce qui acc??l??re la r??action.
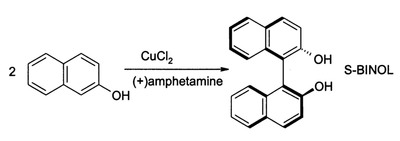
CuCl 2, en pr??sence d' oxyg??ne , peuvent ??galement oxyder ph??nols. Le principal produit peut ??tre dirig?? pour donner soit un quinone ou un produit coupl?? de dim??risation oxydative. Ce dernier proc??d?? fournit une voie ?? haut rendement ?? 1,1-binaphtol:
Ces compos??s sont des interm??diaires dans la synth??se de BINAP et ses d??riv??s
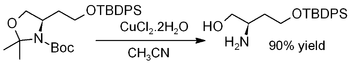
Cuivre (II) dihydrate de chlorure favorise l'hydrolyse des ac??tonides, ?? savoir, par une d??protection pour r??g??n??rer des diols ou des aminoalcools, comme dans cet exemple (o?? = TBDPS tert-butyldiph??nylsilyle):
CuCl 2 catalyse ??galement la addition radicalaire de sulfonyle chlorures ?? alc??nes ; l'alpha-chlorosulfone peut alors subir ??limination avec une base pour donner un vinyle produit de sulfone.
usages de niche
Cuivre (II) chlorure est ??galement utilis?? dans pyrotechniques comme un agent de vert bleu / colorant. Dans un essai ?? la flamme, les chlorures de cuivre, comme tous les compos??s de cuivre, ??mettent vert-bleu.
S??curit??
On concentrations toxiques et seulement en dessous de 5 ppm sont admis dans l'eau potable par le US Environmental Protection Agency.