
Pluie acide
Renseignements g??n??raux
Les articles de cette s??lection ??coles ont ??t?? organis??s par sujet du programme d'??tudes gr??ce aux b??n??voles d'enfants SOS. parrainage SOS enfant est cool!
| |||||||||||||||||||||||
Les pluies acides est la pluie ou toute autre forme de pr??cipitation qui est anormalement acide . Elle a des effets nocifs sur le environnement et sur les structures. Les pluies acides est principalement caus??e par les ??missions dues ?? l'activit?? humaine de soufre et d'azote compos??s qui r??agissent dans l'atmosph??re pour produire des acides. Au cours des derni??res ann??es, de nombreux gouvernements ont adopt?? des lois pour r??duire ces ??missions.
D??finition
Le terme ??pluies acides?? est couramment utilis?? pour d??signer le d??p??t de composants acides dans la pluie, neige, brouillard, ros??e, ou particules s??ches. Le terme plus exact est ??pluies acides??. De l'eau distill??e ne contenant pas de dioxyde de carbone, a un neutre pH de 7. Les liquides ayant un pH inf??rieur ?? 7 sont acides, et ceux qui ont un pH sup??rieur ?? 7 sont basiques. "Clean" ou de la pluie non pollu??e est l??g??rement acide, son pH ??tant d'environ 5,6, parce que le dioxyde de carbone et de l'eau dans l'air r??agissent ensemble pour former de l'acide carbonique, un acide faible.
L'acide carbonique peut alors ioniser dans l'eau formant de faibles concentrations de ions hydronium:
L'acidit?? suppl??mentaire en pluie provient de la r??action des polluants de l'air primaire, principalement des oxydes de soufre et des oxydes d'azote, avec de l'eau dans l'air pour former des acides forts (comme sulfurique et acide nitrique). Les principales sources de ces polluants sont les v??hicules et les installations industrielles et de production d'??nergie.
Histoire
Depuis la r??volution industrielle, les ??missions de dioxyde de soufre et d'oxydes d'azote dans l'atmosph??re ont augment??. Les pluies acides a ??t?? d??couvert dans Manchester , Angleterre . En 1852, Robert Angus Smith trouve la relation entre les pluies acides et la pollution atmosph??rique. Bien que les pluies acides a ??t?? d??couvert en 1852, il ne ??tait pas jusqu'?? la fin des ann??es 1960 que les scientifiques ont commenc?? ?? largement observer et ??tudier le ph??nom??ne. Canadienne Harold Harvey ??tait parmi les premiers ?? la recherche d'une "mort" lac. La sensibilisation du public des pluies acides aux ??tats-Unis a augment?? dans les ann??es 1990 apr??s la New York Times a promulgu?? rapports du Hubbard Brook exp??rimentation foresti??re dans New Hampshire des effets d??l??t??res myriade environnementaux d??montr?? en r??sulter.
Lectures de pH occasionnels de bien en dessous de 2,4 (l'acidit?? du vinaigre) ont ??t?? signal??s dans les r??gions industrialis??es. Pluies acides industrielle est un probl??me important en Chine , Europe de l'Est , la Russie et les zones sous le vent d'eux. Ces zones tous br??lent du charbon contenant du soufre pour produire de la chaleur et de l'??lectricit??. Le probl??me des pluies acides non seulement a augment?? avec la croissance d??mographique et industrielle, mais est devenu plus r??pandu. L'utilisation de hautes chemin??es pour r??duire locale pollution a contribu?? ?? la propagation des pluies acides en lib??rant des gaz dans la circulation atmosph??rique r??gionale. Souvent d??p??t se produit ?? une distance consid??rable sous le vent des ??missions, avec les r??gions montagneuses tendant ?? recevoir le plus (tout simplement en raison de leur plus fortes pr??cipitations). Un exemple de cet effet est faible pH de pluie (par rapport aux ??missions locales) qui tombe Scandinavie.
Les ??missions de produits chimiques conduisant ?? l'acidification
Le gaz le plus important qui conduit ?? l'acidification est du dioxyde de soufre. Les ??missions de oxydes d'azote qui sont oxyd??s pour former de l'acide nitrique sont d'une importance croissante en raison de contr??les plus stricts sur les ??missions de compos??s contenant du soufre. 70 Tg (S) par an sous forme de SO 2 provient de combustibles fossiles combustion et de l'industrie, 2,8 Tg (S) incendies de for??t et 7-8 Tg (S) par an ?? partir de volcans .
Ph??nom??ne Naturel
La principale naturelle ph??nom??nes qui contribuent gaz produisant de l'acide ?? l' atmosph??re sont les ??missions provenant des volcans et ceux des biologiques processus qui se produisent sur le terrain, dans les zones humides, et dans les oc??ans . La source biologique majeur de compos??s contenant du soufre est sulfure de dim??thyle.
Les effets des d??p??ts acides ont ??t?? d??tect??s dans glaciaires des milliers d'ann??es dans les r??gions ??loign??es du globe.
L'activit?? humaine

La principale cause des pluies acides est de soufre et d' azote compos??s provenant de sources humaines, telles que la production d'??lectricit??, les usines et v??hicules automobiles. centrales de charbon sont une des plus polluantes. Les gaz peuvent ??tre r??alis??es sur des centaines de kilom??tres dans l'atmosph??re avant qu'ils ne soient convertis en acides et d??pos??es. Dans le pass??, les usines avaient entonnoirs courtes pour laisser sortir la fum??e, mais cela a caus?? beaucoup de probl??mes; Ainsi, les usines ont maintenant de plus longues chemin??es de fum??e. Cependant, ce qui provoque polluants ?? effectuer plus loin, causant des dommages plus ??cologique.
Les proc??d??s chimiques
la chimie en phase gazeuse
Dans la phase gazeuse du dioxyde de soufre est oxyd?? par r??action avec le via un radical hydroxyle r??action intermol??culaire:
- SO 2 + OH ?? → HOSO 2 ??
qui est suivie par:
- HOSO 2 ?? + O 2 → HO 2 ?? + SO 3
En pr??sence d'eau, le trioxyde de soufre (SO 3) est rapidement converti en acide sulfurique :
- SO 3 (g) + H 2 O (l) → H 2 SO 4 (l)
L'acide nitrique est form?? par la r??action du groupe OH avec Le dioxyde d'azote:
- NO 2 + OH ?? → HNO3
Pour plus d'informations, voir Seinfeld et Pandis (1998).
Chimie en gouttelettes de nuage
Quand les nuages sont pr??sents, le taux de SO 2 de perte est plus rapide que peut ??tre expliqu?? par la chimie en phase gazeuse seul. Cela est d?? ?? des r??actions dans les gouttelettes d'eau liquide
- Hydrolyse
Le dioxyde de soufre se dissout dans l'eau, puis, comme le dioxyde de carbone, hydrolyse dans une s??rie d' ??quilibre des r??actions:
- SO 2 (g) + H 2 O ⇌ SO 2 ?? H 2 O
- SO 2 ?? H 2 O ⇌ H + + HSO 3 -
- HSO 3 - ⇌ H + + SO 3 2-
- Oxydation
Il existe un grand nombre de r??actions aqueuses que oxyder le soufre ?? partir de S ( IV ) ?? S (VI), conduisant ?? la formation d'acide sulfurique. Les r??actions d'oxydation avec les plus importantes sont l'ozone , le peroxyde d'hydrog??ne et de l'oxyg??ne (r??actions avec l'oxyg??ne sont catalys??es par le fer et le mangan??se dans les gouttelettes de nuages).
Pour plus d'informations, voir Seinfeld et Pandis (1998).
Les d??p??ts acides
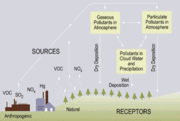
Le d??p??t humide
Le d??p??t humide d'acides se produit lorsque toute forme de pr??cipitations (pluie, neige, etc.) ??limine les acides de l'atmosph??re et le remet ?? la surface de la Terre. Cela peut r??sulter du d??p??t d'acides produits dans les gouttes d'eau (voir la chimie en phase aqueuse ci-dessus) ou par la pr??cipitation ??limination des acides dans les nuages ou l'autre ou au-dessous des nuages. Enl??vement par voie humide des deux gaz et a??rosols sont ?? la fois de l'importance pour les d??p??ts humides.
Le d??p??t sec
Les d??p??ts acides se produit ??galement par d??p??t sec en l'absence de pr??cipitations. Ce peut ??tre responsable d'autant que 20 ?? 60% des d??p??ts acides totaux. Cela se produit lorsque les gaz et les particules adh??rent au sol, les plantes ou d'autres surfaces.
Les effets ind??sirables

Les pluies acides a ??t?? montr?? pour avoir des effets n??fastes sur les for??ts, les eaux douces et les sols, tuer les insectes et les formes de vie aquatiques ainsi que causer des dommages aux b??timents et ayant les impacts possibles sur la sant?? humaine.
Les eaux de surface et les animaux aquatiques
Tant le pH faible et des concentrations en aluminium sup??rieures dans les eaux de surface qui se produisent ?? la suite des pluies acides peuvent causer des dommages aux poissons et autres animaux aquatiques. A des pH inf??rieur ?? 5 oeufs plupart des poissons ne seront pas ??clore et pH inf??rieurs peuvent tuer les poissons adultes. Comme lacs deviennent plus acide biodiversit?? est r??duite. Les pluies acides a ??limin?? la vie des insectes et de certaines esp??ces de poissons, y compris le omble de fontaine dans certains cours d'eau et les ruisseaux des Appalaches. Cependant, il ya eu un d??bat sur la mesure dans laquelle les pluies acides contribue ?? l'acidit?? des lacs (?? savoir que de nombreux lacs acides peuvent entra??ner principalement des caract??ristiques du bassin hydrographique, et non la pluie elle-m??me). Le Site web des Etats de l'EPA: "Sur les lacs et cours d'eau ??tudi??s, les pluies acides caus??es acidit?? dans 75 pour cent des lacs acides et environ 50 pour cent des flux acides".
Sols
Biologie du sol peut ??tre s??rieusement endommag?? par les pluies acides. Certains tropicale microbes peuvent rapidement consomment acides mais d'autres microbes sont incapables de tol??rer des pH bas et sont tu??s. Le de ces enzymes sont des microbes d??natur?? (chang?? de forme de sorte qu'ils ne fonctionnent plus) par l'acide. Les ions hydronium des pluies acides mobilisent aussi toxines et filtrer au nutriments et min??raux essentiels
- 2 H + (aq) + Mg 2+ (argile) ⇌ 2H + (argile) + Mg2 + (aq)
Les for??ts et autres types de v??g??tation

Les effets ind??sirables peuvent ??tre indirectement li??es aux pluies acides, comme les effets de l'acide sur le sol (voir ci-dessus) ou ?? haute concentration de pr??curseurs gazeux ?? la pluie acide. For??ts d'altitude sont particuli??rement vuln??rables car ils sont souvent entour??s de nuages et le brouillard qui sont plus acide que la pluie.
D'autres plantes peuvent aussi ??tre endommag??s par les pluies acides, mais l'effet sur les cultures vivri??res sont minimis??s par l'application d'engrais pour remplacer les nutriments perdus. Dans les zones cultiv??es, le calcaire peut ??galement ??tre ajout?? pour augmenter la capacit?? du sol ?? maintenir la stabilit?? du pH, mais cette tactique est en grande partie inutilisables dans le cas des terres sauvages. Les pluies acides ??puise les min??raux du sol et il entrave la croissance de la plante.
Sant?? humaine
Certains scientifiques ont sugg??r?? des liens directs pour la sant?? humaine, mais aucune n'a ??t?? prouv??e .. Cependant, particules fines, une grande partie de ce qui sont form??es ?? partir des m??mes gaz que les pluies acides (dioxyde de soufre et le dioxyde d'azote), ont ??t?? montr?? pour causer la maladie et aux d??c??s pr??matur??s comme le cancer et d'autres maladies mortelles Pour plus d'informations sur les effets sur la sant?? des a??rosols voir effets sur la sant?? de particules.
Autres effets n??fastes

Les pluies acides peuvent aussi causer des dommages ?? certains mat??riaux de construction et des monuments historiques. Ce est parce que l'acide sulfurique dans la pluie r??agit chimiquement avec les compos??s de calcium dans les pierres (calcaire, gr??s, marbre et granit) pour cr??er le gypse, qui a ensuite ??caille.
- CaCO 3 (s) + H 2 SO 4 (aq) ⇌ CaSO 4 (aq) + CO 2 (g) + H 2 O (l)
Ce est ??galement souvent observ??e sur les vieilles pierres tombales o?? la pluie acide peut causer l'inscription pour devenir compl??tement illisible. Les pluies acides provoque ??galement une augmentation du taux d'oxydation du fer. La visibilit?? est aussi r??duite de sulfate et de nitrate dans l'atmosph??re.
Zones touch??es
Endroits particuli??rement touch??s dans le monde entier comprennent la plupart de l'Europe (en particulier Scandinavie avec de nombreux lacs d'eau acide contenant pas de vie et de nombreux arbres morts) de nombreuses parties du Etats-Unis (Etats comme New York sont tr??s durement touch??e) et le Sud-Ouest du Canada . Autres zones touch??es comprennent la c??te Sud-Est de la Chine et de Taiwan .
Les probl??mes potentiels dans l'avenir
Des endroits comme une grande partie de l'Asie du Sud ( Indon??sie , Malaisie et Tha??lande ), Western Afrique du Sud (pays), dans le sud de l'Inde et du Sri Lanka et m??me Afrique de l'Ouest (des pays comme le Ghana , Togo ] et Nigeria ) pourraient tous ??tre sujettes ?? des pr??cipitations acides dans le avenir.
Les m??thodes de pr??vention
Les solutions techniques
Aux ??tats-Unis, de nombreux charbon br??lant centrales utilisent D??sulfuration des gaz de combustion (DGC) pour ??liminer les gaz contenant du soufre de leurs gaz de chemin??e. Un exemple de FGD est l'??purateur par voie humide qui est couramment utilis?? aux ??tats-Unis et de nombreux autres pays. Un laveur humide est essentiellement une tour de r??action ??quip?? d'un ventilateur qui extrait les gaz de combustion de la fum??e chaude d'une centrale ??lectrique dans la tour. Chaux ou du calcaire sous forme de suspension est ??galement inject??s dans la tour de se m??langer avec les gaz de combustion et de combiner avec le dioxyde de soufre pr??sent. Le carbonate de calcium de la chaux produit du sulfate de calcium ?? pH neutre qui est physiquement retir?? de la tour de lavage. Autrement dit, l'??purateur se pollution de soufre en sulfates industriels.
Dans certaines r??gions, les sulfates sont vendus ?? des entreprises chimiques comme le gypse lorsque la puret?? de sulfate de calcium est ??lev??. Dans d'autres cas, ils sont plac??s dans enfouissement. Cependant, les effets des pluies acides peuvent durer pendant des g??n??rations, que les effets du changement de niveau de pH peuvent stimuler la lixiviation continue de produits chimiques ind??sirables dans les sources d'eau autrement primitifs, tuant esp??ces d'insectes et de poissons vuln??rables et en bloquant les efforts visant ?? restaurer la vie indig??ne.
Automobile contr??le des ??missions r??duit les ??missions d'oxydes d'azote des v??hicules ?? moteur.
Les trait??s internationaux
Un certain nombre de trait??s internationaux sur le transport ?? longue distance des polluants atmosph??riques ont ??t?? convenues par exemple Les ??missions de soufre Protocole de r??duction dans le cadre du Convention sur la pollution atmosph??rique transfronti??re ?? longue distance.
L'??change d'??missions
Un r??gime de r??glementation plus r??cente implique ??change de droits d'??missions. Dans ce sch??ma, toutes les installations polluantes en cours est donn?? une licence d'??mission qui devient une partie des biens d'??quipement. Les op??rateurs peuvent alors installer des ??quipements de contr??le de la pollution, et de vendre une partie de leurs licences d'??missions. L'intention de ce est de donner aux op??rateurs des incitations ??conomiques pour installer les contr??les de pollution.
