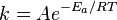L'??nergie d'activation
Renseignements g??n??raux
Enfants SOS ont produit une s??lection d'articles de wikipedia pour les ??coles depuis 2005. Avez-vous voulez savoir sur le parrainage? Voir www.sponsorachild.org.uk

Dans la chimie , de l'??nergie d'activation est un terme introduit en 1889 par le scientifique su??dois Svante Arrhenius qui est d??finie comme l'??nergie minimum qui doit ??tre entr??e dans un syst??me chimique, contenant des r??actifs potentiels, pour qu'une r??action chimique ait lieu. L'??nergie d'activation peut ??galement ??tre d??finie comme l'??nergie minimale n??cessaire pour d??marrer une r??action chimique. L'??nergie d'activation de la r??action est habituellement d??sign??e par E et une donn??e en unit??s de kilojoules par mole.
L'??nergie d'activation peut ??tre consid??r??e comme la hauteur de la barri??re de potentiel (parfois appel??e la barri??re d'??nergie) s??parant deux minima de l'??nergie potentielle (des r??actifs et des produits d'une r??action). Pour une r??action chimique de se d??rouler ?? une vitesse raisonnable, il devrait exister un nombre appr??ciable de mol??cules ayant une ??nergie ??gale ou sup??rieure ?? l'??nergie d'activation.
A un niveau plus avanc??, le terme d'??nergie d'activation d'Arrhenius de l'??quation d'Arrhenius est mieux consid??r?? comme un param??tre d??termin?? exp??rimentalement qui indique la sensibilit?? de la vitesse de r??action ?? la temp??rature. Il ya deux objections ?? associer cette ??nergie d'activation avec la barri??re de seuil pour une r??action ??l??mentaire. Tout d'abord, il est souvent difficile de savoir si ou non r??action ne se d??roule en une seule ??tape; barri??res de seuil qui sont r??parties sur la totalit?? ??tapes ??l??mentaires ont peu de valeur th??orique. Deuxi??mement, m??me si la r??action ??tudi??e est ??l??mentaire, un spectre de collisions individuelles contribue ?? ??valuer constantes obtenues en vrac (??ampoule??) exp??riences impliquant des milliards de mol??cules, avec beaucoup de diff??rentes g??om??tries et des angles r??actif collision, translation diff??rente et (??ventuellement) de vibration - toutes les ??nergies qui peuvent conduire ?? des vitesses de r??action microscopiques.
??nergie d'activation n??gative
Dans certains cas, les taux de r??action diminuent lorsque la temp??rature augmente. En suivant une relation approximativement exponentielle de sorte que la constante de vitesse peut encore ??tre apte ?? une expression Arrhenius, cela se traduit par une valeur n??gative de E un. R??actions ??l??mentaires pr??sentant ces ??nergies d'activation n??gatifs sont g??n??ralement des r??actions sans barri??res, dans lequel la proc??dure de r??action repose sur la capture des mol??cules dans un puits de potentiel. L'augmentation de la temp??rature conduit ?? une probabilit?? r??duite de mol??cules de capture qui entrent en collision les uns des autres (avec plus de collisions de Bragg ne conduisant pas ?? une r??action ult??rieure comme la dynamique entra??ne les particules qui entrent en collision sur le puits de potentiel), exprim?? en r??action section transversale qui diminue lorsque la temp??rature augmente. Une telle situation ne est plus lui-m??me conduit ?? diriger les interpr??tations que la hauteur d'un spot potentiel.
l'ind??pendance de la temp??rature et de la relation de l'??quation d'Arrhenius
Le Donne l'??quation d'Arrhenius base quantitative de la relation entre l'??nergie d'activation et la vitesse ?? laquelle la r??action se poursuit. De l'??quation d'Arrh??nius, l'??nergie d'activation peut ??tre exprim??e comme
o?? A est la facteur de fr??quence pour la r??action, R est le universel constante des gaz, T est la temp??rature (en degr??s Kelvin ), et k est le la vitesse de r??action de coefficient. Bien que cette ??quation indique que l'??nergie d'activation d??pend de la temp??rature, dans les r??gimes o?? l'??quation d'Arrhenius est valide ce est annul??e par la d??pendance en temp??rature de k. Ainsi, un E peut ??tre ??valu??e ?? partir de la constante de vitesse de r??action ?? toute temp??rature (?? moins de la validit?? de l'??quation d'Arrhenius).
Catalyse
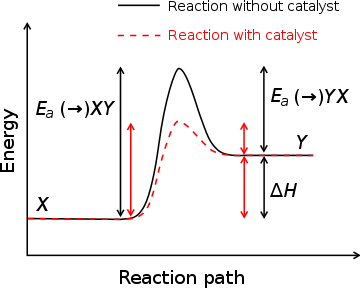
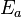 ) Et enthalpie de formation (Δ H) avec et sans catalyseur, trac?? contre le coordonn??e de r??action. La position de la plus haute ??nergie (de la position du pic) repr??sente l'??tat de transition. Avec le catalyseur, l'??nergie n??cessaire pour entrer des diminutions d'??tat de transition, ce qui diminue l'??nergie n??cessaire pour amorcer la r??action.
) Et enthalpie de formation (Δ H) avec et sans catalyseur, trac?? contre le coordonn??e de r??action. La position de la plus haute ??nergie (de la position du pic) repr??sente l'??tat de transition. Avec le catalyseur, l'??nergie n??cessaire pour entrer des diminutions d'??tat de transition, ce qui diminue l'??nergie n??cessaire pour amorcer la r??action. Une substance qui modifie l'??tat de transition d'abaisser l'??nergie d'activation est appel?? un catalyseur ; un biologique est appel??e un catalyseur enzyme. Il est important de noter que le catalyseur augmente la vitesse de r??action sans ??tre consomm?? par elle. En outre, tandis que le catalyseur abaisse l'??nergie d'activation, il ne modifie pas les ??nergies des r??actifs ou des produits d'origine. Au contraire, l'??nergie r??active et l'??nergie du produit restent les m??mes et que l'??nergie d'activation est modifi??e (abaiss??).
Relations avec ??nergie libre de Gibbs
Dans le ??quation d'Arrh??nius, l'??nergie d'activation de l'expression (E a) est utilis?? pour d??crire l'??nergie n??cessaire pour atteindre le ??tat de transition. De m??me, la Eyring ??quation est une ??quation similaire qui d??crit ??galement la vitesse d'une r??action. Au lieu d'en utilisant ??galement E a, cependant, l'??quation Eyring utilise le concept de Gibbs l'??nergie libre et le symbole * 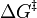 pour d??signer l'??nergie de la ??tat de transition.
pour d??signer l'??nergie de la ??tat de transition.