
Anticorps
Saviez-vous ...
Cette s??lection de wikipedia a ??t?? choisi par des b??n??voles aidant les enfants SOS de Wikipedia pour cette s??lection Wikipedia pour les ??coles. SOS Enfants a regard?? des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?

Anticorps (??galement appel??s immunoglobulines) sont gamma-globuline prot??ines que l'on trouve dans le sang ou autre les fluides corporels de vert??br??s , et sont utilis??s par le syst??me immunitaire pour identifier et neutraliser des corps ??trangers, tels que les bact??ries et les virus . Ils sont typiquement constitu??s de motifs structuraux de base - chacun avec deux grandes cha??nes lourdes et deux petites - cha??nes l??g??res pour former, par exemple, monom??res ?? une unit??, dim??res avec deux unit??s ou pentam??res avec cinq unit??s. Les anticorps sont produits par une esp??ce de globule blanc appel?? Cellule h??te. Il existe plusieurs types de cha??nes lourdes d'anticorps, et de plusieurs types diff??rents d'anticorps, qui sont regroup??es en diff??rentes isotypes sur la base duquel la cha??ne lourde qu'ils poss??dent. Cinq isotypes d'anticorps diff??rents sont connus chez les mammif??res, qui effectuent des r??les diff??rents, et une aide directe de la r??ponse immunitaire appropri??e pour chaque type d'objet ??trang??re diff??rente qu'ils rencontrent.
Bien que la structure g??n??rale de tous les anticorps est tr??s similaire, une petite r??gion ?? l'extr??mit?? de la prot??ine est extr??mement variable, permettant ?? des millions d'anticorps avec peu diff??rentes structures ?? pointes d'exister. Cette r??gion est appel??e la r??gion hypervariable. Chacune de ces variantes peuvent se lier ?? une cible diff??rente, connue en tant que antig??ne. Cette grande diversit?? d'anticorps permet au syst??me immunitaire ?? reconna??tre une aussi grande diversit?? d'antig??nes. La partie unique de l'antig??ne reconnu par un anticorps est appel??e epitope. Ces epitopes se lient avec leurs anticorps ?? une interaction hautement sp??cifique, appel??e ajustement induit, qui permet d'identifier des anticorps et ne lient que leur antig??ne unique dans le milieu des millions de mol??cules diff??rentes qui composent un organisme . La reconnaissance d'un antig??ne par un anticorps ??tiquettes pour elle attaque par d'autres parties du syst??me immunitaire. Les anticorps peuvent ??galement neutraliser des objectifs directement, par exemple, une liaison ?? une partie d'un agent pathog??ne dont il a besoin pour provoquer une infection.
La population importante et diversifi??e d'anticorps est g??n??r?? par des combinaisons al??atoires d'un ensemble de des segments de g??nes qui codent pour l'antig??ne de liaison diff??rents sites (ou paratopes), suivis par hasard des mutations dans cette r??gion du g??ne d'anticorps, ce qui cr??e en outre la diversit??. Les g??nes d'anticorps ??galement r??organiser dans un processus appel?? la commutation de classe qui change la base de la cha??ne lourde de l'autre, cr??ant ainsi un autre isotype de l'anticorps qui conserve la r??gion variable sp??cifique de l'antig??ne. Cela permet ?? un seul anticorps pour ??tre utilis?? par plusieurs parties diff??rentes du syst??me immunitaire. La production d'anticorps est la fonction principale de la syst??me immunitaire humoral.
Formes d'anticorps
Les cellules B activ??es diff??rencier en cellules soit produisant des anticorps appel??s les cellules plasmatiques qui s??cr??tent des anticorps soluble, ou en cellules de m??moire qui survivent dans le corps pendant des ann??es pour permettre au syst??me immunitaire de se rappeler un antig??ne et r??pondre plus rapidement sur les expositions futures. Les anticorps sont, par cons??quent, un produit essentiel de la le syst??me immunitaire adaptatif qui apprend et se souvient des r??ponses ?? des agents pathog??nes envahisseurs. Anticorps se produisent sous deux formes: une soluble forme s??cr??t??e dans le sang et d'autres fluides dans le corps, et un forme li??e ?? la membrane qui est fix??e ?? la surface d'un Cellule h??te.
Anticorps solubles qui sont s??cr??t??es ?? partir d'une cellule B activ??e (dans sa forme des cellules plasmatiques) de liaison ?? des substances ??trang??res et le signal pour leur destruction par le reste du syst??me immunitaire. Ils peuvent aussi ??tre appel??s anticorps libres (jusqu'?? ce qu'ils lient un antig??ne et deviennent partie int??grante d'un complexe immun) ou des anticorps s??cr??t??s.
La forme d'un anticorps li?? ?? la membrane peut ??tre appel?? une immunoglobuline de surface (Sig) ou une immunoglobuline de membrane (MIG). Elle fait partie du r??cepteur de cellule B (BCR), ce qui permet ?? une cellule B pour d??tecter le moment o?? un antig??ne sp??cifique est pr??sent dans le corps et d??clenche l'activation des cellules B. La BCR est compos?? de IgD ou IgM de surface li?? et associ?? Ig-α et β-Ig h??t??rodim??res, qui sont capables de la transduction de signal. Une cellule B humaine typique aura 50 000 ?? 100 000 anticorps li??s ?? sa surface. Lors de la liaison antig??ne, ils se regroupent dans de grandes parcelles, qui peuvent d??passer 1 microm??tre de diam??tre, sur des radeaux lipidiques qui isolent les RCO de la plupart des autres r??cepteurs de signalisation cellulaire. Ces correctifs peuvent am??liorer l'efficacit?? de la r??ponse immunitaire cellulaire. Chez l'homme, la surface de la cellule est ?? nu autour des r??cepteurs des cellules B pour plusieurs milliers d'Angstr??ms, ce qui r??duit encore les BCR isole des influences contradictoires.
Isotypes
| Nom | Types | Description | Anticorps Complexes |
| IgA | 2 | Trouv?? dans les zones de la muqueuse, tels que la Gut, les voies respiratoires et urog??nitale voies, et emp??che la colonisation par agents pathog??nes. On trouve ??galement dans la salive, les larmes, et le lait maternel. |  |
| IgD | 1 | Fonctions principalement comme un r??cepteur de l'antig??ne sur les cellules B qui ne ont pas ??t?? expos??es ?? des antig??nes. Sa fonction est moins d??fini que les autres isotypes. | |
| IgE | 1 | Se lie ?? allerg??nes et les d??clencheurs la lib??ration d'histamine les mastocytes et basophiles, et est impliqu?? dans l'allergie . Prot??ge ??galement contre des vers parasites. | |
| IgG | 4 | Dans ses quatre formes, fournit la majorit?? de l'immunit?? ?? base d'anticorps contre les agents pathog??nes envahisseurs. Le seul anticorps capable de traverser le placenta pour obtenir une immunit?? passive au foetus. | |
| IgM | 1 | Exprim??e ?? la surface des cellules B et sous une forme s??cr??t??e avec une tr??s grande avidit??. ??limine les agents pathog??nes dans les premiers stades de la cellule B m??diation (humorale) l'immunit?? avant qu'il y ait suffisamment de IgG. |
Les anticorps peuvent venir de diff??rentes vari??t??s connues comme isotypes ou des classes. En les mammif??res placentaires, il existe cinq isotypes d'anticorps connus comme IgA, IgD, IgE, IgG et IgM. Ils sont chacun nomm??s avec un pr??fixe "Ig" qui signifie immunoglobuline, un autre nom pour l'anticorps, et diff??rent dans leurs propri??t??s biologiques, les lieux fonctionnels et capacit?? ?? traiter avec diff??rents antig??nes, comme illustr?? dans le tableau.
L'isotype de l'anticorps d'une cellule B cellule change au cours d??veloppement et activation. Cellules B immatures, qui ne ont jamais ??t?? expos??s ?? un antig??ne, sont connus comme des cellules B na??ves et ne expriment que l'isotype IgM sous une forme li??e ?? la surface cellulaire. cellules B commencent ?? exprimer ?? la fois IgM et IgD quand ils atteignent la maturit?? - la co-expression de ces deux isotypes d'immunoglobulines rend la cellule B ??mature?? et pr??t ?? r??pondre ?? l'antig??ne. l'activation des cellules B se ensuit engagement de la mol??cule d'anticorps de cellules li?? ?? un antig??ne, ce qui provoque la cellule de se diviser et diff??rencier en une cellule productrice d'anticorps appel?? plasmocytaire. Dans cette forme activ??e, la cellule B commence ?? produire des anticorps dans un s??cr??t??e forme plut??t qu'une forme li??e ?? la membrane. Certains cellules filles des cellules B activ??es subissent commutation isotypique, un m??canisme qui provoque la production d'anticorps pour passer de IgM ou IgD aux autres isotypes d'anticorps IgE, IgA ou IgG, qui ont d??fini les r??les dans le syst??me immunitaire.
Structure
Les anticorps sont lourds (~ 150k Da) globulaire prot??ines plasmatiques qui sont ??galement connus comme les immunoglobulines. Ils ont des cha??nes ajout??s ?? certains de leurs de sucre d'acides amin??s des r??sidus. En d'autres termes, les anticorps sont glycoprot??ines. L'unit?? fonctionnelle de base de chaque anticorps est une immunoglobuline (Ig) monom??re (contenant une seule unit?? Ig); anticorps s??cr??t??s peuvent ??galement ??tre dim??re avec deux unit??s Ig comme avec IgA, t??tram??re avec quatre unit??s de Ig tels que poissons t??l??ost??ens IgM, ou pentam??re avec cinq unit??s d'Ig, comme des IgM chez les mammif??res.
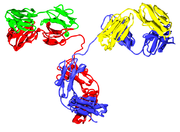
domaines d'immunoglobuline
Le monom??re Ig est une "Y" en forme de mol??cule qui se compose de quatre cha??nes polypeptide; deux cha??nes lourdes identiques et deux cha??nes l??g??res identiques reli??s par des liaisons disulfure. Chaque cha??ne se compose de domaines structuraux appel??s domaines Ig. Ces domaines contiennent environ 70 ?? 110 acides amin??s et sont class??s en diff??rentes cat??gories (par exemple, une variable ou IgV et constante ou CIG) en fonction de leur taille et de la fonction. Ils ont une caract??ristique immunoglobuline pli dans lequel deux feuillets b??ta cr??er une forme ??sandwich??, tenue ensemble par des interactions entre conserv?? cyst??ines et d'autres acides amin??s charg??s.
Cha??ne lourde
Il existe cinq types de mammif??res Ig cha??ne lourde d??sign??s par les lettres grecques : α, δ, ε, γ et μ. Le type de cha??ne lourde pr??sente d??finit la classe d'anticorps; ces cha??nes se trouvent dans les IgA, IgD, IgE, IgG et IgM, respectivement. Cha??nes lourdes distinctes diff??rent par la taille et la composition; α et γ contenir environ 450 acides amin??s, tandis que μ et ε ont environ 550 acides amin??s .
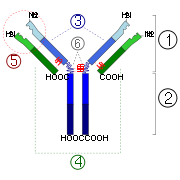
2. R??gion Fc
3. Avec une cha??ne lourde variable (VH) suivi d'un domaine domaine constant (CH1), une r??gion charni??re, et deux plus constante (C H 2 et C H 3) domaines.
4. Cha??ne l??g??re avec une variable (V L) et une constante (C L) domaine
Site de liaison 5. antig??ne (paratope)
6. r??gions de charni??re.
Chaque cha??ne lourde poss??de deux r??gions, la r??gion constante et la r??gion variable. La r??gion constante est identique dans tous les anticorps du m??me isotype, mais en diff??re par les anticorps de diff??rents isotypes. Les cha??nes lourdes γ, α et δ avoir une r??gion constante compos?? de trois tandem (en ligne) Ig domaines et une r??gion charni??re pour plus de flexibilit??; Les cha??nes lourdes μ et ε ont une r??gion constante compos??e de quatre domaines de type immunoglobuline. La r??gion variable de la cha??ne lourde est diff??rente dans diff??rents anticorps produits par les cellules B, mais est le m??me pour tous les anticorps produits par une seule cellule B ou B clone cellulaire. La r??gion variable de chaque cha??ne lourde est d'environ 110 acides amin??s de longueur et est compos??e d'un seul domaine de type Ig.
Cha??ne l??g??re
Chez les mammif??res, il existe deux types de cha??ne l??g??re, qui sont appel??s lambda (λ) et kappa (κ). Une cha??ne l??g??re poss??de deux domaines successifs: un domaine constant et un domaine variable. La longueur approximative d'une cha??ne l??g??re est de 211 ?? 217 acides amin??s. Chaque anticorps contenant deux cha??nes l??g??res qui sont toujours identiques; un seul type de cha??ne l??g??re, κ ou λ, est pr??sent par anticorps chez des mammif??res. D'autres types de cha??nes l??g??res, telles que la cha??ne iota (ι), se trouvent dans inf??rieurs vert??br??s comme Chondrichthyes et Teleostei.
R??gions Fab et Fc
Certaines parties d'un anticorps ont des fonctions uniques. Les extr??mit??s de l'Y, par exemple, contiennent le site qui lie l'antig??ne et, par cons??quent, de reconna??tre des objets ??trangers sp??cifiques. Cette r??gion de l'anticorps est appel?? le Fab (fragment, liaison ?? l'antig??ne) r??gion. Il est compos?? d'une constante et une de chaque domaine variable de cha??ne lourde et l??g??re de l'anticorps. Le paratope est conform??e ?? la l'extr??mit?? terminale amino de l'anticorps monom??re par les domaines variables des cha??nes lourdes et l??g??res.
La base du Y joue un r??le dans la modulation de l'activit?? des cellules immunitaires. Cette r??gion est appel??e la Fc (fragment cristallisable) r??gion, et se compose de deux cha??nes lourdes qui contribuent deux ou trois domaines constants en fonction de la classe de l'anticorps. En se liant ?? des prot??ines sp??cifiques de la r??gion Fc se assure que chaque anticorps produit une r??ponse immunitaire appropri??e pour un antig??ne donn??. La r??gion Fc se lie ??galement ?? divers cellule r??cepteurs, tels que Les r??cepteurs Fc, et d'autres mol??cules immunes, telles que prot??ines du compl??ment. En faisant cela, il m??die diff??rent y compris les effets physiologiques opsonisation, cellule lyse, et de d??granulation mastocytes, basophiles et ??osinophiles.
Fonction
Depuis anticorps existent librement dans le sang, ils sont consid??r??s comme faisant partie de la syst??me immunitaire humoral. Les anticorps circulants sont produits par les cellules B clonales qui r??pondent sp??cifiquement ?? un seul antig??ne, un virus fragment de prot??ine de coque, par exemple. Anticorps contribuent ?? l'immunit?? de trois fa??ons principales: ils peuvent emp??cher les agents pathog??nes de p??n??trer ou d'endommager les cellules en se liant ?? eux; ils peuvent stimuler l'??limination d'un agent pathog??ne par macrophages et d'autres cellules par l'agent pathog??ne rev??tement; et ils peuvent d??clencher la destruction des agents pathog??nes directe en stimulant d'autres r??ponses immunitaires comme le voie compl??ment.
L'activation du compl??ment
Les anticorps qui se lient ?? des antig??nes de surface, par exemple une bact??rie, d'attirer le premier composant de la compl??ter cascade avec leur r??gion Fc et initier l'activation du syst??me du compl??ment "classique". Il en r??sulte la destruction des bact??ries de deux fa??ons. Tout d'abord, la liaison de l'anticorps et le compl??ment mol??cules marque le microbe pour l'ingestion par les phagocytes dans un processus appel?? opsonisation; ces phagocytes sont attir??s par certaines mol??cules du compl??ment g??n??r??s dans la cascade du compl??ment. D'autre part, certains composants du syst??me du compl??ment forment un complexe d'attaque membranaire pour aider les anticorps ?? tuer la bact??rie directement.
L'activation des cellules effectrices
Pour combattre les pathog??nes qui r??pliquent l'ext??rieur des cellules, anticorps se lient ?? des agents pathog??nes pour les relier entre eux, les obligeant ?? agglutinent. Depuis un anticorps comporte au moins deux paratopes il peut se lier plus d'un antig??ne par liaison ?? des epitopes identiques effectu??es sur les surfaces de ces antig??nes. En rev??tant l'agent pathog??ne, les anticorps stimulent les fonctions effectrices contre l'agent pathog??ne dans des cellules qui reconnaissent leur r??gion Fc.
Ces cellules qui reconnaissent les pathog??nes enrob??s ont des r??cepteurs Fc qui, comme son nom l'indique, interagit avec le R??gion Fc d'anticorps IgA, IgG, IgE et. L'engagement d'un anticorps particulier avec le r??cepteur Fc sur une cellule particuli??re d??clenche une fonction effectrice de la cellule; phagocytes sera phagocytose, les mastocytes et neutrophiles sera d??granulent, cellules tueuses naturelles lib??reront cytokines et mol??cules cytotoxiques; qui finira par entra??ner la destruction du microbe envahissant. Les r??cepteurs Fc sont sp??cifiques d'un isotype, ce qui donne une plus grande souplesse au syst??me immunitaire, en invoquant que les m??canismes immunitaires appropri??es pour les agents pathog??nes distincts.
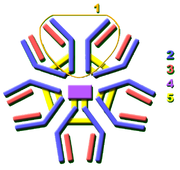
diversit?? d'immunoglobulines
Pratiquement tous les microbes peuvent d??clencher une r??ponse d'anticorps. La reconnaissance r??ussie et l'??radication de nombreux types de microbes n??cessite la diversit?? parmi les anticorps; leur composition en acides amin??s varie en leur permettant d'interagir avec de nombreux antig??nes diff??rents. Il a ??t?? estim?? que les humains produisent environ 10 milliards anticorps diff??rents, chacun ??tant capable de se lier ?? un epitope d'un antig??ne distinct. Bien qu'un vaste r??pertoire d'anticorps diff??rents est g??n??r?? en une seule personne, le nombre de g??nes disponibles pour rendre ces prot??ines est limit??e. Plusieurs m??canismes g??n??tiques complexes ont ??volu?? qui permettent aux cellules de vert??br??s B afin de g??n??rer un ensemble diversifi?? d'anticorps ?? partir d'un nombre relativement faible de g??nes d'anticorps.
La variabilit?? de domaine
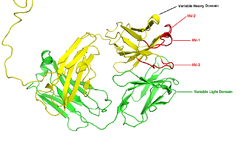
La r??gion (locus) d'un chromosome qui code pour un anticorps est grande et contient plusieurs g??nes distincts pour chaque domaine de l'anticorps - du locus contenant des g??nes de cha??ne lourde ( IGH @) se trouve sur chromosome 14, et le locus contenant des g??nes de cha??ne l??g??re kappa et lambda ( IGL @ et IGK @) se trouvent sur les chromosomes 22 et 2 chez l'homme. Un de ces domaines est appel?? le domaine variable, qui est pr??sent dans chaque cha??ne lourde et l??g??re de chaque anticorps, mais peut varier selon les anticorps g??n??r??s ?? partir de cellules B distinctes. Les diff??rences entre les domaines variables, sont situ??s sur trois boucles appel??es r??gions hypervariables (HV-1, HV-2 et HT-3) ou les r??gions d??terminant la compl??mentarit?? (CDR1, CDR2 et CDR3). CDR sont pris en charge dans les domaines variables par r??gions cadres conserv??s. Le locus de cha??ne lourde contient environ 65 g??nes diff??rents de domaine variable que tous se distinguent par leur CDR. La combinaison de ces g??nes avec un ensemble de g??nes pour d'autres domaines de l'anticorps g??n??re une grande cavaliers d'anticorps avec un degr?? ??lev?? de variabilit??. Cette combinaison est appel??e V (D) J recombinaison discut?? ci-dessous.
V (D) J recombinaison
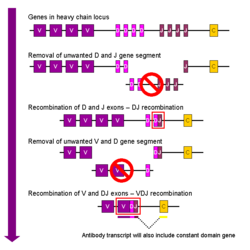
Recombinaison somatique des immunoglobulines, aussi connu comme V (D) J recombinaison implique la g??n??ration d'une r??gion variable d'immunoglobuline unique. La r??gion variable de chaque cha??ne lourde ou l??g??re d'immunoglobuline est cod?? en plusieurs morceaux - connu sous le nom de segments de g??nes. Ces segments sont appel??s variable (V), diversit?? (D) et de jonction (J) segments. V, D et J sont pr??sents dans des segments Ig cha??nes lourdes, mais seulement les segments V et J sont pr??sents dans Cha??nes l??g??res Ig. Des copies multiples du V, D et J segments de g??nes existent, et sont dispos??s en tandem dans le g??nomes de mammif??res . Dans la moelle osseuse, le d??veloppement de chaque cellule B assembler une r??gion variable d'immunoglobuline en s??lectionnant et en combinant de fa??on al??atoire une V, une D et un segment J du g??ne (ou une V et un segment J de la cha??ne l??g??re). Comme il existe de multiples copies de chaque type de segment de g??ne, et diff??rentes combinaisons de segments de g??nes peuvent ??tre utilis??es pour g??n??rer chaque r??gion variable d'immunoglobuline, ce proc??d?? g??n??re un grand nombre d'anticorps, chacun avec diff??rents paratopes, et donc diff??rentes sp??cificit??s antig??niques.
Apr??s une cellule B produit un g??ne d'immunoglobuline fonctionnel au cours de V (D) J recombinaison, elle ne peut exprimer ne importe quelle autre r??gion variable (un processus connu sous le nom all??lique exclusion) ainsi chaque cellule B peut produire des anticorps contenant un seul type de cha??ne variable.
Hypermutation somatique et la maturation d'affinit??
Un autre m??canisme qui g??n??re une diversit?? d'anticorps se produit dans la cellule B mature. Apr??s l'activation avec l'antig??ne, les lymphocytes B commencent ?? prolif??rer rapidement. Dans ces cellules ?? division rapide, les g??nes codant pour les domaines variables des cha??nes lourdes et l??g??res sont soumis ?? un taux ??lev?? de mutation ponctuelle, par un appel?? hypermutation somatique de processus (SHM). SHM r??sultats dans environ un changement de nucleotide par le g??ne variable, par la division cellulaire. Par cons??quent, toute cellule fille B vont acqu??rir l??g??res acides amin??s diff??rences dans les domaines variables de leurs cha??nes d'anticorps.
Hypermutation somatique sert ?? augmenter la diversit?? de la piscine d'anticorps et les effets de l'anticorps de liaison ?? l'antig??ne affinit??. Certaines mutations ponctuelles se traduira par la production d'anticorps qui ont une interaction faible (faible affinit??) avec leur antig??ne de l'anticorps d'origine, et certaines mutations vont g??n??rer des anticorps ayant une interaction plus forte (haute affinit??). les cellules B qui expriment des anticorps de haute affinit?? sur leur surface recevront un signal de survie forte lors des interactions avec d'autres cellules, tandis que ceux avec des anticorps de faible affinit?? sera pas, et mourront par apoptose. Ainsi, les cellules B exprimant des anticorps avec une affinit?? plus ??lev??e pour l'antig??ne seront supplanter ceux avec des affinit??s plus faibles pour la fonction et la survie. Le processus de g??n??rer des anticorps ayant des affinit??s de liaison accrue est appel?? maturation d'affinit??. La maturation d'affinit?? se produit dans les cellules B matures apr??s V (D) J recombinaison, et d??pend de l'aide de cellules T auxiliaires.

commutation de classe
La commutation isotypique ou classe est une processus biologique se produisant apr??s l'activation de la cellule h??te, ce qui permet ?? la cellule de produire diff??rentes classes d'anticorps (IgA, IgE, IgG) ou. Les diff??rentes classes d'anticorps, et donc des fonctions effectrices, sont d??finies par les r??gions (C) de la cha??ne lourde d'immunoglobuline constant. Initialement, les cellules B na??ves expriment seulement IgM de surface cellulaire et IgD avec les r??gions de liaison d'antig??ne identiques. Chaque isotype est adapt?? ?? une fonction distincte, par cons??quent, apr??s activation, un anticorps ayant une fonction effectrice IgG, IgA, IgE ou peut ??tre n??cessaire pour ??liminer efficacement un antig??ne. la commutation de classe permet diff??rentes cellules filles ?? partir de la m??me cellule B activ??e pour produire des anticorps de diff??rents isotypes. Seule la r??gion constante des changements anticorps de cha??ne lourde pendant la commutation de classe; les r??gions variables, et donc la sp??cificit?? d'antig??nes, restent inchang??s. Ainsi, la descendance d'une seule cellule B peut produire des anticorps sp??cifiques, tous pour le m??me antig??ne, mais avec la capacit?? de produire la fonction d'effecteur appropri?? pour chaque d??fi antig??nique. commutation de classe est d??clench?? par les cytokines; l'isotype g??n??r??e d??pend de cytokines qui sont pr??sents dans l'environnement des cellules B.
la commutation de classe se produit dans le g??ne de cha??ne lourde locus par une recombinaison de commutation de classe de m??canisme appel?? (RSE). Ce m??canisme repose sur conserv??e motifs nucl??otidiques, appel?? commutateur (S) r??gions, trouv?? dans l'ADN en amont de chaque g??ne de la r??gion constante (sauf dans le δ-cha??ne). Le brin d'ADN est cass?? par l'activit?? d'une s??rie de enzymes ?? deux S-r??gions s??lectionn??es. Le domaine variable exon est rejoint par un processus appel?? extr??mit?? de jonction (NHEJ) ?? la r??gion constante souhait??e non homologue (γ, α ou ε). Ce processus aboutit ?? un g??ne d'immunoglobuline qui code pour un anticorps de l'isotype d'un autre.
Applications m??dicales
le diagnostic des maladies
D??tection des anticorps particuliers est une forme tr??s courante de m??decine diagnostic et des applications telles que s??rologie d??pendent de ces m??thodes. Par exemple, dans des dosages biochimiques pour le diagnostic de la maladie, une titre d'anticorps dirig?? contre Le virus d'Epstein-Barr ou la maladie de Lyme est estim?? ?? partir du sang. Si ces anticorps ne sont pas pr??sents, soit la personne ne est pas infect??e, ou l'infection a eu lieu il ya tr??s longtemps, et les cellules B g??n??rant ces anticorps sp??cifiques ont naturellement d??compos??. En immunologie clinique, les niveaux de cours individuels d'immunoglobulines sont mesur??s par n??ph??lom??trie (ou turbidim??trie) pour caract??riser le profil d'anticorps de patient. Des ??l??vations de diff??rentes classes d'immunoglobulines sont parfois utiles pour d??terminer la cause de dommages au foie chez les patients dont le diagnostic ne est pas clair. Par exemple, IgA ??lev??e indique alcoolique cirrhose, IgM ??lev??e indique l'h??patite virale et la cirrhose biliaire primaire, tandis que l'IgG est ??lev??e dans h??patite virale, l'h??patite auto-immune et la cirrhose. Maladies auto-immunes peuvent souvent ??tre attribu??s ?? des anticorps qui se lient le corps propre ??pitopes; nombre peut ??tre d??tect??e par des analyses de sang. Anticorps dirig??s contre globules rouges antig??nes de surface cellulaire ?? m??diation immunitaire l'an??mie h??molytique sont d??tect??s avec le Test de Coombs. Le test de Coombs est ??galement utilis?? pour le d??pistage d'anticorps dans la pr??paration de la transfusion sanguine et aussi pour le d??pistage d'anticorps dans femmes en consultations pr??natales. En pratique, plusieurs m??thodes immunodiagnostiques bas??es sur la d??tection de complexes antig??ne-anticorps sont utilis??s pour diagnostiquer des maladies infectieuses, par exemple ELISA, immunofluorescence, Western blot, immunodiffusion, et immuno??lectrophor??se.
la th??rapie de maladies
"Cibl??e" traitement anticorps monoclonal est utilis?? pour traiter des maladies telles que la polyarthrite rhumato??de, la scl??rose en plaques , le psoriasis, et de nombreuses formes de cancer , y compris le lymphome non hodgkinien, cancer colorectal, la t??te et du cou et cancer du sein. Certaines d??ficiences immunitaires, telles que agammaglobulin??mie li??e ?? l'X et hypogammaglobulin??mie, entra??ner un manque partiel ou total d'anticorps. Ces maladies sont souvent trait??es en induisant une forme ?? court terme de l'immunit?? appel?? immunit?? passive. L'immunit?? passive est assur??e par le transfert d'anticorps pr??ts ?? l'emploi sous la forme d'humain ou animal s??rum, mis en commun immunoglobuline ou anticorps monoclonaux, en la personne concern??e.
Th??rapie pr??natale
Anticorps Rho (D) Immunoglobuline sont sp??cifiques pour Rh??sus D (RhD) antig??ne humain, ??galement connu comme Le facteur rh??sus. Ces anticorps anti-RhD sont connus sous plusieurs noms de marque, y compris RhoGAM, BayRHo-D, Gamulin Rh, HypRho-D, et WinRho SDF. Facteur rh??sus est un antig??ne trouv?? sur les globules rouges; les individus qui sont Rh??sus positif (Rh +) ont cet antig??ne sur leurs globules rouges et les individus qui sont Rh??sus n??gatif (Rh) ne font pas. Pendant normale l'accouchement, la livraison traumatisme ou complications pendant la grossesse, le sang d'un f??tus peut entrer dans le syst??me de la m??re. Dans le cas d'une m??re Rh-incompatible et de l'enfant, cons??cutifs m??lange de sang peut sensibiliser une m??re Rh ?? l'antig??ne Rh sur les cellules de sang de l'enfant Rh +, mettre le reste de la grossesse , et tous les grossesses ult??rieures, au risque de la maladie h??molytique du nouveau-n??. Les anticorps anti-RhD sont administr??s dans le cadre d'un pr??natale r??gime de traitement pour pr??venir la sensibilisation qui peut se produire quand une m??re rh??sus n??gatif a un foetus Rh??sus positif. Traitement d'une m??re avec des anticorps anti-RhD avant et imm??diatement apr??s le traumatisme et la livraison d??truit antig??ne Rh dans le syst??me du f??tus de la m??re. Surtout, cela se produit avant que l'antig??ne peut stimuler les cellules B maternels ?? "rappeler" antig??ne Rh en g??n??rant cellules B m??moire. Par cons??quent, son syst??me immunitaire humoral ne fera pas d'anticorps anti-Rh, et ne sera pas attaquer les antig??nes Rh??sus du b??b?? cours ou la suivante. Rho (D) le traitement immunoglobuline pr??vient la sensibilisation qui peut conduire ?? Rh maladie, mais ne pas pr??venir ou traiter la maladie sous-jacente elle-m??me.
applications de recherche
Les anticorps sp??cifiques sont produits par injection d'un antig??ne dans un mammif??re , tel qu'une souris , rat ou lapin pour de petites quantit??s d'anticorps, ou de ch??vre , de mouton ou de cheval pour de grandes quantit??s d'anticorps. Le sang isol?? ?? partir de ces animaux contient - des anticorps polyclonaux plusieurs anticorps qui se lient au m??me antig??ne - dans le s??rum, qui peut maintenant ??tre appel??e antis??rum. Antig??nes sont ??galement inject??s dans des poulets pour la production d'anticorps polyclonaux en le jaune d'oeuf. Pour obtenir un anticorps qui est sp??cifique d'un seul epitope d'un antig??ne, d'un anticorps s??cr??tant Les lymphocytes sont isol??s ?? partir de l'animal et immortalis??es en les fusionnant avec une lign??e cellulaire de cancer. Les cellules fusionn??es sont appel??s hybridomes, et sera constamment cro??tre et s??cr??ter des anticorps dans la culture. Des cellules d'hybridomes individuelles sont isol??es par clonage par dilution pour g??n??rer clones de cellules qui produisent tous le m??me anticorps; ces anticorps sont appel??s des anticorps monoclonaux. Des anticorps polyclonaux et monoclonaux g??n??r??s sont purifi??s en utilisant souvent La prot??ine A / G ou Chromatographie d'affinit?? d'antig??ne.
Utilisation
Dans la recherche, des anticorps purifi??s sont utilis??s dans de nombreuses applications. Ils sont le plus souvent utilis??s pour identifier et localiser intracellulaire et des prot??ines extracellulaires. Les anticorps sont utilis??s dans cytom??trie en flux pour diff??rencier les types cellulaires par les prot??ines qu'ils expriment; diff??rents types de cellules expriment diff??rentes combinaisons de amas de mol??cules de diff??renciation sur leur surface, et de produire intracellulaire diff??rente et prot??ines s??cr??t??es. Ils sont ??galement utilis??s dans immunopr??cipitation de prot??ines distinctes et tout li??s ?? eux (co-immunopr??cipitation) d'autres mol??cules dans un lysat cellulaire, en Western blot analyse pour identifier les prot??ines s??par??es par ??lectrophor??se, et immunohistochimie ou immunofluorescence pour examiner l'expression des prot??ines dans des coupes de tissus ou de localiser des prot??ines au sein des cellules avec l'aide d'un microscope . Les prot??ines peuvent ??galement ??tre d??tect??s et quantifi??s par des anticorps, en utilisant ELISA et Techniques ELISPOT.
Histoire
L'??tude d'anticorps a commenc?? en 1890 lorsque Emil von Behring et Shibasaburo Kitasato d??crit l'activit?? des anticorps contre dipht??rie et toxines de t??tanos. Behring et Kitasato mis en avant la th??orie de l'immunit?? humorale, proposant un m??diateur dans le s??rum pourrait r??agir avec un antig??ne ??tranger. Leur id??e a incit?? Paul Ehrlich de proposer la th??orie de la cha??ne lat??rale de l'anticorps et de l'interaction de l'antig??ne en 1897, lorsqu'il a ??mis l'hypoth??se que les r??cepteurs (d??crits comme des ??cha??nes lat??rales??) sur la surface des cellules peuvent se lier sp??cifiquement ?? toxines - dans une interaction "lock-et-cl??" - et que cette r??action de liaison a ??t?? le d??clencheur pour la production d'anticorps. D'autres chercheurs croient que les anticorps existaient librement dans le sang et, en 1904, Almroth Wright a sugg??r?? que les anticorps solubles rev??tus bact??ries de les ??tiqueter pour phagocytose et la destruction; un processus qu'il a appel?? opsoninization.
Dans les ann??es 1920, Michael Heidelberger et Oswald Avery observ?? que les antig??nes peuvent ??tre pr??cipit??s par des anticorps et a continu?? ?? montrer que les anticorps ont ??t?? faites de prot??ines. Les propri??t??s biochimiques des interactions de liaison antig??ne-anticorps ont ??t?? examin??s plus en d??tail ?? la fin des ann??es 1930 par John Marrack. La prochaine avanc??e majeure ??tait dans les ann??es 1940, lorsque Linus Pauling a confirm?? la th??orie de la serrure et clef propos?? par Ehrlich en montrant que les interactions entre les anticorps et les antig??nes d??pendait plus de leur forme que leur composition chimique. En 1948, Astrid Fagreaus d??couvert que les cellules B, sous la forme de plasmocytes, ??taient responsables de la production d'anticorps.
D'autres travaux concentr??e sur la caract??risation des structures des prot??ines d'anticorps. Une avanc??e majeure dans ces ??tudes structurales ??tait la d??couverte au d??but des ann??es 1960 par Gerald Edelman et Joseph Gally de l'anticorps la cha??ne l??g??re, et leur r??alisation que cette prot??ine est la m??me que la Prot??ine de Bence-Jones a d??crit en 1845 par Henry Bence Jones. Edelman a continu?? de d??couvrir que les anticorps sont compos??es de liaison disulfure li??-cha??nes lourdes et l??g??res. A la m??me ??poque, la queue de liaison d'anticorps (Fab) et l'anticorps (Fc) r??gions d'IgG ont ??t?? caract??ris??s par Rodney Porter. Ensemble, ces scientifiques d??duisent la structure et compl??te acide amin?? s??quence d'IgG, un exploit pour lequel elles ont ??t?? attribu??es conjointement le 1972 Prix Nobel de Physiologie ou m??decine . Alors que la plupart de ces premi??res ??tudes ont port?? sur IgM et IgG, d'autres isotypes d'immunoglobulines ont ??t?? identifi??s dans les ann??es 1960: Thomas Tomasi d??couvert anticorps s??cr??toire ( IgA) et David Rowe et John Fahey identifi?? IgD, et IgE a ??t?? identifi?? par Kikishige Ishizaka et Teruki Ishizaka en tant que classe d'anticorps impliqu??s dans des r??actions allergiques.
Des ??tudes g??n??tiques ont r??v??l?? la base de la grande diversit?? de ces prot??ines d'anticorps lors de la recombinaison somatique des g??nes d'immunoglobuline a ??t?? identifi?? par Susumu Tonegawa en 1976.

