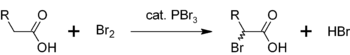Le tribromure de phosphore
?? propos de ce ??coles s??lection Wikipedia
Arrangeant une s??lection Wikipedia pour les ??coles dans le monde en d??veloppement sans internet ??tait une initiative de SOS Enfants. Le parrainage d'enfants aide les enfants un par un http://www.sponsor-a-child.org.uk/ .
| Le tribromure de phosphore | |
|---|---|
 | |
 | |
Le tribromure de phosphore | |
Autres noms phosphore (III) de bromure, | |
| Identificateurs | |
| Num??ro CAS | 7789-60-8 |
| PubChem | 24614 |
| ChemSpider | 23016 |
| Num??ro CE | 232-178-2 |
| Num??ro RTECS | TH4460000 |
| images de Jmol-3D | Image 1 |
SMILES
| |
InChI
| |
| Propri??t??s | |
| Formule mol??culaire | PBr3 |
| Masse molaire | 270,69 g / mol |
| Apparence | , liquide transparent, incolore |
| Densit?? | 2,852 g / cm 3 |
| Point de fusion | -41,5 ?? C (231,7 K) |
| Point d'??bullition | 173,2 ?? C (446,4 K) |
| Solubilit?? dans l'eau | rapide hydrolyse |
| Indice de r??fraction (n D) | 1,697 |
| Viscosit?? | Pas 0.001302 |
| Structure | |
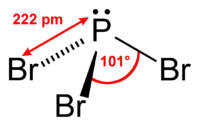
| Forme mol??culaire | trigonale pyramidale |
| Risques | |
| FS | MSDS externe |
| Indice de l'UE | 015-103-00-6 |
| Classification UE | Corrosif (C) |
| Phrases-R | R14, R34, R37 |
| Phrases S | (S1 / 2), S26, S45 |
| NFPA 704 |  0 3 2 |
| Des compos??s apparent??s | |
| D'autres anions | phosphore trifluorure le trichlorure de phosphore triiodure de phosphore |
| D'autres cations | tribromure d'azote arsenic tribromure tribromure d'antimoine |
| Des compos??s apparent??s | pentabromure de phosphore oxybromure de phosphore |
| Page de donn??es suppl??mentaire | |
| Structure et propri??t??s | n, ε r, etc. |
| Thermodynamique donn??es | comportement de phase Solide, liquide, gaz |
| Les donn??es spectrales | UV, IR, RMN , MS |
Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
Le tribromure de phosphore est un liquide incolore ayant la formule P Br 3. Il fum??es dans l'air en raison de hydrolyse et a une odeur p??n??trante. Il est largement utilis?? dans les laboratoires pour la conversion des alcools ?? les bromures d'alkyle.
Pr??paration
PBr 3 est pr??par?? par traitement de phosphore avec le brome . Un exc??s de phosphore est utilis?? dans le but de pr??venir la formation de PBr 5:
R??actions
Tribromure de phosphore, comme PCl 3 et PF 3, a des propri??t??s d'un Base de Lewis et un Acide de Lewis. Par exemple, avec un acide de Lewis tel que tribromure de bore il forme stables 1: 1 adduits tels que Br 3 B-PBr 3. En m??me temps, PBr 3 peut r??agir en tant que ??lectrophile ou un acide de Lewis dans un grand nombre de ses r??actions, par exemple avec des amines .
La r??action la plus importante de PBr3 est avec alcools , o?? il remplace un Groupe OH par un atome de brome pour produire un bromure d'alkyle. Notez que tous les trois atomes de brome peuvent ??tre transf??r??s.
- PBr 3 + 3 ROH → 3 RBr + HP (O) (OH) 2
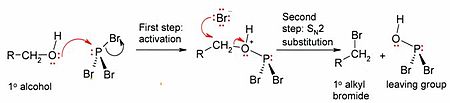
Le m??canisme (repr??sent?? par un alcool primaire) implique l'activation initiale de l'oxyg??ne de l'alcool par le phosphore ??lectrophile (pour former un bon groupe partant), suivie d'une S N 2 ?? la substitution du carbone ?? l'alcool.
En raison de la substitution ??tape 2 S N, la r??action fonctionne g??n??ralement bien pour les alcools primaires et secondaires , mais ne parvient pas ?? des alcools tertiaires. Si le centre de carbone est la r??action chirale, la r??action se produit g??n??ralement avec inversion de configuration au niveau de l'alcool carbone alpha, comme il est habituel avec une r??action S N 2.
Dans une r??action similaire, PBr3 convertit ??galement des acides carboxyliques ?? bromures d'acyle.
- PBr 3 + 3 RCOOH → 3 RCOBr + HP (O) (OH) 2
PBr 3 est une assez forte agent r??ducteur et l'oxydation du PBr 3 avec de l'oxyg??ne gazeux est plus vigoureuse que vu avec PCl 3. Il donne une r??action explosive que les formes P 2 O 5 et Br 2 .
Applications
La principale utilisation est le tribromure de phosphore pour la conversion des primaires ou secondaires alcools ?? bromures d'alkyle, tels que d??crits ci-dessus. PBr 3 donne g??n??ralement des rendements sup??rieurs l'acide bromhydrique, et il ??vite les probl??mes de Carbocation rearrangement- par exemple m??me n??opentyle bromure peut ??tre faite ?? partir de l'alcool avec un rendement de 60%.
Une autre utilisation de PBr 3 est en tant que catalyseur pour la bromation de α- acides carboxyliques . Bien que les bromures acyle sont rarement en comparaison avec les chlorures d'acyle, ils sont utilis??s comme interm??diaires dans Hell-Volhard halog??nation-Zelinsky. Initialement PBr 3 r??agit avec l'acide carboxylique pour former le bromure d'acyle, qui est plus r??actif avec les bromation. L'ensemble du processus peut ??tre repr??sent?? par
Sur une ??chelle commerciale, le tribromure de phosphore est utilis?? dans la fabrication de les produits pharmaceutiques, tels que alprazolam, m??thohexital et f??noprof??ne. Ce est aussi un puissant agent de suppression des incendies commercialis?? sous le nom PhostrEx.
Pr??cautions
PBr3 ??volue HBr corrosif, est toxique, et r??agit violemment avec l'eau et les alcools.
Dans les r??actions qui produisent l'acide phosphoreux en tant que sous-produit, lorsque le traitement final par distillation soient conscients que cela peut se d??composer au-dessus d'environ 160 ?? C pour donner phosphine qui peut provoquer des explosions en contact avec l'air.