
Le t??trachlorure de carbone
Saviez-vous ...
Enfants SOS ont produit une s??lection d'articles de wikipedia pour les ??coles depuis 2005. enfants SOS a regard?? des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| Le t??trachlorure de carbone | |
|---|---|
 |  |
Le t??trachlorure de carbone | |
Autres noms Benziform, chlorure de carbone, de m??thane t??trachlorure, Perchloromethane, tet carbone, Benzinoform, Tetraform, Tetrasol, fr??on 10, Halon 104, Nations Unies 1846 | |
| Identificateurs | |
| Num??ro CAS | 56-23-5 |
| PubChem | 5943 |
| Num??ro CE | 200-262-8 |
| KEGG | C07561 |
| ChEBI | CHEBI: 27385 |
| Num??ro RTECS | FG4900000 |
| images de Jmol-3D | Image 1 |
SMILES
| |
InChI
| |
| Propri??t??s | |
| Formule mol??culaire | CCl 4 |
| Masse molaire | 153,82 g / mol |
| Apparence | Liquide incolore |
| Densit?? | 1,5842 g / cm 3, un liquide 1,831 g.cm -3 ?? -186 ?? C (solide) |
| Point de fusion | -22,92 ?? C (250 K) |
| Point d'??bullition | 76,72 ?? C (350 K) |
| Solubilit?? dans l'eau | 0,8 g / L ?? 25 ?? C |
| log P | 2,64 |
| La pression de vapeur | 11,94 kPa ?? 20 ?? C |
| k H | 365 kJ.mol -1 ?? 24,8 ?? C |
| Structure | |
| Crystal structure | Monoclinique |
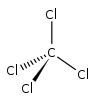
| Forme mol??culaire | Tetrahedral |
| Risques | |
| FS | MSDS externe |
| Classification UE | Toxique (T), Carc. Cat. 2B, Dangereux pour l'environnement (N) |
| Phrases-R | R23 / 24/25, R40, R48 / 23, R59, R52 / 53 |
| Phrases S | (S1 / 2), S23, S36 / 37, S45, S59, S61 |
| NFPA 704 |  0 3 0 |
| Point d'??clair | Non inflammable |
| Page de donn??es suppl??mentaire | |
| Structure et propri??t??s | n, ε r, etc. |
| Thermodynamique donn??es | comportement de phase Solide, liquide, gaz |
| Les donn??es spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les donn??es sont donn??es pour le mat??riel dans leur ??tat standard (?? 25 ?? C, 100 kPa) | |
| R??f??rences d'Infobox | |
Le t??trachlorure de carbone, ??galement connu sous d'autres noms (voir le tableau) est le compos?? chimique ?? la formule CCl 4. C'est un r??actif dans chimie synth??tique et a ??t?? autrefois largement utilis?? dans extincteurs et tant que pr??curseur de r??frig??rants. Ce est un liquide incolore avec une odeur "douce" qui peut ??tre d??tect?? ?? des niveaux faibles.
Le t??trachlorure de carbone et t??trachlorom??thane sont des noms acceptables dans la nomenclature IUPAC . Famili??rement, il est appel?? ??tet de carbone??.
Histoire et de synth??se
La production de t??trachlorure de carbone a fortement diminu?? depuis les ann??es 1980 en raison de pr??occupations environnementales et de la diminution de la demande pour CFC, qui ont ??t?? d??riv??es ?? partir de t??trachlorure de carbone. En 1992, la production aux ??tats-Unis-Europe-Japon a ??t?? estim?? ?? 720.000.000 kilogrammes.
Le t??trachlorure de carbone a ??t?? synth??tis?? en 1839 par r??action de chloroforme avec du chlore, de la pharmacie fran??aise Henri Victor Regnault, mais maintenant il est principalement synth??tis?? ?? partir de m??thane:
- CH 4 + 4 Cl 2 → CCl 4 + 4 HCl
La production utilise souvent sous-produits d'autres r??actions de chloration, tels que la synth??se de dichlorom??thane et chloroforme. Chlorocarbones plus ??lev??s sont ??galement soumis ?? "chlorinolyse:"
- C 2 Cl 6 + Cl 2 → 2 CCl 4
Avant les ann??es 1950, le t??trachlorure de carbone a ??t?? fabriqu?? par la chloration de le disulfure de carbone ?? 105 ?? 130 ?? C:
- CS 2 + 3 Cl 2 → CCl 4 + S 2 Cl 2
Propri??t??s
Dans le t??trachlorure de carbone mol??cule , quatre chlore atomes sont dispos??s de mani??re sym??trique comme dans un des coins t??tra??drique configuration reli?? ?? un carbone atome, au centre, par simple des liaisons covalentes. En raison de cette g??om??trie sym??trique, la mol??cule n'a pas nette moment de dip??le; ce est-CCl 4 est non polaire. En tant que solvant , il est bien adapt?? ?? la dissolution d'autres compos??s non-polaires, des graisses et des huiles. Il est quelque peu volatil, d??gageant vapeurs ayant une caract??ristique de l'odeur d'autres solvants chlor??s, quelque peu similaire ?? la t??trachloro??thyl??ne odeur rappelle Les boutiques de teinturerie.
T??trachlorom??thane solide a deux allotropes : cristalline II ci-apr??s -47,5 ?? C (225,6 K) et cristalline I ci-dessus -47,5 ?? C.
A -47,3 ?? C, il a structure cristalline monoclinique avec le groupe spatial C2 / c et treillis constantes A = 20,3, b = 11,6, c = 19,9 (0,10 nm -1), β = 111 ??.
Utilisations
Au d??but du 20e si??cle, le t??trachlorure de carbone a ??t?? largement utilis?? comme nettoyage ?? sec solvant , comme un r??frig??rant, et extincteurs. Cependant, une fois qu'il est devenu ??vident que l'exposition au t??trachlorure de carbone a eu des effets n??fastes sur la sant?? graves, des alternatives plus s??res telles que t??trachloro??thyl??ne ont ??t?? trouv??s pour ces applications, et son utilisation dans ces r??les est pass?? d'environ 1940 en avant. Le t??trachlorure de carbone a persist?? comme un pesticides pour tuer les insectes dans le grain entrepos??, mais dans 1970 , il a ??t?? interdit dans les produits de consommation dans le ??tats-Unis .
Avant le Protocole de Montr??al, de grandes quantit??s de t??trachlorure de carbone ont ??t?? utilis??s pour produire la r??frig??rants de fr??on R-11 ( trichlorofluorom??thane) et R-12 ( dichlorodifluorom??thane). Cependant, ces fluides frigorig??nes sont maintenant soup??onn??s de jouer un r??le dans la couche d'ozone et ont ??t?? ??limin??es. Le t??trachlorure de carbone est encore utilis?? pour la fabrication de r??frig??rants moins destructrices.
Le t??trachlorure de carbone a aussi ??t?? utilis?? dans la d??tection de neutrinos. Le t??trachlorure de carbone est l'un des plus puissants h??patotoxines, et est utilis?? widly dans la recherche scientifique pour ??valuer les agents de h??patoprotecteurs 7,8
R??activit??
Le t??trachlorure de carbone n'a pratiquement pas inflammabilit?? ?? des temp??ratures inf??rieures. Sous des temp??ratures ??lev??es dans l'air, il forme toxiques phosg??ne.
Comme il n'a pas de liaisons CH, le t??trachlorure de carbone ne subit pas facilement des r??actions radicalaires. Par cons??quent, il est un solvant utile pour les halog??nations soit par l'halog??ne ??l??mentaire, ou par un r??actif d'halog??nation tel que N-bromosuccinimide.
Dans la chimie organique , le t??trachlorure de carbone est une source de chlore dans le Appel r??action.
Solvant
Il est utilis?? comme solvant dans la recherche de la chimie de synth??se, mais en raison de ses effets n??fastes sur la sant??, il ne est plus couramment utilis??, et chimistes essaient g??n??ralement de le substituer par d'autres solvants. Il est parfois utile comme solvant pour spectroscopie infrarouge car il n'y a pas de bandes d'absorption importants> 1600 cm -1. Parce que le t??trachlorure de carbone ne poss??de pas des atomes d'hydrog??ne, il a ??t?? historiquement utilis?? dans proton spectroscopie RMN . Cependant, le t??trachlorure de carbone est toxique, et son pouvoir de dissolution est faible. Son utilisation a ??t?? largement remplac??e par des solvants deut??r??s, qui offrent des propri??t??s de solvatation sup??rieures permettent de deut??rium et de verrouillage par le spectrom??tre.
S??curit??
L'exposition ?? des concentrations ??lev??es de t??trachlorure de carbone (y compris vapeur) peut affecter la syst??me nerveux central, d??g??n??rer le foie et les reins et peut entra??ner (apr??s une exposition prolong??e) en le coma et m??me la mort . L'exposition chronique au t??trachlorure de carbone peut causer foie et des dommages aux reins et pourrait entra??ner le cancer Plus d'informations peuvent ??tre trouv??es dans Fiches de donn??es de s??curit??.
Le t??trachlorure de carbone est ??galement ?? la fois la couche d'ozone et un gaz ?? effet de serre . Cependant, depuis 1992 ses concentrations atmosph??riques ont ??t?? en baisse pour les raisons d??crites ci-dessus (voir aussi l'atmosph??re chiffre s??ries chronologiques).

