
R??action acide-base
Renseignements g??n??raux
Cette s??lection Wikipedia est d??connect?? disponibles ?? partir enfants SOS pour la distribution dans le monde en d??veloppement. SOS Enfants a regard?? des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| Acides et Bases |
|---|
| Constante de dissociation acide Extraction acide-base R??action acide-base Titrage acide-base Constante de dissociation fonction d'acidit?? solutions tampons pH Proton affinit?? Autoprotolyse Force de l'acide |
| Acide types |
| Br??nsted ?? Lewis ?? Min??ral Organic ?? Fort Superacides ?? Faible |
| Les types de base |
| Br??nsted ?? Lewis ?? Organique Forte ?? Superbases Non nucl??ophile ?? Faible |
Une r??action acide-base est une r??action chimique qui se produit entre un acide et un base. Plusieurs concepts existent qui fournissent des d??finitions alternatives pour les m??canismes r??actionnels impliqu??s et leur application dans la r??solution des probl??mes connexes. Malgr?? plusieurs similitudes dans les d??finitions, leur importance devient ??vident que les diff??rentes m??thodes d'analyse lorsqu'il est appliqu?? ?? des r??actions acide-base pour les esp??ces gazeux ou liquides, ou lorsque le caract??re acide ou basique peut ??tre un peu moins ??vident. Historiquement, le premier de ces concepts scientifiques d'acides et de bases ont ??t?? fournis par le fran??ais chimiste Antoine Lavoisier , circa 1776 .
Th??ories acide-base commune
D??finition Lavoisier
Depuis la connaissance de Lavoisier acides forts a ??t?? essentiellement limit??es ?? oxyacides, qui ont tendance ?? contenir des atomes centraux en haute ??tats d'oxydation entour??s par de l'oxyg??ne, tels que HNO 3 et H 2 SO 4 , et comme il ne ??tait pas au courant de la v??ritable composition des acides halohydriques, HCl, HBr et HI, il d??finis acides en termes de leur contenant de l'oxyg??ne , ce qui fait-il nomm?? des mots grecs signifiant ??acide-anciens?? (du grec οξυς (oxys) signifie ??acide?? ou ??forte?? et γεινομαι (geinomai) ou "engendrer"). La d??finition Lavoisier a eu lieu comme une v??rit?? absolue pour les plus de 30 ans, jusqu'?? ce que l'article 1810 et des conf??rences ult??rieures par Sir Humphry Davy dans lequel il prouv?? le manque d'oxyg??ne dans H 2 S, H 2 Te, et la les acides halohydriques.
D??finition Liebig
Cette d??finition a ??t?? propos??e par Justus von Liebig circa 1838 , sur la base de ses importants travaux sur la composition chimique de des acides organiques. Ce termin?? le changement de doctrine ?? partir d'acides ?? base d'oxyg??ne aux acides ?? base d'hydrog??ne, a commenc?? par Davy. Selon Liebig, un acide est une substance contenant de l'hydrog??ne dont l'hydrog??ne peut ??tre remplac?? par un m??tal. La d??finition de Liebig, tout en ??tant compl??tement empirique, est rest?? en service pendant pr??s de 50 ans jusqu'?? l'adoption de la d??finition d'Arrhenius.
D??finition d'Arrhenius
La d??finition d'Arrhenius des r??actions acide-base est un concept acide-base simplifi?? con??u par Svante Arrhenius, qui a ??t?? utilis?? pour fournir une d??finition moderne de bases qui a suivi de son travail avec Friedrich Wilhelm Ostwald dans l'??tablissement de la pr??sence d'ions en solution aqueuse en 1884 , et a conduit ?? la r??ception de la Arrhenius Prix Nobel de chimie en 1903 pour "reconnaissance des services extraordinaires ... rendu ?? l'avancement de la chimie par sa th??orie de la dissociation ??lectrolytique"
Tel que d??fini au moment de la d??couverte, r??actions acide-base se caract??risent par des acides Arrhenius, qui dissocier dans sous forme de solution aqueuse hydrog??ne ou le tard-appel?? oxonium (H 3 O +) des ions, et les bases d'Arrhenius qui forment l'hydroxyde (OH -) ions. Plus r??cent Recommandations IUPAC sugg??rent maintenant le nouveau terme "hydronium" ??tre utilis?? en faveur du terme accept?? "oxonium" plus pour illustrer m??canismes r??actionnels tels que ceux d??finis dans le Br??nsted-Lowry et d??finitions du syst??me de solvants plus clairement, avec la d??finition d'Arrhenius servir comme un simple aper??u g??n??ral de caract??re acido-basique Plus succinctement, la d??finition d'Arrhenius peut supposer que;
| " | Arrhenius acides forment des ions hydrog??ne en solution aqueuse avec des bases formant des ions hydroxydes d'Arrhenius. | " |
La d??finition acide-base aqueuse universel de la notion d'Arrhenius est d??crite comme la formation d'eau ?? partir de l'hydrog??ne et des ions hydroxyde ou ions hydronium et les ions hydroxyde produits ?? partir de la dissociation d'un acide et une base en solution aqueuse (2 H 2 O → OH - 3 O + H +), ce qui conduit ?? la d??finition qui en Arrhenius r??actions acide-base, un sel et de l'eau est form?? ?? partir de la r??action entre un acide et une base - dans les d??finitions scientifiques les plus simples, cette forme de r??action est appel??e r??action de neutralisation.
- + acide + base de - → sel + eau
L'ion positif ?? partir d'une base peut former un sel avec l'ion n??gatif d'un acide. Par exemple, deux moles de la base hydroxyde de sodium (NaOH) peuvent se combiner avec une mole d'acide sulfurique (H 2 SO 4) pour former deux moles d' eau et d'une mole de sulfate de sodium .
- 2NaOH + H 2 SO 4 → 2 H 2 O + Na 2 SO 4
D??finition de Br??nsted-Lowry
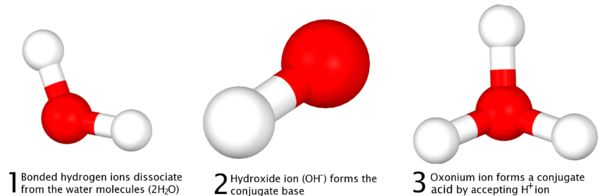
La d??finition de Br??nsted-Lowry, formul?? de fa??on ind??pendante par ses deux promoteurs Johannes Nicolaus Br??nsted et Martin Lowry en 1923 est bas??e sur l'id??e de protonation des bases ?? travers le de-protonation des acides - plus commun??ment appel??s la capacit?? des acides ?? "faire un don" ions hydrog??ne (H +) ou protons ?? des bases, qui "accepte" eux. Contrairement ?? la d??finition d'Arrhenius, la d??finition de Bronsted-Lowry se r??f??re ?? des produits d'une r??action acide-base que les acides conjugu??s et des bases de se r??f??rer ?? la relation d'un proton et d'indiquer qu'il ya eu une r??action entre les deux quantit??s, plut??t que d'une ??formation?? de sel et de l'eau, comme il est expliqu?? dans la d??finition d'Arrhenius.
Il d??finit que dans les r??actions, il est le don et la r??ception d'un proton, ce qui fait essentiellement r??f??rence ?? l'??limination d'un ion d'hydrog??ne li?? au sein d'un compos?? et sa r??action avec un autre compos??, et non l'??limination d'un proton ?? partir du noyau d'un atome , ce qui n??cessiterait des quantit??s excessives d'??nergie r??alisables pas par la simple dissociation des acides. Dans la diff??renciation de la D??finition d'Arrhenius, la d??finition de Bronsted-Lowry postule que, pour chaque acide, il est un acide conjugu?? de la base et ou "paire conjugu??e acide-base" qui est form??e par une r??action compl??te, qui inclut ??galement de l'eau, qui est amphot??re:
|
D??finition de Lewis
La d??finition de Lewis de r??actions acide-base, con??ue par Gilbert Lewis en 1923 est une th??orie englobant les d??finitions de Bronsted-Lowry et de solvant au syst??me en ce qui concerne le principe d'un m??canisme de donation, qui attribue ?? l'inverse du don de paires d'??lectrons ?? partir de bases et de l'acceptation par les acides, plut??t que des protons ou d'autres substances et port??es ?? la fois des r??actions aqueuses et non aqueuses li??s.
- Ag + + 2: NH 3 → [H 3 N: Ag: NH 3] +
- Un cation argent r??agit comme un acide avec de l'ammoniac qui agit comme un donneur de paire d'??lectrons, en formant un produit d'addition d'ammoniac et d'argent
Dans les r??actions entre Des acides de Lewis et bases, on observe la formation d'un produit d'addition lorsque le orbitale mol??culaire occup??e la plus ??lev??e ( HOMO) d'une mol??cule, tels que NH 3 avec disponible paire (s) d'??lectrons seul don de paires d'??lectrons c??libataires ?? la mol??cule de d??ficient en ??lectrons orbitale mol??culaire vacante la plus basse ( LUMO) ?? travers un liaison covalente coordonn??e; Dans une telle r??action, la mol??cule interagissant avec HOMO agit comme une base, et la mol??cule interagissant LUMO agit comme un acide. Dans les mol??cules fortement polaires, tels que le fluorure de bore-Tri (BF 3), le plus ??l??ment ??lectron??gatif tire ??lectrons vers ses propres orbitales, fournir une charge plus positive sur l'??l??ment moins ??lectron??gatif et une diff??rence dans sa structure ??lectronique en raison de la position axiale ou orbite ??quatoriales de ses ??lectrons, entra??nant des effets de r??pulsion de Lone paire de liaison paire (Lp -Bp) les interactions entre les atomes li??s au-del?? de celles d??j?? pr??vues par collage paire de liaison paire (BP-BP) interactions. Produits d'addition impliquant les ions m??talliques sont consid??r??s comme des compos??s de coordination.
D??finition solvant syst??me
Cette d??finition est bas??e sur une g??n??ralisation de la d??finition ant??rieure Arrhenius ?? tous les solvants autodissociating. Dans tous ces solvants il ya une certaine concentration d'une esp??ce, les cations solvonium positives et n??gatives, des esp??ces anions solvate, en ??quilibre avec les mol??cules de solvant neutres. Par exemple:
- 2H 2 O ⇌ H 3 O + ( hydronium) + OH - ( hydroxyde )
- 2NH 3 ⇌ NH 4 + ( ammonium) + NH 2 - ( amide)
ou m??me certains syst??mes aprotiques
- N 2 O 4 ⇌ NO + ( nitrosonium) + NO 3 - ( nitrate )
- 2SbCl 3 ⇌ SbCl 2 + (dichloroantimonium) + SbCl 4 - (tetrachloroantimonate)
Un solut?? provoquant une augmentation de la concentration des ions solvonium et une diminution des ions de produit de solvatation est un acide et une causant l'inverse est une base. Ainsi, dans le liquide de l'ammoniac , KNH 2 (introduction de NH 2 -) est une base forte, et NH 4 NO 3 (introduction de NH 4 +) est un acide fort. En liquide le dioxyde de soufre (SO 2), compos??s de thionyle (SO fournir 2+) se comportent comme des acides, et sulfites (fournissant SO 3 2-) se comportent comme des bases.
Voici quelques r??actions acide-base non aqueux dans l'ammoniac liquide
- 2NaNH 2 (base) + Zn (NH 2) 2 ( amide amphiphile) → Na 2 [Zn (NH 2) 4]
- 2NH 4 I (acide) + Zn (NH 2) 2 ( amide amphiphile) → [Zn (NH 3) 4)] I 2
L'acide nitrique peut ??tre une base dans l'acide sulfurique liquide:
- HNO 3 (base) + 2H 2 SO 4 → NO 2 + + H 3 O + + 2HSO 4 -
Et les choses deviennent encore plus ??trange dans le monde aprotique, par exemple dans le liquide N 2 O 4:
- AgNO 3 (base) + NOCl (acide) → N 2 O 4 + AgCl
Comme solvant d??finition du syst??me d??pend du solvant ainsi que sur le compos?? lui-m??me, le m??me compos?? peut changer son r??le en fonction du choix du solvant. Ainsi, HClO 4 est un acide fort dans l'eau, un acide faible en acide ac??tique et une base faible dans l'acide fluorosulfonique.
D'autres th??ories acide-base
D??finition Usanovich
La d??finition la plus g??n??rale est celle du chimiste russe Mikhail Usanovich, et peut essentiellement se r??sumer comme d??finissant un acide comme tout ce qui accepte esp??ces n??gatives ou positives don, et une base que l'inverse. Ceci tend ?? se chevaucher le concept de redox (oxydation-r??duction), et ne est donc pas tr??s favorable par les chimistes. Ce est parce que les r??actions d'oxydor??duction se concentrent davantage sur les processus de transfert d'??lectrons physiques, plut??t que de d??cision obligataire / processus obligataires rupture, bien que la distinction entre ces deux processus est quelque peu ambigu??.
D??finition Lux-Flood
Cette d??finition, propos?? par le chimiste allemand Hermann Lux en 1939 , encore am??lior??e par Circa H??kon Flood 1947 et maintenant couramment utilis?? dans moderne g??ochimie et ??lectrochimie de sels fondus, d??crit un acide comme accepteur d'ions oxyde et d'une base en tant que donneur d'ions oxyde. Par exemple:
- MgO (base) + CO 2 (acide) → MgCO 3
- CaO (base) + SiO 2 (acide) → CaSiO 3
- NO 3 - (base) + S 2 O 7 2- (acide) → NO 2 + + 2SO 4 2-
D??finition Pearson
En 1963 Ralph Pearson a propos?? un concept connu sous le nom avanc??e qualitative Principe disque acide base souple, plus tard a fait quantitative avec l'aide de Robert Parr en 1984 . 'Hard' applique ?? des esp??ces qui sont de petite taille, ont des ??tats de charge ??lev??s et sont faiblement polarisable. 'Soft' applique ?? des esp??ces qui sont grandes, avoir des ??tats de charge faible et sont fortement polarisable. Les acides et les bases interagissent et les interactions les plus stables sont difficiles dur et mou-mou. Cette th??orie a trouv?? une utilisation ?? la fois dans la chimie organique et inorganique.

