
Uranio
Acerca de este escuelas selección Wikipedia
Este contenido de Wikipedia ha sido seleccionada por SOS para su utilización en las escuelas de todo el mundo. ¿Quieres saber sobre el patrocinio? Ver www.sponsorachild.org.uk
| Uranio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
92 U | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
metálico gris plateado; corroe a una capa de óxido negro astillamiento en el aire  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | uranio, U, 92 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / j ʊ r eɪ n yo ə m / EW- RAY -nee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría metálico | actínidos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | n / a, 7, F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 238.02891 (3) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Rn ] 5f 3 6d 1 7s 2 2, 8, 18, 32, 21, 9, 2 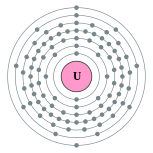 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Martin Heinrich Klaproth (1789) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Eugène-Melchior Péligot (1841) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 19,1 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 17,3 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1405.3 K , 1132,2 ° C, 2070 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 4404 K, 4131 ° C, 7468 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 9.14 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 417.1 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 27.665 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 6, 5, 4, 3, 2, 1 (Débilmente óxido básico) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,38 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 597.6 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1420 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 156 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 196 ± 19:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radio | 186 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | ortorrómbica 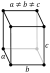 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (0 ° C) 0,280 μΩ · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 27.5 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 13,9 m · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 3155 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | 208 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | 111 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 100 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relación de Poisson | 0.23 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-61-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de uranio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El uranio es un blanco plateado metálico elemento químico en el actínidos serie de la tabla periódica , con símbolo U y número atómico 92. Un átomo de uranio tiene 92 protones y 92 electrones , de los cuales 6 son electrones de valencia. El uranio es débilmente radiactivo porque todos sus isótopos son inestables. Los isótopos más comunes de uranio son de uranio-238 (que tiene 146 neutrones) y de uranio-235 (que tiene 143 neutrones). El uranio tiene la segunda más alta peso atómico del se produce primordialmente elementos, más ligero que sólo plutonio . Su densidad es de aproximadamente 70% mayor que la de plomo , pero no tan densa como oro o de tungsteno . Se produce naturalmente en bajas concentraciones de unos pocos partes por millón en suelo, las rocas y el agua, y es comercialmente extraído de uraníferos minerales tales como uraninita.
En la naturaleza, el uranio se encuentra como uranio-238 (99,2739-99,2752%), el uranio-235 (0,7198 a 0,7202%), y una cantidad muy pequeña de de uranio-234 (0,0050 hasta 0,0059%). El uranio se desintegra lentamente emitiendo una de partículas alfa. La vida media de uranio-238 es de aproximadamente 4,47 mil millones de años y la del uranio-235 es 704 millones de años, que los hace útiles en salir con la edad de la Tierra.
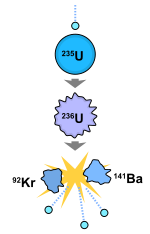
Muchos usos contemporáneos de uranio explotan sus únicas nucleares propiedades. El uranio-235 tiene la distinción de ser el único de origen natural fisible isótopo . El uranio-238 es fisionable por neutrones rápidos, y es fértil, lo que significa que puede ser transmutado fisionable plutonio-239 en un reactor nuclear. Otro isótopo fisible, uranio-233, puede ser producido a partir natural de torio y también es importante en la tecnología nuclear. Mientras que el uranio-238 tiene una pequeña probabilidad de que fisión espontánea o incluso la fisión inducida con neutrones rápidos, uranio-235 y en menor grado de uranio-233 tienen una sección transversal mucho mayor de fisión para los neutrones lentos. En concentración suficiente, estos isótopos mantener un sostenido reacción nuclear en cadena. Esto genera el calor en los reactores nucleares, y produce el material fisible para armas nucleares . El uranio empobrecido (238 U) se utiliza en penetradores de energía cinética y blindaje.
El uranio se utiliza como colorante en vidrio de uranio, la producción de naranja-rojo de limón tonalidades amarillas. También fue utilizado para teñir y el sombreado a principios de la fotografía . El 1789 descubrimiento de uranio en el mineral pechblenda se acredita a Martin Heinrich Klaproth, que nombró el nuevo elemento después de que el planeta Urano . Eugène-Melchior Péligot fue la primera persona para aislar el metal y sus propiedades radiactivas fueron descubiertas en 1896 por Antoine Becquerel. La investigación realizada por Enrico Fermi y otros que comienzan en 1934 llevaron a su uso como combustible en la industria de la energía nuclear y en Niño Pequeño, el primera arma nuclear usado en la guerra. Un subsiguiente carrera armamentista durante la Guerra Fría entre los Estados Unidos y la Unión Soviética produjo decenas de miles de armas nucleares que utilizan derivados de uranio metálico uranio y plutonio-239. La seguridad de esas armas y su material fisible a raíz de la desintegración de la Unión Soviética en 1991, es una preocupación constante para la salud y la seguridad pública. Ver La proliferación nuclear.
Características
Cuando refinada, el uranio es un blanco plateado, débilmente radiactivos de metal , que es más duro que la mayoría de los elementos. Es maleable, dúctil, ligeramente paramagnético, fuertemente electropositivo y es un pobre conductor eléctrico. El metal de uranio tiene una muy alta densidad , que es aproximadamente 70% más denso que el plomo , pero ligeramente menos densa que el oro .
El metal de uranio reacciona con casi todos los elementos no metálicos y sus compuestos , con reactividad aumenta con la temperatura. clorhídrico y nítrico disolver el uranio, pero ácidos distintos de ataque con ácido clorhídrico no oxidante elemento muy lentamente. Cuando finamente dividido, que puede reaccionar con agua fría; en el aire, uranio metálico se recubre con una capa oscura de óxido de uranio. El uranio en los minerales se extrae químicamente y se convirtió en dióxido de uranio o de otras formas químicas utilizables en la industria.
El uranio-235 fue el primer isótopo que se encontró para ser fisionable. Otros isótopos naturales son fisionables, pero no fisionable. Tras el bombardeo con neutrones lentos, su uranio-235 isótopo va la mayor parte de la brecha de tiempo en dos pequeños núcleos , liberando nuclear energía de enlace y más neutrones. Si muchos de estos neutrones son absorbidos por otros núcleos de uranio-235, un reacción nuclear en cadena ocurre que resulta en una explosión de calor o (en circunstancias especiales) una explosión. En un reactor nuclear, una reacción en cadena se hace más lenta y controlada por una veneno neutrónico, absorbiendo algunos de los neutrones libres. Materiales absorbentes tales neutrones son a menudo parte de reactor barras de control (véase la física reactor nuclear para una descripción de este proceso de control del reactor).
Tan poco como 15 libras (7 kg) de uranio-235 se puede utilizar para fabricar una bomba atómica. La primera bomba nuclear usado en la guerra, Little Boy, se basó en la fisión del uranio, mientras que la primera explosión nuclear ( El gadget ) y la bomba que destruyó Nagasaki ( Fat Man) eran bombas de plutonio.
El metal de uranio tiene tres alotrópicas formas:
- α ( ortorrómbica) estable hasta 660 ° C
- β ( tetragonal) estable a partir de 660 ° C a 760 ° C
- γ ( centrada en el cuerpo cúbico) de 760 ° C a punto de fusión-este es el estado más maleable y dúctil.
Aplicaciones
Militar

La principal aplicación de uranio en el sector militar está en alta densidad penetradores. Esta munición consiste en uranio empobrecido (DU) aleado con 1.2% de otros elementos. A la velocidad de alto impacto, la densidad, dureza, y piroforicidad del proyectil permiten la destrucción de objetivos fuertemente blindados. Armadura del tanque y otra extraíble blindaje de vehículos también se endureció con placas de uranio empobrecido. El uso de DU se convirtió en político y ambiental contencioso después del uso de municiones de uranio empobrecido por los EE.UU., Reino Unido y otros países durante las guerras en el Golfo Pérsico y los Balcanes suscitaba cuestiones de compuestos de uranio que quedan en el suelo (ver Síndrome de la Guerra del Golfo).
El uranio empobrecido también se utiliza como un material de blindaje en algunos recipientes utilizados para almacenar y transportar materiales radiactivos. Mientras que el propio metal es radiactivo, su alta densidad hace que sea más eficaz que el plomo en la detención de la radiación de fuentes fuertes tales como el radio . Otros usos de DU incluyen contrapesos para superficies de control del avión, como lastre para misiles re-entrada de vehículos y como material de blindaje. Debido a su alta densidad, este material se encuentra en sistemas de guía inercial y en giroscópico brújulas. DU se prefiere sobre metales de manera similar densos debido a su capacidad para ser fácilmente mecanizada y fundido, así como su coste relativamente bajo. El principal riesgo de la exposición al uranio empobrecido es la intoxicación química por óxido de uranio en lugar de la radiactividad (uranio ser sólo un débil emisor alfa).
Durante las últimas etapas de la Segunda Guerra Mundial , toda la Guerra Fría , y en menor medida después, el uranio-235 se ha utilizado como el material explosivo fisible para producir armas nucleares. Inicialmente, se construyeron dos grandes tipos de bombas de fisión: un dispositivo relativamente simple que utiliza uranio-235 y un mecanismo más complicado que utiliza plutonio-239 deriva de uranio-238. Más tarde, un tipo mucho más complicado y mucho más poderoso de bomba de fisión / fusión ( arma termonuclear) fue construido, que utiliza un dispositivo basado en plutonio para producir una mezcla de tritio y deuterio a someterse fusión nuclear. Tales bombas están forrados en un caso de uranio no fisionable (no enriquecido), y se obtienen más de la mitad de su energía de la fisión de este material por neutrones rápidos desde el proceso de fusión nuclear.
Civil

El principal uso del uranio en el sector civil es alimentar plantas de energía nuclear. Un kilogramo de uranio-235 puede producir teóricamente acerca de 80 terajulios de energía (8 × 10 13 julios), asumiendo la fisión completa; tanta energía en 3000 toneladas de carbón .
Comerciales de energía nuclear plantas utilizan combustible que normalmente se enriquece a alrededor del 3% de uranio-235. La CANDU y Diseños Magnox son los únicos reactores comerciales capaces de utilizar combustible de uranio enriquecido. El combustible utilizado para Reactores Armada de Estados Unidos es típicamente altamente enriquecido en de uranio-235 (los valores exactos son clasificado). En un reactor reproductor, el uranio-238 también se puede convertir en plutonio a través de la siguiente reacción: 238 U (n, gamma) → 239 U - (beta) → 239 Np - (beta) → 239 Pu.

Antes del descubrimiento de la radiactividad, el uranio se utiliza principalmente en pequeñas cantidades para vidrio y cerámica esmaltes amarillos, tales como vidrio de uranio y en Fiestaware.
El descubrimiento y el aislamiento del radio en el mineral de uranio (pechblenda) por Marie Curie dispararon el desarrollo de la minería de uranio para extraer la radio, que fue utilizado para fabricar pinturas que brillan en la oscuridad de esferas de relojes y de aviones. Esto dejó una cantidad prodigioso de uranio como un producto de desecho, ya que lleva tres toneladas de uranio para extraer uno gramo de radio. Este producto de desecho se desvió a la industria de acristalamiento, por lo que los esmaltes de uranio muy baratos y abundantes. Además de los esmaltes cerámicos, esmaltes de azulejos uranio representaron la mayor parte de la utilización, incluso baño y cocina azulejos comunes que se pueden producir en verde, amarillo, malva, negro, azul, rojo y otros colores.

El uranio se utilizó también en fotográficos químicos (especialmente nitrato de uranio como una tóner), en filamentos de las lámparas, para mejorar la apariencia de dentaduras, y en las industrias del cuero y madera para las manchas y tintes. Sales de uranio son mordientes de seda o lana. Acetato de uranilo y formato de uranilo se utilizan como "manchas" electrón-densos en microscopía electrónica de transmisión, para aumentar el contraste de especímenes biológicos en secciones ultrafinas y en tinción negativa de virus , aislado orgánulos celulares y macromoléculas.
El descubrimiento de la radiactividad del uranio marcó el comienzo de los usos científicos y prácticos adicionales del elemento. La larga vida media del isótopo uranio-238 (4,51 × 10 9 años) hace que sea muy adecuado para su uso en la estimación de la edad de las primeras rocas ígneas y para otros tipos de datación radiométrica, incluyendo de uranio-torio de citas, uranio-plomo de citas y datación uranio uranio. El metal de uranio se utiliza para Objetivos de rayos X en la toma de rayos X de alta energía.
Historia
Prehistoria de la fisión natural
En 1972 el físico francés Francis Perrin descubrió quince antigua y ya no ejerce reactores de fisión nuclear naturales en tres depósitos de mineral separadas al Mina de Oklo en Gabón , África occidental , colectivamente conocido como el Reactores fósiles Oklo. El yacimiento es de 1,7 mil millones de años; entonces, el uranio-235 constituye aproximadamente el 3% del total del uranio en la Tierra. Esto es lo suficientemente alta para permitir una reacción en cadena de fisión nuclear sostenida que se produzca, a condición de que existen otras condiciones de apoyo. La capacidad del sedimento circundante para contener el productos de desecho nuclear ha sido citada por el gobierno federal de Estados Unidos evidencia de apoyo para la viabilidad como para almacenar combustible nuclear gastado en el Yucca Mountain.
Uso pre-descubrimiento
El uso de uranio en su estado natural forma de óxido se remonta a por lo menos el año 79 CE, cuando fue utilizado para añadir un color amarillo a esmaltes cerámicos. Vidrio amarillo con 1% de óxido de uranio se encuentra en una romana villa en Cabo Posillipo en el Bahía de Nápoles, Italia por RT Gunther de la Universidad de Oxford en 1912. Desde finales de la Edad Media , la pechblenda se extrajo de la Minas de plata de los Habsburgo en Joachimsthal, Bohemia (ahora Jáchymov en la República Checa ) y fue utilizado como colorante en el local de fabricación de vidrio industria. En el siglo 19, las fuentes sólo conocidas del mundo de mineral de uranio eran estas minas.
Descubrimiento
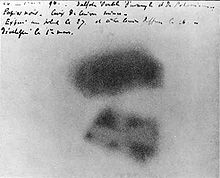
La descubrimiento del elemento se le atribuye al químico alemán Martin Heinrich Klaproth. Mientras trabajaba en su laboratorio experimental en Berlín en 1789, Klaproth fue capaz de precipitar un compuesto amarillo (probablemente diuranato de sodio) por disolución de pitchblende en ácido nítrico y la neutralización de la solución con hidróxido de sodio . Klaproth asumió la sustancia amarilla fue el óxido de un elemento aún por descubrir y se calienta con carbón vegetal para obtener un polvo negro, que creía que era el metal recién descubierto en sí (de hecho, que el polvo era un óxido de uranio). Nombró el elemento recién descubierto después de que el planeta Urano , (llamado así por el primordial Dios griego del cielo), que había sido descubierto ocho años antes por William Herschel.
En 1841, Eugène-Melchior Péligot, catedrático de Química Analítica de la Conservatoire National des Arts et Métiers (Escuela Central de Artes y Manufacturas) en París , aisló la primera muestra de uranio metálico por calentamiento tetracloruro de uranio con potasio . El uranio no fue visto como particularmente peligroso durante gran parte del siglo 19, que conduce al desarrollo de varios usos para el elemento. Uno de esos usos para el óxido era la coloración de la cerámica y el vidrio antes mencionado, pero que ya no es un secreto.
Antoine Henri Becquerel descubrió la radiactividad mediante el uso de uranio en 1896. Becquerel hizo el descubrimiento en París dejando una muestra de una sal de uranio, K 2 UO 2 (SO 4) 2 (potasio sulfato de uranilo), en la parte superior de un no expuesta placa fotográfica en un cajón y observando que la placa se había convertido en "empañado". Se determinó que una forma de luz invisible o rayos emitidos por el uranio había expuesto la placa.
Investigación de la fisión

Un equipo dirigido por Enrico Fermi en 1934 observó que bombardeando el uranio con neutrones produce la emisión de rayos beta ( electrones o positrones de los elementos producidos; ver partícula beta). Los productos de fisión fueron al principio confundido con nuevos elementos de números atómicos 93 y 94, que el decano de la Facultad de Roma, Orso Mario Corbino, bautizó ausonium y hesperium, respectivamente. Los experimentos que conducen al descubrimiento de la capacidad de uranio a la fisión (rompen) en elementos más ligeros y liberación energía de enlace se llevaron a cabo por Otto Hahn y Fritz Strassmann en el laboratorio de Hahn en Berlín. Lise Meitner y su sobrino, físico Otto Robert Frisch, publicó la explicación física en febrero de 1939 y nombró el proceso de " fisión nuclear ". Poco después, Fermi la hipótesis de que la fisión de uranio podría liberar suficientes neutrones para mantener una reacción de fisión. La confirmación de esta hipótesis se produjo en 1939, y la obra posterior encontró que en promedio alrededor de 2,5 neutrones son liberados por cada fisión del isótopo de uranio uranio-235. Más trabajo encontró que la mucho más común isótopo uranio-238 puede ser transmutado en plutonio, que, como el uranio-235, también es fisionable por neutrones térmicos. Estos descubrimientos llevaron numerosos países para comenzar a trabajar en el desarrollo de armas nucleares y la energía nuclear .
El 2 de diciembre de 1942, como parte de la Proyecto Manhattan, otro equipo dirigido por Enrico Fermi fue capaz de iniciar primero sostenido sí lo artificial la reacción en cadena nuclear, Chicago Pile-1. Trabajo en un laboratorio por debajo de los stands de Stagg Field en la Universidad de Chicago, el equipo creó las condiciones necesarias para tal reacción apilando juntas 400 toneladas cortas (360 toneladas métricas) de grafito, 58 toneladas cortas (53 toneladas métricas) de óxido de uranio, y seis toneladas cortas (5,5 toneladas métricas) de uranio metálico.
Bombas

Existen dos tipos principales de bombas atómicas fueron desarrolladas por los Estados Unidos durante la Segunda Guerra Mundial : un dispositivo basado en uranio (con nombre en código " Niño Pequeño ") cuyo material fisible fue altamente uranio enriquecido, y un dispositivo basado en plutonio (ver prueba de la trinidad y " Fat Man ") cuya plutonio fue derivado de uranio-238. El dispositivo de Little Boy base de uranio se convirtió en la primera arma nuclear usado en la guerra cuando fue detonada por el japonés ciudad de Hiroshima el 6 de agosto de 1945. La explosión de un rendimiento equivalente a 12.500 toneladas de TNT, la explosión y la onda térmica de la bomba destruyó casi 50.000 edificios y mató a aproximadamente 75.000 personas (véase Bombardeos atómicos de Hiroshima y Nagasaki). Inicialmente se creía que el uranio era relativamente raro, y que proliferación nuclear podría evitarse simplemente comprando todas las reservas de uranio conocidas, pero dentro de una década se descubrieron grandes yacimientos de que en muchos lugares alrededor del mundo.
Reactores

La X-10 Grafito reactor a Laboratorio Nacional de Oak Ridge (ORNL) en Oak Ridge, Tennessee, anteriormente conocida como la Pila Clinton y X-10 Pila, fue segundo reactor nuclear artificial del mundo (después de Chicago Pile de Enrico Fermi) y fue el primer reactor diseñado y construido para un funcionamiento continuo . Laboratorio Nacional Argonne de EBR-I, ubicado en la estación de pruebas Nacional Reactor de la Comisión de Energía Atómica cerca Arco, Idaho se convirtió en el primer reactor nuclear para generar electricidad, el 20 de diciembre de 1951. En un principio, cuatro bombillas de 150 vatios se encendieron por el reactor, pero las mejoras con el tiempo le permitió alimentar toda la instalación (más tarde, la ciudad de Arco se convirtió en la primera en el mundo en tener toda su electricidad proviene de la energía nuclear generada por BORAX-III, otro reactor diseñado y operado por Argonne Laboratorio Nacional). La primera central nuclear a escala comercial del mundo, Obninsk en la Unión Soviética , comenzó generación con su reactor AM-1 el 27 de junio de 1954. Otras plantas de energía nuclear tempranos eran Calder Hall en Inglaterra que comenzó generación el 17 de octubre de 1956 y el Shippingport Atómica central eléctrica en Pennsylvania, que comenzó el 26 de mayo de 1958. La energía nuclear se utilizó por primera vez para la propulsión de un submarino , el USS Nautilus, en 1954.
La contaminación y el legado de la Guerra Fría
Sobre el suelo pruebas nucleares por parte de la Unión Soviética y los Estados Unidos en la década de 1950 y comienzos de 1960 y por Francia en los años 1970 y 1980 se extienden una cantidad significativa de consecuencias de la hija de uranio isótopos en todo el mundo. Lluvia y la contaminación adicional se produjeron entre varios accidentes nucleares.
Mineros de uranio tienen una mayor incidencia de cáncer . Un exceso de riesgo de cáncer de pulmón entre Mineros de uranio Navajo, por ejemplo, se ha documentado y vinculado a su ocupación. La Ley de Compensación de exposición a la radiación, una ley de 1990 en los EE.UU., requiere 100.000 dólares en pagos "compasión" a los mineros de uranio con diagnóstico de cáncer u otras enfermedades respiratorias.
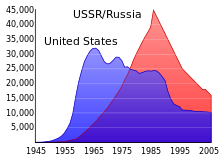
Durante la Guerra Fría entre la Unión Soviética y los Estados Unidos, enormes reservas de uranio se acumularon y decenas de miles de armas nucleares fueron creados usando el uranio y el plutonio enriquecido a partir de uranio. Desde el desintegración de la Unión Soviética en 1991, un estimado de 600 toneladas cortas (540 toneladas métricas) de uranio altamente enriquecido procedente de armas (suficiente para hacer 40.000 ojivas nucleares) se han almacenado en instalaciones menudo inadecuado guardadas en la Federación de Rusia y varios otros ex estados soviéticos. La policía en Asia , Europa , y América del Sur por lo menos en 16 ocasiones desde 1993 hasta 2005 tienen envíos interceptados de uranio enriquecido o plutonio contrabando, la mayoría de los cuales era de fuentes ex-soviéticas. De 1993 a 2005, el Material Protección, Control y Contabilidad Programa, operado por la el gobierno federal de los Estados Unidos, gastó aproximadamente US $ 550 millones para ayudar a salvaguardar las reservas de uranio y plutonio en Rusia. Este dinero fue utilizado para mejoras y mejoras de seguridad en las instalaciones de investigación y almacenamiento. Scientific American informó en febrero de 2006 que en algunas de las instalaciones de seguridad consistió en cercas de malla que se encontraban en estados graves de deterioro. De acuerdo con una entrevista del artículo, una instalación había sido el almacenamiento de muestras de enriquecimiento (grado de armas) de uranio en un armario de escobas antes de que el proyecto de mejora; otra pista había sido mantener sus existencias de ojivas nucleares que utilizan tarjetas de índice mantiene en una caja de zapatos.
Aparición
Bióticos y abióticos

El uranio es una de origen natural elemento que puede ser encontrado en niveles bajos dentro de todas las rocas, el suelo y el agua. El uranio es el elemento número 51 con el fin de abundancia en la corteza terrestre. El uranio es también el elemento de número más alto que se encuentra de forma natural en cantidades significativas en la Tierra y. Junto con todos los elementos que tiene pesos atómicos más altos que el de hierro , que se forma sólo de forma natural en las supernovas . La desintegración del uranio, torio , y potasio-40 en la de la Tierra manto se piensa que es la principal fuente de calor que mantiene la líquido del núcleo externo y unidades convección del manto, que a su vez impulsa la tectónica de placas .
Concentración media de uranio en la Tierra 's corteza es (dependiendo de la referencia) 2 a 4 partes por millón, o alrededor de 40 veces más abundante como la plata . La corteza de la Tierra desde la superficie hasta 25 km (15 millas) de profundidad se calcula para contener 10 17 kg (2 × 10 17 libras) de uranio mientras que los océanos pueden contener 10 13 kg (2 × 10 13 lb). La concentración de uranio en el suelo varía desde 0,7 hasta 11 partes por millón (hasta 15 partes por millón en tierras de cultivo del suelo debido al uso de fosfato de fertilizantes ), y su concentración en el agua de mar es de 3 partes por mil millones.
El uranio es más abundante que el antimonio , el estaño , el cadmio , el mercurio , o plata, y es casi tan abundante como el arsénico o el molibdeno . El uranio se encuentra en cientos de minerales incluyendo uraninita (el uranio más común mineral), carnotita, autunita, uranophane, torbernita, y coffinite. Las concentraciones elevadas de uranio se producen en algunas sustancias como fosfato depósitos de rocas y minerales como lignito, y arenas de monacita en minerales de uranio-rica (que se recupera a partir de fuentes comercialmente con tan poco como 0,1% de uranio).
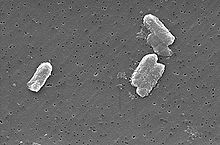
Algunas bacterias, tales como S. putrefaciens y G. metallireducens han demostrado reducir U (VI) a U (IV).
Algunos organismos, tales como la involuta Trapelia liquen o microorganismos tales como la bacteria Citrobacter, puede absorber concentraciones de uranio que son hasta 300 veces más altos que en su entorno. Especies de Citrobacter absorben uranilo iones cuando dado glicerol fosfato (u otros fosfatos orgánicos similares). Después de un día, un gramo de bacterias puede incrustar sí mismos con nueve gramos de cristales de fosfato de uranilo; esto crea la posibilidad de que estos organismos podrían ser utilizados en biorremediación a descontaminar el agua contaminadas con uranio.
En la naturaleza, el uranio (VI) forma complejos carbonatados altamente solubles a pH alcalino. Esto conduce a un aumento de la movilidad y la disponibilidad de uranio para las aguas subterráneas y del suelo a partir de desechos nucleares que conduce a riesgos para la salud. Sin embargo, es difícil para precipitar el uranio en forma de fosfato en presencia de un exceso de carbonato a pH alcalino. A sp Sphingomonas. cepa BSAR-1 se ha encontrado para expresar una alta actividad de la fosfatasa alcalina (Phok) que se ha aplicado para bioprecipitación de uranio como especies de fosfato de uranilo a partir de soluciones alcalinas. La capacidad de precipitación se mejoró mediante la sobreexpresión de la proteína en E. Phok coli.
Las plantas absorben parte del uranio del suelo. Las concentraciones de peso seco de uranio en plantas variar de 5 a 60 partes por mil millones, y la ceniza de madera quemada pueden tener concentraciones de hasta 4 partes por millón. Las concentraciones de peso seco de uranio en alimentos plantas son generalmente más bajos con uno a dos microgramos por día ingeridos a través de la comida que la gente come.
La producción y la minería
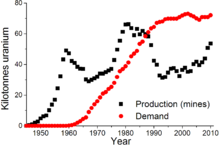

La producción mundial de uranio en 2010 ascendió a 53.663 de toneladas, de las cuales 17 803 t (33,2%) se extraen en Kazajstán . Otros países mineros de uranio importantes son Canadá (9.783 t), Australia (5.900 t), Namibia (4.496 t), Níger (4.198 t) y Rusia (3.562 t).
Mineral de uranio se extrae de varias maneras: por a cielo abierto, subterráneo, in-situ de lixiviación, y la minería de pozo (ver la extracción de uranio). Mineral de uranio de bajo grado minado contiene típicamente 0,01 a 0,25% de óxidos de uranio. Amplias medidas se deben emplear para extraer el metal de su mineral. Minerales de alto grado encuentran en Depósitos cuenca de Athabasca en Saskatchewan, Canadá puede contener hasta un 23% de óxidos de uranio en promedio. El mineral de uranio se tritura y se vuelve en un polvo fino y después se lixivia con ya sea un ácido o álcali. La lixiviado se somete a una de varias secuencias de precipitación, extracción con disolvente, y el intercambio de iones. La mezcla resultante, llamada torta amarilla, contiene al menos 75% de óxidos de uranio U 3 O 8. La torta amarilla es entonces calcinado para eliminar las impurezas del proceso de molienda antes de la refinación y la conversión.
Uranio de calidad comercial se puede producir a través de la reducir uranio haluros con alcalinos o metales alcalinotérreos . El metal de uranio también se puede preparar a través de la electrólisis de 5 o KUF UF 4, se disolvió en fundido de cloruro de calcio (Ca Cl 2) y cloruro de sodio ( Na ) solución de Cl. Uranio muy puro se produce a través de la la descomposición térmica de los haluros de uranio en un filamento caliente.
Suministro
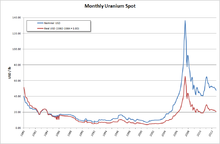
En 2005, diecisiete países producen óxidos de uranio concentrado, Canadá (27,9% de la producción mundial) y Australia (22,8%) son los mayores productores y Kazajstán (10,5%), Rusia (8,0%), Namibia (7,5%), Níger ( 7,4%), Uzbekistán (5,5%), el de los Estados Unidos (2,5%), Argentina (2,1%), Ucrania (1,9%) y de China (1,7%) también producir cantidades significativas. Kazajstán sigue aumentando la producción y se puede haber convertido en el mayor productor mundial de uranio para el 2009 con una producción prevista de 12.826 toneladas, frente a Canadá con 11.100 toneladas y Australia con 9.430 t. El último de uranio disponibles se cree que es suficiente para al menos los próximos 85 años, aunque algunos estudios indican la falta de inversión en el siglo XX puede producir problemas de suministro en el siglo 21. Depósitos de uranio parecen ser log-normal distribuida. Hay un aumento de 300 veces en la cantidad de uranio recuperable para cada disminuir diez veces en la ley del mineral. En otras palabras, hay poco mineral de alto grado y mineral proporcionalmente mucho más baja calidad disponible.
Compuestos
Estados de oxidación y óxidos
Óxidos
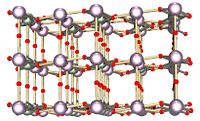 |  | |
Octaoxide Triuranium (izquierda) y de dióxido de uranio (derecha) son los dos óxidos de uranio más comunes. | ||
Torta amarilla de uranio calcinado como se produce en muchas grandes molinos contiene una distribución de las especies de oxidación del uranio en diversas formas que van desde el más oxidado a menos oxidado. Las partículas con tiempos de residencia cortos en un calcinador serán generalmente menos oxidado que aquellos con tiempos de retención largos o partículas recuperado en el lavador de pila. Contenido de uranio se suele hace referencia a U 3 O 8, que data de los días de la Proyecto Manhattan cuando U 3 O 8 se utilizó como una norma de información química analítica.
Relaciones de fase en el sistema de uranio-oxígeno son complejas. Los estados de oxidación más importantes de uranio son de uranio (IV) y el uranio (VI), y sus dos correspondientes óxidos son, respectivamente, dióxido de uranio (UO 2) y trióxido de uranio (UO 3). Otro (· 2H 2 O UO 4) también existen óxidos de uranio, tales como monóxido de uranio (UO), pentóxido de diuranium (U 2 O 5), y peróxido de uranio.
Las formas más comunes de óxido de uranio son octaoxide triuranium (U 3 O 8) y UO 2. Ambas formas de óxido son sólidos que tienen baja solubilidad en agua y son relativamente estables en un amplio rango de condiciones ambientales. Octaoxide Triuranium es (dependiendo de las condiciones) el compuesto más estable de uranio y es la forma más común en la naturaleza. Dióxido de uranio es la forma en que el uranio es más comúnmente utilizado como combustible de reactor nuclear. A temperatura ambiente, UO 2 se convertirá gradualmente a U 3 O 8. Debido a su estabilidad, óxidos de uranio se consideran en general la forma química preferida para su almacenamiento o disposición.
Química acuosa

Las sales de muchos estados de oxidación de uranio son agua soluble y pueden ser estudiados en soluciones acuosas. Las formas más comunes son iónicos U 3+ (marrón-rojo), U 4+ (verde), UO +
2 (inestable), y UO 2 +
2 (amarillo), por U (III), U (IV), U (V), y U (VI), respectivamente. Unos sólidos existen compuestos y semi-metálicos como UO y los Estados Unidos para el uranio formal de estado de oxidación (II), pero no hay iones simples se sabe que existen en solución para ese estado. Los iones de U3 + de liberar a hidrógeno a partir de agua y por lo tanto se considera que son muy inestables. La UO 2 +
2 representa el ion de uranio (VI) estado y es conocido para formar compuestos tales como carbonato de uranilo, cloruro de uranilo y uranilo sulfato. UO 2 +
2 también formas complejos con varios orgánica agentes quelantes, la más comúnmente encontrados de que es acetato de uranilo.
A diferencia de las sales de uranilo de uranio y formas catiónicas de iones de uranio-óxido de poliatómicos, la uranatos, sales que contienen un anión poliatómico óxido de uranio, generalmente no son solubles en agua.
Los carbonatos
Las interacciones de los aniones carbonato con uranio (VI) hacen que el Diagrama de Pourbaix para cambiar en gran medida cuando se cambia el medio de agua a una solución que contiene carbonato. Mientras que la gran mayoría de los carbonatos son insolubles en agua (estudiantes a menudo se les enseña que todos los carbonatos distintos de los de metales alcalinos son insolubles en agua), carbonatos de uranio son a menudo solubles en agua. Esto es porque una U (VI) catión es capaz de unirse a dos óxidos de terminales y tres o más carbonatos para formar complejos aniónicos.
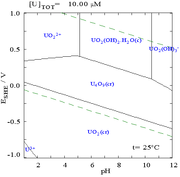 | 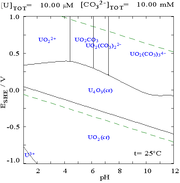 | 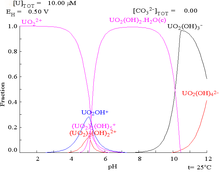 | 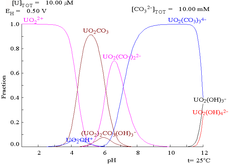 |
| El uranio en un medio acuoso no de complejos (por ejemplo,ácido perclórico / hidróxido de sodio). | El uranio en solución de carbonato | Concentraciones relativas de las diferentes formas químicas de uranio en un medio acuoso no complejante (por ejemplo,ácido perclórico / hidróxido de sodio). | Las concentraciones relativas de las diferentes formas químicas de uranio en una solución acuosa de carbonato. |
Efectos del pH
Los diagramas de fracciones de uranio en presencia de carbonato ilustran este además: cuando el pH de una uranio (VI) aumenta solución, el uranio se convierte en un hidróxido de óxido de uranio hidratado y a altas pHs se convierte en un complejo aniónico de hidróxido.
Cuando se añade carbonato, el uranio se convierte en una serie de complejos de carbonato de si se aumenta el pH. Uno de los efectos de estas reacciones se aumenta la solubilidad del uranio en el rango de pH de 6 a 8, un hecho que tiene una relación directa con la estabilidad a largo plazo de los combustibles nucleares de dióxido de uranio gastado.
Hidruros, carburos y nitruros
El metal de uranio calienta a 250 a 300 ° C (482-572 ° F) reacciona con hidrógeno para formar hidruro de uranio. Incluso las temperaturas más altas se eliminarán de forma reversible el hidrógeno. Esta propiedad hace que los hidruros de uranio materiales de partida convenientes para crear polvo de uranio reactiva, junto con varios de uranio de carburo, nitruro, y compuestos de haluro. Existen dos modificaciones cristalinas de hidruro de uranio: una forma α que se obtiene a bajas temperaturas y una forma β que se crea cuando la temperatura de formación está por encima de 250 ° C.
Carburos de uranio y nitruros de uranio son ambos relativamente inerte compuestos semimetálicos que son mínimamente soluble en ácidos , reaccionan con el agua, y pueden encenderse en el aire para formar T 3 O 8 . Carburos de uranio incluyen monocarburo uranio (U C ), dicarbide uranio ( UC 2 ) y tricarbide diuranium ( T 2 C 3 ). Tanto UC y UC 2 se forman mediante la adición de carbono al uranio fundido o mediante la exposición del metal para el monóxido de carbono a altas temperaturas. Estable por debajo de 1800 ° C, U 2 C 3 se prepara sometiendo una mezcla calentada de UC y UC 2 a la tensión mecánica. Nitruros uranio obtenidos por la exposición directa del metal a nitrógeno incluyen mononitride uranio (ONU), dinitride uranio ( ONU 2 ), y trinitride diuranium ( U 2 N 3 ).
Haluros

Todos los fluoruros de uranio se crean usando tetrafluoruro de uranio ( UF 4 ); UF 4 en sí se prepara por hidrofluoración de dióxido de uranio. Reducción de la UF 4 con hidrógeno a 1.000 ° C produce trifluoruro de uranio ( UF 3 ). Bajo las condiciones adecuadas de temperatura y presión, la reacción de sólido UF 4 con gaseoso hexafluoruro de uranio ( UF 6 ) pueden formar los fluoruros intermedios de U 2 F 9 , U 4 F 17 , y UF 5 .
A temperatura ambiente, la UF 6 tiene una alta presión de vapor, por lo que es útil en el proceso de difusión gaseosa para separar el raro uranio-235 de la común isótopo uranio-238. Este compuesto puede prepararse a partir de dióxido de uranio y el hidruro de uranio por el siguiente proceso:
- UO2+ 4 HF →UF4+ 2H2O(500 ° C, endotérmica)
- UF4+F2→UF6(350 ° C, endotérmica)
El resultanteUF6, un sólido blanco, es altamentereactivo(por fluoración), fácilmentesublima (que emite un vapor que se comporta como un casigas ideal), y es el compuesto más volátil de uranio sabe que existen.
Un método de preparación de tetracloruro de uranio ( UCl 4 ) es combinar directamente cloro ya sea con uranio metal o hidruro de uranio. La reducción de UCl 4 por hidrógeno produce tricloruro de uranio ( UCl 3 ), mientras que los cloruros superiores de uranio se preparan por reacción con el cloro adicional. Todos los cloruros de uranio reaccionan con el agua y el aire.
Bromuros y yoduros de uranio se forman por reacción directa de, respectivamente, bromo y yodo con uranio o mediante la adición de UH 3 a los ácidos de los elementos. Ejemplos conocidos son: UBR 3 , UBR 4 , interfaz de usuario 3 y la interfaz de usuario 4 . Oxihaluros uranio son solubles en agua e incluyen UO 2 F 2 , UOCl 2 , UO 2 Cl 2 , y UO 2 Br 2 . Estabilidad de los oxihalogenuros disminuir como el peso atómico del componente de haluro de aumentos.
Isótopos
Concentraciones naturales
El uranio natural consiste en tres principales isótopos : el uranio-238 (99,28% abundancia natural), el uranio-235 (0,71%), y el uranio-234 (0.0054%). Los tres son radiactivo, emitiendo partículas alfa, con la excepción de que todos los tres de estos isótopos tienen pequeñas probabilidades de sufrir fisión espontánea, en lugar de emisión alfa.
El uranio-238 es el isótopo más estable de uranio, con una vida media de alrededor de 4,468 × 10 9 años, aproximadamente el edad de la Tierra. uranio-235 tiene una vida media de alrededor de 7,13 × 10 8 años, y el uranio-234 tiene una vida media de aproximadamente 2.48 × 10 5 años. Para uranio natural, alrededor del 49% de sus rayos alfa son emitidos por cada uno de 238 U átomo, y también 49% en 234 U (ya que este último se forma a partir de la primera) y aproximadamente 2,0% de ellos por el 235 U. Cuando la Tierra era joven, probablemente alrededor de una quinta parte de su uranio era el uranio-235, pero el porcentaje de 234 U era probablemente mucho más bajo que esto.
El uranio-238 es por lo general un emisor α (de vez en cuando, se somete a la fisión espontánea), descomposición a través de la"Serie de uranio" de la desintegración nuclear, que tiene 18 miembros, todos los cuales eventualmente se desintegran enplomo-206, por una variedad de diferentes caminos de desintegración .
La serie de desintegración de la 235 U, que se llama la serie actinio tiene 15 miembros, todos los cuales eventualmente decaen en plomo-207. Las tasas constantes de decaimiento en estas series de desintegración hace que la comparación de las relaciones de los padres a los elementos hija útil en datación radiométrica.
El uranio-234 es un miembro de la"Serie de uranio", y decae a plomo-206 a través de una serie de isótopos relativamente de corta vida.
El uranio-233 está hecho de torio-232 por bombardeo de neutrones, por lo general en un reactor nuclear, y 233 U es también fisionable. Su serie de desintegración termina con talio -205.
El uranio-235 es importante tanto para losreactores nucleares ylas armas nucleares, ya que es el único isótopo de uranio existente en la naturaleza en la Tierra en cualquier cantidad significativa que es fisionable.Esto significa que se puede dividir en dos o tres fragmentos (productos de fisión) por neutrones térmicos.
El uranio-238 no es fisionable, pero es un isótopo fértil, porque después de la activación de neutrones que puede producir plutonio-239, otro isótopo fisionable. De hecho, el 238 núcleo T puede absorber un neutrón para producir el isótopo radiactivo de uranio-239. 239 U decae por emisión beta a neptunio -239, también un beta-emisor, que se descompone a su vez, dentro de unos pocos días en plutonio-239. 239 Pu se utilizó como material fisible en la primera bomba atómica detonada en la " prueba de la Trinidad "el 15 de julio de 1945 en Nuevo Mexico.
Enriquecimiento

En la naturaleza, el uranio se encuentra como el uranio-238 (99.2742%) y uranio-235 (0.7204%). Isotope concentrados de separación (enriquece) la fisionable uranio-235 para armas nucleares y la mayoría de las plantas de energía nuclear, a excepción de reactores refrigerados por gas y presión reactores de agua pesada. La mayoría de los neutrones liberados por un átomo de fisión del uranio-235 deben afectar otros uranio-235 átomos para sostener el reacción nuclear en cadena. La concentración y la cantidad de uranio-235 necesario para lograr esto se llama una ' masa crítica '.
Para ser considerado 'enriquecido', la fracción de uranio-235 debe estar entre 3% y 5%. Este proceso produce enormes cantidades de uranio que se agota de uranio-235 y con un aumento de la correspondiente fracción de uranio-238, llamado uranio empobrecido o 'DU'. Para ser considerado 'agotado', la concentración de isótopos de uranio-235 no debe ser mayor de 0,3%. El precio del uranio ha aumentado desde 2001, por lo que los relaves de enriquecimiento que contengan más de 0,35% de uranio-235 se están considerando para la re-enriquecimiento, impulsando el precio de hexafluoruro de uranio empobrecido por encima de 130 dólares por kilogramo en julio de 2007 a partir de $ 5 en 2001.
La proceso de centrifugadora de gas, donde gaseoso hexafluoruro de uranio ( UF 6 ) se separa por la diferencia de peso molecular entre 235 UF 6 y 238 UF 6 usando alta velocidad centrifugadoras, es el proceso de enriquecimiento más barata y líder. La proceso de difusión gaseosa había sido el método principal para el enriquecimiento y fue utilizado en el Proyecto Manhattan. En este proceso, el hexafluoruro de uranio se repetidamente difunde a través de una plata - zinc membrana y los diferentes isótopos de uranio están separados por velocidad de difusión (ya que el uranio 238 es más pesado que difunde un poco más lento que el uranio-235). La método de separación isotópica por láser molecular emplea un láser de haz de energía precisa para romper el vínculo entre el uranio-235 y flúor. Esto deja uranio-238 unido a flúor y permite uranio-235 de metal a precipitar de la solución. Un método alternativo de enriquecimiento por láser se conoce como vapor atómico isotópica por láser de separación (SILVA) y emplea visibles láseres sintonizables tales como láseres de colorante. Otro método utilizado es la difusión térmica líquido.
La exposición humana
Una persona puede estar expuesto a uranio (o sus hijas radiactivos tales como el radón ) por la inhalación de polvo en el aire o por la ingestión de agua y alimentos contaminados. La cantidad de uranio en el aire es generalmente muy pequeña; Sin embargo, las personas que trabajan en las fábricas que procesan fosfatos fertilizantes , viven cerca de las instalaciones del gobierno que hicieron o probaron armas nucleares, vivir o trabajar cerca de un campo de batalla moderno, donde uranio empobrecido armas se han utilizado, o vivir o trabajar cerca de un carbón planta de energía -fired, instalaciones que extraen mineral de uranio o proceso, o enriquecen uranio para combustible de reactor, puede haber una mayor exposición al uranio. Casas o estructuras que son más de yacimientos de uranio (natural o artificial de los depósitos de escoria) pueden tener una mayor incidencia de la exposición al gas radón.
La mayoría de uranio ingerida se excreta durante la digestión. sólo el 0,5% se absorbe cuando formas insolubles de uranio, tales como su óxido, se ingieren, mientras que la absorción de la más soluble de iones de uranilo puede ser de hasta 5%. Sin embargo, los compuestos de uranio solubles tienden a pasar rápidamente a través del cuerpo mientras que los compuestos de uranio insolubles, especialmente cuando se inhala a través de polvo en los pulmones, plantean un riesgo de exposición más grave. Después de entrar en el torrente sanguíneo, el uranio absorbido tiende a bioacumularse y permanecer durante muchos años en el tejido óseo debido a la afinidad de uranio para los fosfatos. El uranio no se absorbe por la piel, y las partículas alfa liberadas por el uranio no puede penetrar la piel.
Uranio Incorporated se convierte en iones uranilo, que se acumulan en el hueso, el hígado, el riñón y los tejidos reproductivos. El uranio puede ser descontaminado de superficies de acero y acuíferos.
Efectos y precauciones
El funcionamiento normal del riñón , cerebro , hígado, corazón , y otros sistemas pueden ser afectados por la exposición al uranio, porque, además de ser débilmente radiactivo, el uranio es un metal tóxico. El uranio también es un tóxico para la reproducción. Efectos radiológicos son generalmente locales ya que la radiación alfa, la principal forma de 238 U decadencia, tiene un alcance muy corto, y no penetrar la piel. uranilo ( UO +
2 iones), como de trióxido de uranio o de nitrato de uranilo y otros compuestos de uranio hexavalente, se ha demostrado que causa defectos de nacimiento y daños en el sistema inmune en animales de laboratorio. Mientras que el CDC ha publicado un estudio que ningún ser humano el cáncer se ha visto como resultado de la exposición al uranio natural o empobrecido, la exposición al uranio y sus productos de desintegración, especialmente el radón , son ampliamente conocidos y las amenazas para la salud. La exposición al estroncio-90, yodo-131, y otros productos de fisión no está relacionada con la exposición al uranio, pero puede ser el resultado de los procedimientos médicos o la exposición al combustible de reactor gastado o consecuencias de las armas nucleares. Aunque la exposición por inhalación accidental a una alta concentración de hexafluoruro de uranio ha dado lugar a muertes humanas, esas muertes se asociaron con generación de ácido fluorhídrico y altamente tóxico fluoruro de uranilo en lugar de con uranio sí mismo. Uranio metálico finamente dividido presenta un riesgo de incendio porque el uranio es pirofórico; pequeños granos se inflamarse espontáneamente en el aire a temperatura ambiente.
El uranio metálico se maneja comúnmente con guantes como medida de precaución suficiente. Concentrado de uranio se maneja y contenía a fin de garantizar que las personas no inhalan o ingieren.
| Sistema corporal | Los estudios en humanos | Los estudios en animales | In vitro |
|---|---|---|---|
| Renal | Los niveles elevados de excreción de proteínas, catalasa urinaria y diuresis | El daño a los túbulos contorneados proximales, las células necróticas emitidos desde epitelio tubular, cambios glomerulares (insuficiencia renal) | Ningún estudio |
| Cerebro / CNS | Disminución de rendimiento en las pruebas neurocognitivas | Toxicidad colinérgica aguda; Acumulación dependiente de la dosis en la corteza, el mesencéfalo y vermis; Cambios electrofisiológicos en el hipocampo | Ningún estudio |
| ADN | El aumento de informes de cánceres | Aumento de la mutagenicidad (en ratones) y la inducción de tumores | Células binucleadas con micronúcleos, la inhibición de la cinética del ciclo celular y la proliferación; Inducción cromátida hermana, fenotipo tumorigénico |
| Bone / muscular | Ningún estudio | La inhibición de la formación de hueso periodontal; y la cicatrización de heridas alveolar | Ningún estudio |
| Reproductivo | Mineros de uranio han nacido más primero niñas | Moderada a severa atrofia tubular focal; vacuolización de las células de Leydig | Ningún estudio |
| Pulmones / respiratoria | No tiene efectos adversos para la salud reportados | Congestión nasal severa y hemorragia, lesiones pulmonares y fibrosis, edema e inflamación, cáncer de pulmón | Ningún estudio |
| Gastrointestinal | Vómitos, diarrea, albuminuria | Ningún estudio | Ningún estudio |
| Hígado | No hay efectos vistos en dosis de exposición | Hígados grasos, necrosis focal | Ningún estudio |
| Piel | No hay datos de evaluación de la exposición disponibles | Células epidérmicas vacuolados inflamados, daño a los folículos pilosos y las glándulas sebáceas | Ningún estudio |
| Tejidos circundantes incrustados fragmentos de uranio empobrecido | Concentraciones urinarias elevadas de uranio | Concentraciones en orina de uranio elevada, perturbaciones en las pruebas bioquímicas y neuropsicológica | Ningún estudio |
| Sistema inmune | Infecciones de fatiga, erupción, los oídos y los ojos crónicas, cabello y la pérdida de peso, tos. Puede ser debido a la exposición química combinada en lugar de DU solos | Ningún estudio | Ningún estudio |
| Ojos | Ningún estudio | La conjuntivitis, inflamación irritación, edema, ulceración de sacos conjuntivales | Ningún estudio |
| Sangre | Ningún estudio | Disminución en el recuento de glóbulos rojos y la concentración de hemoglobina | Ningún estudio |
| Cardiovascular | La miocarditis resultante de la ingestión de uranio, que terminó 6 meses después de la ingestión | No hay efectos | Ningún estudio |
