
Bario
Antecedentes de las escuelas de Wikipedia
SOS Children han producido una selección de artículos de la Wikipedia para escuelas desde 2005. SOS Children ha cuidado de niños en África durante cuarenta años. ¿Puedes ayudar a su trabajo en África ?
| Bario | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
56 Ba | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
gris plateado  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | de bario, Ba, 56 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / b ɛər yo ə m / BAIR -ee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría metálico | metales de tierras alcalinas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 2 (metales alcalinotérreos) , 6, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 137.327 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Xe ] 6s 2 2, 8, 18, 18, 8, 2 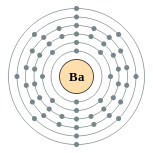 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Carl Wilhelm Scheele (1772) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Humphry Davy (1808) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 3,51 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 3,338 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1000 K , 727 ° C, 1341 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 2170 K, 1897 ° C, 3447 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 7.12 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 140.3 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 28.07 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 2 (Fuertemente óxido básico) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 0,89 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 502,9 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 965.2 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 3600 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 222 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 215 ± 23:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radio | 268 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | centrada en el cuerpo cúbico  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 332 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 18.4 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 20,6 m · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 1620 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | 13 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | 4,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 9,6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 1.25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-39-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de bario | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
El bario es un elemento químico con el símbolo Ba y número atómico 56. Es el quinto elemento en el Grupo 2, un plateado suave metálico metal alcalinotérreo . Debido a su alta químico bario reactividad nunca se encuentra en la naturaleza como elemento libre. Su hidróxido era conocido en la historia premoderna barita; esta sustancia no se produce como un mineral, pero se puede preparar por calentamiento de carbonato de bario.
Los minerales que ocurren naturalmente más común de bario son barita (sulfato de bario, BaSO4) y witherita (carbonato de bario, BaCO3), siendo ambos insoluble en agua. El nombre de bario se origina a partir del derivado alquímico "varita", que a su vez proviene del griego βαρύς (barys), que significa "pesado". El bario se identificó como un elemento nuevo en 1774, pero no se reduce a un metal de hasta 1808, poco después de que se dispusiera de técnicas de aislamiento electrolíticos.
El bario hay pocos aplicaciones industriales. El metal se ha utilizado históricamente para recoger aire en tubos de vacío. Es un componente de YBCO ( superconductores de alta temperatura) y electroceramica, y se añade al acero y hierro para reducir el tamaño de los granos de carbono dentro de la microestructura del metal fundido. Los compuestos de bario se añaden a los fuegos artificiales para impartir un color verde. El sulfato de bario se utiliza como un aditivo pesada insoluble para pozo de petróleo fluido de perforación, y en forma más pura, como rayos X agentes de radiocontraste para formación de imágenes del tracto gastrointestinal humano. Compuestos de bario solubles son tóxicos debido a la liberación de los iones de bario soluble, y por lo tanto se han utilizado como raticidas.
Características
Propiedades físicas

El bario es un metal blando, blanco plateado, con un ligero tono dorado cuando ultrapura. El color blanco plateado de metal de bario se desvanece rápidamente después la oxidación en el aire proporcionando una capa de óxido de color gris oscuro. De bario tiene un medio de peso específico y una buena conductividad eléctrica. Ultrapura bario es muy difícil de preparar, y por lo tanto muchas de las propiedades de bario no se han medido con precisión aún.
A temperatura ambiente y presión, bario tiene una centrada en el cuerpo estructura cúbica, con una distancia de bario de bario de 503 picómetros, ampliando con calentamiento a una velocidad de aproximadamente 1,8 × 10 -5 / ° C. Es un metal muy blando con una dureza de Mohs de 1,25. Su temperatura de fusión de 1.000 K (730 ° C; 1340 ° F) es intermedio entre el de los de estroncio más ligero (1.050 K, 780 ° C; 1430 ° F) y el radio más pesado (973 K, 700 ° C; 1292 ° F) ; sin embargo, su punto de 2170 K (1900 ° C; 3.450 ° F) de ebullición mayor que la de estroncio (1655 K, 1382 ° C; 2519 ° F). La densidad (3,62 g · cm -3) es de nuevo intermedios entre los de estroncio (2,36 g · cm -3) y el radio (~ 5 g · cm -3).
Reactividad química
El bario es químicamente similar a la de magnesio, calcio y estroncio, siendo incluso más reactivo. Siempre exhibe el estado de oxidación de +2. Reacciones con calcógenos son altamente exotérmica (liberación de energía); la reacción con oxígeno o aire se produce a temperatura ambiente, y por lo tanto de bario se almacena bajo aceite o atmósfera de gas inerte. Las reacciones con otros los elementos no metálicos, tales como carbono, nitrógeno, fósforo, silicio e hidrógeno, son generalmente exotérmica y proceder con el calentamiento. Las reacciones con agua y alcoholes también son muy exotérmica y liberan gas hidrógeno:
- Ba + 2 ROH → Ba (OR) 2 + H 2 ↑ (R es un alquilo o un átomo de hidrógeno)
Además, bario reacciona con amoniaco para formar complejos tales como Ba (NH 3) 6.
El metal es atacado fácilmente por la mayoría de los ácidos. El ácido sulfúrico es una excepción notable, ya pasivación se detiene la reacción mediante la formación de la insoluble sulfato de bario. El bario se combina con varios metales, incluyendo aluminio , zinc , plomo y estaño , formando fases y aleaciones intermetálicos.
Compuestos
| O 2- | S 2- | F - | Cl - | SO 2- 4 | CO 2- 3 | O 2- 2 | H - | |
|---|---|---|---|---|---|---|---|---|
| Ca 2+ | 3.34 | 2.59 | 3.18 | 2.15 | 2.96 | 2.83 | 2.9 | 1.7 |
| Sr 2+ | 5.1 | 3.7 | 4.24 | 3.05 | 3.96 | 3.5 | 4.78 | 3.26 |
| Ba 2+ | 5.72 | 4.3 | 2.1 | 1.9 | 4.49 | 4.29 | 4.96 | 4.16 |
| Zn 2+ | 5.6 | 4.09 | 4.9 | 2.09 | 3.8 | 4.4 | 1.57 | - |
Sales de bario son típicamente blanco cuando son sólidos e incoloro cuando se disuelve, como iones de bario no proporcionan ninguna coloración específica. También son más densas que sus estroncio o calcio análogos, a excepción de la haluros (ver tabla; zinc se da para la comparación).
Hidróxido de bario ("varita") era conocido por alquimistas que lo produjeron calentando carbonato de bario. A diferencia de hidróxido de calcio, absorbe muy poco CO 2 en soluciones acuosas y es, por tanto, insensible a las fluctuaciones atmosféricas. Esta propiedad se utiliza en la calibración de equipos de pH.
Compuestos de bario volátiles se queman con un verde a verde pálido llama, que es una prueba eficiente para detectar un compuesto de bario. Los resultados de color de líneas espectrales a 455.4, 493.4, 553.6, y 611.1 nm.
Compuestos Organobarium son una clase creciente de compuestos: por ejemplo, dialkylbariums son conocidos, como lo son alkylhalobariums.
Isótopos
El bario se produce de forma natural en la Tierra como una mezcla de siete nucleidos primordiales, bario-130, 132, y 134 a través de 138. Los dos primeros se cree que son radiactivos: bario-130 debe decaer a xenón-130 a través de doble beta además de decaimiento, y bario-132 deben decaer de manera similar al xenón-132. Las vidas medias correspondientes deben exceder la edad del Universo por lo menos mil veces. Sus abundancias son ~ 0,1% con respecto al de bario natural. Su radiactividad es tan débil que no suponen ningún peligro para la vida. Fuera de los isótopos estables, bario-138 hace hasta 71,7% del total de bario, y el encendedor del isótopo, menos es abundante. En total, bario tiene unos 50 isótopos conocidos, que varían en masa entre 114 y 153. El isótopo metaestable más estable es de bario-133, que tiene una vida media de aproximadamente 10,51 años, y cinco isótopos más tener su media-vida más larga que un día. De bario también tiene 10 estados de la meta, de los cuales de bario-133m1 es la más estable, que tiene una media-vivo de aproximadamente 39 horas.
Historia

Los alquimistas de la Edad Media temprana sabían de algunos minerales de bario. Piedras de cantos rodados como lisas de barita mineral que se encuentra en Bolonia , Italia , eran conocidas como "piedras de Bolonia." Las brujas y alquimistas fueron atraídos por ellos, porque después de la exposición a la luz que les ilumine para años. Las propiedades fosforescentes de barita calentadas con compuestos orgánicos se describen por V. Casciorolus en 1602.
Carl Scheele identificó como barita que contiene un elemento nuevo en 1774, pero no pudo aislar de bario, sólo óxido de bario. Johan Gottlieb Gahn también aislado óxido de bario dos años más tarde en estudios similares. Bario oxidado fue al principio llamado "barote," por Guyton de Morveau, un nombre que fue cambiado por Antoine Lavoisier a barita. También en el siglo 18, mineralogista Inglés William Withering observó una pesada mineral en las minas de plomo de Cumberland, ahora se sabe que witherita. El bario fue aislado por primera vez por electrólisis de sales de bario fundidas en 1808, por Sir Humphry Davy en Inglaterra . Davy, por analogía con calcio llamado "bario" después de barita, con el "-ium" final significa un elemento metálico. Robert Bunsen y Augusto Matthiessen obtiene de bario puro por electrólisis de una mezcla fundida de cloruro de bario y de cloruro de amonio.
La producción de oxígeno puro en el Proceso Brin era una aplicación a gran escala de peróxido de bario en la década de 1880, antes de que fuera reemplazado por electrólisis y destilación fraccionada del aire licuado en el año 1900. En este proceso de óxido de bario reacciona a 500-600 ° C (932-1.112 ° F) con aire para formar peróxido de bario, que se descompone por encima de 700 ° C (1292 ° F) por la liberación de oxígeno:
- 2 BaO + O 2 ⇌ 2 BaO2
En 1908, el sulfato de bario se aplicó por primera vez como un agente de contraste radiológico en Imágenes de rayos X del sistema digestivo.
Ocurrencia y producción
La abundancia de bario es 0,0425% en la corteza terrestre y 13 mg / L en el agua de mar. La principal fuente comercial de bario es barita (también llamados baritina o espato pesado), que es un mineral de sulfato de bario. Sus depósitos están repartidos por todo el mundo. La única otra fuente comercial es mucho menos importante que la barita; es witherita, un mineral de carbonato de bario. Sus principales depósitos se encuentran en Inglaterra, Rumania y la ex Unión Soviética.

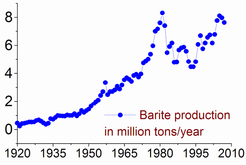
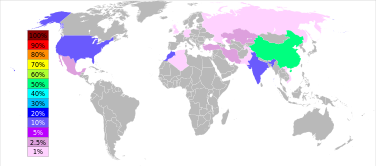
Las reservas de barita se estiman entre 0,7 y 2 mil millones toneladas. La producción máxima se consiguió en 1981, en 8,3 millones de toneladas, y sólo 7-8% de ellos se utilizó para hacer de bario o de sus compuestos. La producción de barita ha vuelto a aumentar desde la segunda mitad de la década de 1990: de 5,6 millones de toneladas en 1996 a 7,6 en 2005 y 7,8 en 2011. China representa más del 50% de esta producción, seguido por la India (14% en 2011), Marruecos (8,3%), Estados Unidos (8,2%), Turquía (2,5%), Irán y Kazajstán (2,6% cada uno).
El mineral extraído se lava, se tritura, clasifica y separa de cuarzo. Si el cuarzo penetra demasiado profundamente en el mineral, o el hierro, zinc, o el contenido de plomo es anormalmente alta, entonces métodos de flotación de espuma se aplican. El producto es un barita pura 98% (en masa); la pureza no debe ser inferior al 95%, con un contenido mínimo de hierro y dióxido de silicio . Se reduce entonces por el carbono en sulfuro de bario:
- Baso 4 + 2 C → BaS + 2 CO 2 ↑
El sulfuro de bario soluble en agua es el punto de partida para otros compuestos: BaS disueltos tras la reacción con oxígeno da el hidróxido, con ácido nítrico al nitrato, con dióxido de carbono del carbonato, y así sucesivamente. El nitrato puede ser descompone térmicamente para producir el óxido. Metal bario se produce por reducción con aluminio a 1100 ° C (2010 ° F). La Baal compuesto intermetálico 4 se produjo por primera vez:
- 3 BaO + 14 Al → 3 Baal 4 + Al 2 O 3
Es un intermediario, que reacciona con el óxido de bario para dar el metal. Tenga en cuenta que no todos bario se reduce.
- 8 BaO + Baal 4 → Ba ↑ + 7 Baal 2 O 4
El óxido de bario restante reacciona con el óxido de aluminio formado:
- BaO + Al 2 O 3 → Baal 2 O 4
y la reacción global es
- 4 BaO + 2 Al → 3 Ba ↑ + Baal 2 O 4
El vapor de bario producido de este modo se recoge en la parte más fría del aparato y luego embalado en moldes bajo atmósfera de argón. Este método se utiliza comercialmente y se puede producir de bario ultrapura. De bario vendido comúnmente es de aproximadamente 99% puro, con las principales impurezas siendo estroncio y calcio (hasta 0,8% y 0,25%) y otros contaminantes que contribuyen menos de 0,1%.
Una reacción similar con silicio a 1200 ° C (2190 ° F) se obtiene de bario y bario metasilicato. La electrólisis no se usa porque bario se disuelve fácilmente en haluros de fundido y es bastante impuro cuando se aíslan con este método.

Piedra preciosa
Un mineral que contiene bario benitoita (bario silicato de titanio) se presenta como una piedra preciosa azul fluorescente muy raro, y es la joya oficial del estado de California .
Aplicaciones
Metales y aleaciones
De bario, como un metal o cuando aleado con aluminio, se utiliza para eliminar gases no deseados ( gettering) a partir de tubos de vacío, tales como los tubos de imagen de televisión. El bario es adecuado para este propósito debido a su baja presión de vapor y reactividad hacia el oxígeno, nitrógeno, dióxido de carbono, y agua; que puede eliminar incluso parcialmente gases nobles mediante su disolución en la red cristalina. Esta aplicación está desapareciendo gradualmente debido a la creciente popularidad de los televisores LCD y de plasma sin cámara de aire.
Otros usos de bario elemental son leves e incluyen un aditivo para silumin (aleaciones de aluminio y silicio) que refina su estructura, así como
- teniendo aleaciones;
- plomo-estaño aleaciones de soldadura - para aumentar la resistencia a la fluencia;
- aleación con níquel para bujías;
- aditivo de acero y hierro fundido como un inoculante;
- aleaciones con calcio, manganeso, silicio y aluminio como desoxidantes de acero de alto grado.
El sulfato de bario y barita

El sulfato de bario (barita mineral, BaSO 4) es importante para la industria del petróleo, por ejemplo, como una fluido de perforación en los pozos de petróleo y gas. El precipitado del compuesto (llamado "blanco fijo", a partir de una expresión francesa que significa "blanco permanente") se usa en pinturas y barnices, y también como relleno en timbre de tinta, plásticos y cauchos. También es un pigmento de recubrimiento de papel. En la forma de nanopartículas, se puede mejorar las propiedades físicas de algunos polímeros, tales como epoxis.
El sulfato de bario tiene una toxicidad baja y una densidad relativamente alta de ca. 4.5 g · cm-3 (y por tanto la opacidad a los rayos X). Por esta razón, se utiliza como una agente de contraste radiológico en Imágenes de rayos X del sistema digestivo (" comidas bario "y" enemas de bario "). Litopón, un pigmento que contiene sulfato de bario y sulfuro de zinc, es un blanco permanente que tiene un buen poder cubriente, y no se oscurece cuando se expone a sulfuros.
Otros compuestos de bario

Aparte del sulfato, otros compuestos de bario encuentran sólo las aplicaciones de nicho. Aplicaciones están limitados por la toxicidad de los iones Ba 2+ (carbonato de bario es una veneno para ratas), que no es un problema para el insoluble BaSO4.
- Óxido de bario se utiliza en un revestimiento para la electrodos de lámparas fluorescentes, lo que facilita la liberación de electrones .
- Carbonato de bario se utiliza en la fabricación de vidrio. Siendo un elemento pesado, bario incrementa la índice de refracción y el brillo del vidrio. El compuesto también se utiliza para reducir las fugas de rayos X desde tubos de rayos catódicos (CRT) televisores.
- Bario, típicamente como nitrato de bario, se añade a los fuegos artificiales para darles un color verde. Las especies responsables de la brillante verde es monocloruro de bario; en ausencia de cloro de un verde "manzana" de color amarillo o se produce en su lugar.
- Peróxido de bario puede ser utilizado como un catalizador para iniciar una reacción aluminotérmica al soldar ferrovías juntos. También se puede utilizar en verde munición trazadora y como un agente de blanqueo.
- Titanato de bario es un prometedor electrocerámica.
- Fluoruro de bario se utiliza para la óptica en aplicaciones de infrarrojos debido a su amplia gama transparencia de 0,15 a 12 micrómetros.
- YBCO fue el primero superconductor de alta temperatura que podrían ser enfriado por nitrógeno líquido, como su temperatura de transición de 93 K (-180,2 ° C; -292.3 ° F) excede el punto de ebullición del nitrógeno (77 K, -196.2 ° C; -321.1 ° F) .
Peligros y precauciones biológicos
Debido a la alta reactividad del metal, sólo están disponibles para los compuestos datos toxicológicos. Compuestos de bario solubles en agua son venenosas. En dosis bajas, los iones de bario actúan como un estimulante del músculo, mientras que las dosis más elevadas afectan a la sistema nervioso, causando irregularidades cardíacas, temblores, debilidad, ansiedad, disnea y parálisis. Esto puede ser debido a la capacidad de Ba 2+ para bloquear canales iónicos de potasio, que son críticos para la función apropiada del sistema nervioso. Otros órganos diana para los compuestos de bario solubles en agua (es decir, iones de bario) son ojos, el sistema inmunológico, el corazón, el sistema respiratorio y la piel. Afectan el cuerpo con fuerza, haciendo que, por ejemplo, la ceguera y la sensibilización.
El bario no es cancerígeno, y no lo hace bioacumulación. Sin embargo, se inhala polvo que contiene compuestos de bario insolubles pueden acumularse en los pulmones, causando una condición benigna llamada baritosis. Para la comparación de los venenos solubles, el sulfato insoluble no es tóxico y por lo tanto no está clasificado como un buen peligroso.
Para evitar una reacción química potencialmente vigorosa, metal de bario se mantiene bajo argón o aceites minerales. El contacto con el aire es peligroso, ya que puede causar la ignición. La humedad, la fricción, calor, chispas, llamas, choques, electricidad estática, reacciones con oxidantes y ácidos debe ser evitado. Todo lo que pueden hacer contacto con bario debe estar conectado a tierra. Los que trabajan con el metal debe usar zapatos pre-limpiado no produzcan chispas, ropa de goma resistentes al fuego, guantes de goma, delantal, gafas protectoras y una máscara de gas; no se les permite fumar en el área de trabajo y deben lavarse después de la manipulación de bario.
