
Telurio
Sabías ...
SOS Children ha intentado que el contenido de Wikipedia más accesible por esta selección escuelas. Haga clic aquí para obtener más información sobre SOS Children.
| Telurio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
52 Te | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
gris plateado brillante  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | telurio, Te, 52 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / t ɨ l ʲ ʊər yo ə m / te- LewR -ee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | metaloide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 16 (calcógenos), 5, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 127.60 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Kr ] 4d 10 5s 2 5p 4 2, 8, 18, 18, 6 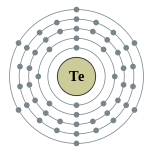 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Franz-Joseph Müller von Reichenstein (1782) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Martin Heinrich Klaproth | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 6,24 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 5,70 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 722,66 K , 449.51 ° C, 841,12 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 1261 K, 988 ° C, 1810 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 17.49 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 114.1 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 25.73 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 6, 5, 4, 2, -2 (Levemente ácida óxido) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,1 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 869.3 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1790 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 2698 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 138 ± 16:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radio | 206 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | (1,97-3,38) W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 2610 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | 43 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | 16 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 65 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 2.25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 180 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 13494-80-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de teluro | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Telurio es un elemento químico con el símbolo de Te y número atómico 52. Un frágil, ligeramente tóxico, raro, blanco plateado metaloide que tiene una apariencia similar a la de estaño , teluro está químicamente relacionada con selenio y azufre . Ocasionalmente se encuentra en forma nativa, en forma de cristales elementales. Telurio es mucho más común en el universo como un todo de lo que es en la Tierra. Su extrema rareza en la corteza terrestre, comparable a la de platino , es en parte debido a su alto número atómico, pero también debido a su formación de una volátil hidruro de que causó el elemento que se perdió al espacio como un gas durante la formación de la nebulosa caliente del planeta.
Telurio fue descubierto en Transilvania (hoy parte de Rumania ) en 1782 por Franz-Joseph Müller von Reichenstein en un mineral que contiene telurio y oro . Martin Heinrich Klaproth nombrado el nuevo elemento en 1798 después de la palabra latina que significa "tierra", tellus. Minerales teluro de oro son los compuestos naturales de oro más notables. Sin embargo, no son una fuente comercialmente significativa de teluro sí mismo, que normalmente se extrae como un subproducto de cobre y plomo de producción.
Comercialmente, el uso principal de teluro está en aleaciones, sobre todo en acero y de cobre para mejorar la maquinabilidad. Aplicaciones en paneles solares y como un semiconductor material también consumen una fracción considerable de la producción de teluro.
Telurio no tiene ninguna función biológica, aunque los hongos pueden incorporar en su lugar de azufre y selenio en aminoácidos tales como tellurocysteine y telluromethionine. En los seres humanos, telurio se metaboliza parcialmente en teluro de dimetilo, (CH3) 2 Te, un gas con un ajo -como olor que es exhalado en la respiración de las víctimas de la toxicidad de telurio o exposición.
Características
Propiedades físicas
Cuando cristalina , telurio es de color blanco plateado y cuando se encuentra en estado puro que tiene un brillo metálico. Es un metaloide frágil y fácilmente pulverizado. Teluro amorfo se encuentra por precipitación desde una solución de tellurous o telúrico ácido (Te (OH 6)). Telurio es un semiconductor que muestra una mayor conductividad eléctrica en ciertas direcciones que depende atómica de alineación; los aumentos de conductividad ligeramente cuando se expone a la luz ( fotoconductividad). Cuando está en su estado fundido, telurio es corrosivo para el cobre, el hierro y acero inoxidable.
Propiedades químicas
Telurio adopta una estructura polimérica, que consiste en cadenas de zig-zag de átomos de Te. Este material gris resiste la oxidación por el aire y no es volátil.
Isótopos
Naturalmente ocurriendo telurio tiene ocho isótopos. Cinco de esos isótopos, 122 Te, Te 123, 124 Te, Te 125 y 126 Te, son estables. Los otros tres, 120 Te, Te 128 y 130 de Te, se han observado a ser radiactivo. Los isótopos estables representan sólo el 33,2% del telurio de origen natural; este es posiblemente debido a los largos períodos de semidesintegración de los isótopos inestables. Ellos están en el rango de 10 13 a 2,2 × 10 24 años (por 128 Te). Esto hace 128 Te isótopo con la vida media más larga entre todos radionucleidos, que es aproximadamente 160 billones (10 12) veces la edad del universo conocido .
Hay 38 conocida isómeros nucleares de teluro con masas atómicas que van desde 105 a 142. El telurio es uno de los elementos más ligeros conocidos para someterse a la desintegración alfa, con isótopos 106 a 110 de Te Te poder someterse a este modo de desintegración. La masa atómica del telurio (127,60 g · mol -1) supera a la de la siguiente elemento yodo (126,90 g · mol -1).
Aparición


Con una abundancia de la Tierra en la corteza comparable a la de platino, telurio es uno de los elementos sólidos estables más raras en la corteza terrestre. Su abundancia es de aproximadamente 1 mg / kg. En comparación, incluso el más raro de los lantánidos tienen abundancias de la corteza de 500 mg / kg (véase Abundancia de los elementos químicos).
La extrema rareza de telurio en la corteza de la Tierra no es un reflejo de su abundancia cósmica, que es en realidad mayor que el de rubidio , a pesar de que el rubidio es diez mil veces más abundante en la corteza terrestre. El extraordinariamente baja abundancia de telurio en la Tierra está más bien cree que es debido a las condiciones de formación de la Tierra, cuando la forma estable de ciertos elementos, en ausencia de oxígeno y agua , fue controlado por el poder reductor del libre hidrógeno . Bajo este escenario, algunos elementos como el telurio que forman volátil hidruros fueron gravemente diezmadas durante la formación de la corteza terrestre, a través de la evaporación de estos hidruros. Telurio y selenio son los elementos pesados más empobrecido en la corteza terrestre por este proceso.
Telurio se encuentra a veces en su forma nativa (es decir, elemental), pero más a menudo se encuentra como los telururos de oro tales como calaverite y Krennerita (dos diferentes polimorfos de Aute 2), Petzita, Ag 3 Aute 2, y silvanita, AgAuTe 4. La ciudad de Telluride, Colorado fue nombrado en la esperanza de una huelga de teluro de oro (que nunca se materializó, aunque se encontró mineral de metal de oro). Oro en sí mismo se encuentra generalmente sin combinar, pero cuando se encuentra naturalmente como un compuesto químico, que más a menudo se combina con teluro (unos pocos compuestos de oro no telururo raras tales como el antimonide aurostibite, ausb 2, y bismuthide maldonite, Au 2 Bi, también se conocen).
Aunque teluro se encuentra con oro con más frecuencia que en forma no combinada, se encuentra incluso más a menudo combinado con otros elementos que el oro, como telururos metales más comunes (por ejemplo, melonite, nite 2). Natural telurita y minerales telurato también se producen, formado por oxidación de telururos cerca de la superficie de la Tierra. En contraste con el selenio, telurio no es, en general, capaz de reemplazar el azufre en sus minerales, debido a la gran diferencia de radio de iones de azufre y teluro. En consecuencia, muchos minerales de sulfuro común contienen cantidades considerables de selenio, pero sólo trazas de teluro.
En la fiebre del oro de 1893, excavadoras en Kalgoorlie descarta un material pirítico que encontraban a su paso en su búsqueda de oro puro. Los residuos Kalgoorlie fue por lo tanto utiliza para rellenar los baches o como parte de las aceras. Pasaron tres años antes de que se dieron cuenta de que estos residuos era calaverite, un telururo de oro que no había sido reconocida. Esto llevó a una segunda fiebre del oro en 1896 que incluía la extracción de las calles.
Producción
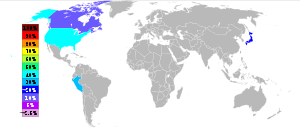
La principal fuente de teluro es de ánodo lodos producidos durante el refinado electrolítico de blister de cobre . Es un componente de polvos de alto horno de refinación de plomo . El tratamiento de 500 toneladas de mineral de cobre típicamente produce una libra (0,45 kg) de teluro. Telurio se produce principalmente en el Estados Unidos , Perú , Japón y Canadá . Para el año 2009 la British Geological Survey da los siguientes números: Estados Unidos 50 t, Perú 7 t, Japón y Canadá 40 t 16 t.
Los lodos anódicos contienen el seleniuros y telururos de la metales nobles en compuestos con la fórmula M 2 M 2 Se o Te (M = Cu, Ag, Au). A temperaturas de 500 ° C los lodos anódicos se tuestan con carbonato de sodio bajo aire. Los iones metálicos se reducen a los metales, mientras que el teluro de se convierte telurita sodio.
- H 2 Te + O2 + Na 2 CO 3 → Na 2 TeO 3 + 2 H + CO 2
Teluritos se pueden lixiviar de la mezcla con agua y están presentes normalmente como hydrotellurites HTeO 3 - en solución. Selenitas también se forman durante este proceso, pero se pueden separar mediante la adición de ácido sulfúrico . Los hydrotellurites se convierten en la insoluble dióxido de telurio mientras los selenitas permanecen en solución.
- HTeO -
3 + OH - + H 2 SO 4 → TeO2 + SO 2-
4 + 2 H 2 O
La reducción al metal se realiza ya sea por electrólisis o haciendo reaccionar la dióxido de teluro con dióxido de azufre en ácido sulfúrico.
- TeO 2 + 2 SO 2 + 2 H 2 O → Te + SO 2-
4 + 4 H +
Telurio de calidad comercial se comercializa normalmente como 200- polvo de malla, pero también está disponible como losas, lingotes, barras, o bultos. El precio de fin de año para el telurio en 2000 fue de US $ 14 por libra. En los últimos años, el precio de teluro fue impulsado por el aumento de la demanda y la oferta limitada, llegando tan alto como US $ 100 por libra en 2006. A pesar de la duplicación prevista en la producción debido a los métodos de extracción mejoradas, la Departamento de Energía de los Estados (DoE) anticipa un déficit de suministro de telurio en 2025.
Compuestos
Telurio pertenece a la misma familia química como oxígeno , azufre , selenio y polonio : la familia calcógeno. Compuestos de telurio y selenio son similares. Exhibe la oxidación establece -2, 2, 4 y 6, con el estado 4 siendo el más común.
- Telururos
Reducción de Te metal produce la telururos y polytellurides, Te 2- n. El estado de oxidación -2 se exhibe en compuestos binarios con muchos metales, tales como telururo de zinc, ZnTe, formada por calentamiento de teluro con zinc. Descomposición de CnTe con ácido clorhídrico rendimientos telururo de hidrógeno (H 2 Te), un análogo altamente inestable de los otros hidruros de calcógeno, H 2 O , H 2 S y H 2 Se:
- CnTe + 2 HCl → ZnCl2 + H 2 Te
H 2 Te es inestable, mientras que las sales de su base conjugada [TeH] - son estables.
- Haluros
El estado de oxidación +2 es exhibida por los dihaluros, TECL 2, TeBr 2 y TeI 2. Los dihaluros no se han obtenido en forma pura, aunque son productos de descomposición de los tetrahaluros conocidos en disolventes orgánicos, y sus derivados tetrahalotellurates son bien caracterizados:
- Te + X 2 + 2 X - → TeX 2-
4
donde X es Cl, Br o I. Estos aniones son cuadrada plana en la geometría. También existen especies aniónicas polinucleares, tales como el marrón oscuro Te
2 I 2-
6, y el negro Te
4 I 2-
14.
El flúor forma dos haluros con teluro: la de valencia mixta Te 2 F 4 y TEF 6. En el estado de oxidación +6, el grupo estructural -OTeF 5 se produce en un número de compuestos tales como HOTeF 5, B (OTEF 5) 3, Xe (OTEF 5) 2, Te (OTEF 5) 4 y Te (OTEF 5) 6. La anión antiprismatic plaza TEF 2-
8 también ha quedado en evidencia. Los otros halógenos no forman haluros con teluro en el estado de oxidación +6, pero sólo tetrahaluros ( TECL 4, TeBr 4 y TeI 4) en el estado 4, y otros haluros inferiores (Te 3 Cl 2, Te 2 Cl 2, Br 2 2 Te, Te 2 I y dos formas de TEI). En el estado de oxidación +4, aniones halotellurate son conocidos, tales como TECL 2-
6 y Te 2 Cl 2-
10. Cationes Halotellurium están también confirmados, incluyendo CTeI +
3, que se encuentra en CTeI 3 AsF 6.
- Oxocompounds

Monóxido de telurio se informó por primera vez en 1883 como un negro sólido amorfo formado por la descomposición térmica de Teso 3 en el vacío, en desproporción dióxido de teluro, TeO 2 y teluro elemental tras el calentamiento. Desde entonces, sin embargo, algunos han surgido dudas sobre su existencia en la fase sólida, aunque se sabe como un fragmento en fase de vapor; el sólido negro puede ser simplemente una mezcla equimolar de telurio elemental y dióxido de teluro.
Dióxido de telurio se forma por calentamiento de teluro en el aire, haciendo que se queme con una llama azul. Trióxido de telurio, TeO β- 3, se obtiene por descomposición térmica de Te (OH) 6. Las otras dos formas de trióxido reportado en la literatura, las formas α- y γ-, se encontró que no sean verdaderos óxidos de teluro en el estado de oxidación +6, sino una mezcla de Te 4+, OH - y O -
2. Telurio también exhibe óxidos de valencia mixta, Te 2 O 5 y Te 4 O 9.
Los óxidos de telurio y óxidos hidratados forman una serie de ácidos, incluyendo ácido tellurous (H 2 TeO 3), ácido orthotelluric (Te (OH) 6) y ácido metatelluric ((H 2 TeO 4) n). Las dos formas de sales de ácido telúrico telurato de formulario que contienen el 2- TeO
4 y TeO 6-
6 aniones, respectivamente. Formas de ácido Tellurous telurito sales que contienen el anión TeO 2-
3. Otros cationes telurio incluyen TEF 2+
8, que consta de dos anillos fusionados de telurio y la TEF polimérico 2+
7.
- Cationes Zintl
Cuando el teluro se trata con ácido sulfúrico concentrado, forma soluciones rojos que contienen el Ion Zintl, Te 2+
4. La oxidación de teluro por AsF5 en líquido SO 2 también produce este plaza de cationes planar, así como con el trigonal prismático, de color amarillo-naranja Te 4+
6:
- 4 Te + 3 AsF5 → Te 2+
4 (ASF -
6) 2 + 3 AsF - 6 Te + 6 AsF5 → Te 4+
6 (ASF -
6) 4 + 2 AsF 3
Otros cationes de telurio Zintl incluyen el Te polimérico 2+
7 y el Te azul-negro 2+
8, que consta de dos anillos condensados de telurio de 5 miembros. Este último catiónico se forma por la reacción de teluro con tungsteno hexacloruro:
- 8 Te + 2 WCl6 → Te 2+
8 (CMT -
6) 2
También existen cationes Interchalcogen, tales como Te 2 Se 2+
6 (geometría cúbica distorsionada) y Te 2 Se 2+
8. Estas se forman por oxidación de mezclas de teluro y selenio con 5 o AsF SbF 5.
- Compuestos Organotellurium
Telurio no forma fácilmente análogos de alcoholes y tioles, con el grupo funcional -TeH y se llaman tellurols. El grupo funcional -TeH también se atribuye al uso de la tellanyl- prefijo. Como H 2 Te, estas especies son inestables con respecto a la pérdida de hidrógeno. Telluraethers (R-Te-R) son más estables como son telluroxides.
Historia

Telurio ( América tellus que significa "tierra") fue descubierto en el siglo 18 en un mineral de oro de las minas en Zlatna, cerca de lo que hoy es Sibiu, Rumania . Este mineral se conoce como "Faczebajer weißes blättriges Golderz" (mineral de oro de hoja blanca de Faczebaja, nombre alemán de Facebánya, ahora Fata Baii en Alba County) o antimonalischer Goldkies (pirita de oro antimónico), y, de acuerdo con Anton von Rupprecht, era Spießglaskönig (molybdique argent), que contiene nativo de antimonio . En 1782 Franz-Joseph Müller von Reichenstein, quien entonces se desempeñaba como inspector jefe austríaco de minas en Transilvania, llegó a la conclusión de que el mineral no contenía antimonio, pero que era sulfuro de bismuto. Al año siguiente, informó que este era errónea y que el mineral contenía en su mayoría de oro y un metal desconocido muy similar a la de antimonio. Después de una exhaustiva investigación que duró tres años y consistió en más de cincuenta pruebas, Müller determina la gravedad específica del mineral y tomó nota del rábano olor -como del humo blanco que pasó cuando era el nuevo metal calentado, el color rojo que el metal imparte a ácido sulfúrico , y el precipitado negro, que esta solución da cuando se diluye con agua. Sin embargo, no fue capaz de identificar este metal y le dio el paradoxium nombres aurum y Metallum problematicum, ya que no mostró las propiedades predichas para el antimonio se esperaba.
En 1789, otro científico húngaro, Pál Kitaibel, también descubrió el elemento de forma independiente en un mineral de Deutsch-Pilsen, que había sido considerado como argentífera molibdenita, pero más tarde le dio el crédito a Müller. En 1798, fue nombrado por Martin Heinrich Klaproth que antes de aislarla del mineral calaverite. La década de 1960 redujo el crecimiento en aplicaciones termoeléctricas para teluro (como se telururo de bismuto), así como su uso en maquinado libre de acero , que se convirtió en el uso dominante.
Aplicaciones
Metalurgia
El mayor consumidor de teluro es la metalurgia , donde se utiliza en aleaciones de hierro, cobre y plomo. Cuando se añade a acero inoxidable y cobre que hace que estos metales más mecanizable. Se alea en hierro fundido para la promoción de frío para los propósitos espectroscópicas, como la presencia de grafito libre eléctricamente conductor tiende a afectar perjudicialmente chispa resultados de las pruebas de emisiones. En la derivación mejora la resistencia y durabilidad y disminuye la acción corrosiva del ácido sulfúrico .
Semiconductor y usos de la industria electrónica

Telurio se utiliza en teluro de cadmio (CdTe) paneles solares. Pruebas de laboratorio Laboratorio Nacional de Energía Renovable que utilizan este material lograron algunas de las más altas eficiencias para la generación de energía eléctrica de células solares. Producción comercial masiva de Paneles solares de CdTe por First Solar en los últimos años ha aumentado considerablemente la demanda de telurio. Si algunos de los cadmio en CdTe se sustituye por el zinc entonces (Cd, Zn) Te está formado que se utiliza en estado sólido Detectores de rayos X.
Aleado con tanto el cadmio y el mercurio , para formar mercurio teluro de cadmio, un sensible a infrarrojos semiconductor se forma material. Compuestos tales como Organotellurium telururo de dimetilo, teluro dietílico, teluro de diisopropilo, teluro de dialilo y teluro alil metil se utilizan como precursores para crecimiento metalorgánico vapor fase epitaxia de II-VI semiconductores compuestos. Diisopropil teluro de (DIPTe) se emplea como el precursor preferido para lograr el crecimiento a baja temperatura de CdHgTe por MOVPE. Para estos procesos más alta pureza Compuesto organometálico tanto de selenio y teluro se utilizan. Los compuestos para la industria de semiconductores y se preparan purificación aducto.
Telurio como un subóxido de telurio se utiliza en la capa media de varios tipos de regrabable discos ópticos, incluso Regrabables Discos Compactos ( CD-RW), regrabables Discos de Video Digital ( DVD-RW) y regrabables Los discos Blu-ray.
Telurio se utiliza en el nuevo chips de memoria de cambio de fase desarrollados por Intel . Teluro de bismuto (Bi 2 Te 3) y teluro de plomo son elementos trabajando dispositivos termoeléctricos. Teluro de plomo se utiliza en Lejano detectores de infrarrojos.
Otros usos
- Se utiliza para el color cerámica.
- El fuerte incremento de la refracción óptica tras la adición de seleniuros y telururos en el vidrio se utiliza en la producción de fibras de vidrio para las telecomunicaciones. Estos vidrios calcogenuros son ampliamente utilizados.
- Las mezclas de selenio y teluro se utilizan con peróxido de bario como oxidante en el polvo de retraso eléctrico detonadores.
- Telururos orgánicos han sido empleados como iniciadores para la polimerización por radicales vivos y rico en electrones mono- y di-telururos poseen antioxidante actividad.
- Caucho puede ser vulcanizado con azufre en lugar de teluro o selenio. El caucho producido de esta manera muestra resistencia al calor mejorada.
- Telurito agar se utiliza para identificar miembro de la género Corynebacterium, más típicamente Corynebacterium diphtheriae, el patógeno responsable de la difteria.
Papel biológico
Telurio no tiene ninguna función biológica conocida, aunque los hongos pueden incorporar en su lugar de azufre y selenio en aminoácidos tales como telluro-cisteína y telluro-metionina. Los organismos han mostrado una tolerancia muy variable a compuestos de telurio. La mayoría de los organismos metabolizan teluro en parte para formar dimetil teluro de ditelluride dimetil aunque también se forma por algunas especies. Telururo de dimetilo se ha observado en aguas termales en concentraciones muy bajas.
Precauciones
Compuestos de telurio y telurio se consideran ser ligeramente tóxicos y deben manejarse con cuidado, a pesar de la intoxicación aguda es rara. Telurio no se divulga para ser cancerígenos.
Los seres humanos expuestos a tan poco como 0,01 mg / m 3 o menos en el aire exudan una falta ajo -como olor conocido como "aliento telurio". Esto es causado desde el teluro se metaboliza por el cuerpo, convirtiéndolo de cualquier estado de oxidación de telururo de dimetilo, (CH 3) 2 Te. Este es un compuesto volátil con un olor a ajo muy picante. Aunque no se conocen las vías metabólicas de telurio, se asume generalmente que se asemejan a los de los más ampliamente estudiados selenio , debido a que los productos metabólicos finales metilados de los dos elementos son similares.
