
Propiedades del agua
Acerca de este escuelas selecci??n Wikipedia
SOS cree que la educaci??n da una mejor oportunidad en la vida para los ni??os en el mundo en desarrollo tambi??n. Todos los ni??os disponibles para el apadrinamiento de ni??os de Aldeas Infantiles SOS son atendidos en una casa de familia por la caridad. Leer m??s ...
| Agua (H 2 O) | |
|---|---|
 | |
 | |
Agua | |
Otros nombres Agua | |
| Identificadores | |
| CAS | 7732-18-5 |
| N??mero RTECS | ZC0110000 |
| Propiedades | |
| F??rmula molecular | H 2 O o HOH |
| Masa molar | 18,01524 g / mol |
| Apariencia | s??lido de color blanco o casi incoloro, transparente, con un ligero toque de azul cristalino, s??lido o l??quido |
| Densidad | 1.000 kg ?? m -3, l??quido (4 ?? C) 917 kg ?? m -3, s??lido |
| Punto de fusion | |
| Punto de ebullicion | 100 ?? C, 212 ?? F (373.15 K) |
| Acidez (p K a) | 15.74 ~ 35-36 |
| Basicidad (p K b) | 15.74 |
| Viscosidad | 0,001 Pa ?? s a 20 ?? C |
| Estructura | |
| Estructura cristalina | Hexagonal Ver hielo |
| Forma molecular | doblado |
| Momento bipolar | 1.85 D |
| Peligros | |
| Principal peligros | intoxicaci??n por agua, ahogamiento (v??ase tambi??n Mon??xido de dihidr??geno) |
| NFPA 704 |  0 0 1 |
| Compuestos relacionados | |
| Relacionados disolventes | acetona metanol |
| Compuestos relacionados | vapor de agua hielo agua pesada |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ?? C, 100 kPa) | |
| Exenciones y referencias | |
Agua ( H 2 O , H OH ) es el m??s abundante mol??cula en la Tierra superficie 's, que compone de alrededor del 70% de la superficie de la Tierra como estado l??quido y s??lido, adem??s de estar presente en la atm??sfera en forma de vapor. Est?? dentro equilibrio din??mico entre el l??quido y estados de vapor a temperatura y presi??n est??ndar. En temperatura ambiente, es casi incoloro con un toque de azul, ins??pido, y l??quido inodoro. Muchas sustancias se disuelven en agua y se conocen com??nmente como lo universal solvente . Debido a esto, el agua en la naturaleza y en uso rara vez es pura, y puede tener algunas propiedades diferentes de las que en el laboratorio. Sin embargo, hay muchos compuestos que son esencialmente, si no completamente, insoluble en agua. El agua es la ??nica sustancia com??n que se encuentra de forma natural en los tres comunes estados de la materia-para otras sustancias, ver propiedades qu??micas . El agua tambi??n representa el 75% del cuerpo humano.
Formas de agua
El agua puede tomar muchas formas. El estado s??lido de agua se conoce com??nmente como el hielo (aunque existen muchas otras formas; ver agua s??lido amorfo); el estado gaseoso es conocido como vapor de agua (o de vapor), y el l??quido com??n fase se toma generalmente como simplemente agua. Por encima de un cierto temperatura cr??tica y la presi??n (647 K y 22.064 MPa), las mol??culas de agua asume una condici??n supercr??tica, en el que los cl??sters de l??quidos como flotan dentro de una fase de vapor similar.
El agua pesada es agua en la que el hidr??geno es reemplazado por su pesado is??topo , deuterio. Es qu??micamente casi id??ntica a la del agua normal. El agua pesada se utiliza en el industria nuclear para frenar los neutrones .
F??sica y qu??mica del agua
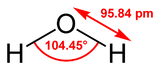
El agua es el sustancia qu??mica con la f??rmula qu??mica H 2 O : una mol??cula de agua tiene dos hidr??geno ??tomos covalentemente unido a un solo ox??geno ??tomo. El agua es un l??quido ins??pido, inodoro en temperatura y presi??n ambiente, y parece incolora en peque??as cantidades, aunque tiene su propia intr??nseca tonalidad azul muy claro. El hielo tambi??n aparece incoloro, y vapor de agua es esencialmente invisible como un gas. El agua es principalmente un l??quido en condiciones est??ndar, que no se predice a partir de su relaci??n con otros hidruros de an??logos de la familia de ox??geno en la tabla peri??dica , que son gases tales como sulfuro de hidr??geno. Tambi??n los elementos circundantes de ox??geno en la tabla peri??dica , nitr??geno , fl??or , f??sforo , azufre y cloro , se combinan con hidr??geno para producir gases en condiciones est??ndar. La raz??n de que dihidruro de ox??geno (agua) forma un l??quido es que es m??s electronegativo que todos estos elementos (excepto el fl??or). El ox??geno atrae electrones mucho m??s fuertemente que el hidr??geno, lo que resulta en una carga positiva neta en los ??tomos de hidr??geno, y una carga neta negativa en el ??tomo de ox??geno. La presencia de una carga en cada uno de estos ??tomos da a cada mol??cula de agua una red momento bipolar. Atracci??n el??ctrica entre las mol??culas de agua debido a este dipolo tira de mol??culas individuales m??s juntos, lo que hace m??s dif??cil separar las mol??culas y por lo tanto elevar el punto de ebullici??n. Esta atracci??n es conocida como enlaces de hidr??geno. El agua puede ser descrito como un l??quido polar que se disocia de manera desproporcionada en el ion hidronio (H3O + (aq)) y un asociado de hidr??xido de litio (OH - (aq)). El agua es en equilibrio din??mico entre el l??quido , gas y s??lido estados en temperatura y presi??n normales (0 ?? C, 100,000 kPa), y es la ??nica sustancia pura que se encuentra naturalmente en la Tierra para ser as??.
Agua, hielo y vapor
Capacidad de calor y calores de vaporizaci??n y de fusi??n
El agua tiene la segunda m??s alta capacidad espec??fica de calor de cualquier compuesto qu??mico conocido, despu??s de amoniaco , as?? como un alto calor de vaporizaci??n (40,65 kJ mol -1), ambos de los cuales son el resultado de la extensa enlaces de hidr??geno entre sus mol??culas. Estas dos propiedades inusuales permiten que el agua de la Tierra moderar el clima tamponando grandes fluctuaciones en la temperatura.
La espec??fica entalp??a de fusi??n del agua es 333,55 kJ kg -1 a 0 ??C. De las sustancias comunes, s??lo la de amon??aco es mayor. Esta propiedad confiere resistencia a la fusi??n sobre el hielo de los glaciares y hielo a la deriva. Antes de la llegada de la mec??nica refrigeraci??n, el hielo era de uso com??n para retardar la descomposici??n de los alimentos.
Densidad del agua y el hielo
| Temperatura (?? C) | Densidad (g / cm 3) |
|---|---|
| 100 | 0.9584 |
| 80 | 0.9718 |
| 60 | 0.9832 |
| 40 | 0.9922 |
| 30 | 0.9956502 |
| 25 | 0.9970479 |
| 22 | 0.9977735 |
| 20 | 0.9982071 |
| 15 | 0.9991026 |
| 10 | 0.9997026 |
| 4 | 0.9999720 |
| 0 | 0.9998395 |
| -10 | 0.998117 |
| -20 | 0.993547 |
| -30 | 0.983854 |
| La densidad del agua en gramos por cent??metro c??bico a diversas temperaturas en grados Celsius Los valores por debajo de 0 ?? C se refieren a agua-enfriada. Agua - Densidad y peso espec??fico | |
La forma s??lida de la mayor??a de sustancias es m??s denso que el l??quido de fase ; por lo tanto, un bloque de sustancia s??lida pura se hundir?? en una tina de sustancia l??quida pura. Pero, por el contrario, a una cuadra de com??n hielo flotar?? en una tina de agua porque el agua s??lida es menos denso que el agua l??quida. Esta es una propiedad caracter??stica extremadamente importante de agua. En la temperatura ambiente, el agua l??quida se vuelve m??s densa con la reducci??n de la temperatura, al igual que otras sustancias. Pero a 4 ?? C (m??s precisamente 3.98), justo encima de la congelaci??n, el agua alcanza su densidad m??xima, y como el agua se enfr??a m??s hacia su punto de congelaci??n, el agua l??quida, bajo condiciones est??ndar, se expande a ser menos denso. La raz??n para esto es f??sica relacionada con la estructura cristalina de corriente de hielo , conocido como hexagonal hielo Ih. Agua, plomo , uranio , ne??n y silicio son algunos de los pocos materiales que se expanden al congelarse; m??s contrato de otros materiales. No todas las formas de hielo son menos densos que el agua l??quida sin embargo, HDA y VHDA por ejemplo son tanto m??s densa que la fase l??quida el agua pura. Por lo tanto, la raz??n de que la forma com??n de hielo es menos denso que el agua es un poco no intuitivo y depende en gran medida de las propiedades inusuales inherentes a la enlace de hidr??geno.
En general, el agua se expande cuando se congela debido a su estructura molecular, en conjunto con el inusual la elasticidad del enlace de hidr??geno y lo particular m??s bajo de energ??a hexagonal cristal conformaci??n que adopta bajo condiciones est??ndar. Es decir, cuando el agua se enfr??a, se trata de apilar en una configuraci??n de red cristalina que se extiende la rotacional y componentes de vibraci??n de la uni??n, por lo que el efecto es que cada mol??cula de agua es empujada m??s lejos de cada uno de sus mol??culas vecinas. Esto reduce efectivamente el ρ densidad del agua cuando el hielo se forma bajo condiciones est??ndar.
Acciones de agua del estado l??quido de mayor densidad con s??lo unos pocos materiales como el galio , germanio , bismuto y antimonio .
La importancia de esta propiedad no se puede exagerar por su papel en la ecosistema de la Tierra. Por ejemplo, si el agua fuese m??s denso cuando se congela, lagos y oc??anos en un entorno polar eventualmente congelan (de arriba abajo). Esto suceder??a porque el hielo congelado se asentar??a en el lago y lechos de r??os, y el fen??meno del calentamiento necesario (ver m??s abajo) no podr??a ocurrir en verano, ya que la capa superficial c??lida ser??a menos densa que la capa congelada s??lida continuaci??n. Es una caracter??stica importante de la naturaleza que esto no ocurre naturalmente en el ambiente.
Sin embargo, la inusual expansi??n de congelaci??n del agua (en entornos naturales ordinarias en los sistemas biol??gicos relevantes), debido a la enlace de hidr??geno, a partir de 4 ?? C por encima de la congelaci??n hasta el punto de congelaci??n ofrece una ventaja importante para la vida de agua dulce en invierno. El agua enfriada en la superficie aumenta en densidad y se hunde, formando convecci??n corrientes que enfr??an todo el cuerpo de agua, pero cuando la temperatura del agua del lago llega a 4 ?? C, el agua en la superficie disminuci??n en la densidad, ya que enfr??a a??n m??s y se mantiene como una capa de superficie que eventualmente congela y forma de hielo. Desde convecci??n hacia abajo del agua m??s fr??a es bloqueada por el cambio de densidad, cualquier gran masa de agua dulce congelada en invierno va a tener el agua m??s fr??a cerca de la superficie, lejos de la cauce o lecho del lago.
El agua se congela a 0 ?? C (32 ?? F, 273 K), sin embargo, puede ser superenfriada en un estado fluido hasta su cristal de la nucleaci??n homog??nea a casi 231 K (-42 ?? C).
El agua se expande significativamente a medida que aumenta la temperatura. La densidad es 4% menor que la m??xima medida que la temperatura se aproxima a ebullici??n.
Densidad del agua salada y hielo
La densidad del agua es dependiente del contenido de sal disuelta, as?? como la temperatura del agua. Hielo todav??a flota en los oc??anos, de lo contrario se congelar??an de abajo hacia arriba. Sin embargo, el contenido de sal de los oc??anos disminuye el punto de congelaci??n en aproximadamente 2 ?? C y reduce la temperatura de la m??xima densidad del agua hasta el punto de congelaci??n. Por eso, en el agua del oc??ano, la convecci??n hacia abajo del agua fr??a no est?? bloqueado por una expansi??n del agua a medida que se vuelve m??s fr??o cerca del punto de congelaci??n. Agua fr??a de los oc??anos cerca del punto de congelaci??n contin??a hundi??ndose. Por esta raz??n, cualquier criatura intentar sobrevivir en la parte inferior de dicha agua fr??a como el oc??ano ??rtico generalmente vive en agua que es de 4 ?? C m??s fr??a que la temperatura en la parte inferior de congelado-over lagos de agua dulce y r??os en el invierno.
Como la superficie del agua salada comienza a congelarse (a -1,9 ?? C para el normal salinidad del agua de mar , 3,5%) el hielo que se forma es esencialmente libre de sal con una densidad aproximadamente igual a la de hielo de agua dulce. Este hielo flota en la superficie y la sal que se "congela out" se suma a la la salinidad y la densidad del agua de mar justo debajo de ??l, en un proceso conocido como rechazo de salmuera. Esta agua salada m??s densa se hunde por convecci??n y el agua de mar sustituci??n est?? sujeta al mismo proceso. Esto proporciona esencialmente de hielo de agua dulce a -1,9 ?? C en la superficie. El aumento de la densidad del agua de mar por debajo de la formaci??n de hielo provoca que se hunda hacia el fondo.
Miscibilidad y la condensaci??n
El agua es miscible con muchos l??quidos, por ejemplo etanol en todas las proporciones, formando un solo l??quido homog??neo. Por otro lado, y m??s agua aceites son inmiscibles generalmente formando capas de acuerdo con aumento de la densidad de la parte superior.
Como un gas, vapor de agua es completamente Miscible con aire. Por otro lado la presi??n m??xima de vapor de agua que es termodin??micamente estable con el l??quido (o s??lido) a una temperatura dada es relativamente baja en comparaci??n con la presi??n atmosf??rica total. Por ejemplo, si el vapor presi??n parcial es del 2% de la presi??n atmosf??rica y el aire se enfr??a desde 25 ?? C, a partir de unos 22 ?? C el agua comenzar?? a condensarse, la definici??n de la punto de roc??o, y la creaci??n de niebla o roc??o. El proceso inverso representa la niebla quemar en la ma??ana. Si uno plantea la humedad a temperatura ambiente, por ejemplo mediante la ejecuci??n de una ducha caliente o un ba??o, y la temperatura se mantiene igual, el vapor de pronto llega a la presi??n por el cambio de fase, y se condensa en forma de vapor. Un gas en este contexto se conoce como saturado o 100% de humedad relativa, cuando la presi??n de vapor de agua en el aire se encuentra en equilibrio con la presi??n de vapor debido a (l??quido) de agua; agua (o hielo, si es lo suficientemente cool) dejar??n de perder masa por evaporaci??n cuando se expone al aire saturado. Debido a que la cantidad de vapor de agua en el aire es peque??a humedad, relativa, la relaci??n de la presi??n parcial debido a que el vapor de agua a la presi??n parcial de vapor saturado, es mucho m??s ??til. Presi??n de vapor de agua por encima de la humedad relativa del 100% se llama super-saturada y puede ocurrir si el aire se enfr??a r??pidamente, por ejemplo por el aumento de repente en una corriente ascendente.
Presiones de vapor de agua
| Temperatura (?? C) | Presi??n (torr) |
|---|---|
| 0 | 4.58 |
| 5 | 6.54 |
| 10 | 9.21 |
| 12 | 10.52 |
| 14 | 11.99 |
| 16 | 13.63 |
| 17 | 14.53 |
| 18 | 15.48 |
| 19 | 16.48 |
| 20 | 17.54 |
| 21 | 18.65 |
| 22 | 19.83 |
| 23 | 21.07 |
| 24 | 22.38 |
| 25 | 23.76 |
Compresibilidad
La compresibilidad del agua es una funci??n de la presi??n y la temperatura. A 0 ?? C en el l??mite de presi??n cero la capacidad de compresi??n es de 5,1 ?? 10 -5 bar -1. En el l??mite de presi??n cero la capacidad de compresi??n llega a un m??nimo de 4,4 ?? 10 -5 -1 bar alrededor de 45 ?? C antes de aumentar de nuevo al aumentar la temperatura. A medida que la presi??n se incrementa las disminuciones de compresibilidad, siendo 3,9 ?? 10 -5 bar -1 a 0 ?? C y 1000 bar. La m??dulo de volumen de agua es de 2,2 ?? 10 9 Pa. La baja compresibilidad de los no-invernadero, y del agua en particular, los lleva a menudo se asume como incompresible. La baja compresibilidad del agua significa que incluso en los profundos oc??anos en 4000 m de profundidad, donde las presiones son 4 ?? 10 7 Pa, s??lo hay una disminuci??n de 1,8% en volumen.
Punto Triple
| Fases en equilibrio estable | Presi??n | Temperatura |
|---|---|---|
| el agua l??quida, hielo Ih, y vapor de agua | 611,73 Pa | 273,16 K (0,01 ?? C) |
| agua l??quida, hielo Ih, y hielo III | 209,9 MPa | 251 K (-22 ?? C) |
| agua l??quida, hielo III, y hielo V | 350,1 MPa | -17,0 ?? C |
| agua l??quida, hielo V y VI de hielo | 632,4 MPa | 0,16 ?? C |
| hielo Ih, Hielo II, III y hielo | 213 MPa | -35 ?? C |
| hielo II, III de hielo, y el hielo V | 344 MPa | -24 ?? C |
| hielo II, V hielo, y el hielo VI | 626 MPa | -70 ?? C |
La temperatura y presi??n a la que s??lido, l??quido, y el agua gaseosa coexisten en equilibrio se denomina punto triple del agua. Este punto se utiliza para definir las unidades de temperatura (el kelvin , la unidad SI de temperatura termodin??mica y, de manera indirecta, el grado Celsius y hasta el grado Fahrenheit). Como consecuencia, la temperatura del punto triple del agua es un valor prescrito en lugar de una cantidad medida. El punto triple es a una temperatura de 273,16 K (0,01 ?? C) por convenci??n, y a una presi??n de 611,73 Pa. Esta presi??n es muy baja, alrededor de 1/166 de la presi??n barom??trica a nivel del mar normal de 101.325 Pa. La presi??n en la superficie atmosf??rica en el planeta Marte es extraordinariamente cerca de la presi??n del punto triple, y la elevaci??n cero o "nivel del mar" de Marte se define por la altura a la que la presi??n atmosf??rica corresponde al punto triple del agua.

Aunque com??nmente se denomina como "el punto triple del agua", la combinaci??n estable de agua l??quida, hielo I, y el vapor de agua no es sino uno de los varios puntos triples en la diagrama de fases del agua. Gustav Tammann en G??ttingen produce datos sobre varios otros puntos triples en el siglo 20. Kamb y otros documentaron m??s puntos triples en la d??cada de 1960.
Efecto Mpemba
La Efecto Mpemba es el sorprendente fen??meno por el cual el agua caliente puede, bajo ciertas condiciones, congelar m??s pronto que el agua fr??a, a pesar de que debe pasar la temperatura m??s baja en el camino a la congelaci??n. Sin embargo, esto se puede explicar con evaporaci??n, convecci??n, sobreenfriamiento, y la efecto de aislante heladas.
Congelaci??n de transici??n a temperatura ambiente
Hielo caliente es el nombre dado a otro fen??meno sorprendente en que el agua a temperatura ambiente puede convertirse en hielo que se mantiene a temperatura ambiente por la alineaci??n de los dipolos de agua y cristalizaci??n en hielo c??bico polar a trav??s de suministrar un campo el??ctrico en el orden de 10 6 voltios por metro. Este fen??meno fue m??s tarde descart?? por no ser debido a la congelaci??n inducida por tensi??n y atribuido a un artefacto.
El efecto de tales campos el??ctricos se ha sugerido como una explicaci??n de la formaci??n de nubes. Las primeras formas de nubes de hielo de tiempo alrededor de una part??cula de arcilla, se requiere una temperatura de -10 ?? C, pero posterior congelaci??n en torno a la misma part??cula de arcilla requiere una temperatura de s??lo -5 ?? C, lo que sugiere alg??n tipo de cambio estructural.
Tensi??n superficial
Las gotas de agua son estables, debido a la alta tensi??n superficial del agua, 72,8 mN / m, el m??s alto de los l??quidos no met??licos. Esto se puede ver cuando se ponen peque??as cantidades de agua sobre una superficie tal como vidrio: el agua permanece unida en forma de gotas. Esta propiedad es importante para la vida. Por ejemplo, cuando el agua se lleva a trav??s de xilema hasta los tallos en las plantas de los fuertes atracciones intermoleculares mantienen la columna de agua juntos. Propiedades de cohesi??n fuerte influencia columna de agua juntos y fuertes propiedades adhesivas se pegan el agua al xilema, y evitar la ruptura de tensi??n causados por tir??n transpiraci??n. Otros l??quidos con baja tensi??n superficial tendr??an una mayor tendencia a "rip", formando bolsas de aire o de vac??o y haciendo que el transporte de agua xilema inoperante.
Propiedades el??ctricas
El agua pura no contiene iones es una excelente aislante, sin embargo, ni siquiera agua "desalinizada", est?? completamente libre de iones. Sufre Agua auto-ionizaci??n a cualquier temperatura por encima del cero absoluto . Adem??s, porque el agua es un buen disolvente tal, que casi siempre tiene alg??n soluto disuelto en ella, con mayor frecuencia una sal. Si el agua tiene incluso una peque??a cantidad de una impureza tal, entonces se puede conducir la electricidad f??cilmente, como impurezas, tales como la sal se separan en libres iones en soluci??n acuosa por el que una corriente el??ctrica puede fluir.
El agua puede dividirse en sus elementos constituyentes, hidr??geno y ox??geno, haciendo pasar una corriente a trav??s de ??l. Este proceso se llama electr??lisis . Las mol??culas de agua se disocian de forma natural en H + y OH - iones, que son arrastrados hacia el c??todo y ??nodo, respectivamente. En el c??todo, dos iones H + captan electrones y forma H 2 gas. En el ??nodo, cuatro iones OH - se combinan y liberan O 2 de gas, agua molecular, y cuatro electrones. Los gases producidos burbuja a la superficie, donde pueden ser recogidos. Se sabe que la resistividad el??ctrica m??xima te??rica para el agua es de aproximadamente 182 kW ?? m?? / m (o 18,2 MΩ ?? cm?? / cm) a 25 ?? C. Esta cifra concuerda bien con lo que normalmente se ve en ??smosis inversa, ultrafiltrado y desionizada sistemas de agua ultrapura utilizar, por ejemplo, en las plantas de fabricaci??n de semiconductores. A nivel de contaminante sal o ??cido incluso superior a la de 100 partes por trill??n (ppt) en agua ultrapura comenzar?? a disminuir notablemente su nivel de resistividad por hasta varios metros-kilohm cuadrado por metro (un cambio de varios cientos nanosiemens por metro de conductancia).
Conductividad el??ctrica
El agua pura tiene un bajo conductividad el??ctrica, pero esto aumenta significativamente de solvataci??n de una peque??a cantidad de agua de material i??nico tal como cloruro de hidr??geno. As?? los riesgos de electrocuci??n son mucho mayores en el agua con las impurezas habituales que no se encuentran en el agua pura. (Vale la pena se??alar, sin embargo, que los riesgos de electrocuci??n disminuci??n cuando las impurezas aumentan hasta el punto donde el agua misma es mejor conductor que el cuerpo humano. Por ejemplo, los riesgos de electrocuci??n en agua de mar son m??s bajos que en agua dulce , ya que el mar tiene un nivel mucho m??s alto de impurezas, particularmente la sal com??n, y la trayectoria de la corriente principal ser?? buscar el mejor conductor. Esta es, sin embargo, no es infalible y riesgos sustanciales permanecer en el agua salada.) Cualquier propiedades el??ctricas observables en el agua son a partir de los iones de sales minerales y di??xido de carbono disueltos en ella. El agua hace auto-ionizar donde dos mol??culas de agua se convierten en uno de hidr??xido de aniones y uno cationes hidronio, pero no lo suficiente como para llevar suficiente corriente el??ctrica para hacer cualquier trabajo o da??o para la mayor??a de las operaciones. En el agua pura, equipo sensible puede detectar una ligera el??ctrica conductividad de 0.055 mS / cm a 25 ?? C. El agua tambi??n puede ser electrolizada en gases de ox??geno e hidr??geno, pero en ausencia de iones disueltos este es un proceso muy lento, como se lleva a cabo muy poca corriente. Mientras que los electrones son los principales portadores de carga en el agua (y metales), en el hielo (y algunos otros electrolitos), los protones son los portadores primarios (v??ase conductor de protones).
Naturaleza dipolar del agua
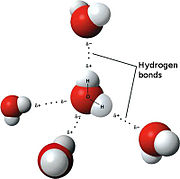
Una caracter??stica importante del agua es su naturaleza polar. La mol??cula de agua forma un ??ngulo, con ??tomos de hidr??geno en las extremidades y el ox??geno en el v??rtice. Puesto que el ox??geno tiene una mayor electronegatividad que el hidr??geno, el lado de la mol??cula con el ??tomo de ox??geno tiene una carga negativa parcial. Una mol??cula con una diferencia de carga de este tipo se llama una dipolo. Las diferencias de carga provocan que las mol??culas de agua se atraen entre s?? (las ??reas relativamente positivos siendo atra??dos a las zonas relativamente negativos) ya otras mol??culas polares. Esta atracci??n es conocida como enlaces de hidr??geno, y explica muchas de las propiedades del agua. Ciertas mol??culas, tales como di??xido de carbono, tambi??n tienen una diferencia en electronegatividad entre los ??tomos, pero la diferencia es que la forma de di??xido de carbono es sim??tricamente alineado y por lo que las cargas opuestas se cancelan mutuamente. Este fen??meno de agua se puede ver si se mantiene una fuente el??ctrica cerca de un delgado chorro de agua que cae verticalmente, haciendo que el flujo de doblar hacia la fuente el??ctrica.
Aunque el enlace de hidr??geno es una atracci??n relativamente d??bil en comparaci??n con los enlaces covalentes dentro de la propia mol??cula de agua, que es responsable de un n??mero de propiedades f??sicas del agua. Una de estas propiedades es su relativamente alta de fusi??n y punto de ebullici??n temperaturas; m??s calor se requiere energ??a para romper los enlaces de hidr??geno entre las mol??culas. El sulfuro de hidr??geno compuesto similar (H 2 S), que tiene mucho m??s d??bil enlace de hidr??geno, es un gas a temperatura ambiente a pesar de que tiene el doble de la masa molecular del agua. La uni??n adicional entre las mol??culas de agua tambi??n da agua l??quida en gran capacidad de calor espec??fico. Esta alta capacidad de calor hace que el agua un buen medio de almacenamiento de calor.
El enlace de hidr??geno tambi??n da regar su comportamiento inusual al congelar. Cuando se enfr??a a cerca del punto de congelaci??n, la presencia de enlaces de hidr??geno significa que las mol??culas, ya que se reordenan para minimizar su energ??a, forman la hexagonal estructura de cristal de hielo que es en realidad de densidad m??s baja: por lo tanto, la forma s??lida, hielo, flotar?? en el agua. En otras palabras, el agua se expande cuando se congela, mientras que casi todos los dem??s materiales se contraen en la solidificaci??n.
Una consecuencia interesante de la s??lida que tiene una densidad menor que el l??quido es que el hielo se derretir?? si se aplica presi??n suficiente. Con el aumento de la presi??n de la temperatura del punto de fusi??n cae y cuando la temperatura del punto de fusi??n es inferior a la temperatura ambiente el hielo empieza a derretirse. Se requiere un aumento significativo de la presi??n para bajar la temperatura del punto de fusi??n -la presi??n ejercida por un patinador de hielo en el hielo s??lo reducir??a el punto de fusi??n en aproximadamente 0,09 ?? C (0,16 ?? F).
- Polaridad electronegativo
El agua tiene una carga negativa parcial (σ-) cerca del ??tomo de ox??geno debido a los pares de electrones no compartidos, y las cargas positivas parciales (σ +) cerca de los ??tomos de hidr??geno. En el agua, esto sucede porque el ??tomo de ox??geno es m??s electronegativo que los ??tomos de hidr??geno - es decir, que tiene un "fuerte potencia de tracci??n "en la de la mol??cula electrones , acerc??ndolos (junto con su carga negativa) y haciendo que el ??rea alrededor del ??tomo de ox??geno m??s negativo que el ??rea alrededor tanto del hidr??geno ??tomos.
Adhesi??n

Palos de agua a s?? mismo ( cohesi??n) porque es polar. El agua tambi??n tiene un alto propiedades de adherencia debido a su naturaleza polar. El extremadamente limpio / lisa de vidrio el agua puede formar una pel??cula delgada porque las fuerzas moleculares entre el vidrio y las mol??culas de agua (fuerzas adhesivas) son m??s fuertes que las fuerzas de cohesi??n. En las c??lulas biol??gicas y org??nulos, el agua est?? en contacto con la membrana y prote??nas superficies que est??n hidr??filo; es decir, superficies que tienen una fuerte atracci??n por el agua. Irving Langmuir observ?? una fuerza de repulsi??n fuerte entre las superficies hidrof??licas. Para deshidratar hidrof??licos superficies para eliminar las capas fuertemente arraigadas de agua de hidrataci??n, requiere hacer un trabajo sustancial en contra de estas fuerzas, llamadas fuerzas de hidrataci??n. Estas fuerzas son muy grandes, pero disminuyen r??pidamente durante un nan??metro o menos. Su importancia en la biolog??a ha sido ampliamente estudiado por V. Adrian Parsegian de la Instituto Nacional de Salud. Son particularmente importantes cuando las c??lulas se deshidratan por la exposici??n a ambientes secos o a la congelaci??n extracelular.
Tensi??n superficial

El agua tiene una alta tensi??n superficial causada por la fuerte cohesi??n entre las mol??culas de agua. Esto se puede ver cuando se ponen peque??as cantidades de agua sobre una superficie no-soluble, tal como polietileno; el agua permanece unida en forma de gotas. Igualmente significativo, el aire atrapado en los disturbios de la superficie forma burbujas, que a veces duran el tiempo suficiente para transferir mol??culas de gas para el agua. Otro efecto de la tensi??n superficial es ondas capilares que son las ondas superficiales que se forman de todo el impacto de las gotas de agua sobre las superficies, y algunas veces se producen con corrientes subsuperficiales fuerte flujo a la superficie del agua. La elasticidad aparente causada por la tensi??n superficial impulsa las olas.
Acci??n capilar
La acci??n capilar se refiere al proceso del agua en movimiento hacia arriba de un tubo estrecho contra la fuerza de la gravedad . Se produce porque el agua se adhiere a los lados del tubo, y luego la tensi??n superficial tiende a enderezar la superficie haciendo que el aumento de la superficie, y m??s agua se tira a trav??s de la cohesi??n. El proceso se repite mientras el agua fluye por el tubo hasta que haya suficiente agua que la gravedad contrarresta la fuerza adhesiva.
El agua como disolvente

El agua tambi??n es un buen disolvente debido a su polaridad. Las sustancias que se mezclan bien y se disuelven en agua (por ejemplo, sales ) se conocen como " "sustancias (amantes del agua), mientras que los que se mezcla bien con el agua (por ejemplo, hidrof??licos grasas y aceites ), que se conoce como " "(temiendo agua) las sustancias hidr??fobas. La capacidad de una sustancia para disolverse en agua se determina por si o no la sustancia puede igualar o mejor la fuerte fuerzas atractivas que las mol??culas de agua generan entre otras mol??culas de agua. Si una sustancia tiene propiedades que no le permiten superar estas fuerzas intermoleculares fuertes, las mol??culas son " empujado fuera "desde el agua, y no se disuelven. Contrariamente a las sustancias error com??n, agua e hidr??fobos no" repeler ", y la hidrataci??n de una superficie hidr??foba es energ??ticamente, pero no entr??picamente, favorable.
Cuando un compuesto i??nico o polar entra en el agua, que est?? rodeado por mol??culas de agua ( La hidrataci??n). El tama??o relativamente peque??o de mol??culas de agua normalmente permite que muchas mol??culas de agua para rodear una mol??cula de soluto . Los extremos de dipolo parcialmente negativos del agua son atra??dos a cargado positivamente componentes del soluto, y viceversa para los extremos de dipolo positivos.
En general, sustancias i??nicas y polares, tales como ??cidos , alcoholes , y sales son relativamente soluble en agua, y las sustancias no polares tales como grasas y aceites no lo son. Mol??culas no polares permanecen juntos en el agua debido a que es energ??ticamente m??s favorable para las mol??culas de agua a enlace de hidr??geno entre s?? que para participar en interacciones de van der Waals con las mol??culas no polares.
Un ejemplo de un soluto i??nico es la sal de mesa ; el cloruro de sodio, NaCl, se separa en + Na cationes y Cl - aniones , estando cada uno rodeados por mol??culas de agua. Los iones son luego transportados f??cilmente fuera de su red cristalina en la soluci??n. Un ejemplo de un soluto no i??nico es el az??car de mesa . Los dipolos de agua hacen que los enlaces de hidr??geno con las regiones polares de la mol??cula de az??car (grupos OH) y permitir que sea llevada a la soluci??n.
Naturaleza Anf??tero de agua
Qu??micamente, el agua es anf??tero - es decir, es capaz de actuar ya sea como un ??cido o una base. En ocasiones, el ??cido hydroxic t??rmino se utiliza cuando el agua act??a como un ??cido en una reacci??n qu??mica. A un pH de 7 (neutro), la concentraci??n de hidr??xido de iones (OH -) es igual a la de la hidronio (H 3 O +) o hidr??geno (H +) iones. Si el equilibrio se altera, la soluci??n se vuelve ??cida (mayor concentraci??n de iones hidronio) o b??sica (mayor concentraci??n de iones hidr??xido).
El agua puede actuar como un ??cido o una base en las reacciones. De acuerdo con la Sistema de Bronsted-Lowry, un ??cido se define como una especie que dona un prot??n (H + un ion) en una reacci??n, y una base como uno que recibe un prot??n. Cuando se hace reaccionar con un ??cido m??s fuerte, el agua act??a como una base; cuando se hace reaccionar con una base fuerte, act??a como un ??cido. Por ejemplo, se recibe un ion H + a partir de HCl en el equilibrio:
- HCl + H2O ⇌ H3O + + Cl -
Aqu?? el agua est?? actuando como una base, mediante la recepci??n de un ion H +.
En la reacci??n con amoniaco , NH 3, agua dona un H + de iones, y est?? actuando de este modo como un ??cido:
- NH 3 + H 2 O ⇌ NH 4 + + OH -
La acidez en la naturaleza
En teor??a, el agua pura tiene una pH de 7 a 298 K. En la pr??ctica, el agua pura es muy dif??cil de producir. El agua que queda expuesto al aire durante mucho tiempo se disolver?? r??pidamente el di??xido de carbono , formando una soluci??n diluida de ??cido carb??nico, con un pH de aproximadamente 5,7 limitante. Como gotas de las nubes se forman en la atm??sfera y, como gotas de agua caen a trav??s de las peque??as cantidades de aire de CO 2 son absorbidas y por lo tanto mayor cantidad de lluvia es ligeramente ??cida. Si grandes cantidades de nitr??geno y de azufre ??xidos est??n presentes en el aire, ellos tambi??n se disuelven en la nube y la lluvia cae produciendo m??s graves lluvia ??cida problemas.
El enlace de hidr??geno en el agua
Una mol??cula de agua puede formar un m??ximo de cuatro enlaces de hidr??geno, ya que puede aceptar dos y donar dos hidr??genos. Otras mol??culas como fluoruro de hidr??geno, amon??aco , metanol enlaces de hidr??geno forma, pero que no muestran un comportamiento an??malo de termodin??mica , propiedades cin??ticas o estructurales como las que se observan en el agua. La respuesta a la aparente diferencia entre el agua y otros l??quidos de enlaces de hidr??geno radica en el hecho de que, aparte de agua ninguna de las mol??culas de enlace de hidr??geno puede formar cuatro enlaces de hidr??geno, ya sea debido a una incapacidad para donar / aceptar hidr??genos o debido a efectos est??ricos en los residuos voluminosos. En local de agua tetra??drica orden debido a los cuatro enlaces de hidr??geno da lugar a una estructura abierta y una red de compensaci??n de 3 dimensiones, que existe en contraste con las estructuras estrechamente empaquetados de simples l??quidos . Hay una gran similitud entre el agua y la s??lice en su comportamiento an??malo, a pesar de que uno (agua) es un l??quido que tiene una red de enlaces de hidr??geno mientras que el otro (s??lice) tiene una red covalente con un punto de fusi??n muy alto. Una de las razones de que el agua es muy adecuado, y elegidos, por las formas de vida, es que se exhibe sus propiedades ??nicas sobre un r??gimen de temperatura que se adapte a diversa procesos biol??gicos, incluyendo hidrataci??n.
Se cree que enlace de hidr??geno en el agua es en gran parte debido a las fuerzas electrost??ticas y una cierta cantidad de covalencia. La naturaleza covalente parcial de enlace de hidr??geno predicho por Linus Pauling en la d??cada de 1930 a??n no se ha demostrado de forma inequ??voca por los experimentos y c??lculos te??ricos.
Las propiedades cu??nticas de agua molecular
Aunque la f??rmula molecular del agua se considera generalmente que es un resultado estable en termodin??mica molecular, el trabajo reciente comenz?? en 1995 ha mostrado que en ciertas escalas, el agua puede actuar m??s como H 3/2 O de H 2 O en el nivel cu??ntico. Este resultado podr??a tener ramificaciones significativas en el nivel de, por ejemplo, el enlace de hidr??geno en biol??gica , qu??mica y f??sica de sistemas. El experimento muestra que cuando los neutrones y los electrones chocan con agua, se dispersan de una manera que indica que s??lo se ven afectadas por una proporci??n de 1,5: 1 de hidr??geno a ox??geno respectivamente. Sin embargo, la escala de tiempo de esta respuesta s??lo se ve en el nivel de attosegundos (10 -18 segundos), y as?? s??lo es relevante en altamente resuelto cin??tica y sistemas din??micos.
Agua Pesada y isotop??logos de agua
El hidr??geno tiene tres is??topos. El m??s com??n, lo que representa m??s de 99,98% de la de hidr??geno en agua, tiene 1 prot??n y 0 neutrones. Un segundo is??topo, deuterio (forma corta "D"), tiene 1 protón y 1 neutrón. El deuterio, D 2 O , también se conoce como agua pesada y se utiliza en reactores nucleares como moderador de neutrones. La tercera isótopo, tritio, tiene 1 protón y 2 neutrones, y es radiactivo, con una vida media de 4.500 días. T 2 O existe en la naturaleza sólo en pequeñas cantidades, que se produce principalmente a través de reacciones nucleares de rayos cósmicos impulsada en la atmósfera. D 2 O es estable, pero se diferencia de H 2 O en que es más densa - por lo tanto, "agua pesada" - y en que varias otras propiedades físicas son ligeramente diferentes de las del común, hidrógeno-1 que contiene "agua ligera". De agua con uno de deuterio átomo de HDO se produce naturalmente en el agua ordinaria en concentraciones muy bajas (~ 0,03%) y D 2 O en cantidades mucho más bajas (0,000003%). El consumo de aislado puro D 2 O puede afectar a procesos bioquímicos - ingestión de grandes cantidades daña los riñones y la función del sistema nervioso central. Sin embargo, grandes cantidades de agua pesada deben ser consumidos por cualquier toxicidad sea aparente, y cantidades más pequeñas pueden ser consumidos sin efectos nocivos en absoluto.
El oxígeno también tiene tres isótopos estables, con16O presente en el 99,76%,17S en 0,04% y18O en el 0,2% de las moléculas de agua.
Transparencia
La transparencia del agua es también una propiedad importante del líquido. Si el agua no fuera transparente, la luz del sol, esencial para las plantas acuáticas, no meta la mano en los mares y océanos.
Historia
Las propiedades del agua se han utilizado históricamente para definir diversas escalas de temperatura. Cabe destacar que el Kelvin , Celsius y Fahrenheit escalas estaban, o están, definidas por los puntos de congelación y ebullición del agua. Las escalas menos comunes de Delisle, Newton, Réaumur y Rømer se definieron de manera similar. La punto triple del agua es un punto de norma más utilizada en la actualidad.
La primera descomposición científica de agua en hidrógeno y oxígeno, por electrólisis , se llevó a cabo en 1800 por William Nicholson, un químico Inglés. En 1805, Joseph Louis Gay-Lussac y Alexander von Humboldt demostró que el agua se compone de dos partes de hidrógeno y uno de oxígeno parte (en volumen).
Gilbert Newton Lewis aisló la primera muestra de puraagua pesada en 1933.
Polywater era una hipotética forma polimerizada de agua que ha sido objeto de mucha controversia científica a finales del 1960. El consenso actual es que no existe.
Nomenclatura sistemática
La aceptaciónnombre IUPAC del agua es simplemente "agua", aunque hay otros dos nombres sistemáticos que pueden ser utilizados para describir la molécula.
El nombre más simple y mejor sistemática de agua es óxido de hidrógeno . Esto es análogo a los compuestos relacionados tales como peróxido de hidrógeno , sulfuro de hidrógeno, y óxido de deuterio (agua pesada). Otro nombre sistemático, Oxidane , está aceptado por la IUPAC como nombre de los padres para la nomenclatura sistemática de la base de oxígeno grupos sustituyentes, aunque incluso éstos suelen tener otros nombres recomendados. Por ejemplo, el nombre se recomienda hidroxilo sobre oxidanyl para el grupo -OH. El nombre oxano se menciona explícitamente por la IUPAC como inadecuado para este propósito, puesto que ya es el nombre de un éter cíclico también conocido como tetrahidropirano en el sistema de Hantzsch-Widman ; compuestos similares incluyen dioxano y trioxano.
Nomenclatura sistemática y humor
Monóxido de dihidrógeno o DHMO es un nombre covalente sistemática excesivamente pedante de agua. Este término se ha utilizado en parodias de la investigación química que llamar para esta "química letal" para ser prohibido. En realidad, un nombre sistemático más realista sería óxido de hidrógeno , ya que el "di-" y "MON" prefijos son superfluas. El sulfuro de hidrógeno, H 2 S, no se conoce como "monosulfuro de dihidrógeno", y peróxido de hidrógeno , H 2 O 2 , no se llama "El dióxido de dihidrógeno".
Algunos exceso de celohojas de datos de seguridad de la lista de agua lo siguiente: Precaución: Puede causar ahogamiento!
Otros nombres sistemáticos para agua incluyen ácido hydroxic o ácido hidroxílico . Del mismo modo, el nombre alcalino sistemática de agua es hidróxido de hidrógeno -tanto existen nombres de ácidos y alcalinos para el agua, ya que es capaz de reaccionar tanto como un ácido o un álcali, dependiendo de la fuerza del ácido o álcali que se hace reaccionar con ( anfótero) . Ninguno de estos nombres se utilizan ampliamente fuera de los sitios de DHMO.

