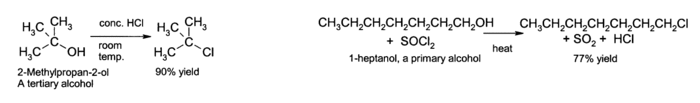Alcohol
Sabías ...
SOS Children, una organización benéfica educación , organizó esta selección. Infantil SOS es la mayor donación de caridad del mundo niños huérfanos y abandonados de la oportunidad de la vida familiar.

En química , un alcohol es cualquier compuesto orgánico en el que una hidroxilo grupo (- O H ) está unido a un carbono de un átomo de alquilo o grupo alquilo sustituido. La fórmula general para un simple alcohol acíclico es C n H 2n + 1 OH.
En términos simples, la palabra alcohol ( árabe : الكحل, "al-Kuhl") por lo general se refiere a etanol , también conocido como alcohol de grano o espíritus (mayores) de vino, ni a ninguna bebida alcohólica. El etanol es un líquido incoloro, volátil con un olor suave que se puede obtener por el la fermentación de azúcares. (Industrialmente, es más comúnmente obtiene por hidratación de etileno - de la reacción de etileno con agua en presencia de ácido fosfórico .) etanol es el más ampliamente utilizado depresor en el mundo, y ha sido durante miles de años. Este sentido subyace en el término alcoholismo ( adicción al alcohol).
Otros alcoholes se describen generalmente con un adjetivo aclarar, como en alcohol isopropílico (propan-2-ol) o alcohol de madera (alcohol metílico o metanol ). El sufijo -ol aparece en la "oficial" IUPAC nombre químico de todos los alcoholes.
Hay tres grandes subconjuntos de alcoholes: primaria (1 °), secundario (2 °) y terciarias (3 °), basado en el número de átomos de carbono de carbono del grupo C-OH (mostrado en rojo) está unido a. El etanol es una sencilla alcohol "primaria". El alcohol secundario más simple es alcohol isopropílico (propan-2-ol), y un alcohol terciario sencillo es alcohol terc-butilo (2-metil-2-ol).
La fenoles con compuesto original fenol tienen un grupo hidroxilo (que se adjunta a un benceno anillo) como alcoholes, pero difieren bastante en propiedades como para justificar un tratamiento distinto.
Los hidratos de carbono (azúcares) y alcoholes de azúcar son una clase importante de compuestos que contienen grupos funcionales alcohol múltiple. Por ejemplo, sacarosa (azúcar común) contiene ocho grupos hidroxilo por molécula y sorbitol tiene seis. La mayoría de los atributos de estos polioles, de nomenclatura, a la aparición, el uso y la toxicidad, son suficientemente diferentes de alcoholes alifáticos simples como para requerir un tratamiento separado.
Alcoholes simples
Los alcoholes simples y más comúnmente utilizados son metanol y etanol . El metanol se obtuvo anteriormente por la destilación de la madera y el llamado "alcohol de madera". Ahora es un producto barato, el producto químico de monóxido de carbono reacciona con hidrógeno a alta presión. El metanol es intoxicante pero no directamente venenosos. Es tóxico por su desglose ( intoxicación) por el enzima alcohol deshidrogenasa en el hígado mediante la formación de ácido fórmico y formaldehído que causa permanente ceguera por la destrucción de la nervio óptico.
Aparte de su papel familiar en bebidas alcohólicas, el etanol también se utiliza como un disolvente industrial altamente controlada y materia prima. Para evitar los altos impuestos sobre el etanol para el consumo, se añaden aditivos para que sea desagradable (como benzoato de denatonio - "Bitrex") o venenosos (tal como metanol). Etanol en esta forma se conoce generalmente como alcohol desnaturalizado; cuando se utiliza metanol, puede ser referido como alcohol de quemar ("Meths") o "espíritus quirúrgicos".
Otros dos alcoholes cuyos usos son relativamente generalizada (aunque no tanto como las de metanol y etanol) son propanol y butanol. Como el etanol, pueden ser producidos por procesos de fermentación. (Sin embargo, el agente de fermentación es una bacteria, Clostridium acetobutylicum, que se alimenta de de celulosa, no azúcares como la levadura Saccharomyces que produce etanol.)
Nomenclatura
Los nombres sistemáticos
En la IUPAC sistema, el nombre de la cadena de alcano pierde la "e" terminal y añade "ol", por ejemplo "metanol" y "etanol". Cuando sea necesario, la posición del grupo hidroxilo se indica mediante un número entre el nombre del alcano y el "ol": propan-1-ol para CH 3 CH 2 CH 2 OH, propan-2-ol para CH 3 CH (OH) CH 3. A veces, el número de posición se escribe antes del nombre IUPAC: 1-propanol y 2-propanol. Si un grupo de mayor prioridad está presente (como una aldehído, cetona o ácido carboxílico ), entonces es necesario usar el prefijo "hidroxi", por ejemplo: 1-hidroxi-2-propanona (CH 3 COCH 2 OH).
Algunos ejemplos de alcoholes simples y la forma de nombrarlos:

Los nombres comunes de alcoholes por lo general toma el nombre del correspondiente alquilo grupo y añadir la palabra "alcohol", por ejemplo, alcohol metílico, alcohol etílico o tert butil alcohol. Alcohol propílico puede ser n propil alcohol o alcohol isopropílico dependiendo de si el grupo hidroxilo está unido a la primera o segunda carbono en la cadena de propano. El alcohol isopropílico también es ocasionalmente llamada alcohol sec propil.
Como se mencionó anteriormente alcoholes se clasifican como primaria (1 °), secundario (2 °) o terciario (3 °), y los nombres comunes a menudo indican esto en el prefijo del grupo alquilo. Por ejemplo (CH 3) 3 COH es un alcohol terciario se conoce comúnmente como alcohol terc-butilo. Esto se denomina 2-metil-2-ol bajo las reglas de la IUPAC, que indica una cadena de propano con grupos metilo e hidroxilo tanto adjunta a la mitad (# 2) de carbono.
Alcohol primaria (1 °) - tienen fórmulas generales RCH2OH alcohol secundario (2 °) - Tener fórmulas generales RR'CHOH alcohol terciario (3 °) - Disponer de fórmulas generales orden resistencia de la unión de hidrógeno RR'R COH: 1 °> 2 ° > 3 ° orden Punto de ebullición: 1 °> 2 °> 3 ° orden Acidez: 1 °> 2 °> 3 °
Etimología
La palabra alcohol aparece en Inglés en el siglo 16, prestado a través de francés a partir médica América , en última instancia, del árabe al-Kuhl. Al es el árabe para la artículo definitivo, el de Inglés. Kuhl fue el nombre dado al polvo muy fino, producido por la sublimación del mineral natural Stibnita para formar antimonio sulfuro de Sb 2 S 3 (de ahí la esencia o "espíritu" de la sustancia), que fue utilizado como un antiséptico y delineador de ojos.
La introducción de la palabra a la terminología europea en la alquimia se remonta al siglo 12 , por las traducciones latinas de obras de Razi (865-925), quien describió el arte de la destilación . Bartolomé Traheron en su traducción de 1543 Juan de Vigo introduce la palabra como un término usado por los "bárbaros" ( ) Autores árabes para "polvo fino":
- los auctours bárbaras usan alcohol, o (como yo fynde que sometymes wryten) alcofoll, por moost poudre bien.
William Johnson en su 1657 Lexicon Chymicum glosa la palabra como antimonio stibium sive. Por extensión, la palabra pasó a referirse a cualquier fluido obtenido de la destilación, incluyendo "el alcohol del vino", la esencia destilada de vino. Libavius en Alchymia (1594) tiene alcohol vini vinum vel alcalisatum. Johnson (1657) glosas vini alcohol como quando omnis superfluitas vini un separatur vino, ita ut accensum ardeat donec totum consumatur, nihilque fæcum aut phlegmatis in fundo remaneat. Significado de la palabra se restringió al "espíritu del vino" ( etanol ) en el siglo 18 y se extendió de nuevo a la familia de sustancias denominadas en la química moderna desde 1850.
El nombre actual Árabe para el alcohol es الكحول al-kuḥūl, reintroducido del uso occidental, mientras que el Clásica palabra árabe es الغول al-Gawl (por ejemplo, sura 37:47), literalmente " espíritu "(la palabra al-Gawl es también el origen del Inglés palabra " ghoul ", y el nombre de la estrella Algol ).
Propiedades físicas y químicas
La grupo hidroxilo generalmente hace que la molécula de alcohol polar. Estos grupos pueden formar enlaces de hidrógeno entre sí y con otros compuestos. Este enlace de hidrógeno significa que los alcoholes se pueden utilizar como disolventes próticos. Dos tendencias de solubilidad opuestas en alcoholes son: la tendencia de la polar OH para promover la solubilidad en agua, y de la cadena de carbono para resistir. Por lo tanto, metanol, etanol, propanol y son miscibles en agua debido a que el grupo hidroxilo ha sufrido a lo largo de la cadena de carbono corta. Butanol, con una cadena de cuatro carbonos, es moderadamente soluble debido a un equilibrio entre las dos tendencias. Los alcoholes de cinco o más átomos de carbono ( Pentanol y superior) son efectivamente insolubles en agua debido a la posición dominante de la cadena de hidrocarburos. Todos los alcoholes simples son miscibles en disolventes orgánicos.
Porque enlaces de hidrógeno, alcoholes tienden a tener puntos de ebullición más altos que los comparable hidrocarburos y éteres . El punto de etanol alcohol de ebullición es de 78,29 ° C, en comparación con 69 ° C para el hidrocarburo Hexano (un componente común de gasolina) y 34.6 ° C de Éter dietílico.
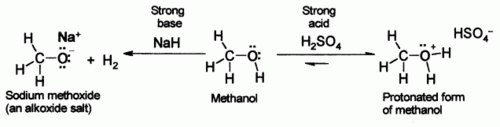
Alcoholes, como el agua, pueden mostrar propiedades ya sea ácidos o básicos en el grupo OH. Con un pKa de alrededor de 16 a 19 que son generalmente un poco más débiles ácidos que el agua , pero todavía son capaces de reaccionar con bases fuertes como hidruro de sodio o metales reactivos como el sodio . La sales que resultan se llaman alcóxidos, con la fórmula general R O - M +.
Mientras tanto, el átomo de oxígeno tiene pares de electrones no enlazantes que la hacen débilmente básico en presencia de ácidos fuertes tales como ácido sulfúrico . Por ejemplo, con metanol:
Los alcoholes también pueden someterse oxidación para dar aldehídos, cetonas o ácidos carboxílicos , o pueden ser deshidratado para alquenos . Ellos pueden reaccionar para formar compuestos de ésteres, y pueden (si se activa primero) someterse a sustitución nucleófila reacciones. Los pares solitarios de electrones en el oxígeno del grupo hidroxilo también hace alcoholes nucleófilos. Para más detalles ver las reacciones de los alcoholes sección de abajo.
Aplicaciones
Los alcoholes pueden ser utilizados como una bebida ( etanol solo), como combustible y para muchas utilidades científicos, médicos e industriales. El etanol en la forma de bebidas alcohólicas han sido consumidas por los seres humanos desde tiempos prehistóricos. Una solución v / v 50% de etileno glicol en agua se utiliza comúnmente como una anticongelante.
Algunos alcoholes, principalmente el etanol y metanol , se pueden utilizar como una Alcohol carburante. Rendimiento de combustible se puede incrementar en inducción forzada motores de combustión interna mediante la inyección de alcohol en la entrada de aire después de la turbocompresor o supercargador ha presurizado el aire. Esto enfría el aire a presión, proporcionando una carga de aire más denso, lo que permite más combustible, y por lo tanto más energía.
Los alcoholes tienen aplicaciones en la industria y la ciencia como reactivos o disolventes . Debido a su baja toxicidad y capacidad de disolver sustancias no polares, el etanol se pueden usar como un disolvente en medicamentos, perfumes y esencias vegetales como la vainilla . En síntesis orgánica, alcoholes sirven como intermedios versátiles.
El etanol puede ser utilizado como un antiséptico para desinfectar la piel antes de administrar las inyecciones, a menudo junto con el yodo. Jabones a base de etanol son cada vez más comunes en los restaurantes y son convenientes porque no requieren secado debido a la volatilidad del compuesto. El alcohol también se utiliza como una conservante para especímenes.
Producción
Alcoholes industrialmente se producen de varias maneras:
- Por fermentación utilizando la glucosa producida a partir de azúcar de la hidrólisis de almidón, en presencia de levadura y temperatura de menos de 37 ° C para producir etanol. Por ejemplo la conversión de invertasa a la glucosa y fructosa o la conversión de glucosa a zimasa y etanol .
- Por directo hidratación usando etileno ( etileno hidratación u otros alquenos a partir de craqueo de fracciones de destilado de petróleo crudo . Por lo general utiliza un catalizador de ácido fosfórico en condiciones de alta temperatura y presión de 50-120.
- El metanol se produce a partir gas de síntesis, donde el monóxido de carbono se combinan y 2 equivalentes de gas hidrógeno para producir metanol usando un cobre , óxido de zinc y óxido de aluminio catalizador a 250 ° C y una presión de 50-100 atm.
Endógeno
Es inevitable que todos los seres humanos siempre tienen cierta cantidad de alcohol en su cuerpo en todo momento, incluso si nunca beben bebidas alcohólicas en sus vidas. Esto es debido a un proceso llamado producción endógena de etanol. Muchas de las bacterias en los intestinos utilice alcohol de fermentación como una forma de la respiración. Este método metabólica produce alcohol como un producto de desecho, de la misma manera que los resultados del metabolismo en la formación de dióxido de carbono y agua . Por lo tanto, los cuerpos humanos siempre contienen alguna cantidad de alcohol que se produce por estas bacterias benignas.
La síntesis de Laboratorio
Existen varios métodos para la preparación de alcoholes en el laboratorio.
- Primario haluros de alquilo reaccionan con solución acuosa de NaOH o KOH principalmente a alcoholes primarios en sustitución alifática nucleófila . (Haluros de alquilo secundarios y especialmente las terciarias darán la (alqueno) producto de eliminación en su lugar).
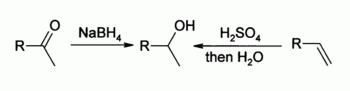
- Aldehídos o cetonas son reducida con borohidruro de sodio o hidruro de litio y aluminio (después de un tratamiento ácido). Otra reducción por aluminumisopropylates es la Reducción de Meerwein-Ponndorf-Verley.
- Los alquenos se involucran en un ácido catalizada reacción de hidratación utilizando concentrada de ácido sulfúrico como catalizador que da generalmente alcoholes secundarios o terciarios. La hidroboración-oxidación y oximercuración de reducción de alquenos son más confiables en síntesis orgánica. Los alquenos reaccionan con NBS y agua en reacción de formación de halohidrina
- Reactivos de Grignard reaccionan con grupos carbonilo a alcoholes secundarios y terciarios
- Noyori hidrogenación asimétrica es la reducción asimétrica de β-ceto-ésteres
- Las aminas pueden ser convertidos a sales de diazonio que luego son hidrolizados.
La formación de un alcohol secundario a través de la reducción y la hidratación se muestra:
Reacciones
La desprotonación
Los alcoholes pueden comportarse como ácidos débiles, sometidos a desprotonación. La reacción de desprotonación para producir una alcóxido la sal se lleva a cabo ya sea con una base fuerte tal como hidruro de sodio o n-butil-litio, o con sodio o potasio metálico.
- 2 R-OH + 2 NaH → 2 RO - Na + + 2 H 2 ↑
- 2 R-OH + 2 Na → 2R-O - Na + H 2
- Ej 2 CH 3 CH 2 OH + 2 Na → 2 CH 3 -CH 2 -O - Na + H 2
El agua es similar en pKa para muchos alcoholes, así que con el hidróxido de sodio no es un equilibrio establecido que por lo general se encuentra a la izquierda:
- R-OH + NaOH <=> RO - Na + + H 2 O (equilibrio hacia la izquierda)
Cabe señalar, sin embargo, que las bases utilizadas para desprotonar alcoholes son fuertes sí mismos. Las bases utilizadas y los alcóxidos creados son ambos reactivos químicos sensibles altamente humedad.
La acidez de alcoholes también se ve afectada por la estabilidad general de la ion alcóxido. Grupos unidos al carbono que contiene el grupo hidroxilo servirá para estabilizar el alcóxido cuando se forman, lo que resulta en una mayor acidez aceptor de electrones. Por otro lado, la presencia de grupo donador de electrones se traducirá en un ión alcóxido menos estable formado. Esto resultará en un escenario en el que el ion alcóxido inestable formado tenderá a aceptar un protón para reformar el alcohol originales.
Con haluros de alquilo alcóxidos dan lugar a éteres en el Síntesis de éter de Williamson.
Sustitución nucleófila
La OH grupo no es un buen dejando grupo en sustitución nucleofílica reacciones, por lo que los alcoholes neutros no reaccionan en tales reacciones. Sin embargo, si el oxígeno está protonado primero para dar R-OH + 2, el grupo saliente ( agua ) es mucho más estable, y la sustitución nucleófila puede tener lugar. Por ejemplo, alcoholes terciarios reaccionan con ácido clorhídrico para producir terciaria haluros de alquilo, donde el grupo hidroxilo está reemplazado por un cloro átomo por sustitución nucleófila unimolecular. Si alcoholes primarios o secundarios son a hacerse reaccionar con ácido clorhídrico , un activador tal como cloruro de zinc se necesita. Alternativamente, la conversión puede llevarse a cabo directamente usando cloruro de tionilo.
Los alcoholes pueden igualmente ser convertidos a alquil bromuros usando ácido bromhídrico o tribromuro de fósforo , por ejemplo:
- 3 R-OH + PBr 3 → 3 RBr + H 3 PO 3
En el Barton-McCombie desoxigenación un alcohol es desoxigenada a un alcano con hidruro de tributilestaño o una complejo de agua trimethylborane en una reacción de sustitución radical.
Deshidratación
Los alcoholes son ellos mismos nucleófila, por lo R-OH + 2 puede reaccionar con ROH para producir éteres y agua en una reacción de deshidratación, aunque esta reacción se utiliza raramente excepto en la fabricación de éter dietílico.
Más útil es la E1 reacción de eliminación de alcoholes para producir alquenos . La reacción generalmente obedece Regla de Zaitsev, que establece que se forma la más estable (generalmente el más sustituido) alqueno. Alcoholes terciarios eliminan fácilmente a justo por encima de la temperatura ambiente, pero alcoholes primarios requieren una temperatura más alta.
Este es un diagrama de catalizada con ácido deshidratación de etanol para producir eteno :
Una reacción de eliminación más controlada es la Eliminación Chugaev con disulfuro de carbono y yodometano.
La esterificación
Para formar una éster de un alcohol y un ácido carboxílico de la reacción, conocida como Esterificación de Fischer, se realiza generalmente en reflujo con un catalizador de concentrado de ácido sulfúrico :
- R-OH + R'-COOH → R'-COOR + H 2 O
Con el fin de conducir el equilibrio hacia la derecha y producir un buen rendimiento de éster, se retira normalmente agua, ya sea por un exceso de H 2 SO 4 o utilizando un Aparato de Dean-Stark. Los ésteres también se pueden preparar por reacción del alcohol con una cloruro de ácido en presencia de una base tal como piridina.
Otros tipos de éster se preparan de similar, por ejemplo, tosilo (tosilato) ésteres se hacen por reacción del alcohol con p- cloruro de toluenosulfonilo en piridina.
Oxidación
Los alcoholes primarios (R-CH 2 -OH) se pueden oxidar, ya sea a aldehídos (R-CHO) o ácidos carboxílicos (R-CO 2 H), mientras que la oxidación de alcoholes secundarios (R 1 R²CH-OH) normalmente termina en la cetona (R 1 R²C = O) etapa. Alcoholes terciarios (R 1 R²R³C-OH) son resistentes a la oxidación.
La oxidación directa de alcoholes primarios a ácidos carboxílicos normalmente procede a través del aldehído correspondiente, que se transforma a través de una hidrato de aldehído (R-CH (OH) 2) por reacción con el agua antes de que pueda ser oxidado adicionalmente en el ácido carboxílico.
A menudo es posible interrumpir la oxidación de un alcohol primario en el nivel de aldehídos mediante la realización de la reacción en ausencia de agua, de modo que no se puede formar hidrato de aldehído.
Los reactivos útiles para la transformación de alcoholes primarios a aldehídos son normalmente también es adecuado para la oxidación de alcoholes secundarios a cetonas. Éstas incluyen:
- Reactivos basados en cromo, tales como Collins reactivo (CrO3 · Py 2), PDC o PCC.
- Activado DMSO, resultante de la reacción de DMSO con electrófilos, tales como cloruro de oxalilo ( Oxidación de Swern), una carbodiimida ( Pfitzner-Moffatt oxidación) o el complejo SO3 · Py ( Parikh-Doering oxidación).
- Compuestos de yodo hipervalente, tales como Dess-Martin peryodinano o Ácido 2-yodoxibenzoico.
- Catalítico TPAP en presencia de un exceso de NMO ( Ley de oxidación).
- Catalítico TEMPO en presencia de exceso de lejía ( NaOCl) ( La oxidación de Anelli).
Alílico y alcoholes bencílicos se pueden oxidar en presencia de otros alcoholes usando ciertos oxidantes selectivos tales como dióxido de manganeso (MnO 2).
Los reactivos útiles para la oxidación de alcoholes secundarios a cetonas, pero normalmente ineficientes para la oxidación de alcoholes primarios a aldehídos, incluyen trióxido de cromo (CrO 3) en una mezcla de ácido sulfúrico y acetona ( Oxidación) y ciertas cetonas, tales como Jones ciclohexanona, en presencia de isopropóxido de aluminio ( La oxidación de Oppenauer).
La oxidación directa de alcoholes primarios a ácidos carboxílicos puede llevarse a cabo usando:
- El permanganato de potasio (KMnO4).
- Oxidación de Jones.
- PDC en DMF.
- Oxidación Heyns.
- Tetróxido de rutenio (RuO 4).
- TEMPO.
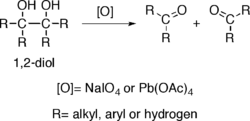
Los alcoholes que poseen dos grupos hidroxi situados en carbonos adyacentes, es decir, 1,2- diols- sufrir la rotura oxidativa en un enlace carbono-carbono con algunos oxidantes tales como peryodato de sodio (NaIO4) o tetraacetato de plomo (Pb (OAc 4)), lo que resulta en la generación de dos grupos carbonilo.
Toxicidad
Alcoholes menudo tienen un olor descrito como 'morder' que 'cuelga' en los conductos nasales. El etanol en forma de bebidas alcohólicas han sido consumidas por los seres humanos desde tiempos prehistóricos, para una variedad de razones higiénicas, dietéticas, medicinales, religiosos y recreativos. El consumo de grandes dosis da lugar a embriaguez o intoxicación (que puede conducir a una resaca como el efecto desaparece) y, dependiendo de la dosis y la regularidad de uso, puede causar insuficiencia respiratoria aguda o la muerte y con el uso crónico tiene repercusiones médicas. Dado que el alcohol afecta el juicio, a menudo puede ser un catalizador para el comportamiento imprudente o irresponsable. La LD 50 de etanol en ratas es de 11 300 mg / kg. Esta relación se correspondería con un 80 kg (176,4 libras) de consumición del hombre 65 tiros de 80 prueba de alcohol o 46 botellas de un litro y medio de cerveza con un 5% de contenido en alcohol, aunque la DL50 no se traduce directamente a los seres humanos. Se acordó en general que una dosis fatal en humanos sería de alrededor de un tercio de las ratas, o alrededor de 22 bebidas todo se consume en una sola sesión por unos 80 kg (176,4 libras) hombre.
Otros alcoholes son sustancialmente más venenoso que el etanol, en parte porque se toman mucho más tiempo para ser metabolizados, ya menudo su metabolismo produce sustancias aún más tóxicas. El metanol o alcohol de madera, por ejemplo, se oxida por alcohol deshidrogenasa enzimas en el hígado a la venenosa formaldehído, que puede causar ceguera o la muerte.
Un tratamiento eficaz para prevenir la toxicidad formaldehído después de la ingestión de metanol es administrar etanol. La alcohol deshidrogenasa tiene una mayor afinidad para el etanol, evitando así metanol a partir de la unión y que actúa como una sustrato. Cualquier metanol restante entonces tendrá tiempo para ser excretado por los riñones. Restante formaldehído se convertirá en ácido fórmico y se excreta.