
Éter
Antecedentes de las escuelas de Wikipedia
SOS ofrecen una descarga completa de esta selección de escuelas para su uso en escuelas intranets. Todos los niños disponibles para el apadrinamiento de niños de Aldeas Infantiles SOS son atendidos en una casa de familia por la caridad. Leer más ...
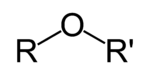
El éter es una clase de compuestos químicos que contienen un éter grupo - un oxígeno átomo conectado a dos (sustituido) alquilo o grupos arilo - de la fórmula general R-O-R '. Un ejemplo típico es el disolvente y anestésico éter dietílico, se denomina comúnmente simplemente como "éter" (etoxietano, CH 3 -CH 2 -O-CH 2 -CH 3).
Propiedades físicas
Éter moléculas no pueden formar enlaces de hidrógeno entre sí, resultando en un relativamente bajo punto de ebullición comparable al de los análogos alcoholes . Sin embargo, las diferencias en los puntos de ebullición de los éteres y sus alcoholes isométricas se hacen más pequeñas como las cadenas de carbono se hacen más largos, ya que el naturaleza hidrófoba de la cadena de carbono se hace más predominante sobre la presencia de enlaces de hidrógeno.
Los éteres son un poco polar como el R - C - O - C - ángulo de enlace Z en el grupo funcional es de unos 110 grados, y la C - dipolo O hace cancela. Éteres son menos polares que los alquenos, pero no tan polar como alcoholes, ésteres o amidas de estructura comparable. Sin embargo, la presencia de dos pares solitarios de electrones en los átomos de oxígeno hace que el enlace de hidrógeno con moléculas de agua posible, haciendo que la solubilidad de alcoholes (por ejemplo, butan-1-ol) y éteres (etoxietano) a ser bastante diferentes.
Éteres cíclicos tales como tetrahidrofurano y 1,4-dioxano son totalmente miscible en agua a causa de la átomo de oxígeno más expuestos para la unión de hidrógeno en comparación con éteres alifáticos.
Los éteres pueden actuar como Bases de Lewis. Por ejemplo, éter dietílico forma un complejo con boro compuestos, tales como boro dietil trifluoruro (BF3. OEt 2). Éteres también coordinan al magnesio en Reactivos de Grignard (RMgBr).
Nomenclatura
En la nomenclatura de la IUPAC sistema, éteres se nombran utilizando la fórmula general "alcoxialcano", por ejemplo CH 3 -CH 2 -O-CH 3 es metoxietano. Si el éter es parte de una molécula más compleja, que se describe como un sustituyente alcoxi, por lo -OCH 3 sería considerado un " metoxi- "grupo. El más simple alquilo radical está escrito en frente, así CH 3 -O-CH 2 CH se daría 3 como metoxi (CH 3) etano (CH 2 CH 3). La nomenclatura de describir los dos grupos alquilo y agregando "éter", por ejemplo, "éter metil etil" en el ejemplo anterior, es un el uso trivial.
Estructuras similares

Los éteres no deben confundirse con las siguientes clases de compuestos con la misma estructura ROR general.
- Compuestos aromáticos como furano donde el oxígeno es parte del sistema aromático.
- Compuestos en los que uno de los átomos de carbono próximos al oxígeno está conectado al oxígeno, nitrógeno , o azufre :
- Ésteres RC (= O) -OR
- Los acetales R-CH (-OR) -OR
- Aminals R-CH (-NH-R) -OR
- Anhídridos RC (= O) -OC (= O) -R
Primaria, secundaria y terciaria éteres
Los términos "éter primaria", "éter secundaria", y "éter terciario" se utilizan en ocasiones y se refieren al átomo de carbono al lado del oxígeno del éter. En un éter primaria este carbono está conectado a una sola otros carbonos como en éter dietílico CH 3 -CH 2 -O-CH 2 -CH 3. Un ejemplo de un éter secundaria es diisopropil éter (CH 3) 2 CH-O-CH (CH3) 2 y la de un éter terciario se éter di-terc-butilo (CH 3) 3 COC (CH 3) 3.
![]()
![]()
![]()
![]()
Dimetil éter, una amina primaria, una secundaria, y un éter terciario.
Poliéteres
Los poliéteres son compuestos con más de un grupo éter. Mientras que el término generalmente se refiere a polímeros como polietilenglicol y glicol de polipropileno, compuestos de bajo peso molecular tales como la éteres corona a veces pueden ser incluidos.
Reacciones orgánicas
Síntesis
Los éteres se pueden preparar en el laboratorio de varias maneras diferentes.
- La deshidratación intermolecular de alcoholes :
- R-OH + R-OH → ROR + H 2 O
- Esta reacción directa requiere condiciones drásticas (calentamiento a 140 grados centígrados y un catalizador ácido, ácido sulfúrico concentrado por lo general). Efectiva para la fabricación de éteres simétricos, pero no tan útil para la síntesis de éteres asimétricos porque la reacción producirá una mezcla de éteres, por lo que es por lo general no aplicable:
- 3R-OH + 3R'-OH → ROR + R'-O + R'-O '+ 3 H 2 O
- Las condiciones también deben ser controlados para evitar el sobrecalentamiento de 170 grados lo que hará que la deshidratación intramolecular, una reacción que produce alquenos. Además, el alcohol debe estar en exceso.
- R-CH2-CH2 (OH) → R-CH = CH 2 + H 2 O
- Tales condiciones pueden destruir las delicadas estructuras de algunos grupos funcionales. Existen varios métodos más suaves para producir éteres.
- El desplazamiento nucleofílico de haluros de alquilo de alcóxidos
- RO - + RX → ROR + X -
- Esta reacción se denomina Síntesis de éter de Williamson. Se incluye el tratamiento de un padre alcohol con un fuerte base para formar el alcóxido de aniones seguido de la adición de un compuesto alifático apropiado que lleva un adecuado grupo saliente (RX). Los grupos salientes adecuados (X) incluyen yoduro, bromuro, o sulfonatos. Este método no funciona si R es aromático como en bromobenceno (Br-C 6 H 5), sin embargo, si el grupo saliente está separado por al menos un carbono del benceno, la reacción debe proceder (como en Br-CH2-C 6 H 5). Asimismo, este método sólo da los mejores rendimientos de carbonos primarios, como carbonos secundarios y terciarios se someterá a la eliminación E2 sobre la exposición al anión alcóxido básico utilizado en la reacción debido al impedimento estérico de los grandes grupos alquilo. Éteres de arilo pueden ser preparados en el Condensación Ullmann.
- Desplazamiento nucleófilo de haluros de alquilo con fenolatos
- El RX no se puede usar para reaccionar con el alcohol. Sin embargo, fenoles pueden utilizarse para reemplazar el alcohol, mientras se mantiene el haluro de alquilo. Puesto que los fenoles son ácidos, que reaccionan fácilmente con una fuerte base como hidróxido de sodio para formar iones fenóxido. El ion fenóxido entonces sustituir el grupo -X en el haluro de alquilo, formando un éter con un grupo arilo unido a ella en una reacción con una Mecanismo SN2.
- HO-C 6 H 5 + OH - → O - -C 6 H 5
- O - -C 6 H 5 + RX → ROC 6 H 5
- Adición electrofílica de alcoholes a alquenos .
- R 2 C = CR 2 + R-OH → R 2 CH-C (-OR) -R 2
- Acid catálisis se requiere para esta reacción. A menudo, Mercury trifluoroacetato de (Hg (OCOCF 3) 2 se utiliza como un catalizador para la reacción, la creación de un éter con Regioquímica Markovnikov. Éteres de tetrahidropiranilo se utilizan como grupos protectores para alcoholes.
Éteres cíclicos que son también conocidos como epóxidos se pueden preparar:
- Por la oxidación de alquenos con una peroxiácido tal como m-CPBA.
- Por la sustitución nuclephilic intramolecular base de una halohidrina.
Reacciones

Éteres en general son de muy baja química reactividad. Las reacciones orgánicas son:
- La hidrólisis.
- Éteres se hidrolizado sólo bajo condiciones drásticas, como la calefacción con tribromuro de boro o de ebullición en ácido bromhídrico. Ácidos minerales inferiores que contienen un halógeno, tales como ácido clorhídrico se unirá éteres, pero muy lentamente. Ácido bromhídrico y ácido yodhídrico son los dos únicos que lo hacen a una velocidad apreciable. Ciertos éteres de arilo pueden ser escindidos por cloruro de aluminio .
- Epóxidos, o éteres cíclicos en ciclos de tres miembros, son altamente susceptibles al ataque nucleófilo y son reactivos de esta manera.
- La formación de peróxido.
- Éteres de primaria y secundaria con un grupo CH junto al oxígeno del éter forman fácilmente altamente explosivo peróxidos orgánicos (por ejemplo, peróxido de éter dietílico) en presencia de oxígeno, la luz, y el metal y impurezas de aldehído. Por esta razón, los éteres como éter dietílico y THF general, se evita como disolventes en los procesos industriales
Éteres importantes
 | Óxido de etileno | El éter cíclico más pequeño. |
| | Dimetil éter | Una aerosol aerosol propulsor. |
| | Éter dietílico | Un disolvente común bajo punto de ebullición (punto de ebullición 34,6 ° C). |
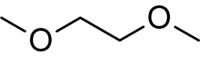 | Dimetoxietano (DME) | Un disolvente de alto punto de ebullición (punto de ebullición 85 ° C): |
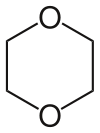 | Dioxano | Un éter cíclico y disolvente de alto punto de ebullición (punto de ebullición 101,1 ° C). |
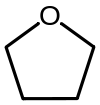 | El tetrahidrofurano (THF) | Un éter cíclico, uno de los éteres simples polares mayoría de los que se utiliza como un disolvente. |
 | Anisol (metoxibenceno) | Un éter de arilo y un constituyente principal de la aceite esencial de semillas de anís. |
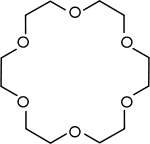 | Los éteres corona | Poliéteres cíclicos que se utilizan como catalizadores de transferencia de fase. |
| | El polietilenglicol (PEG) | Un poliéter lineal, por ejemplo utilizado en cosméticos: |
