
Benceno
Sabías ...
Esta selección Wikipedia está disponible sin conexión de SOS Children para su distribución en el mundo en desarrollo. SOS Children ha cuidado de niños en África durante cuarenta años. ¿Puedes ayudar a su trabajo en África ?
| Benceno | |
|---|---|
 | |
El benceno (o 1,3,5-cyclohexatriene) | |
Otros nombres Benzol | |
| Identificadores | |
| CAS | 71-43-2 |
| Número RTECS | CY1400000 |
| Imágenes-Jmol 3D | Image 1 |
SONRISAS
| |
| Propiedades | |
| Fórmula molecular | C 6 H 6 |
| Masa molar | 78,1121 g / mol |
| Apariencia | Líquido incoloro |
| Densidad | 0,8786 g / cm³, líquidos |
| Punto de fusion | 5,5 ° C (278,6 K) |
| Punto de ebullicion | 80,1 ° C (353,2 K) |
| Solubilidad en agua | 1,79 g / L (25 ° C) |
| Viscosidad | 0,652 cp a 20 ° C |
| Momento bipolar | 0 D |
| Peligros | |
| MSDS | MSDS externa |
| Clasificación de la UE | (F) Carc. Gato. 1 Muta. Gato. 2 Tóxico (T) |
| Frases R | R45, R46, R11, R36 / 38, R48 / 23/24/25, R65 |
| Frases S | S53, S45 |
| NFPA 704 |  4 3 0 |
| Punto de inflamabilidad | -11 ° C |
| Compuestos relacionados | |
| Compuestos relacionados | tolueno borazine |
| Página de datos complementaria | |
| Estructura y propiedades | n, ε r, etc. |
| Termodinámica datos | Comportamiento de fase Sólido, líquido, gas |
| Los datos espectrales | UV, IR, RMN , MS |
| Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
El benceno, o Benzol (véase también Bencina), es un orgánico compuesto químico con la fórmula C 6 H 6. A veces se abrevia Ph-H. El benceno es un incolora y altamente líquido inflamable con un olor dulce y un punto de fusión relativamente alto. Debido a esto, su uso como aditivo en la gasolina ahora es limitada, pero es una importante industrial disolvente y precursor en la producción de medicamentos, plásticos , fibras sintéticas de caucho , y colorantes. El benceno es un componente natural de petróleo crudo , pero por lo general se sintetiza a partir de otros compuestos presentes en el petróleo. El benceno es una hidrocarburo aromático y el segundo [n] - anuleno (-annulene), un hidrocarburo cíclico con un continuo enlace pi.
Historia
Descubrimiento
La palabra "benceno" deriva históricamente de "goma benjuí", a veces llamado "benjamin" (es decir, resina de benjuí), una resina aromática conocida por los farmacéuticos y los perfumistas europeos desde el siglo 15 como un producto del sureste de Asia. "Benjuí" es en sí mismo una corrupción de la expresión árabe "jawi luban" o "incienso de Java." Un material ácido se deriva de benjuí por sublimación, y nombrado "flores de benjuí", o ácido benzoico. El hidrocarburo derivado del ácido benzoico adquirió así el nombre bencina, benzol, o benceno. El benceno ha sido objeto de muchos estudios científicos que van desde Michael Faraday a Linus Pauling . Faraday primero aislado e identificado benceno en 1825 a partir del residuo oleoso derivado de la producción de gas de alumbrado, dándole el nombre bicarburet de hidrógeno. En 1833, Eilhard Mitscherlich produjo a través de la destilación de ácido benzoico (de benjuí encías) y lima. Mitscherlich dio el compuesto del nombre de bencina. En 1836 el químico francés Auguste Laurent nombrada la sustancia "Phene"; esta es la raíz de la palabra de fenol , que es benceno hidroxilado, y fenilo, que es el radical formado por abstracción de un átomo de hidrógeno a partir de benceno.
En 1845, Charles Mansfield, bajo trabajo August Wilhelm von Hofmann, aislado benceno de alquitrán de hulla. Cuatro años más tarde, Mansfield comenzó la primera producción a escala industrial de benceno, basado en el método de alquitrán de hulla.
Poco a poco el sentido desarrollado entre los químicos que las sustancias relacionadas con el benceno forman una familia química natural. En 1855 August Wilhelm Hofmann utilizó la palabra " aromático "para designar esta relación familiar, después de una propiedad característica de muchos de sus miembros.
Fórmula Anillo
La fórmula empírica para el benceno se conocía mucho, pero su gran estructura poliinsaturadas fue difícil de determinar. Archibald Scott Couper en 1858 y Joseph Loschmidt en 1861 sugirió posibles estructuras que contenían múltiples enlaces dobles o múltiples anillos, pero el estudio de los compuestos aromáticos fue en sus primeros años, y muy poca evidencia era entonces disponible para ayudar a los químicos decidir sobre cualquier estructura particular.
En 1865 el químico alemán Friedrich August Kekulé publicó un artículo en francés (por lo entonces enseñaba en la Bélgica francófona) lo que sugiere que la estructura contenía un anillo de seis miembros de átomos de carbono con la alternancia de enlaces simples y dobles. Al año siguiente se publicó un documento mucho más largo en alemán sobre el mismo tema. Kekulé utilizó evidencia de que se había acumulado en los años intermedios, a saber, que siempre parecía ser sólo una isómero de cualquier monoderivative de benceno, y que siempre parecía ser exactamente tres isómeros de cada diderivative-argumentar a favor de su estructura propuesta. Anillo simétrico de Kekulé podría explicar estos curiosos hechos.
La nueva comprensión de benceno, y por lo tanto de todos los compuestos aromáticos, resultó ser tan importante tanto para la química pura y aplicada que en 1890 la Sociedad Química Alemana organizó una apreciación elaborada en honor de Kekulé, celebrando el vigésimo quinto aniversario de su primer documento de benceno . Aquí Kekulé habló de la creación de la teoría. Él dijo que había descubierto la forma de anillo de la molécula de benceno después de tener una ensoñación o día-sueño de una serpiente incautación su propia cola (esto es un símbolo común en muchas culturas antiguas conocidas como la Ouroboros). Esta visión, dijo, llegó a él después de años de estudio de la naturaleza de los enlaces carbono-carbono. Esto fue 20 años después de haber resuelto el problema de cómo los átomos de carbono podrían unir a otros hasta cuatro átomos en el mismo tiempo. Es curioso que una representación humorística similar de benceno había aparecido en 1886 en la Berichte der Durstigen Chemischen Gesellschaft (Revista de la Sociedad Química Sediento), una parodia de la Berichte der Deutschen Gesellschaft Chemischen, sólo la parodia tenía monos apoderándose de unos a otros en un círculo, en lugar de serpientes como en la anécdota de Kekulé. Algunos historiadores han sugerido que la parodia era una sátira de la anécdota serpiente, posiblemente ya conocido a través de la transmisión oral, aunque todavía no había aparecido en la prensa. Otros han especulado que la historia de Kekulé en 1890 fue una re-parodia de la parodia de mono, y era una mera invención en lugar de un recuerdo de un acontecimiento en su vida.
1890 El discurso de Kekulé en que estas anécdotas aparecieron ha sido traducido al Inglés. Si se toma la anécdota como el recuerdo de un hecho real, las circunstancias mencionadas en la historia sugieren que debe haber sucedido a principios de 1862.
La naturaleza cíclica de benceno fue finalmente confirmado por el eminente crystallographer Kathleen Lonsdale.
Estructura
El benceno representa un problema especial, ya que, para dar cuenta de todos los bonos, debe haber alterna dobles enlaces carbono:
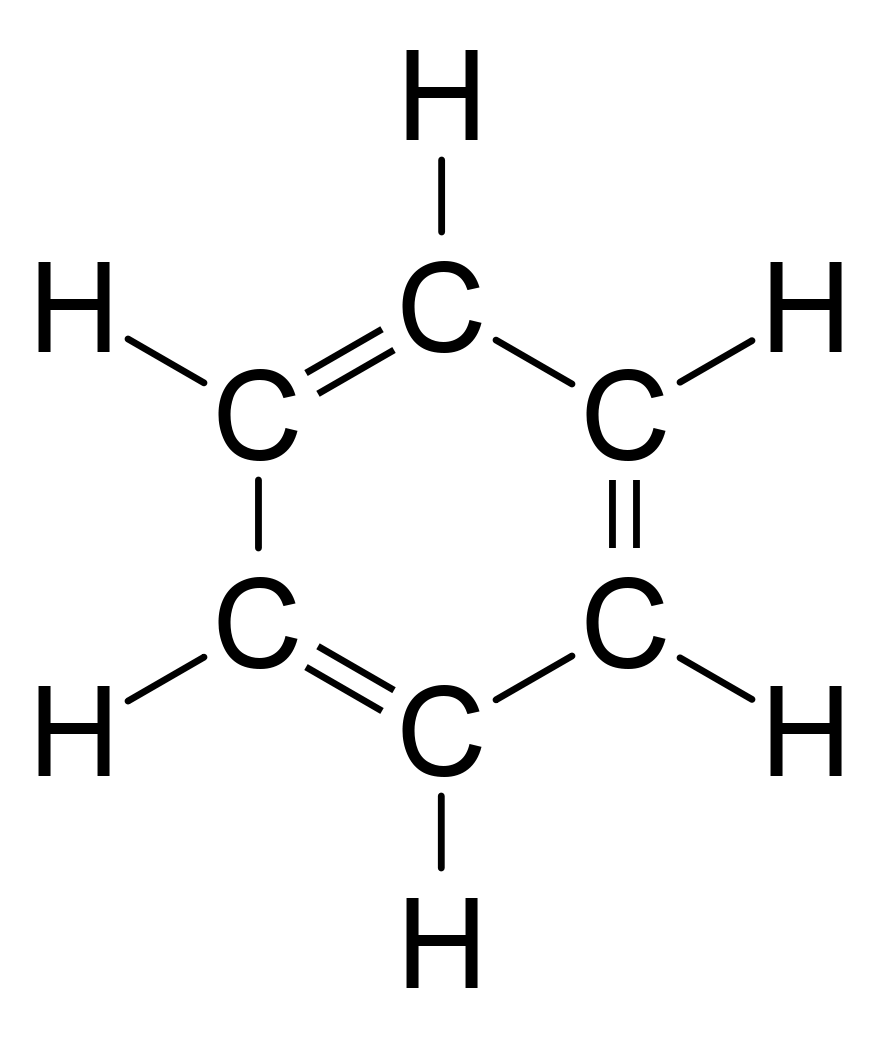
Uso Difracción de rayos X, los investigadores descubrieron que todos los enlaces carbono-carbono en benceno son de la misma longitud de 140 picómetros (pm). El C-C longitudes de enlace son mayores que un doble enlace (135pm), pero más corto que un enlace simple (147pm). Esta distancia intermedia se explica por electrones deslocalización: los electrones para C-C de unión se distribuyen a partes iguales entre cada uno de los seis átomos de carbono. Una representación es que existe la estructura como una superposición de llamada estructuras de resonancia, en lugar de cualquiera de las formas individualmente. Esta deslocalización de los electrones se conoce como aromaticidad, y da benceno gran estabilidad. Esta estabilidad mejorada es la propiedad fundamental de moléculas aromáticas que las diferencia de las moléculas que son no aromático. Para reflejar la naturaleza deslocalizado de la unión, el benceno se representa a menudo con un círculo dentro de una disposición hexagonal de átomos de carbono:

Como es común en la química orgánica, los átomos de carbono en el diagrama anterior se han dejado sin marcar.
El benceno se produce con suficiente frecuencia como un componente de moléculas orgánicas que hay una Símbolo Unicode con el 232C código para representar con tres dobles enlaces, y 23E3 para una versión deslocalizada.
Derivados de benceno sustituidos
Muchos productos químicos importantes se derivan de benceno, en el que con uno o más de los átomos de hidrógeno está reemplazado con otro grupo funcional. Ejemplos de derivados de benceno simples son fenol , tolueno , y anilina, abreviado PhOH, PhMe, y PhNH 2, respectivamente. Vinculación anillos de benceno da bifenilo, C 6 H 5 -C 6 H 5. Además pérdida de hidrógeno da hidrocarburos aromáticos "fusionadas", tales como naftaleno y antraceno. El límite del proceso de fusión es el material libre de hidrógeno grafito.
En heterociclos, átomos de carbono en el anillo de benceno son reemplazados con otros elementos. Los derivados más importantes son los anillos que contienen nitrógeno . Reemplazando un CH con N da el compuesto piridina, C 5 H 5 N. Aunque el benceno y piridina son estructuralmente relacionado, benceno no se puede convertir en piridina. Sustitución de un segundo enlace CH con N da, en función de la ubicación de la segunda N, piridazina, pirimidina, y pirazina.
Producción
Las trazas de benceno puede resultar cada vez carbono ricos en materiales experimentan incompleta combustión. Se produce en los volcanes y los incendios forestales, y es también un componente de humo de cigarro.
Hasta la Segunda Guerra Mundial , la mayoría de benceno se produce como un subproducto de la producción de coque (o "aceite ligero del horno de coque") en el acero de la industria. Sin embargo, en la década de 1950, el aumento de la demanda de benceno, especialmente de la creciente plásticos industria, hecho necesaria la producción de benceno a partir del petróleo. Hoy en día, la mayoría de benceno proviene de la industria petroquímica, con sólo una pequeña fracción que se produce a partir de carbón.
Tres procesos químicos contribuyen por igual a la producción de benceno industrial: reformado catalítico, tolueno hidrodesalquilación, y craqueo a vapor.
El reformado catalítico
En el reformado catalítico, una mezcla de hidrocarburos con puntos de ebullición entre 60-200 ° C se mezcla con hidrógeno gas y luego expuestos a una bifuncional de platino o cloruro de renio cloruro de catalizador a 500-525 ° C y presiones que van desde 8 hasta 50 atm. En estas condiciones, hidrocarburos alifáticos forman anillos y pierden de hidrógeno para convertirse en hidrocarburos aromáticos. Los productos aromáticos de la reacción se separan entonces de la mezcla de reacción (o reformado) por extracción con uno cualquiera de un número de disolventes , incluyendo dietilenglicol o sulfolano, y el benceno se separa de los otros compuestos aromáticos por destilación. La etapa de extracción de compuestos aromáticos del reformado está diseñado para producir compuestos aromáticos con componentes no aromáticos más bajos. La llamada "BTX (benceno-tolueno-xilenos)" proceso consta de tales etapas de extracción y destilación.
De manera similar a este reformado catalítico, UOP y BP comercializado un método de LPG (principalmente de propano y butano) para compuestos aromáticos.
Hidrodesalquilación Tolueno
Hidrodesalquilación tolueno convierte tolueno al benceno. En este proceso intensivo de hidrógeno, tolueno se mezcla con hidrógeno, luego se pasa a través de una de cromo , molibdeno , o de platino catalizador de óxido a 500-600 ° C y 40 a 60 atm de presión. A veces, las temperaturas más altas se utilizan en lugar de un catalizador (en las condiciones de reacción similar). En estas condiciones, el tolueno se somete a la desalquilación de acuerdo con la ecuación química:
- C 6 H 5 CH 3 + H 2 → C 6 H 6 + CH 4
Esta reacción irreversible se acompaña de una reacción secundaria que produce equilibrio bifenilo (aka difenil) a temperatura más alta: 2 C 6 H 6 ↔ H 2 + C 12 H 10
Si la corriente de material crudo contiene tanto componentes no aromáticos (parafinas o naftenos), son propensos a descomponerse hidrocarburos inferiores, como el metano, lo que aumenta el consumo de hidrógeno.
Un rendimiento de la reacción típica superior a 95%. A veces, xilenos y compuestos aromáticos más pesados se utilizan en lugar de tolueno, con una eficacia similar.
Esto es a menudo llamado método de "on-propósito" para producir benceno, en comparación con los procesos convencionales BTX (benceno-tolueno-xileno). El proceso de hidrodesalquilación no es económicamente factible si la diferencia de precio entre el benceno y el tolueno es pequeño (o la diferencia es menor que aproximadamente 15% del precio de benceno).
Desproporcionación de tolueno
Cuando un complejo químico tiene demandas similares tanto para el benceno y el xileno, a continuación, tolueno desproporción (TDP) puede ser una alternativa atractiva a la hidrodesalquilación tolueno. En términos generales 2 moléculas de tolueno y se hacen reaccionar los grupos metilo reordenan de una molécula de tolueno a la otra, produciendo una molécula de benceno y una molécula de xileno.
Dado que la demanda de para-xileno ( p-xileno) excede sustancialmente la demanda de otros isómeros de xileno, se puede utilizar un refinamiento del proceso de TDP llamada selectiva TDP (STDP). En este proceso, la corriente de xileno sale de la unidad TDP es de aproximadamente 90% de paraxileno. En algunos sistemas catalíticos actuales, incluso la relación de benceno-para-xilenos se reduce (más xilenos) cuando la demanda de xilenos es mayor.
Craqueo a vapor
Craqueo con vapor es el proceso para la producción de etileno y otras olefinas a partir de hidrocarburos alifáticos. Dependiendo de la materia prima utilizada para producir las olefinas, craqueo con vapor puede producir un subproducto líquido rica en benceno llamada gasolina de pirólisis. Gasolina de pirólisis puede ser mezclado con otros hidrocarburos como un aditivo de la gasolina, o destilado (en proceso BTX) para separarla en sus componentes, incluyendo benceno.
Usos
Los primeros usos
En los siglos 19 y principios del 20, el benceno se utilizó como una loción para después del afeitado, por su agradable olor. Antes de la década de 1920, el benceno se utiliza con frecuencia como un solvente industrial, especialmente para desengrasar metales. Como su toxicidad se hizo evidente, benceno fue suplantado por otros disolventes, especialmente tolueno (benceno de metilo), que tiene propiedades físicas similares pero no es tan cancerígeno.
En 1903, Ludwig Roselius popularizó el uso de benceno para descafeinar el café. Este descubrimiento llevó a la producción de Sanka (las letras "ka" en el nombre de la marca representan kaffein). Este proceso fue luego suspendido.
Como aditivo de gasolina, benceno aumenta el octanaje y reduce llamar. En consecuencia, la gasolina a menudo contenía varios puntos porcentuales benceno antes de la década de 1950, cuando tetraetilo de plomo reemplazó como aditivo antidetonante más utilizado. Con la eliminación gradual mundial de la gasolina con plomo, benceno ha hecho una reaparición como un aditivo de la gasolina en algunas naciones. En el Estados Unidos , la preocupación por sus efectos negativos para la salud y la posibilidad de entrar en el benceno agua subterránea han llevado a la regulación estricta de contenido de benceno de la gasolina, con límites típicamente alrededor de 1%. Especificaciones europeas gasolina ahora contienen el mismo límite del 1% en el contenido de benceno. Los EE.UU. EPA tiene nuevas regulaciones que reducirán el contenido de benceno en la gasolina a 0,62% en 2011.
Usos actuales de benceno
Hoy benceno se utiliza principalmente como intermedio en la producción de otros productos químicos. Sus derivados más ampliamente producidos incluyen estireno, que se utiliza para hacer polímeros y plásticos, fenol para resinas y adhesivos (a través cumeno), y ciclohexano, que se utiliza en la fabricación de Nylon. Cantidades más pequeñas de benceno se utilizan para hacer algunos tipos de cauchos , lubricantes, colorantes, detergentes, drogas, explosivos, napalm y pesticidas.
En la investigación de laboratorio, tolueno se usa ahora a menudo como un sustituto para el benceno. El disolvente-propiedades de los dos son similares, pero tolueno es menos tóxico y tiene un rango más amplio de líquido.
El benceno se ha utilizado como una herramienta de investigación básica en una variedad de experimentos incluyendo análisis de una gas de dos dimensiones
Reacciones de benceno
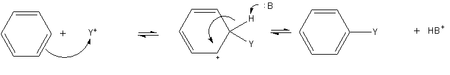
- Sustitución aromática electrófila es un método general de la derivatización de benceno. El benceno es suficientemente nucleófila que se somete a la sustitución por iones acilio o alquilo carbocationes para dar derivados sustituidos.
- La Acilación de Friedel-Crafts es un ejemplo específico de sustitución electrofílica aromática. La reacción implica la acilación de benceno (o muchos otros anillos aromáticos) con una cloruro de acilo usando un fuerte Ácido de Lewis catalizador tal como cloruro de aluminio o cloruro de hierro, que actúan como un portador de halógeno.

- Al igual que la acilación de Friedel-Crafts, la Friedel-Crafts implica la alquilación de benceno (y muchos otros anillos aromáticos) utilizando una haluro de alquilo en presencia de un catalizador ácido de Lewis fuerte.
- sulfonación.
- Nitración: benceno sufre nitración con iones nitronioum (NO 2 +) como electrófilo. Por lo tanto, el calentamiento de benceno a 50-55 grados centígrados, con una combinación de ácido sulfúrico concentrado y ácido nítrico para producir el electrófilo, da nitrobenceno.
- La hidrogenación (reducción): El benceno y derivados se convierten en derivados de ciclohexano y cuando se tratan con hidrógeno a 450 K y 10 atm de presión con un finamente dividido níquel catalizador .
- El benceno es un excelente ligando en el química organometálica de los metales en bajo estado de. Ejemplos importantes incluyen los complejos sándwich y medio sándwich respectivamente Cr (C 6 H 6) 2 y [RuCl 2 (C 6 H 6)] 2.
Efectos en la salud
La exposición al benceno tiene graves efectos en la salud. Respirar altos niveles de benceno puede resultar en la muerte , mientras que los niveles bajos pueden causar somnolencia, mareos, taquicardia, dolores de cabeza , temblores, confusión y pérdida del conocimiento. Comer o beber alimentos que contienen altos niveles de benceno puede causar vómitos, irritación de la estómago, mareos, somnolencia, convulsiones y muerte.
Los principales efectos de benceno son (a largo plazo) la exposición crónica a través de la sangre . Benceno daña los la médula ósea y puede causar una disminución en las células rojas de la sangre, dando lugar a anemia . También puede causar sangrado excesivo y deprimir el sistema inmunológico , aumentando la posibilidad de infección .
Algunas mujeres que respiraron altos niveles de benceno durante varios meses tuvieron irregular períodos menstruales y una disminución en el tamaño de su ovarios. No se sabe si la exposición al benceno afecta a los países en desarrollo feto en mujeres embarazadas o la fertilidad en los hombres.
Los estudios en animales han mostrado bajo peso al nacer, retraso en la formación de hueso, y el daño de la médula ósea cuando los animales preñados respiraron benceno.
La Departamento de Salud y Servicios Humanos (DHHS) de Estados Unidos clasifica al benceno como un ser humano carcinógeno. La exposición prolongada a altos niveles de benceno en el aire puede causar leucemia, una potencialmente fatal del cáncer de los órganos hematopoyéticos. En particular, La leucemia mieloide aguda o leucemia no linfocítica aguda (AML y ANLL) puede ser causada por el benceno.
Varias pruebas pueden determinar la exposición al benceno. Hay una prueba para medir el benceno en el aliento; esta prueba debe realizarse poco después de la exposición. El benceno también puede medirse en la sangre; Sin embargo, como el benceno desaparece rápidamente de la sangre, las mediciones son exactas solamente para exposiciones recientes.
En el cuerpo, el benceno es metabolizada. Algunos metabolitos, tales como trans, ácido -muconic trans se puede medir en el orina. Sin embargo, esta prueba debe realizarse poco después de la exposición y no es un indicador fiable de la exposición al benceno, ya que los mismos metabolitos pueden estar presentes en la orina de otras fuentes.
La Agencia de Protección Ambiental de los Estados Unidos ha establecido el nivel máximo permisible de benceno en el agua potable a 0.005 miligramos por litro (0.005 mg / L). La EPA requiere que derrames o liberaciones accidentales al medio ambiente de 10 libras (4,5 kg) o más de benceno ser notificada a la EPA.
Los EE.UU. Administración de Seguridad y Salud Ocupacional (OSHA) ha establecido un límite de exposición permisible de 0,5 partes de benceno por millón de partes de aire (0.5 ppm) en el trabajo durante una jornada de 8 horas diarias, 40 horas. El límite de exposición a corto plazo para el benceno en el aire es de 5 ppm durante 15 minutos.
En la historia reciente ha habido muchos ejemplos de los efectos nocivos para la salud de benceno y sus derivados. Síndrome del Aceite Tóxico causó localizada inmunosupresión en Madrid en 1981 de personas ingiriendo anilida contaminados aceite de colza. Síndrome de fatiga crónica también ha sido altamente correlacionado con las personas que comen alimentos "desnaturalizada" que utilizan disolventes para eliminar la grasa o contengan ácido benzoico.
Los trabajadores de diversas industrias que manufacturan o usan benceno pueden estar en riesgo de estar expuestos a altos niveles de esta sustancia cancerígena. Las industrias que implican el uso de benceno incluyen el caucho de la industria, las refinerías de petróleo, plantas químicas, fabricantes de calzado, y industrias relacionadas con la gasolina. En 1987, OSHA estima que alrededor de 237.000 trabajadores en los Estados Unidos fueron potencialmente expuestos al benceno, y no se sabe si este número ha cambiado sustancialmente desde entonces.
Agua y la contaminación del suelo son vías importantes de interés para la transmisión de contacto benceno. En los EE.UU. hay aproximadamente 100 mil sitios diferentes que tienen suelo benceno o contaminación del agua subterránea. En 2005, el suministro de agua a la ciudad de Harbin en China, con una población de casi nueve millones de personas, se cortó debido a una hay riesgo de contacto benceno. El benceno se filtró en la Río Songhua, que abastece de agua potable a la ciudad, después de una explosión en una China National Petroleum Corporation (CNPC) fábrica en la ciudad de Jilin en 13 de noviembre.
En marzo de 2006, el funcionario Agencia de Normas Alimentarias en Gran Bretaña llevó a cabo una encuesta de 150 marcas de bebidas no alcohólicas. Se encontró que cuatro contenían niveles de benceno por encima de la Organización Mundial de la Salud límites. Los lotes afectados fueron retirados de la venta. Ver benceno en los refrescos
Oxidación biológica y actividad carcinogénica
Una manera de entender los efectos cancerígenos del benceno es mediante el examen de los productos de la oxidación biológica. Benceno puro, por ejemplo, se oxida en el cuerpo para producir un epóxido, óxido de benceno, que no se excreta fácilmente y puede interactuar con el ADN para producir mutaciones perjudiciales. Sin embargo, un alquilbenceno, tolueno por ejemplo, se somete a oxidación en el cuerpo para producir ácido benzoico. El ácido benzoico se excreta en lugar fácilmente del cuerpo y no interacciona perjudicialmente con el ADN.
Estas diferencias contribuyen en gran medida al hecho de que el benceno es cancerígeno mientras tolueno (en cantidades razonables) no lo es.
