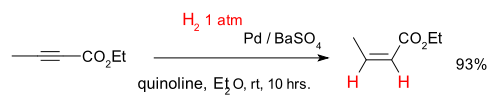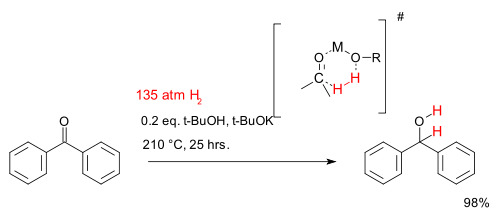La hidrogenación
Sabías ...
Organizar una selección Wikipedia para las escuelas en el mundo en desarrollo sin acceso a Internet era una iniciativa de SOS Children. Ver http://www.soschildren.org/sponsor-a-child para averiguar sobre el apadrinamiento de niños.
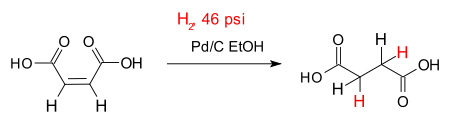
La hidrogenación es una clase de reacciones químicas que dan lugar a una adición de hidrógeno (H 2) por lo general a insaturados compuestos orgánicos . El proceso constituye la adición de hidrógeno átomos a la dobles enlaces de una molécula a través del uso de un catalizador . El hidrógeno también se suma a triples enlaces si están presentes. Sustratos típicos incluyen alquenos , alquinos, cetonas , nitrilos, y iminas. La mayoría de las hidrogenaciones implican la adición directa de hidrógeno diatómico (H 2), pero algunos implican las fuentes alternativas de hidrógeno, no H 2: estos procesos se denominan hidrogenaciones de transferencia. La reacción inversa, la eliminación de hidrógeno, se llama deshidrogenación. Una reacción que implica hidrógeno y la escisión de una enlace carbono-oxígeno o enlace carbono-nitrógeno se llama Hidrogenólisis. La hidrogenación se diferencia de protonación o Además hidruro (por ejemplo, uso de borohidruro de sodio): en la hidrogenación, los productos tienen la misma carga que los reactivos.
El ejemplo clásico de una hidrogenación es la adición de hidrógeno en insaturados enlaces entre carbono átomos , la conversión de alquenos a alcanos . Un ejemplo sencillo es la hidrogenación de ácido maleico, para ácido succínico representado a la derecha. Numerosas aplicaciones importantes se encuentran en el petroquímica, farmacéutica y alimentaria.
Las preocupaciones de salud asociados con la hidrogenación de grasas insaturadas para producir grasas saturadas y Las grasas trans son un aspecto importante de la conciencia del consumidor actual.
Proceso
La hidrogenación tiene tres componentes:
- la sustrato insaturado,
- el hidrógeno (o una fuente de hidrógeno) y, invariablemente,
- un catalizador.
Los usos tecnológicos escala más grande de H 2 son la hidrogenación y reacciones de hidrogenólisis asociados con las industrias de productos químicos, tanto pesados y finos. La hidrogenación es la adición de H 2 a insaturados compuestos orgánicos tales como alquenos para dar alcanos y aldehídos para dar alcoholes . Las reacciones de hidrogenación requieren catalizadores de metal, a menudo aquellos compuestos de platino o similar metales preciosos.
La adición de H 2 a un alk e ne proporciona un alk un ne en el prototipo de la reacción:
- RCH = CH 2 + H 2 → RCH 2 CH 3 (R = alquilo , arilo)
Una característica importante de alqueno y alquino hidrogenaciones tanto homogéneos como heterogéneos es que la adición de hidrógeno se lleva a cabo con Además syn con hidrógeno que entra desde el lado menos impedido.
Catalizadores
Con raras excepciones, no reacción por debajo de 480 ° C se produce entre H 2 y los compuestos orgánicos en ausencia de catalizadores metálicos. El catalizador se une al mismo tiempo tanto el H 2 y el sustrato saturado y facilita su unión. Metales del grupo del platino, especialmente platino , paladio , rodio y rutenio , son catalizadores muy activos. Altamente catalizadores activos operan a temperaturas más bajas y presiones más bajas de H 2. Catalizadores de metales no preciosos, especialmente los basados en níquel (como Níquel Raney y Urushibara níquel) también se han desarrollado como alternativas económicas pero a menudo son más lenta o requerir temperaturas más altas. La compensación es la actividad (velocidad de reacción) vs. coste del catalizador y el coste del aparato requerido para el uso de altas presiones.
Dos grandes familias de catalizadores son conocidos - homogénea y heterogénea. Los catalizadores homogéneos se disuelven en el disolvente que contiene el sustrato insaturado. Los catalizadores heterogéneos son sólidos que se encuentran suspendidas en el mismo disolvente con el sustrato o se tratan con sustrato gaseoso. En la industria farmacéutica y para aplicaciones químicas especiales, soluble " "Homogéneo" "catalizador se emplean a veces, como el rodio basado en compuesto conocido como Catalizador de Wilkinson, o el iridio basado Catalizador de Crabtree.
La actividad y selectividad de los catalizadores pueden ser ajustados cambiando el ambiente alrededor del metal, es decir, el esfera de coordinación. Diferente caras de un catalizador heterogéneo cristalino muestran distintas actividades, por ejemplo. Del mismo modo, los catalizadores heterogéneos se ven afectados por sus soportes, es decir, se une el material sobre el con el catalizador heterogéneo. Los catalizadores homogéneos se ven afectados por su ligandos. En muchos casos, las modificaciones altamente empíricos implican "venenos". Selectivos Por lo tanto, un catalizador cuidadosamente elegido puede ser utilizado para hidrogenar algunos grupos funcionales sin afectar a otros, tales como la hidrogenación de alquenos sin tocar anillos aromáticos, o la hidrogenación selectiva de alquinos a alquenos utilizando Catalizador de Lindlar. Para sustratos proquirales, la selectividad del catalizador se pueden ajustar de tal manera que se produce un producto enantiomérico.
Mecanismo de la reacción
Debido a su relevancia tecnológica, la "activación" catalizada por metales de H 2, ha sido objeto de considerable estudio, centrándose en la mecanismos de reacción de los metales por el cual median estas reacciones. Ante todo el etiquetado de isótopos usando deuterio se puede utilizar para determinar la regioquímica de la adición:
- RCH = CH2 + D 2 → RCHDCH 2 D
Esencialmente, el metal se une a ambos componentes para dar un alqueno de metal intermedio (H) 2 compleja. La secuencia general de reacciones es:
- la unión del hidrógeno para dar un complejo dihidruro ("adición oxidativa"):
- L n M + H 2 → L n MH 2
- unión del alqueno:
- L n M (η 2 H 2) + CH2 = CHR → L n-1 MH 2 (CH2 = CHR) + L
- transferencia de un átomo de hidrógeno del metal al carbono (inserción migratoria)
- L n-1 MH 2 (CH2 = CHR) → L n-1 M (H) (CH 2 -CH 2 R)
- transferencia de la segunda átomo de hidrógeno del metal para el grupo alquilo con de disociación simultánea del alcano ("eliminación reductiva")
- L n-1 M (H) (CH 2 -CH 2 R) → L n-1 M + CH 3 -CH 2 R
Antes de la adición oxidativa de H 2 es la formación de una complejo dihidrógeno.
Temperaturas
La reacción se lleva a cabo a diferentes temperaturas y presiones dependiendo del sustrato. La hidrogenación es un fuertemente reacción exotérmica. En la hidrogenación de aceites vegetales y ácidos grasos, por ejemplo, el calor liberado es de aproximadamente 25 kcal por mol (105 kJ / mol), suficiente para elevar la temperatura del aceite por 1.6 a 1.7 ° C por gota número de yodo.
Alcance
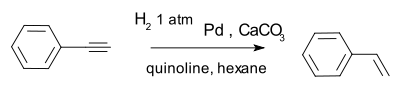
Los alquinos se pueden convertir selectivamente en alquenos en una llamada semihidrogenación, por ejemplo con el compuesto 2-Etil Butynoate y catalizador de paladio sobre sulfato de bario y quinolina (que desactiva el catalizador de la mejora quimioselectividad):
o con 4- (trimetilsilil) -3-butin-1-ol:
- 4- (trimetilsilil) hidrogenación -3-butin-1-ol
La siguiente reacción con carvona es un ejemplo de es decir, la catálisis homogénea Catalizador de Wilkinson:
La hidrogenación es sensible a impedimento estérico explicar la selectividad para la reacción con el doble enlace exocíclico pero no el doble enlace interno.
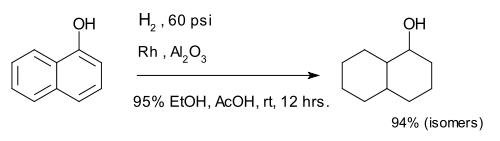
El compuesto 1-naftol está completamente reducido a una mezcla de decalina-ol isómeros.
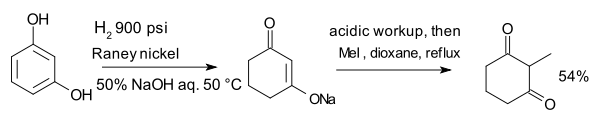
El compuesto resorcinol, hidrogenado con Níquel Raney en presencia de aqeous hidróxido de sodio forma una enolato que se alquila con yoduro de metilo para 2-metil-1,3-ciclohexanodiona:
Un catalizador eficaz es la Catalizador de Lindlar por ejemplo, en la conversión de fenilacetileno a estireno.
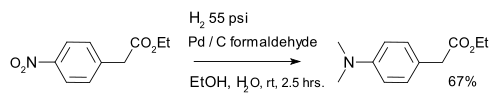
La hidrogenación también se utiliza en reducción orgánica de compuestos nitro, por ejemplo compuestos nitro aromático en combinación con paladio sobre carbono y formaldehído:
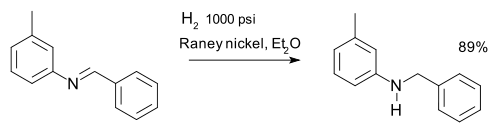
o la reducción de iminas, por ejemplo, en una síntesis de m-tolylbenzylamine:
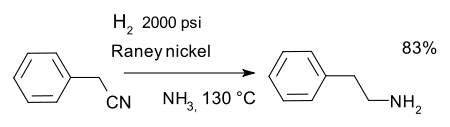
o la reducción de nitrilos por ejemplo, en una síntesis de feniletilamina con Níquel Raney y amoniaco :
En la industria alimentaria
| Tipos de grasas en los alimentos |
|---|
|
| Ver también |
|
La hidrogenación es ampliamente aplicada al tratamiento de aceites vegetales y grasas. Hidrogenación completa convierte insaturados ácidos grasos a los saturados. En la práctica el proceso no se realiza por lo general a la terminación. Dado que los aceites originales por lo general contienen más de una doble enlace por molécula (es decir, son poli-insaturados), el resultado se describe generalmente como aceite vegetal parcialmente hidrogenado; es decir algunos, pero por lo general no todos, de los dobles enlaces en cada molécula se han reducido. Esto se hace mediante la restricción de la cantidad de hidrógeno (o agente reductor) se deja reaccionar con la grasa.
Resultados hidrogenación en la conversión de vegetal líquido aceites de las grasas sólidas o semisólidas, como las que se presentan en margarina. Cambiar el grado de saturación de la grasa cambia algunas propiedades físicas importantes tales como el punto de fusión, por lo que los aceites líquidos se convierten en semi-sólido. Grasas semisólidas se prefieren para la cocción porque la forma en que la grasa se mezcla con harina produce una textura más deseable en el producto horneado. Dado que los aceites vegetales parcialmente hidrogenados son más baratas que las grasas de origen animal, están disponibles en una amplia gama de consistencias, y tienen otras características deseables (por ejemplo, aumento de la estabilidad oxidativa (vida útil más larga)), que son las grasas predominantes utilizados en la mayoría de los productos horneados comerciales . Mezclas de grasas formulados para este propósito son llamados mantecas.
Consecuencias para la salud
Un efecto secundario de hidrogenación que tiene implicaciones incompletas para la salud humana es el isomerización de los enlaces de carbono insaturados restantes. La configuración cis de estos dobles enlaces predomina en las grasas sin procesar en fuentes de grasa más comestibles, pero hidrogenación incompleta convierte parcialmente estas moléculas para isómeros trans, que han sido implicados en las enfermedades circulatorias, incluyendo enfermedades del corazón (ver grasas trans). El proceso de hidrogenación catalítica favorece la conversión de cis a trans bonos porque la configuración trans tiene una energía más baja que la cis natural. En el equilibrio, la relación trans / cis isómero es de aproximadamente 2: 1. La legislación alimentaria en los EE.UU. y códigos de prácticas en la UE ha exigido a largo etiquetas que declaran el contenido de grasa de los alimentos en el comercio al por menor, y más recientemente, también han requerido la declaración del contenido de grasa trans.
En 2006, la ciudad de Nueva York adoptó por primera vez la prohibición municipal importante de los EE.UU. sobre las grasas trans artificiales más en el restaurante de cocina.
Historia
La primera es que la hidrogenación de platino catalizada adición de hidrógeno a oxígeno en el Lámpara de Döbereiner, un dispositivo comercializado ya en 1823. El químico francés Paul Sabatier es considerado el padre del proceso de hidrogenación. En 1897 se descubrió que la introducción de un rastro de níquel como catalizador facilita la adición de hidrógeno a las moléculas de compuestos de carbono gaseoso en lo que hoy se conoce como la Proceso Sabatier. Para este trabajo Sabatier ganó la mitad del 1912 Premio Nobel de Química . Wilhelm Normann fue concedido una patente en Alemania en 1902 y en Gran Bretaña en 1903 para la hidrogenación de aceites líquidos utilizando gas hidrógeno, que fue el comienzo de lo que hoy es un mundo muy grande en toda la industria. La comercialmente muy importante Proceso Haber-Bosch (hidrogenación amoníaco) fue descrito por primera vez en 1905 y en menor medida Fischer-Tropsch (hidrogenación del monóxido de carbono) proceso en 1922. Otra aplicación comercial es el proceso oxo (1938), un acoplamiento de hidrógeno mediada de aldehídos con alquenos. Catalizador de Wilkinson fue el primero catalizador homogéneo desarrollado en los años 1960 y Noyori hidrogenación asimétrica (1987) una de las primeras aplicaciones en las síntesis asimétrica. Un artículo de revisión de 2007 abogó por el uso de más hidrogenaciones en reacciones de acoplamiento CC como el proceso oxo.
Libre de metal de hidrogenación
Aunque a efectos prácticos hidrogenación requiere un catalizador metálico existen algunos sistemas catalíticos libres de metal que son investigados en la investigación académica. Uno de tales sistemas para la reducción de cetonas consiste en terc-butanol y terc-butóxido de potasio y temperaturas muy altas. La reacción se representa a continuación describe la hidrogenación de benzofenona:
La cinética química estudio encontró esta reacción es de primer orden en los tres reactivos que sugiere una cíclico de 6 miembros estado de transición.
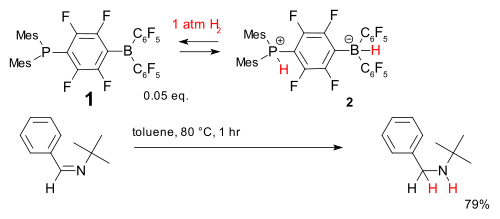
Otro sistema se basa en la phosphine- compuesto de borano (1). Se acepta de forma reversible dihidrógeno a temperaturas relativamente bajas para formar el fosfonio borato de 2 que es capaz de reducir una sencilla obstaculizado yo mismo.