
Iridium
Antecedentes
SOS cree que la educación da una mejor oportunidad en la vida para los niños en el mundo en desarrollo también. patrocinio SOS Niño es cool!
| Iridium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
77 Ir | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
blanco plateado  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | iridio, Ir, 77 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / ɨ r ɪ d yo ə m / i- RID -ee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | metal de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 9, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 192.217 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Xe ] 4f 14 5d 7 6s 2 2, 8, 18, 32, 15, 2 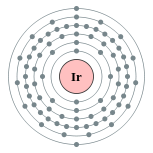 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Smithson Tennant (1803) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Smithson Tennant (1803) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 22,56 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 19 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 2739 K , 2466 ° C, 4471 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 4701 K, 4428 ° C, 8002 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 41.12 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 563 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 25.10 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | -3, -1, 0, 1, 2, 3, 4, 5, 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,20 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 880 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1600 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 136 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 141 ± 18:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | cara cúbica centrada  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 47,1 nΩ · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 147 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | 6,4 m / (m · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 4825 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | 528 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | 210 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 320 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relación de Poisson | 0.26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 6.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 1760 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 1670 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7439-88-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de iridio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Iridium es el elemento químico con número atómico 77, y está representado por el símbolo Ir. Un, frágil, de color blanco plateado muy duro metal de transición de la familia del platino, iridio es el segundo más densa elemento (después de osmio ) y es la más a la corrosión del metal resistentes, incluso a temperaturas de hasta 2.000 ° C. Aunque sólo ciertas sales fundidas y halógenos son corrosivos para iridio sólido, polvo de iridio finamente dividido es mucho más reactivo y puede ser inflamables.
Iridium fue descubierto en 1803 entre las impurezas insolubles naturales platino . Smithson Tennant, el descubridor primario, nombrado el iridio para la diosa Iris, personificación del arco iris, debido a los colores llamativos y diversos de sus sales. Iridium es uno de los elementos más raros del la corteza de la Tierra , con una producción anual y el consumo de sólo tres 191 toneladas. IR y 193 IR son los dos únicos que ocurren naturalmente isótopos de iridio, así como los únicos isótopos estables ; este último es el más abundante de los dos.
Los compuestos de iridio más importantes en el uso de las sales y ácidos que forma con el cloro , aunque iridio también forma un número de compuestos organometálicos utilizados en industrial catálisis , y en la investigación. Metales Iridium se emplea cuando se necesita una alta resistencia a la corrosión a altas temperaturas, como en la gama alta bujías, crisoles para la recristalización de los semiconductores a altas temperaturas, y electrodos para la producción de cloro en el proceso de cloro-álcali. Iridium radioisótopos se utilizan en algunos generadores termoeléctricos de radioisótopos.
Iridium se encuentra en los meteoritos con una abundancia mucho mayor que su abundancia promedio en la corteza terrestre. Por esta razón la inusualmente alta abundancia de iridio en la capa de arcilla en el Límite Cretácico-Paleógeno dio lugar a la Alvarez hipótesis de que el impacto de un objeto extraterrestre masiva causó la la extinción de los dinosaurios y muchas otras especies hace 65 millones de años. Se cree que la cantidad total de iridio en el planeta Tierra es mucho mayor que la observada en las rocas de la corteza terrestre, pero como con otros metales del grupo del platino, la alta densidad y tendencia de iridio para vincularse con hierro causó más de iridio a descender por debajo de la corteza cuando el planeta era joven y todavía fundido.
Características
Propiedades físicas

Un miembro de la del grupo del platino metales , iridio es de color blanco, que se asemeja platino , pero con un ligero tono amarillento. Debido a su dureza, fragilidad, y muy alto punto de fusión , el iridio sólido es difícil de mecanizar, la forma, o el trabajo, y por lo tanto metalurgia de polvos se emplea comúnmente en su lugar. Es el único metal para mantener buenas propiedades mecánicas en el aire a temperaturas superiores a 1600 ° C. Iridium tiene un muy alto punto de ebullición ( 10a entre todos los elementos) y se convierte en un superconductor a temperaturas inferiores a 0,14 K .
De Iridium módulo de elasticidad es la segunda más alta entre los metales, sólo siendo superada por el osmio . Esto, junto con un alto módulo de corte y una cifra muy baja para La relación de Poisson (la relación de longitudinal a lateral cepa), indican el alto grado de la rigidez y resistencia a la deformación que han prestado su fabricación en componentes útiles una cuestión de gran dificultad. A pesar de estas limitaciones y el alto costo de iridio, un número de aplicaciones se han desarrollado en la resistencia mecánica es un factor esencial en algunas de las condiciones extremadamente severas encontradas en la tecnología moderna.
La medida de densidad de iridio es sólo ligeramente inferior (alrededor de 0,12%) que el de osmio , el elemento más denso conocido. No había habido cierta ambigüedad en cuanto a cuál de los dos elementos era más densa, debido al pequeño tamaño de la diferencia en la densidad y la dificultad de medir con precisión, pero, con mayor precisión en los factores utilizados para calcular la densidad de Datos cristalográficas de rayos X produjeron densidades de 22,56 g / cm 3 para iridio y 22,59 g / cm 3 para osmio.
Propiedades químicas
Iridium es el metal más resistente a la corrosión conocido: que no es atacado por casi cualquier ácido , agua regia, metales fundidos o silicatos a altas temperaturas. Se puede, sin embargo, ser atacado por algunos fundidos sales , tales como cianuro de sodio y cianuro de potasio, así como el oxígeno y los halógenos (especialmente flúor ) a temperaturas más altas.
Compuestos
| Estados de oxidación | |
|---|---|
| -3 | [Ir (CO) 3] 3- |
| -1 | [Ir (CO) 3 (PPh3)] - |
| 0 | Ir 4 (CO) 12 |
| 1 | [Ir (CO) Cl (PPh3) 2] |
| 2 | IrCl 2 |
| 3 | IrCl 3 |
| 4 | IrO 2 |
| 5 | Ir 4 F 20 |
| 6 | IRF 6 |
Iridium forma compuestos en estados de oxidación entre -3-6; los estados de oxidación más comunes son 3 y 4. Ejemplos bien caracterizados de el estado de oxidación más alto son raras, pero incluyen IRF 6 y dos óxidos mixtos Sr 2 Mgiro 6 y Sr 2 Cairo 6. Además, se informó en 2009 de que el iridio (VIII) óxido (IRO 4) se preparó bajo condiciones de aislamiento de la matriz (6 K en Ar) por irradiación UV de un complejo de iridio peroxo. Esta especie, sin embargo, no se espera que sea estable como graneles sólidos a temperaturas más altas.
Dióxido de Iridium, IrO 2, un polvo marrón, es el único óxido de bien caracterizado de iridio. La sesquióxido, Ir 2 O 3, ha sido descrito como un polvo de color azul-negro que se oxida a IrO 2 por HNO 3. Los correspondientes disulfuros, diselenuros, sesquisulfuros y sesquiselenides son conocidos y IRS 3 también ha sido reportado. Iridium también forma iridates con estados de oxidación 4 y 5, tales como K 2 IrO 3 y Kiro 3, que se pueden preparar por la reacción de óxido de potasio o superóxido de potasio con iridio a altas temperaturas.
Si bien no binario hidruros de iridio, Ir x H y son conocidas, complejos son conocidos que contienen IRH 4-
5 y IRH 3-
6, donde el iridio tiene las 1 y 3 estados de oxidación, respectivamente. Se cree que el hidruro ternario Mg 6 Ir 2 H 11 para contener tanto el IRH 4-
5 y el 18 electrones IRH 5-
4 anión.
No hay monohaluros o dihalogenuros son conocidos, mientras que trihaluros, IRX 3, son conocidos por todos los halógenos. Para estados de oxidación +4 y por encima de, sólo el tetrafluoruro, pentafluoruro y hexafluoruro son conocidos. Hexafluoruro de Iridium, IRF 6, es un volátil y amarillo altamente reactivo sólido, compuesto de moléculas octaédricos. Se descompone en agua y se reduce a IRF 4, un sólido cristalino, por el negro de iridio. Pentafluoruro de Iridium tiene propiedades similares, pero en realidad es una tetrámero, Ir 4 F 20, formado por cuatro octaedros esquina compartir.
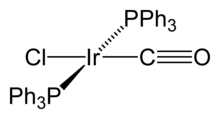
Hexachloroiridic (IV), ácido H 2 IrCl 6, y su sal de amonio son los compuestos de iridio más importantes desde el punto de vista industrial. Están involucrados en la purificación de iridio y se utilizan como precursores para la mayoría de otros compuestos de iridio, así como en la preparación de recubrimientos de ánodo. El IrCl 2-
6 ion tiene un intenso color marrón oscuro, y se puede reducir fácilmente a la de color más claro IrCl 3-
6 y viceversa. Tricloruro de iridio, IrCl 3, que se puede obtener en forma anhidra de la oxidación directa de polvo de iridio por cloro a 650 ° C, o en forma hidratada disolviendo Ir 2 O 3 en ácido clorhídrico , a menudo se utiliza como material de partida para la síntesis de otros compuestos Ir (III). Otro compuesto usado como material de partida es hexachloroiridate de amonio (III), (NH 4) 3 IrCl 6. Complejos de iridio (III) son diamagnéticos ( de bajo spin) y generalmente tienen una geometría molecular octaédrica.
Compuestos Organoiridium contienen iridio carbono bonos donde el metal es por lo general en los estados de oxidación más bajos. Por ejemplo, el estado de oxidación cero se encuentra en dodecacarbonilo tetrairidium, Ir 4 (CO) 12, que es el binario más común y estable carbonilo de iridio. En este compuesto, cada uno de los átomos de iridio está unido a los otros tres, formando un grupo tetraédrica. Algunos compuestos organometálicos Ir (I) son lo suficientemente notable para ser el nombre de sus descubridores. Uno es Complejo de Vaska, IrCl (CO) [P (C 6 H 5) 3] 2, que tiene la propiedad inusual de la unión a la molécula de dioxígeno , O 2. Otra es Catalizador de Crabtree, una catalizador homogéneo para la hidrogenación reacciones. Estos compuestos son tanto cuadrada plana, d 8 complejos, con un total de 16 electrones de valencia, lo que explica su reactividad.
Isótopos
Iridium tiene dos naturales y estables isótopos , 191 Ir y 193 IR, con abundancias naturales de 37,3% y 62,7%, respectivamente. Al menos 34 radioisótopos también se han sintetizado, que van en número de masa 164 a 199. 192 Ir, que cae entre los dos isótopos estables, es el radioisótopo más estable, con una vida media de 73,827 días, y encuentra aplicación en braquiterapia y en industrial radiografía, en particular para los ensayos no destructivos de las soldaduras de acero en las industrias de petróleo y gas; fuentes de iridio-192 han participado en una serie de accidentes radiológicos. Otros tres isótopos tienen una vida media de al menos un día-188 Ir, Ir 189, 190 Ir. Isótopos con masas por debajo de 191 se desintegran por alguna combinación de β + decadencia, decaimiento α, y emisión de protones, con las excepciones de 189 Ir, que decae por captura de electrones, y 190 Ir, que decae por emisión de positrones. Sintético isótopos más pesados que 191 se desintegran por β - decaimiento, aunque 192 Ir también tiene un menor captura de electrones camino decadencia. Todos los isótopos conocidos de iridio fueron descubiertos entre 1934 y 2001; el más reciente es 171 Ir.
Al menos 32 isómeros metaestables se han caracterizado, que varían en número de masa de 164 a 197. El más estable de estos es 192m2 Ir, que decae por transición isomérica con una vida media de 241 años, por lo que es más estable que cualquiera de los isótopos sintéticos de iridio en sus estados fundamentales. El isómero menos estable es 190m3 Ir con una vida media de sólo 2 mS. El isótopo 191 Ir fue el primero de cualquier elemento que se muestra para presentar una Efecto Mössbauer. Esto hace que sea útil para Espectroscopia Mössbauer para la investigación en la física, la química, la bioquímica, la metalurgia y mineralogía.
Historia

El descubrimiento de iridio se entrelaza con la de platino y otros metales del grupo del platino. Platino nativo utilizado por los antiguos etíopes y por las culturas de América del Sur siempre contenía una pequeña cantidad de los otros metales del grupo del platino, incluyendo iridio. Platinum llegó a Europa como platina ("pequeño plata"), que se encuentra en el siglo 17 por los conquistadores españoles en una región hoy conocida como la departamento del Chocó en Colombia . El descubrimiento de que este metal no era una aleación de elementos conocidos, pero en su lugar un nuevo elemento distinto, no se produjo hasta 1748.
Los químicos que estudiaron platino disuelven en aqua regia (una mezcla de clorhídrico y ácido nítrico ) para crear sales solubles. Siempre observaron una pequeña cantidad de un residuo oscuro, insoluble. Joseph Louis Proust pensaba que el residuo era grafito. Los químicos franceses Victor Collet-Descotils, Antoine-François de Fourcroy, y Louis Nicolas Vauquelin también observó el residuo negro en 1803, pero no obtuvo suficiente para experimentos adicionales.
En 1803, el científico británico Smithson Tennant (1761-1815) analizó el residuo insoluble y se llegó a la conclusión de que debe contener un nuevo metal. Vauquelin tratado el polvo alternativamente con alcalinos y ácidos y obtuvo un nuevo óxido volátil, que él cree que es de este nuevo metal que llamó ptene, de la palabra griega πτηνός ptēnós, "alas". Tennant, que tenía la ventaja de una mayor cantidad de residuos, continuó su investigación e identificó a los dos elementos anteriormente desconocidos en el residuo negro, iridio y osmio. Se obtuvieron cristales de color rojo oscuro (probablemente de Na 2 [IrCl 6] · n H 2 O) por una secuencia de reacciones con hidróxido de sodio y ácido clorhídrico . Nombró iridio después Iris (Ἶρις), la alada diosa griega del arco iris y el mensajero de los dioses olímpicos, porque muchas de las sales que obtuvo fueron fuertemente coloreados. El descubrimiento de los nuevos elementos se documentó en una carta a la Royal Society el 21 de junio 1804.
Científico británico John George Children fue el primero en fundir una muestra de iridio en 1813 con la ayuda de "la mayor batería galvánica que jamás se haya construido" (en ese momento). El primero en obtener una alta pureza fue iridio Robert Hare en 1842. Él encontró que tenía una densidad de alrededor de 21,8 g / cm 3 y señaló que el metal es casi unmalleable y muy duro. El primero de fusión en cantidad apreciable hecho por Henri Sainte-Claire Deville y Jules Henri Debray en 1860. Ellos requieren la quema de más de 300 litros de O2 puro y H 2 por cada kilogramo de iridio.
Estas dificultades extremas para fundir el metal limitan las posibilidades de manejo de iridio. John Isaac Hawkins estaba buscando para obtener una multa y punto difícil para plumillas fuente y en 1834 logró crear una pluma de oro-iridio puntiagudo. En 1880 John Holland y William Dudley Lofland fueron capaces de derretir iridio mediante la adición de fósforo y patentaron el proceso en los Estados Unidos; Empresa británica Johnson Matthey indicó más adelante que habían estado usando un proceso similar desde 1837 y ya habían presentado iridio fundido en una serie de Exposiciones universales. El primer uso de una aleación de iridio con rutenio en termopares fue hecha por Otto Feussner en 1933. Estos permitido para la medición de altas temperaturas en el aire hasta 2000 ° C.
En 1957 Rudolf Mössbauer, en lo que ha sido llamado uno de los "experimentos de la señal en la física del siglo XX", descubrió el resonante y emisión y absorción de retroceso libre- rayos gamma por átomos en una muestra de metal sólido que contiene sólo 191 de IR. Este fenómeno, conocido como el Efecto Mössbauer (que ya se ha observado en otros núcleos, como 57 Fe), y se desarrolló como Espectroscopia Mössbauer, ha hecho importantes contribuciones a la investigación en la física, la química, la bioquímica, la metalurgia y mineralogía. Mössbauer recibido el Premio Nobel de Física en 1961, a la edad de 32 años, sólo tres años después publicó su descubrimiento.
Aparición

Iridium es una de las elementos abundantes en menos de la Tierra corteza , que tienen una fracción de la masa media de 0.001 ppm en la corteza terrestre; el oro es 40 veces más abundante, el platino es 10 veces más abundante, y la plata y el mercurio . son 80 veces más abundante telurio es casi tan abundante como el iridio, y sólo tres de origen natural elementos estables son menos abundantes: renio , rutenio y rodio , iridio siendo 10 veces más abundantes que los dos últimos. En contraste con su escasa abundancia en la corteza terrestre, el iridio es relativamente común en meteoritos, con concentraciones de 0.5 ppm o más. Se cree que la concentración global de iridio en la Tierra es mucho mayor que lo que se observa en la corteza terrestre, pero a causa de la densidad y siderophilic ("hierro amante") carácter de iridio, descendió por debajo de la corteza y en el Núcleo de la Tierra cuando el planeta todavía estaba fundida.
Iridium se encuentra en la naturaleza como un elemento sin combinar o naturales aleaciones; especialmente las aleaciones de iridio-osmio, osmiridio (osmio rico), y iridiosmium (iridio ricos). En las de níquel y de cobre depósitos de los metales del grupo del platino se producen como sulfuros (es decir, (Pt, Pd) S), telururos (es decir PtBiTe), antimoniuros (PDSB), y arseniuros (es decir ptas 2). En todos estos compuestos de platino se intercambia por una pequeña cantidad de iridio y osmio. Como con todos los metales del grupo del platino, el iridio se puede encontrar naturalmente en aleaciones con níquel en bruto o cobre en bruto.
Dentro de la corteza terrestre, el iridio se encuentra en concentraciones más altas en tres tipos de estructura geológica: depósitos ígneas (intrusiones de la corteza desde abajo), los cráteres de impacto, y los depósitos vuelto a trabajar de una de las antiguas estructuras. Las mayores reservas primarias conocidas están en el Bushveld complejo ígneo en Sudáfrica , a pesar de los grandes yacimientos de cobre-níquel cerca Norilsk, en Rusia , y el Cuenca de Sudbury en Canadá también son importantes fuentes de iridio. Reservas más pequeñas se encuentran en los Estados Unidos. Iridium también se encuentra en depósitos secundarios, combinado con platino y otros metales del grupo del platino en depósitos aluviales. Los depósitos aluviales utilizados por pueblos precolombinos en la Departamento del Chocó Colombia siguen siendo una fuente de metales del grupo del platino. A partir de 2003 no se habían estimado las reservas mundiales.
Cretácico-Paleógeno presencia límite

La Cretácico-Paleógeno de hace 65 millones de años, que marca la frontera temporal entre el Cretácico y Periodos Paleógeno de tiempo geológico , fue identificado por una delgada estrato de iridio-rica arcilla. Un equipo dirigido por Luis Alvarez propuso en 1980 un origen extraterrestre para este iridio, atribuyéndolo a un asteroide o cometa impacto. Su teoría, conocida como la Alvarez hipótesis, es ahora ampliamente aceptada para explicar la desaparición de los dinosaurios . Una gran estructura cráter de impacto enterrado con una edad estimada de unos 65 millones de años más tarde fue identificado bajo lo que hoy es el Península de Yucatán (el Cráter de Chicxulub). Dewey M. McLean y otros argumentan que el iridio puede haber sido de origen volcánico origen en cambio, como la Tierra núcleo 's es rico en iridio y volcanes activos, tales como Piton de la Fournaise, en la isla de Reunión, siguen lanzando iridio.
Producción
| Año | Consumo (toneladas) | Precio ( $ / ozt) |
|---|---|---|
| 2001 | 2.6 | 415.25 |
| 2002 | 2.5 | 294.62 |
| 2003 | 3.3 | 93.02 |
| 2004 | 3.60 | 185.33 |
| 2005 | 3.86 | 169.51 |
| 2006 | 4.08 | 349.45 |
| 2007 | 3.70 | 444.43 |
| 2008 | 3.10 | 448.34 |
| 2009 | 2.52 | 420.4 |
| 2010 | 10.40 | 642.15 |
Iridium se obtiene comercialmente como un subproducto del níquel y cobre de minería y procesamiento. Durante electrolítico de cobre y níquel, metales nobles tales como plata, oro y los metales del grupo del platino, así como el selenio y el teluro se depositan en el fondo de la celda de ánodo como el barro, que forma el punto de partida para su extracción. Para separar los metales, que primero deben ser llevados a la solución. Varios métodos están disponibles dependiendo del proceso de separación y la composición de la mezcla; dos métodos representativos son la fusión con peróxido de sodio seguido por disolución en agua regia, y la disolución en una mezcla de cloro con ácido clorhídrico .
Después de que se disuelve, iridio se separa de los otros metales del grupo del platino por precipitación de (NH 4) 2 IrCl 6 o mediante la extracción de IrCl 2-
6 con aminas orgánicas. El primer método es similar al procedimiento Tennant y Wollaston utilizan para su separación. El segundo método se puede planificar como continua Por lo tanto, la extracción líquido-líquido y es más adecuado para la producción a escala industrial. En cualquier caso, el producto se reduce utilizando hidrógeno, dando el metal como un polvo o una esponja que puede ser tratada usando técnicas de metalurgia de polvos.
El precio de iridio fluctúa considerablemente, como se muestra en la tabla, debido a la inestabilidad de la oferta, la demanda, la especulación y el acaparamiento, amplificada por el pequeño tamaño del mercado y la inestabilidad en los países productores. La fuerte disminución de alrededor de 2003 se ha relacionado con el exceso de oferta de crisoles Ir utilizados para el crecimiento industrial de grandes monocristales.
Aplicaciones
La demanda de iridio aumentó de 2,5 toneladas en 2009 a 10,4 toneladas en 2010, sobre todo debido a las aplicaciones relacionadas con la electrónica que han visto un aumento de 0,2 a 6 toneladas - crisoles de iridio son comúnmente utilizados para el cultivo de grandes monocristales de alta calidad, la demanda para que ha aumentado considerablemente. Este aumento en el consumo de iridio se predice para saturar debido a la acumulación de existencias de crisoles, como ocurrió anteriormente en la década de 2000. Otras aplicaciones principales incluyen bujías que consumieron 0,78 toneladas de Ir en 2007, electrodos para la proceso de cloro-álcali (1,1 t en 2007) y catalizadores químicos (0,75 t en 2007).
Industrial y médica
La resistencia de alto punto de fusión, la dureza y la corrosión de iridio y sus aleaciones determinar la mayoría de sus aplicaciones. Iridium y especialmente de iridio-aleaciones de platino o aleaciones de osmio-iridio tienen un bajo desgaste y se utilizan, por ejemplo, para multi-poros hileras, a través del cual una masa fundida de polímero plástico se extruye para formar fibras, tales como rayón. Osmio e iridio se utiliza para rodamientos y de los saldos de la brújula.
La corrosión y la resistencia al calor hace iridio agente de aleación importante. Ciertas partes de motores de aeronaves de larga duración están hechas de una aleación de iridio y un iridio de titanio aleación se utilizan para tuberías de aguas profundas, debido a su resistencia a la corrosión. Iridium también se utiliza como un agente de endurecimiento en aleaciones de platino. La Vickers dureza de platino puro es de 56 HV mientras que el platino con un 50% de iridio puede alcanzar más de 500 HV.
Los dispositivos que deben soportar temperaturas extremadamente altas a menudo se hacen de iridio. Por ejemplo, alta temperatura crisoles hechos de iridio se utilizan en el Proceso de Czochralski para producir monocristales óxido (tales como zafiros) para su uso en dispositivos de memoria de ordenador y en láseres de estado sólido. Los cristales, tales como gadolinio granate de galio e itrio de galio granate, se cultivan por la fusión de los cargos pre-sinterizadas de óxidos mixtos bajo condiciones oxidantes a temperaturas de hasta 2.100 ° C. Su resistencia a la erosión de arco hace que las aleaciones de iridio ideal para contactos eléctricos para bujías.
Compuestos de iridio se utilizan como catalizadores en la Proceso de Cativá para carbonilación de metanol para producir ácido acético .
El radioisótopo iridio-192 es una de las dos fuentes más importantes de energía para su uso en industrial γ-radiografía de ensayos no destructivos de los metales . Además, Ir 192 se utiliza como una fuente de la radiación gamma para el tratamiento de cáncer usando braquiterapia, una forma de radioterapia en la que se coloca una fuente radiactiva sellada dentro o junto a la zona que requiere tratamiento. Tratamientos específicos incluyen la braquiterapia de alta dosis de próstata tasa, la braquiterapia conducto biliar, y la braquiterapia intracavitaria cuello uterino.
Científico

Una aleación de 90% de platino y 10% de iridio se usó en 1889 para construir el Prototipo Internacional Metro y kilogramo de masa, mantenido por el Oficina Internacional de Pesas y Medidas, cerca de París . La barra de metro fue sustituido como la definición de la unidad fundamental de longitud en 1960 por una línea en la espectro atómico de criptón , pero el prototipo kilogramo sigue siendo el estándar internacional de la masa.
Iridium se ha utilizado en el generadores termoeléctricos de radioisótopos de naves no tripuladas, como la Voyager, Vikingo, Pioneer, Cassini , Galileo, y Nuevos Horizontes. Iridium fue elegido para encapsular el plutonio-238 de combustible en el generador, ya que puede soportar las temperaturas de funcionamiento de hasta 2.000 ° C y por su gran fuerza.
Otra óptica de rayos X de uso preocupaciones, especialmente telescopios de rayos-X. Los espejos de la Observatorio de rayos X Chandra están recubiertos con una capa de iridio 60 nm de espesor. Iridium demostró ser la mejor opción para que refleja los rayos X después de níquel, oro, y platino también se probaron. La capa de iridio, que tuvo que ser lisa para dentro de unos pocos átomos, se aplicó mediante el depósito de vapor de iridio bajo alto vacío sobre una capa de base de cromo .
Iridium se utiliza en la física de partículas para la producción de antiprotones, una forma de antimateria. Antiprotones son hechas por disparar un haz de protones de alta intensidad a un objetivo de conversión, que necesita ser hecho de un material de muy alta densidad. Aunque de tungsteno se pueden utilizar en lugar, el iridio tiene la ventaja de una mejor estabilidad bajo la ondas de choque inducidas por el aumento de temperatura debido a la del haz incidente.
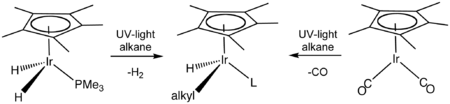
Activación del enlace carbono-hidrógeno (activación C-H) es un área de investigación sobre las reacciones que escinden enlaces carbono-hidrógeno, que tradicionalmente se consideraban no reactivo. El primer informe de éxitos en la activación de enlaces CH en hidrocarburos saturados , publicados en 1982, utilizaron complejos organometálicos de iridio que se someten a un Además oxidativo con el hidrocarburo.
Complejos de iridio están siendo investigados como catalizadores para hidrogenación asimétrica. Estos catalizadores se han utilizado en la síntesis de productos naturales y capaces de hidrogenar ciertos sustratos difíciles, tales como alquenos no funcionalizados, enantioselectiva (generando sólo una de las dos posibles enantiómeros).
Iridium forma una variedad de complejos de interés fundamental en la recolección triplete.
Histórico

Aleaciones Iridium-osmio se utilizaron para inclinar plumillas fuente. El primer uso importante de iridio fue en 1834 en puntas montadas en oro. Desde 1944, el famoso Parker 51 estilográfica fue equipado con una punta con punta por un rutenio y de aleación de iridio (con 3,8% de iridio). El material de la punta de las plumas modernas todavía se llama convencionalmente "iridio", aunque rara vez existe iridio en ella; otros metales como el tungsteno han tomado su lugar.
Una aleación de iridio-platino se utilizó para la toca agujeros o ventilar piezas de cañón. De acuerdo con un informe de la Exposición de París de 1867, una de las piezas que se exhiben por Johnson Matthey y "se ha utilizado en un arma Withworth por más de 3.000 rondas, y apenas muestra signos de desgaste aún. Los que conocen el problema constante y gastos que son ocasionados por el desgaste de los respiraderos cañones cuando en servicio activo , apreciarán esta importante adaptación ".
El negro de iridio pigmento, que consiste en iridio muy finamente dividido, se utiliza para la pintura porcelana un intenso negro; se dijo que "todos los demás colores negro porcelana aparecen en gris por el lado de la misma".
Precauciones
Iridium en forma metálica a granel no es biológicamente importantes o peligrosos para la salud debido a su falta de reactividad con tejidos; sólo hay alrededor de 20 partes por trillón de iridio en el tejido humano. Sin embargo, el polvo de iridio finamente dividido puede ser peligroso de manejar, ya que es un irritante y puede inflamarse en el aire. Se sabe muy poco acerca de la toxicidad de los compuestos de iridio porque se utilizan en cantidades muy pequeñas, pero las sales solubles, tales como los haluros de iridio, podría ser peligroso debido a los elementos distintos de iridio o debido a iridio en sí. Sin embargo, la mayoría de los compuestos de iridio son insolubles, lo que hace que la absorción en el cuerpo difícil.
Un radioisótopo de iridio, 192 Ir, es peligroso como otros isótopos radiactivos. Las únicas lesiones reportadas relacionadas con iridio exposición accidental preocupación a la radiación de 192 Ir utilizado en braquiterapia. De alta energía de la radiación gamma de 192 Ir puede aumentar el riesgo de cáncer. La exposición externa puede causar quemaduras, envenenamiento por radiación, y la muerte. La ingestión de 192 Ir puede quemar los revestimientos del estómago y los intestinos. 192 Ir, Ir 192m y 194m Ir tienden a depositar en el hígado, y pueden plantear riesgos para la salud, tanto de gamma y radiación beta.
