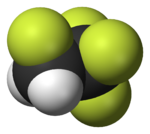
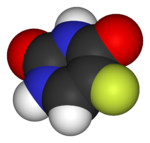
Fl??or
Sab??as ...
SOS Children hizo esta selecci??n Wikipedia junto a otros recursos de escuelas . Una buena manera de ayudar a otros ni??os es mediante el patrocinio de un ni??o
| Fl??or | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
9 F | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||
| gas: amarillo muy p??lido l??quido: amarillo brillante s??lido: transparente (beta), opaco (alfa)  Fl??or l??quido a temperaturas criog??nicas | ||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||
| Nombre, s??mbolo, n??mero | fl??or, F, 9 | |||||||||||||||||||||||||||
| Pronunciaci??n | / F l ʊər yo n /, / F l ʊər ɪ n /, / F l ɔər yo n / | |||||||||||||||||||||||||||
| Categor??a Elemento | hal??geno | |||||||||||||||||||||||||||
| Grupo, per??odo, bloque | 17 (hal??genos) , 2, p | |||||||||||||||||||||||||||
| Peso at??mico est??ndar | 18.9984032 (5) | |||||||||||||||||||||||||||
| Configuraci??n electr??nica | [??l] 2s 2 2p 5 2, 7 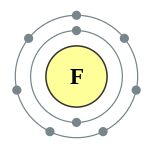 | |||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||
| Descubrimiento | Andr??-Marie Amp??re (1810) | |||||||||||||||||||||||||||
| Primer aislamiento | Henri Moissan (26 de junio 1886) | |||||||||||||||||||||||||||
| Nombrado por | Humphry Davy | |||||||||||||||||||||||||||
| Propiedades f??sicas | ||||||||||||||||||||||||||||
| Fase | gas | |||||||||||||||||||||||||||
| Densidad | (0 ?? C, 101,325 kPa) 1,696 g / L | |||||||||||||||||||||||||||
| L??quido densidad en pb | 1,505 g ?? cm -3 | |||||||||||||||||||||||||||
| Punto de fusion | 53.53 K , -219.62 ?? C, -363.32 ?? F | |||||||||||||||||||||||||||
| Punto de ebullicion | 85.03 K, -188.12 ?? C, -306.62 ?? F | |||||||||||||||||||||||||||
| Punto cr??tico | 144,4 K, 5.215 MPa | |||||||||||||||||||||||||||
| El calor de vaporizaci??n | 6.51 kJ ?? mol -1 | |||||||||||||||||||||||||||
| Capacidad calor??fica molar | (C p) (21,1 ?? C) 825 J ?? mol -1 ?? K -1 (C v) (21.1 ?? C) 610 J ?? mol -1 ?? K -1 | |||||||||||||||||||||||||||
| Presi??n del vapor | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Propiedades at??micas | ||||||||||||||||||||||||||||
| Estados de oxidaci??n | -1 (Oxida ox??geno) | |||||||||||||||||||||||||||
| Electronegatividad | 3,98 (escala de Pauling) | |||||||||||||||||||||||||||
| Energ??as de ionizaci??n ( m??s) | Primero: 1.681 kJ ?? mol -1 | |||||||||||||||||||||||||||
| Segundo: 3374 kJ ?? mol -1 | ||||||||||||||||||||||||||||
| Tercero: 6147 kJ ?? mol -1 | ||||||||||||||||||||||||||||
| Radio covalente | 64 pm | |||||||||||||||||||||||||||
| Van der Waals radio | 135 pm | |||||||||||||||||||||||||||
| Miscel??nea | ||||||||||||||||||||||||||||
| Estructura cristalina | c??bico 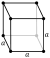 la estructura se refiere a fl??or s??lido, justo debajo del punto de fusi??n, 1 atm | |||||||||||||||||||||||||||
| Ordenamiento magn??tico | diamagn??tico | |||||||||||||||||||||||||||
| Conductividad t??rmica | 0.02591 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||
| N??mero de registro del CAS | 7782-41-4 | |||||||||||||||||||||||||||
| La mayor??a de los is??topos estables | ||||||||||||||||||||||||||||
| Art??culo principal: Los is??topos de fl??or | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Fl??or (s??mbolo F) es el elemento qu??mico con n??mero at??mico 9. Es el m??s ligero hal??geno . En presi??n y temperatura est??ndar, el fl??or es un gas de color amarillo p??lido compuesta de mol??culas diat??micas, F 2. El fl??or es el m??s elemento electronegativo y es extremadamente reactivo, lo que requiere un gran cuidado en la manipulaci??n. Tiene una sola estable is??topo , fl??or-19.
En las estrellas, fl??or es raro en comparaci??n con otros elementos ligeros. En la corteza terrestre, el fl??or es el elemento m??s abundante XIII. Mineral m??s importante de fl??or, fluorita, se describi?? por primera vez oficialmente en 1530, en el contexto de fundici??n. El nombre del mineral se deriva del verbo latino fluo, que significa "flujo", porque fluorita esta en minerales met??licos a bajar sus puntos de fusi??n. Sugerido como un elemento qu??mico en 1811, fl??or fue nombrado despu??s de que el mineral fuente, pero se resisti?? a muchos intentos de aislar el elemento. En 1886, el qu??mico franc??s Henri Moissan lo consigui??. Su m??todo de electr??lisis sigue siendo el m??todo de producci??n industrial de gas fl??or. El uso principal de fl??or elemental, el enriquecimiento de uranio, fue desarrollado durante el Proyecto Manhattan.
Debido a la dificultad en la fabricaci??n de fl??or elemental, la mayor parte de fl??or utilizado en el comercio nunca se convierte en libre de fl??or. En lugar de ello, ??cido fluorh??drico es la clave intermedio para los $ 16 mil millones al a??o la industria qu??mico fluorado global. La fluoruros de metales cargados bajos son compuestos i??nicos (sales); las de los metales cargados altos son vol??tiles compuestos moleculares . Los mayores usos de fluoruros inorg??nicos son la fabricaci??n de acero y refinaci??n de aluminio.
Compuestos de fl??or org??nicos tienden a tener alta estabilidad qu??mica y t??rmica. El uso comercial m??s grande est?? en gases refrigerantes (los muchos tipos de "freones"). Aunque tradicional clorofluorocarbonos son ampliamente prohibidos, los gases de reemplazo todav??a contienen fl??or. Politetrafluoroetileno (Teflon) es el m??s importante fluoropol??mero y se utiliza en el aislamiento el??ctrico, piezas resistentes a productos qu??micos, techos de estadios, y utensilios de cocina. Una fracci??n cada vez mayor de productos farmac??uticos modernos contienen fl??or; Lipitor y Prozac son ejemplos destacados. Mientras que algunas plantas y bacterias sintetizan venenos organofluorados, fl??or no tiene ning??n papel metab??lico en los mam??feros. El ion fluoruro, cuando se aplica directamente a los dientes, reduce la caries y por esta raz??n se utiliza en pasta de dientes y municipal la fluoraci??n del agua.
Caracter??sticas
Propiedades f??sicas
Formas de fl??or mol??culas diat??micas en estado gaseoso a temperatura ambiente. La densidad es de aproximadamente 1,3 veces la del aire. Aunque a veces citado como amarillo-verde, gas fl??or es en realidad un amarillo muy p??lido. Su color s??lo se puede observar en gas fl??or concentrado cuando mirando hacia abajo el eje de tubos largos. Parece transparente cuando se observa desde el lado en tubos de vidrio normales o si se le permite escapar a la atm??sfera. El elemento tiene un "picante" olor caracter??stico que es notable en concentraciones tan bajas como 20 ppb.
El fl??or se condensa en un l??quido de color amarillo brillante a -188 ?? C (-307 ?? F), cerca de las temperaturas de condensaci??n de ox??geno y nitr??geno. El fl??or se solidifica a -220 ?? C (-363 ?? F) en una estructura c??bica, llamado beta-fl??or. Esta fase es transparente y suave, con el trastorno significativo de las mol??culas. En -228 ?? C (-378 ?? F) fl??or se somete a un s??lido-s??lido transici??n de fase en una estructura monocl??nica llamada alfa-fl??or. Esta fase es opaco y duro con capas apretadas de mol??culas. El cambio de fase de estado s??lido requiere m??s energ??a que la transici??n del punto de fusi??n y puede ser violento, rompiendo las muestras y que desaparezcan las ventanas portamuestras. En general, de estado s??lido de fl??or es m??s similar al ox??geno de que a los otros hal??genos.
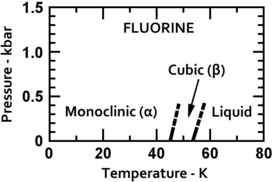 |  |
| Fases de fl??or de baja temperatura | Estructura cristalina alfa-fl??or |
Estructura atomica
Un ??tomo de fl??or tiene nueve protones y nueve electrones , uno menos que el ne??n , dispuestos en el configuraci??n electr??nica [??l] 2s 2 2p 5. Electrones exteriores de fl??or son relativamente separados uno de otro, y por lo tanto no protegen entre s?? desde el n??cleo. Por lo tanto, experimentan un alto carga nuclear efectiva. El fl??or tiene una relativamente peque??a radio covalente, un poco menos de 60 pic??metros, que es inferior a su vecinos, ox??geno y ne??n.
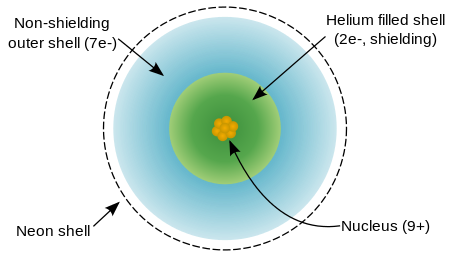
El fl??or es reacio a ionizar y en su lugar tiene un atractivo para un electr??n m??s para lograr el acuerdo de ne??n como extremadamente estable. Fl??or de primero energ??a de ionizaci??n (energ??a requerida para quitar un electr??n para formar F +) es 1681 kilojulios por mol, que es superior a la de cualquier otro elemento, excepto ne??n y helio. Fl??or de afinidad electr??nica (energ??a liberada por la adici??n de un electr??n para formar F -) es de 328 kilojulios por mol, que es mayor que la de cualquier otro elemento, excepto cloro.
Estructura molecular
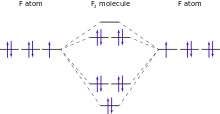
Aunque un ??tomo de fl??or individuo tiene un electr??n no apareado, en fl??or molecular se emparejado todos los electrones. Debido a esto, fl??or elemental es diamagn??ticos (ligeramente repelidos por los imanes). En contraste, las mol??culas de ox??geno elemento vecino, con dos electrones desapareados por mol??cula, son paramagn??tico (atra??dos por los imanes). El valor medido de de fl??or susceptibilidad magn??tica es -9,6 ?? 10 -6 (CGS), que est?? cerca de las predicciones te??ricas. El resultado experimental no se llev?? a cabo hasta 1999 debido a las dificultades en el manejo de gas de fl??or, as?? como la necesidad de purificar especialmente el fl??or de cualquier rastro de ox??geno paramagn??tico.
El v??nculo fl??or fl??or de la mol??cula difluorine es relativamente d??bil en comparaci??n con el v??nculo de los otros hal??genos. La energ??a de enlace es significativamente m??s d??bil que las de dicloro o dibromuro mol??culas y similares a los bonos de ox??geno-ox??geno f??cilmente escindidos de per??xidos o bonos de nitr??geno-nitr??geno de hidrazinas. El radio covalente de fl??or en mol??culas difluorine, alrededor de 71 pic??metros, es significativamente mayor que en otros compuestos, debido a la uni??n d??bil entre ??tomos de fl??or. Esto sucede porque el electr??n y repulsiones internuclear son relativamente grandes, y el solapamiento orbital de uni??n se redujo debido al peque??o tama??o de los ??tomos.
2p electrones de fl??or son puramente 2p, y la mol??cula difluorine tiene exactamente un enlace (un orden de enlace de exactamente 1). En contraste, los niveles de electrones p Los hal??genos m??s pesados 'se hibridan en parte con los de los electrones d. Esto hace que se comporten en parte como electrones d, y este personaje d parcial permite mostrar la vinculaci??n parcial entre electrones d. Por lo tanto, los hal??genos m??s pesados tienen una orden de enlace con eficacia mayor que 1; por ejemplo, el cloro tiene un orden de enlace de 1,12. Electrones de fl??or no pueden mostrar este car??cter d porque no hay electrones d cercanos en energ??a para 2p del fl??or.
| X | X 2 | HX | BX 3 | AlX3 | CX 4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| YO | 151 | 294 | 272 | 285 | 239 |
Reactividad qu??mica
La qu??mica del fl??or est?? dominada por su tendencia a aumentar de un electr??n. Es el m??s elemento electronegativo y un oxidante fuerte. La eliminaci??n de un electr??n de un ??tomo de fl??or requiere tanta energ??a que no oxidante conocido puede oxidar fl??or a cualquier positivo estado de oxidaci??n .
Reacciones con fl??or son a menudo repentina o explosivo. Muchas sustancias generalmente no reactivos tales como el acero en polvo, fragmentos de vidrio y fibras de amianto se consumen f??cilmente por fl??or gaseoso fr??o. Madera e incluso el agua arden con llamas cuando se somete a un chorro de fl??or, sin la necesidad de una chispa.
El fl??or reacciona con cesio, video por la Royal Institution. (Ambos videos filmados en un laboratorio de fl??or de la Universidad de Leicester.) |
Forma compuestos de fl??or, fluoruros, con todos los elementos excepto ne??n y helio . Todos los elementos hasta einsteinium , elemento 99, se han comprobado a excepci??n de astato y francio . El fl??or tambi??n se conoce para formar compuestos con rutherfordium , elemento 104, y seaborgium , elemento 106. Varios elementos radiactivos pesados no han sido fluorada debido a su extrema rareza, pero tales reacciones son te??ricamente posible.
Todos los metales reaccionan con fl??or, pero las condiciones var??an con el metal. A menudo, el metal debe ser en polvo debido a que muchos metales pasivar (formar capas protectoras del fluoruro de metal que resisten m??s fluoraci??n). Los metales alcalinos reaccionan con fl??or con una explosi??n (peque??a explosi??n), mientras que los metales de tierras alcalinas reaccionan a temperatura ambiente, as??, pero no tan agresivamente. La metales nobles rutenio, rodio, paladio, platino, y oro reaccionan menos f??cilmente, requiriendo fl??or gaseoso puro a 300-450 ?? C (575-850 ?? F).
El fl??or reacciona explosivamente con hidr??geno de una manera similar a la de los metales alcalinos. Los hal??genos reaccionan f??cilmente con el gas fl??or al igual que el gas noble pesado rad??n . Los gases nobles m??s ligeros xen??n y cript??n se pueden hacer reaccionar con fl??or bajo condiciones especiales y arg??n se combinar?? con fluoruro de hidr??geno. El nitr??geno, con su muy estable triples enlaces, requiere descarga el??ctrica y las altas temperaturas de combinar directamente con fl??or.
Is??topos
El fl??or se produce naturalmente en la Tierra exclusivamente en la forma de su ??nico estable is??topo , fl??or-19, lo cual hace que el elemento monoisot??pico y mononuclidic. Diecisiete radiois??topos han sido sintetizados: n??meros de masa 14-18 y 20-31. Fl??or-18 es el radiois??topo m??s estable de fl??or, con una vida media de 109,77 minutos. Tambi??n es el m??s ligero nucleido inestable con igualdad de n??mero impar de protones y neutrones .
Los is??topos de fl??or m??s ligeros, los que tienen n??meros de masa de 14 a 16, a trav??s de la descomposici??n captura de electrones. 17 F y 18 F se someten decaimiento m??s beta (emisi??n de positrones). Todos los is??topos m??s pesados que el fl??or-19 estable se desintegran por modo de menos beta (emisi??n de electrones). Algunos de ellos tambi??n se desintegran por emisi??n de neutrones.
S??lo uno is??mero nuclear (estado nuclear excitado vivido largo), fl??or-18m, se ha caracterizado. Su vida media antes emisi??n de rayos gamma es 160 nanosegundos. Esto es menos que la vida media de descomposici??n de cualquiera de los radiois??topos de fl??or estados fundamentales nuclear excepto los n??meros 14-16, 28, y 31.
Origen y presencia
En el universo
| At??mico n??mero | Elemento | Relativo cantidad |
|---|---|---|
| 6 | Carbono | 4800 |
| 7 | Nitr??geno | 1500 |
| 8 | Ox??geno | 8800 |
| 9 | Fl??or | 1 |
| 10 | Ne??n | 1400 |
| 11 | Sodio | 24 |
| 12 | Magnesio | 430 |
Desde la perspectiva de la cosmolog??a, el fl??or es relativamente poco frecuente, con 400 ppb en el universo. Dentro de estrellas, cualquier fl??or que es creado se elimina r??pidamente a trav??s de la fusi??n nuclear: o bien con hidr??geno para formar ox??geno y helio, o con helio para hacer ne??n e hidr??geno. La presencia de fl??or en absoluto fuera de la existencia temporal de estrellas-es algo de un misterio debido a la necesidad de escapar de estas reacciones fl??or destruir.
Existen tres soluciones te??ricas al misterio. En tipo II supernovas, los ??tomos de ne??n son golpeados por neutrinos durante la explosi??n y se convirtieron al fl??or. En Estrellas Wolf-Rayet (estrellas azules sobre 40 veces m??s pesada que el Sol), un fuerte viento solar sopla el fl??or de la estrella antes de hidr??geno o helio puede destruirlo. En rama gigante asint??tica (un tipo de gigante roja) estrellas, las reacciones de fusi??n se producen en pulsos y convecci??n levanta fl??or de la estrella interior. S??lo la hip??tesis de gigante roja se evidencia de apoyo de las observaciones.
En el espacio, fl??or combina com??nmente con hidr??geno para formar fluoruro de hidr??geno. (Este compuesto se ha sugerido como un proxy para permitir el seguimiento de los dep??sitos de hidr??geno en el universo.) Adem??s de HF, fl??or monoat??mico se ha observado en el medio interestelar. Fl??or cationes se han visto en las nebulosas planetarias y en las estrellas, incluyendo nuestro Sol
En La Tierra
El fl??or es el elemento m??s com??n decimotercero en la corteza terrestre, que comprende entre 600 y 700 ppm de la corteza en masa. Debido a su reactividad, que, esencialmente, s??lo se encuentra en los compuestos. Tres minerales existir que son fuentes de inter??s industrial: fluorita, fluorapatita, y criolita.
- Fluorita (CaF2), tambi??n llamada espato fl??or o Blue John, es la principal fuente de fl??or comercial. La fluorita es un mineral de colores asociado a los yacimientos hidrotermales. Es com??n y se encuentra en todo el mundo. China suministra m??s de la mitad de la demanda mundial; M??xico es el segundo mayor productor. Los Estados Unidos producen m??s de fluorita del mundo en el siglo 20, pero la ??ltima mina, en Illinois, cerr?? en 1995.
- Fluorapatito (Ca 5 (PO 4) 3 F) se extrae junto con otros apatitas para su contenido de fosfato y se utiliza sobre todo para la producci??n de fertilizantes. La mayor??a de fl??or de la Tierra est?? obligado en este mineral, pero debido a que el porcentaje en el mineral es baja (3,5%), el fl??or se desecha como residuo. S??lo en Estados Unidos hay una recuperaci??n significativa. All??, el hexafluorosilicatos producidos como subproductos se utilizan para suministrar la fluoraci??n del agua municipal.
- La criolita (Na 3 AlF 6) es el menos abundante de los tres, pero es una fuente concentrada de fl??or. Antes fue utilizado directamente en la producci??n de aluminio. Sin embargo, la principal mina comercial, en la costa oeste de Groenlandia, se cerr?? en 1987.
| Los principales minerales que contienen fl??or | ||
 |  |  |
| Fluorita | Fluorapatito | Criolita |
Varios otros minerales, como la piedra preciosa topacio, contiene fluoruro. El fl??or no es significativo en agua de mar o salmuera, a diferencia de la otra haluros, porque los fluoruros alcalinot??rreos precipitan fuera del agua.
Organofluorines se han observado en las erupciones volc??nicas y en manantiales geot??rmicos. Su origen ??ltimo se dice que variar de formaci??n f??sica en condiciones geol??gicas rubricar la producci??n biol??gica y la deposici??n de sedimentos. Sin embargo, todav??a se est?? estudiando la procedencia, como es la distribuci??n organofluorine natural. Ellos no se encuentran en quantites grandes (comparar tambi??n el n??mero de organofluorines naturales conocidos, 30, a la de los organoclorados, 2150), por lo que no son comercialmente importante fuente de fl??or.
La posibilidad de que peque??as cantidades de fl??or gaseoso dentro de cristales se ha debatido durante muchos a??os. Una forma de fluorita, antozonite, tiene un olor sugestivo de fl??or cuando se aplastan. El mineral tambi??n tiene un color negro oscuro, tal vez de calcio libre (no unida a fluoruro). En 2012, un estudio inform?? de la detecci??n de cantidades traza (0,04% en peso) de fl??or diat??mico en antozonite. Se sugiri?? que la radiaci??n de peque??as cantidades de uranio dentro de los cristales hab??an causado el fl??or defectos.
Historia

La palabra "fl??or" deriva de la ra??z latina del mineral principal fuente, fluorita, que fue mencionado por primera vez en 1529 por Georgius Agricola, que lo describi?? como un de flujo de un aditivo que ayuda a los minerales y escorias de fusi??n durante la fundici??n. Piedras de fluorita fueron llamados Fl??sse schone en el alem??n de la ??poca. Agricola, escribiendo en lat??n, sino que describe la industria del siglo 16, invent?? varios cientos de nuevos t??rminos en lat??n. Para las piedras Fl??sse schone, utiliz?? los FLUORESCENTE sustantivo latino, "flujos", porque hab??an hecho minerales met??licos fluyen cuando en un incendio. Despu??s Agricola, el nombre del mineral evolucion?? a fluorita (todav??a se utiliza com??nmente) y luego a la fluorita.
Algunas fuentes afirman que la primera producci??n de ??cido fluorh??drico era por Heinrich Schwanhard, un cortador de vidrio alem??n, en 1670. Un estudio de revisi??n inter pares de los escritos de Schwanhard, sin embargo, no mostr?? ninguna menci??n espec??fica de discusi??n fluorita y s??lo de un ??cido muy fuerte. Es la hip??tesis de que se trataba probablemente de ??cido n??trico o agua regia, ambos capaces de grabado de vidrio suave. Andreas Segismundo Marggraf hizo la primera preparaci??n grabado de ??cido fluorh??drico en 1764 cuando se calienta de fluorita con ??cido sulf??rico en el vidrio, que fue corro??do en gran medida por el producto. En 1771, el qu??mico sueco Carl Wilhelm Scheele repiti?? esta reacci??n. Scheele reconoci?? el producto de la reacci??n como un ??cido, que ??l llam?? "fluss-polainas-Syran" (fluor-espato-??cido); en Ingl??s, que era conocido como "??cido fluorh??drico". En 1810, el f??sico franc??s Andr??-Marie Amp??re sugiri?? que el ??cido era un compuesto de hidr??geno con un elemento desconocido, an??logo al cloro. Fluorita se muestra a continuaci??n, que se compone en su mayor??a de fluoruro de calcio.
Sir Humphry Davy sugiri?? originalmente el nombre de fl??or, tomando la ra??z del nombre de "??cido fluorh??drico" y el sufijo ine, de manera similar a otros hal??genos. Este nombre, con modificaciones, lleg?? a la mayor??a de los idiomas europeos. (Griego, ruso y otros idiomas usan el nombre ftor o derivados, que fue sugerida por Amp??re y viene del griego (φθόριος phthorios), que significa "destructor".) El nombre de Nueva Am??rica (fluorum) dio el elemento de su s??mbolo actual , F, aunque el s??mbolo Fl se ve en los primeros trabajos. El s??mbolo Fl ahora se utiliza para la elemento s??per pesado flerovium .
Debido a su extrema reactividad, fl??or elemental no fue aislado hasta muchos a??os despu??s de la caracterizaci??n de la fluorita. El progreso en el aislamiento de fl??or elemental fue lento debido a que su electrol??tica preparaci??n fue dif??cil de realizar y porque el gas reacciona con la mayor??a de los materiales. La generaci??n de fl??or elemental demostr?? ser excepcionalmente peligrosa, matando o cegadora varios experimentadores tempranos. Jean Dussaud refiri?? a estos hombres como "m??rtires de fl??or", un t??rmino todav??a se utiliza.
Edmond Fr??my pensaba que el paso de corriente el??ctrica a trav??s de ??cido fluorh??drico pura podr??a funcionar. Anteriormente, fluoruro de hidr??geno s??lo estaba disponible en una soluci??n de agua. Por lo tanto, Fr??my ide?? un m??todo para producir fluoruro de hidr??geno seco por acidificaci??n bifluoruro de potasio (KHF 2). Desafortunadamente, el fluoruro de hidr??geno puro no pas?? una corriente el??ctrica.

Qu??mico franc??s Henri Moissan, anteriormente uno de los estudiantes de Fremy, continu?? la b??squeda. Despu??s de probar muchos enfoques diferentes, construy?? en el intento anterior de Fr??my combinando bifluoruro de potasio y fluoruro de hidr??geno. La soluci??n resultante llev?? a cabo la electricidad. Moissan tambi??n construy?? equipo especialmente resistente a la corrosi??n: recipientes hechos de una mezcla de platino y el iridio (qu??micamente m??s resistente que el platino puro) con tapones de fluorita. Despu??s de 74 a??os de esfuerzo de muchos qu??micos, el 26 de junio de 1886, Moissan inform?? el aislamiento de fl??or elemental. El informe de Moissan de la Academia Francesa de hacer fl??or mostr?? su agradecimiento por la haza??a:
Uno puede de hecho hacer varias hip??tesis sobre la naturaleza del gas liberado; el m??s simple ser??a que estamos en presencia de fl??or
Moissan ide?? m??s tarde un aparato menos costoso para la toma de fl??or: Equipo de cobre recubierto con fluoruro de cobre. En 1906, dos meses antes de su muerte, Moissan recibi?? el Premio Nobel de Qu??mica por su aislamiento de fl??or, as?? como la invenci??n de la horno de arco el??ctrico.
Durante los a??os 1930 y 1940, los Empresa DuPont comercializa compuestos org??nicos de fl??or a grandes escalas. Despu??s de los ensayos de los clorofluorocarbonos como refrigerantes por investigadores General Motors, DuPont desarroll?? la producci??n a gran escala de Fre??n-12. DuPont y GM formaron una empresa conjunta en 1930 para comercializar el nuevo producto; en 1949 DuPont hizo cargo del negocio. Fre??n result?? ser un ??xito mercado, r??pidamente reemplazando antes, m??s t??xico, refrigerantes y el crecimiento del mercado global de los frigor??ficos de la cocina.
En 1938, el politetrafluoroetileno (tefl??n) fue descubierto por accidente por un PhD DuPont recientemente contratado, Roy J. Plunkett. Mientras trabajaba con un cilindro de tetrafluoroetileno, no fue capaz de liberar el gas, aunque el peso no hab??a cambiado. Raspando el recipiente, se encontr?? con escamas blancas de un pol??mero nuevo en el mundo. Las pruebas mostraron que la sustancia era resistente a la corrosi??n de la mayor??a de sustancias y ten??a mejor estabilidad a alta temperatura que cualquier otro pl??stico. A principios de 1941, un programa de choque estaba haciendo cantidades comerciales.

Producciones a gran escala de fl??or elemental comenzaron durante la Segunda Guerra Mundial. Alemania utiliza la electr??lisis de alta temperatura para producir toneladas de trifluoruro de cloro, un compuesto previsto para ser utilizado como un incendiario. La Proyecto Manhattan en los Estados Unidos produce a??n m??s fl??or para su uso en separaci??n de uranio. Gaseoso hexafluoruro de uranio se utiliza para separar de uranio-235, un importante nuclear explosivo, desde el m??s pesado de uranio-238 en centrifugadoras y plantas de difusi??n. Debido a que el hexafluoruro de uranio libera peque??as cantidades de fl??or corrosivo, las plantas de separaci??n fueron construidas con materiales especiales. Todos los tubos se recubrieron con n??quel; articulaciones y partes flexibles se fabrican a partir de tefl??n.
En 1958, un gerente de investigaci??n de DuPont en el negocio de tefl??n, Bill Gore, dej?? la compa????a debido a su unwillingess desarrollar tefl??n como aislamiento de cables de recubrimiento. El hijo de Gore Robert encontr?? un m??todo para resolver el problema de alambre de recubrimiento y la empresa WL Gore y Asociados naci??. En 1969, Robert Gore desarroll?? una membrana de PTFE expandido que condujo a la gran Negocio de Gore-tex en ropa impermeable transpirable. La compa????a ha desarrollado muchos otros usos de PTFE.
En los a??os 1970 y 1980, las preocupaciones desarrollaron sobre el papel clorofluorocarbonos juegan en da??ar la capa de ozono. Para 1996, casi todas las naciones hab??an prohibido refrigerantes clorofluorocarbonos y la producci??n comercial cesado. Fl??or sigui?? desempe??ando un papel en la refrigeraci??n sin embargo: hidroclorofluorocarbonos (HCFC) y hidrofluorocarbonos (HFC) se han desarrollado como refrigerantes de reemplazo.
Industria y aplicaciones
El mercado mundial de productos qu??micos fluorados era alrededor de $ 16 mil millones por a??o a partir de 2006. Hist??ricamente, la industria ha crecido un peque??o tanto por ciento por a??o y se prev?? hacerlo en el futuro. Aunque la demanda fluoroqu??mica contrajo durante el 2008-2009 recesi??n global, la industria se prev?? llegar a 2,6 millones de toneladas por a??o en 2015.
El mayor mercado es Estados Unidos. Europa Occidental es la segunda m??s grande. Asia Pac??fico es la regi??n de mayor crecimiento de la producci??n. En particular, China ha experimentado un importante crecimiento como mercado fluoroqu??mica y se est?? convirtiendo en un productor de ellos tambi??n.
Miner??a Fluorita (la principal fuente de fl??or) se estim?? en 2003 a ser una industria de $ 550 millones, la extracci??n de 4,5 millones de toneladas por a??o. La mayor??a de los minerales deben ser procesadas para concentrar la fluorita de otros minerales por varios m??todos de separaci??n por flotaci??n. Sin embargo, s??lo alrededor del 1% de la fluorita se extrae nunca se convirti?? al fl??or elemental.

Fluoruros inorg??nicos
Fluorita extra??do se separa en dos grados principales, con aproximadamente igual producci??n de cada Acidspar es al menos 97% CaF 2;. Metspar es la pureza mucho menor, 60-85%. (Se realiza tambi??n una peque??a cantidad de la sustancia intermedia, de cer??mica, de grado.)
Metspar se utiliza casi exclusivamente para la fundici??n de hierro. Acidspar es principalmente convierte en ??cido fluorh??drico (por reacci??n con ??cido sulf??rico). El HF resultante se utiliza sobre todo para producir organofluoruros y criolita sint??tica.
Acerca de 3 kg (6,5 libras) de fluorita de grado metspar, a??adidos directamente al lote, se utilizan por cada tonelada de acero fabricado. Los iones de fluoruro de CaF2 menor temperatura de la masa fundida y viscosidad (hacer el runnier l??quido). El contenido de calcio tiene un beneficio tangencial en la eliminaci??n de azufre y f??sforo, pero otros aditivos tales como cal siguen siendo necesarias. Metspar se utiliza de manera similar en la producci??n de hierro fundido y de otras aleaciones que contienen hierro.
Fluorita de grado acidspar se utiliza directamente como un aditivo a la cer??mica y esmaltes, fibras de vidrio y el vidrio empa??ado, y el cemento, as?? como en el revestimiento exterior de las barras de soldadura. Acidspar se utiliza principalmente para la fabricaci??n de ??cido fluorh??drico, que es una qu??mico intermedio para la mayor??a de los compuestos que contienen fl??or. Usos directos significativos de HF incluyen decapado (limpieza) de acero, craqueo de alcanos en la industria petroqu??mica, y el grabado de vidrio.
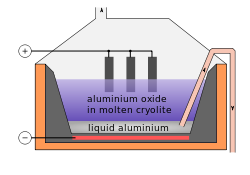
Un tercio de HF (sexto de fl??or extra??do) se utiliza para hacer criolita sint??tica ( hexafluoroaluminato de sodio) y trifluoruro de aluminio. Estos compuestos se usan en la electr??lisis de aluminio. Se necesitan alrededor de 23 kg (51 libras) por cada tonelada de aluminio. Estos compuestos se utilizan tambi??n como un flujo de vidrio.
Fluorosilicatos son los pr??ximos fluoruros inorg??nicos m??s significativos formados a partir de HF. El m??s com??n, el de sodio, se utiliza para la fluoraci??n del agua, como un intermedio para la criolita sint??tica y tetrafluoruro de silicio, y para el tratamiento de efluentes en lavander??as.
MgF 2 y, en menor medida, otros Difluoruros alcalinot??rreos son materiales ??pticos especiales. Difluoruro de magnesio se utiliza ampliamente como una revestimiento antirreflectante para gafas y equipos ??pticos. El compuesto es tambi??n un componente en las construcciones de nueva ideados ( metamateriales de ??ndice negativos) que son objeto de la investigaci??n "invisibilidad". Las estructuras en capas puede curvar la luz alrededor de los objetos.
Otros fluoruros inorg??nicos hechas en grandes cantidades incluyen difluoruro de cobalto (para la s??ntesis organofluorine), n??quel difluoruro (electr??nica), fluoruro de litio (un flujo), fluoruro de sodio (la fluoraci??n del agua), fluoruro de potasio (flujo), y fluoruro de amonio (varios). Sodio y potasio bifluoruros son significativos para la industria qu??mica.
Los fluorocarbonos
Haciendo fluoruros org??nicos es el principal uso de ??cido fluorh??drico, consumiendo m??s del 40% de la misma (m??s del 20% de toda la fluorita minada). Dentro de organofluoruros, gases refrigerantes siguen siendo el segmento dominante, consumiendo aproximadamente el 80% de HF. A pesar de que los clorofluorocarbonos son ampliamente prohibidos, los refrigerantes de sustituci??n son a menudo otras mol??culas fluorados. Fluoropol??meros est??n a menos de un cuarto del tama??o de gases refrigerantes en t??rminos de uso de fl??or, pero est??n creciendo m??s r??pido. Fluorados son un peque??o segmento de la masa pero son significativos econ??micamente debido a los precios muy altos.
Los gases refrigerantes
Tradicionalmente, los clorofluorocarbonos (CFC) fueron los predominantes qu??mico org??nico fluorado. CFC se identifican por un sistema de numeraci??n que explica la cantidad de fl??or, cloro, carbono e hidr??geno en las mol??culas. El t??rmino fre??n se ha utilizado coloquialmente para los CFC y mol??culas halogenados similares, aunque estrictamente hablando, esto es s??lo un nombre de marca DuPont, y existen muchos otros productores. Terminolog??a neutral Marca es utilizar "R" como prefijo. CFC prominentes incluyeron R-11 ( triclorofluorometano), R-12 ( diclorodifluorometano), y R-114 ( 1,2-diclorotetrafluoroetano).

La producci??n de CFC creci?? con fuerza a trav??s de la d??cada de 1980, principalmente para la refrigeraci??n y el aire acondicionado, pero tambi??n para propelentes y solventes. Dado que el uso final de estos materiales est?? prohibido en la mayor??a de los pa??ses, esta industria se ha reducido dr??sticamente. A principios del siglo 21, la producci??n de CFC fue de menos de 10% del pico de mediados de 1980, con el resto de uso principalmente como un intermedio para otros productos qu??micos. La prohibici??n de CFC inicialmente deprimido la demanda global de producci??n de fluorita pero 21o siglo de la fuente mineral se ha recuperado a los niveles de 1980.
Los hidroclorofluorocarbonos (HCFC) y los hidrofluorocarbonos (HFC) sirven ahora como sustitutos de los refrigerantes CFC; pocos fueron fabricados comercialmente antes de 1990. En la actualidad m??s del 90% de fl??or utilizado para org??nicos entra en estas dos clases (en cantidades aproximadamente iguales). HCFC prominentes incluyen R-22 ( clorodifluorometano) y R-141b ( 1,1-dicloro-1-fluoroetano). El HFC principal es el R-134a ( 1,1,1,2-tetrafluoroetano).
Un bromofluoroalkane "Halon" ( bromotrifluorometano) est?? siendo ampliamente utilizado en los buques y aeronaves sistemas de extinci??n de incendios gaseosos. Debido a que la producci??n de Halon est?? prohibida desde 1994, los sistemas dependen de las tiendas anteriores a la prohibici??n y el reciclaje.
Fluoropol??meros
Los fluoropol??meros son menos de 0.1% de todos los pol??meros producidos en t??rminos de peso. Ellos son m??s caros y tienen tasas de crecimiento m??s altas que el promedio pol??meros. A partir de aproximadamente 2006-2007, las estimaciones de la producci??n mundial de fluoropol??mero variaban de m??s de 100.000 a 180.000 toneladas m??tricas por a??o. Las estimaciones de ingresos anuales oscilaron entre m??s de 2,5 mil millones a m??s de $ 3,5 mil millones.
PTFE (politetrafluoroetileno) es del 60-80% de la producci??n de fluoropol??mero del mundo en una base de peso. El t??rmino de tefl??n se utiliza a veces de forma gen??rica para la sustancia, pero existen es una marca DuPont productores de PTFE nombre-s?? y DuPont veces usa la marca Teflon para otros materiales. PTFE obtiene su fl??or sin la necesidad de gas de fl??or: cloroformo (triclorometano) se trata con HF para hacer clorodifluorometano (R-22, un HFC); cuando esta sustancia qu??mica marcas con calefacci??n tetrafluoroetileno (TFE abreviado), el punto de partida para PTFE.
La mayor demanda de PTFE es en aislamiento el??ctrico. Es una excelente diel??ctrico y muy estable qu??micamente. Tambi??n se utiliza ampliamente en la industria de procesos qu??micos donde se requiere resistencia a la corrosi??n: en las tuber??as de revestimiento, en la tuber??a, y juntas. Otro uso importante es tejido arquitect??nico (tela de fibra de vidrio recubierto de PTFE utilizado para cubiertas de estadios y tal). La aplicaci??n principal consumidor es utensilios de cocina antiadherente.
| Aplicaciones PTFE Principales | ||
 |  |  |
| Diel??ctrica PTFE separa del n??cleo y met??lica exterior en un cable coaxial de la especialidad | Primera marca sart??n de tefl??n, 1961 | El interior de la Tokyo Dome. El techo es de fibra de vidrio y aire apoyado recubiertas de PTFE. |
Cuando se estira con un tir??n, pel??culas de PTFE hace un poro fino membrana: PTFE expandido ( ePTFE). El t??rmino "Gore-tex" a veces se usa gen??ricamente para este material, pero que es un nombre de marca espec??fica. WL Gore no es el ??nico productor de ePTFE y adem??s "de Gore-tex" a menudo se refiere a m??s complicada membranas multicapa o telas laminadas. ePTFE se utiliza en ropa de lluvia, ropa de protecci??n y l??quidos y filtros de gas. PTFE tambi??n se puede formar en fibras que se utilizan en empaque de la bomba (sellos) y bolso filtros casas para las industrias con escapes corrosivos.
Otros polímeros fluorados tienden a tener propiedades similares a la resistencia química-PTFE alta y buenas propiedades dieléctricas, lo cual conduce a utilizar en la industria de procesos químicos y aislamiento eléctrico. Son más fáciles de trabajar con (para formar en formas complejas), pero son más caros que PTFE y tienen menor estabilidad térmica. propileno etileno fluorado (FEP) es el segundo fluoropolímero más producido. Películas de dos polímeros fluorados diferentes sirven como vidrio-reemplazos en las células solares.

Fluorados ionómeros son materiales costosos, resistentes a químicos utilizados como membranas de ciertas células electroquímicas. Nafion, desarrollado en la década de 1960, fue el primer ejemplo y sigue siendo el material más destacado en la clase. La aplicación inicial fue Nafion como un material de célula de combustible en la nave espacial. Desde entonces, el material se ha ido transformando los 55 millones de toneladas al año la industria cloro-álcali; que está reemplazando las células que contienen mercurio peligrosos con las células de la membrana que también son más eficientes energéticamente. Mientras que las plantas de tecnología de más edad siguen funcionando, las nuevas plantas suelen utilizar células de la membrana. Para el año 2002, más de un tercio de la capacidad mundial de la industria fue de la membrana celular basada. Recientemente, la aplicación de pilas de combustible ha resurgido; importantes investigaciones se están llevando a cabo y las inversiones hace referencia a la obtención de células de la membrana de intercambio de protones (PEM) de combustible en los vehículos.
Los fluoroelastómeros son sustancias similares al caucho que se componen de mezclas reticuladas de fluoropolímeros. Viton es un ejemplo prominente. Resistentes a productos químicos juntas tóricas son la aplicación primaria. Fluoroelastómeros tienden a ser más rígido que los elastómeros convencionales, pero con química superior y resistencia al calor.
Los surfactantes

Tensioactivos fluorados son pequeñas moléculas organofluorados, utilizados principalmente en DWR (repelente al agua duradero). Fluorados forman un gran mercado, más de $ 1 mil millones por año a partir de 2006. Scotchgard es una marca prominente, con más de 300 millones de ingresos en 2000. fluorotensioactivos son productos químicos caros, comparables a los productos químicos farmacéuticos: $ 200-2000 por kilogramo ($ 90 a 900 por libra ).
Fluorosurfactantes hacen una parte muy pequeña del mercado de surfactante en general, la mayoría de los cuales está basado en hidrocarburo y mucho más barato. Algunas aplicaciones posibles (por ejemplo, pinturas low cost) no pueden utilizar fluorados debido al impacto del precio de la capitalización, incluso en pequeñas cantidades de fluorotensioactivo. Uso en pinturas fue sólo alrededor de $ 100 millones al 2006.
DWR es un acabado (capa muy delgada) poner en telas que hace a la ligera lluvia resistente, que hace de perlas de agua. En primer lugar se desarrolló en la década de 1950, fluorosurfactantes eran el 90% de la industria de DWR en 1990. DWR se usa con tejidos de prendas de vestir, alfombras y envasado de alimentos. DWR se aplica a los tejidos por "dip-squeeze-seca" (inmersión en baño de agua DWR, presionando el agua, y luego el secado).
Gas flúor
Para los países con datos disponibles (países de libre mercado), cerca de 17.000 toneladas métricas de flúor se producen al año por 11 empresas, todas G7 residente. El flúor es relativamente barato, costando alrededor de US $ 08.05 por kilogramo ($ 04.02 por libra) cuando se vende como el hexafluoruro de uranio o hexafluoruro de azufre. Debido a las dificultades en el almacenamiento y la manipulación, el precio del gas flúor puro es mucho mayor. Los procesos que exigen grandes cantidades de flúor gaseoso generalmente se integran verticalmente y producen el gas en sitio para uso directo.
El mayor solicitud de flúor elemental es la preparación de hexafluoruro de uranio, que se utiliza en la producción de combustibles nucleares. Para obtener el compuesto, de dióxido de uranio se trata primero con ácido fluorhídrico, para producir tetrafluoruro de uranio. Este compuesto es luego fluorado aún más por la exposición directa a flúor gas para hacer que el hexafluoruro. Monoisotopic ocurrencia natural de flúor hace que sea útil en el enriquecimiento de uranio, porque las moléculas de hexafluoruro de uranio diferirán en masa sólo a causa de diferencias de masa entre el uranio-235 y uranio-238. Estas diferencias de masa se ??????utilizan para separar el uranio-235 y uranio-238 a través de la difusión y la centrifugación. Hasta 7.000 toneladas por año de gas flúor se utilizan para esta aplicación.

El segundo más grande solicitud de gas flúor es hexafluoruro de azufre, que se utiliza como un medio dieléctrico en las estaciones de conmutación de alta tensión. SF 6 gas tiene una resistencia dieléctrica mucho mayor que el aire. Es extremadamente inerte y, en comparación con aparamenta llena de aceite, no tiene PCB (una sustancia química peligrosa). El hexafluoruro de azufre también se utiliza en ventanas insonorizadas, en la industria electrónica, así como nichos de aplicaciones médicas y militares. El compuesto se puede hacer sin necesidad de utilizar gas flúor, pero la reacción entre el azufre puro y gas flúor puro, primero desarrollado por Moissan, sigue siendo la práctica comercial. Cerca de 6.000 toneladas anuales de gas flúor se consumen.
Varios compuestos a base de flúor elemental sirven la industria electrónica. Renio y tungsteno hexafluoruros se utilizan para la deposición de vapor químico de películas metálicas delgadas en semiconductores. tetrafluorometano, se utilizan para el grabado de plasma en semiconductores de fabricación, la producción plana pantalla del panel, y sistemas microelectromecánicos fabricación. trifluoruro de nitrógeno se utilizan cada vez más para el equipo de limpieza en las plantas de fabricación de visualización . El flúor elemental, sí, a veces se utiliza para los equipos de limpieza.
Para hacer organofluorines nichos y productos farmacéuticos que contienen flúor, fluoración directa suele ser muy difícil de controlar. Preparación de fluorinators resistencia intermedios de gas flúor resuelve este problema. El halógeno fluoruros ClF 3 , BrF 3 , y si 5 proporcionan fluoración más suave, con una serie de puntos fuertes. También son más fáciles de manejar. Tetrafluoruro de azufre se utiliza sobre todo para la fabricación de Pharmacueticals fluorados.
Estados Unidos y científicos espaciales soviéticas en la década de 1960 estudió flúor elemental como un posible agente propulsor del cohete debido a la mayor impulso específico generado cuando el flúor reemplaza el oxígeno en la combustión. Los experimentos fracasaron porque el flúor resultó difícil de manejar, y su producto de la combustión (normalmente fluoruro de hidrógeno) era extremadamente tóxico y corrosivo.
Producción de gas de flúor

Los productores comerciales de gas flúor siguen utilizando el método de la electrólisis por primera vez por Moissan, con algunas modificaciones en el diseño de la célula. Debido a la corrosividad de los gases, se requieren materiales de contención especiales y precauciones de manipulación. Rutas químicas a la forma elemental se publicaron en 1986.
Síntesis electrolítica
Varios miles de toneladas de flúor elemental se producen anualmente por electrólisis de bifluoruro de potasio en fluoruro de hidrógeno. Formas bifluoruro de potasio espontáneamente de fluoruro de potasio y el fluoruro de hidrógeno:
- HF + KF ??? KHF2
Una mezcla con la composición aproximada KF ??? 2HF se funde a 70 ° C (158 ° F) y se electroliza entre 70 ° C y 130 ° C (160-265 ° F). Bifluoruro de potasio aumenta la conductividad eléctrica de la solución y proporciona el anión bifluoruro, que libera flúor en el ánodo (parte negativa de la célula). Si solo HF se electroliza, las formas de hidrógeno en el cátodo (parte positiva de la célula) y los iones fluoruro permanecen en solución. Después de la electrólisis, fluoruro de potasio permanece en solución.
- 2 HF2 -??? H2+ F ???2??? + 2 F-
Existen varios otros aspectos biológicos de flúor. El fluoruro es ampliamente utilizado para la prevención de caries dentales. En los productos farmacéuticos y agroquímicos, flúor ve aumentar su uso en nuevas moléculas. Los venenos que contienen flúor son bien conocidos por matar insectos y roedores y los pocos organismos que incorporen flúor en su bioquímica lo hacen para hacer venenos naturales. Ambos isótopos radiactivos de flúor y naturales son importantes en aplicaciones de escaneo respectivos. Perfluorocarbonos oxígeno portadores presentan una posibilidad para el ser humano la respiración líquida.
Cuidado dental
Los iones fluoruro en contacto con los dientes se han pensado mucho limitar cavidades girando la formación de la hidroxiapatita de dientes en menos fluorapatite soluble. Los estudios más arriba-hasta la fecha no muestran diferencias en los niveles de caries entre los dientes con esmalte fluorada en diferentes grados, mientras que los bajos niveles de fluoruro en el fluido de la placa y la saliva sin duda ayudan a combatir las caries tempranas. El proceso de absorción de fluoruro sólo funciona por contacto directo ( tratamiento tópico). Los iones fluoruro que se tragan no se benefician de los dientes.
La fluoración del agua es la adición controlada de fluoruro a un servicio público para reducir la caries dental. Su uso comenzó en la década de 1940, a raíz de los estudios de los niños en una región donde el agua está fluorada de manera natural. Ahora se utiliza durante unos dos tercios de la población de Estados Unidos en los sistemas públicos de agua y aproximadamente el 5,7% de las personas en todo el mundo. Aunque la mejor evidencia disponible no muestra asociación con efectos adversos distintos de fluorosis (dentales y, en casos peores, esqueléticos), la mayoría de los cuales es leve, la fluoración del agua ha sido polémico por ética, seguridad y razones de eficacia, y la oposición a la fluoración del agua existe a pesar de su apoyo de las organizaciones de salud pública. Los beneficios de la fluoración del agua han disminuido recientemente, presumiblemente debido a la disponibilidad de fluoruro en otras formas, pero todavía son medibles, especialmente para los grupos de bajos ingresos. Las revisiones sistemáticas en 2000 y 2007 mostró una reducción significativa de caries en los niños vinculados a la fluoración del agua.
El fluoruro de sodio, difluoruro de estaño, y, más comúnmente, monofluorofosfato de sodio, se utilizan en pasta de dientes. En 1955, la primera pasta dental con fluoruro se introdujo, en los Estados Unidos. Ahora, casi toda la pasta de dientes en los países desarrollados está fluorada. Por ejemplo, 95% de pasta de dientes Europea contiene fluoruro. Los geles y espumas a menudo se aconseja para los grupos de pacientes especiales, en particular los sometidos a radioterapia en la cabeza (pacientes con cáncer). El paciente recibe una aplicación de cuatro minutos de una alta cantidad de fluoruro. Existen barnices que realizan una función similar, pero se aplican con mayor rapidez. El fluoruro también está contenida en recetados y sin receta enjuagues bucales y es un componente de rastreo de los alimentos elaborados a partir de los suministros de agua fluorada.
Farmacéuticos
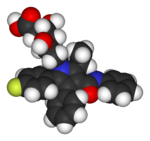
Varios productos farmacéuticos importantes contienen flúor. De los fármacos comercializados, ya 20% contienen flúor, ya que incluso un solo átomo de mejora la reactividad química de la molécula de fármaco utilizado.
Debido a la gran estabilidad del enlace carbono-flúor, muchos medicamentos son fluorado para retrasar su metabolismo (convirtiéndose en otra molécula, el proceso químico detrás de esto es cómo funcionan las drogas). Esto prolonga sus vidas medias y permite tiempos más largos entre la dosificación y la activación. Por ejemplo, una anillo aromático puede añadir para evitar que el metabolismo de un fármaco, pero esto presenta un problema de seguridad, debido a que algunos compuestos aromáticos son metabolizados en el cuerpo en venenosas epóxidos por el organismo de nativo enzimas. Sustituyendo un átomo de flúor en un párrafo posición, sin embargo, protege el anillo aromático y evita que el epóxido a partir de que se produce.
La adición de flúor a orgánicos biológicamente activos aumenta su lipofilicidad (capacidad de disolver en grasas), debido a que el enlace carbono-flúor es aún más hidrófobo que el enlace carbono-hidrógeno. Este efecto aumenta a menudo de un medicamento biodisponibilidad debido a la mayor penetración de la membrana celular. Aunque el potencial del flúor que se libera como un fluoruro grupo saliente depende de su posición en la molécula, organofluoruros son generalmente muy estable, ya que el enlace carbono-flúor es fuerte.
Flúor también encuentran sus usos en común mineralocorticoides, una clase de fármacos que aumentan la presión arterial . Adición de un flúor aumenta tanto su potencia médica y efectos anti-inflamatorios. Contiene flúor fludrocortisona es uno de los dichos fármacos más comunes. dexametasona y triamcinolona, ??????que están entre los más potentes del sintéticos relacionados con corticosteroides clase de medicamentos, contienen flúor también.
Varios generales inhaladosagentes anestésicos, incluyendo los agentes inhalados más utilizados, también contienen flúor. Los ejemplos incluyen sevoflurano,desflurano yisoflurano, que sonderivados de hidrofluorocarbonos.
Muchos Antidepresivos ISRS son orgánicos fluorados, incluyendoel citalopram,el escitalopram yfluoxetina.Las fluoroquinolonas son una familia de uso general deantibióticos de amplio espectro.
 |  |  |  |
|---|---|---|---|
| Lipitor (atorvastatina) | 5-FU (fluorouracilo) | Florinef (fludrocortisona) | El isoflurano |
Agroquímicos y venenos naturales

Se estima que el 30% de los compuestos agroquímicos contiene flúor. La mayoría de ellos son venenos, pero unos pocos estimular el crecimiento en su lugar. El uso de agroquímicos más de flúor se dice que se basan en la mejora de la reacción de síntesis (la reducción de los costos planteados por el contenido de flúor) y el nivel de la química verde consideración (compuestos fluorados son más respetuosos del medio ambiente).
Sint??tico fluoroacetato de sodio se ha utilizado como un insecticida, pero es especialmente eficaz contra las plagas de mamíferos. El nombre de "1080" se refiere al número de catálogo del veneno, que se convirtió en su marca. Fluoroacetato es similar a acetato, que tiene un papel fundamental en el ciclo de Krebs (una parte clave del metabolismo celular). Fluoroacetato detiene el ciclo y hace que las células de ser privados de energía. Varios otros insecticidas contienen fluoruro de sodio, que es mucho menos tóxico que fluoroacetato. Actualmente el compuesto está prohibido. Otra agrichemcial importante es Trifluralina. Que una vez fue muy importante (por ejemplo, en 1998 más de un medio de la zona de campo de algodón de Estados Unidos fue revestido con la sustancia química); sin embargo, sus propiedades cancerígenas sospechosas causaron algunos países del norte de Europa para prohibir que en 1993. En la actualidad, toda la Unión Europea ha prohibido que, aunque hubo un caso la intención de cancelar la decisión.
Los agroquímicos utilizados en la actualidad utilizan otra táctica: En lugar de ser venenosa sí mismos, ellos penetran en el metabolismo no afectar directamente, sino a transformar en realidad compuestos venenosos. Por ejemplo, los insectos alimentados 29-fluorostigmasterol producir los fluoroacetates de ella. Si un átomo de flúor se transfiere a una célula del cuerpo, que bloquea el metabolismo en la posición ocupada.
Organofluorines biológicamente sintetizados se han encontrado en microorganismos y plantas, pero no en animales. El ejemplo más común es fluoroacetato, con una molécula veneno activo idéntico al comercial "1080". Se utiliza como una defensa contra los herbívoros por lo menos 40 plantas verdes en Australia, Brasil y África; otros organofluorines sintetizados biológicamente incluyen ??-fluoro ácidos grasos , fluoroacetona, y 2-fluorocitrato. En las bacterias, la enzima -adenosil fluoruro sintasa, que hace que el enlace carbono-flúor, fue aislado. El descubrimiento fue promocionado como posiblemente lleve a rutas biológicas para la síntesis organofluorine.
Exploración
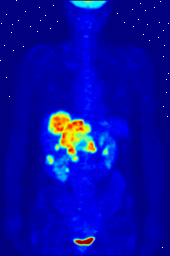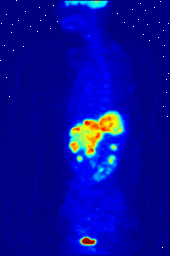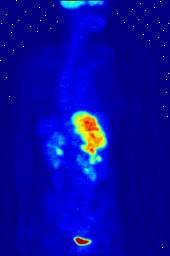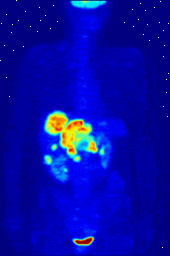
Los compuestos que contienen flúor-18, un isótopo radiactivo que emite positrones, a menudo se utilizan en la tomografía por emisión de positrones (TEP), ya que la vida media del isótopo de alrededor de 110 minutos es largo para los estándares de positrones-emisor. Uno de tales radiofármaco es 2-desoxi-2- ( 18 F) fluoro-D-glucosa (genéricamente denominado fludesoxiglucosa), comúnmente abreviado como 18 F-FDG, o simplemente FDG. En la PET, FDG puede ser utilizado para asessing metabolismo de la glucosa en el cerebro y para obtener imágenes de los tumores de cáncer. Después de la inyección en la sangre, la FDG es absorbido por los tejidos "FDG-ávidos" con una alta necesidad de la glucosa, como el cerebro y la mayoría de los tipos de tumores malignos. Tomografía, a menudo con la asistencia de un equipo para formar un PET / CT (CT significa "tomografía computarizada") de la máquina, entonces se puede utilizar para diagnosticar o controlar el tratamiento de los cánceres; especialmente el linfoma de Hodgkin, el cáncer de pulmón y cáncer de mama.
Flúor natural es monoisotópico, que consiste únicamente en flúor-19. Los compuestos de flúor son altamente susceptibles de resonancia magnética nuclear (RMN), porque flúor-19 tiene un espín nuclear de ½, un alto momento magnético nuclear, y una alta relación magnetogírica. Los compuestos de flúor tienen típicamente una RMN rápido de relajación, que permite el uso de promediación rápido para obtener una relación señal-ruido similares a los espectros de RMN de hidrógeno-1. Flúor-19 se utiliza comúnmente en el estudio de RMN de metabolismo, las estructuras de proteínas y cambios conformacionales. Además, los gases fluorados inertes tienen el potencial de ser una herramienta barata y eficiente para la ventilación pulmonar de imágenes.
Investigación sobre el transporte de oxígeno
Fluorocarbonos líquidos tienen una muy alta capacidad de mantener el gas en solución. Ellos pueden tener más oxígeno o dióxido de carbono que lo hace la sangre. Por esa razón, han despertado el interés en curso en relación con la posibilidad de que la sangre artificial o de la respiración líquida.

Sucedáneos de sangre son el objeto de la investigación porque la demanda de transfusiones de sangre crece más rápido que las donaciones. En algunos escenarios, la sangre artificial puede ser más conveniente o seguro. Debido a que los fluorocarbonos normalmente no se mezclan con agua, deben ser mezclados en emulsiones (pequeñas gotas de perfluorocarbono en suspensión en agua) para ser utilizados como la sangre. Uno de esos productos, Oxycyte, ha sido a través de los ensayos clínicos iniciales.
Posibles usos médicos de la respiración líquida (que utiliza líquido perflurocarbon pura, no una emulsión de agua) implican la asistencia para los bebés prematuros o para víctimas de quemaduras (porque la función pulmonar normal se ve comprometida). Tanto el llenado parcial de los pulmones y el llenado completo de los pulmones se han considerado, aunque sólo el primero tiene ninguna prueba significativos en los seres humanos. Varios ensayos con animales se han realizado algunos ensayos y la ventilación líquida parcial humanos. Un esfuerzo, por Alliance Pharmaceuticals, alcanzó ensayos clínicos, pero fue abandonado debido a la ventaja insuficiente en comparación con otras terapias.
Los nanocristales representan un posible método de entrega de agua o grasa fármacos solubles dentro de un fluido químico perfluorado. El uso de partículas está siendo desarrollado para ayudar a los bebés a tratar con los pulmones dañados.
Otras aplicaciones incluyen postuladas buceo de aguas profundas y los viajes espaciales, las aplicaciones que habría tanto requerir ventilación líquida total, no la ventilación parcial. La película 1989 El Abismo mostró una utilización ficticia de perfluorocarbono para el buceo humana, sino también filmó una rata verdadera sobrevivir mientras se enfría y se sumerge en perfluorocarbono. (Ver tambi??n lista de tratamientos de ficción de la respiración perfluorocarbono.)
Peligros
Gas flúor y el ion fluoruro

El flúor elemental es altamente tóxico. Por encima de una concentración de 25 ppm, flúor causa irritación significativa mientras ataca los ojos, las vías respiratorias, los pulmones, el hígado y los riñones. A una concentración de 100 ppm, los ojos humanos y la nariz están seriamente dañadas.
Fluoruros solubles son moderadamente tóxico. Para fluoruro de sodio, la dosis letal para los adultos es de 5-10 g, que es equivalente a 32-64 mg de fluoruro elemental por kilogramo de peso corporal. La dosis que pueden dar lugar a efectos adversos para la salud es de aproximadamente una quinta parte de la dosis letal. El consumo de fluoruro en exceso crónico puede conducir a la fluorosis esquelética, una enfermedad de los huesos que afecta a millones de personas en Asia y África.
El ion fluoruro se absorbe fácilmente por el estómago y los intestinos. Ingerido formas fluoruro de ácido fluorhídrico en el estómago. En esta forma, el fluoruro cruza las membranas celulares y entonces se une con calcio y interferir con diversas enzimas. El fluoruro se excreta por la orina. Los límites de exposición de fluoruro se basan en las pruebas de orina que ha determinado la capacidad del cuerpo humano para librarse de fluoruro.
Históricamente, la mayoría de los casos de envenenamiento por fluoruro han sido causados ??????por la ingestión accidental de insecticidas que contienen fluoruro inorgánico, la actualidad, la mayoría de las llamadas a los centros de control de veneno para su posible envenenamiento por fluoruro provienen de la ingestión de pasta dental que contenga fluoruro. Mal funcionamiento de los equipos de la fluoración del agua ha ocurrido varias veces, incluyendo un incidente de Alaska, que afectó a cerca de 300 personas y mató a uno.
Acido hidrofluorico
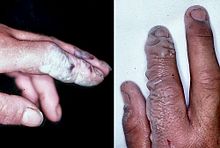
El ácido fluorhídrico es un veneno de contacto y debe manejarse con mucho cuidado, mucho más allá de las que disfruten otros ácidos minerales. Debido a su menor disociación química en agua (restante una molécula neutra), fluoruro de hidrógeno penetra en el tejido más rápidamente que los ácidos típicos. La intoxicación puede ocurrir fácilmente a través de la exposición de la piel o los ojos, o cuando se inhala o se ingiere. Los síntomas de la exposición al ácido fluorhídrico pueden no ser evidente de inmediato, con un retraso de 8 horas para el 50% de HF y hasta 24 horas si la concentración es menor. El fluoruro de hidrógeno interfiere con la función nerviosa, lo que significa que las quemaduras no pueden inicialmente ser doloroso. Exposiciones accidentales pueden pasar desapercibidos, retrasar el tratamiento y aumentar el alcance y la gravedad de la lesión. Si la quemadura se ha dado cuenta al principio, luego HF deben lavarse con un fuerte chorro de agua durante diez a quince minutos, para evitar su penetración en el cuerpo. Ropa usada por la persona quemada también pueden presentar peligro.
Una vez en la sangre, fluoruro de hidrógeno reacciona con el calcio y el magnesio, resultando en desequilibrio de electrolitos, arritmia cardiaca, y potencialmente, la muerte. Formación de insoluble de fluoruro de calcio posiblemente cause tanto una caída en el calcio sérico y el dolor fuerte asociado con toxicidad tisular. En algunos casos, las exposiciones pueden provocar hipocalcemia. Quemaduras con superficies superiores a 160 cm 2 (25 en 2 ) pueden causar grave toxicidad sistémica de la interferencia con los niveles sanguíneos de calcio y tejido.
La exposición al ácido fluorhídrico se trata a menudo con gluconato de calcio, una fuente de Ca 2+ que se une con los iones fluoruro. Quemaduras de la piel pueden ser tratados con un lavado con agua y 2.5% de gel de gluconato de calcio o soluciones de lavado especiales. Sin embargo, debido HF se absorbe, el tratamiento médico es necesario; a veces puede ser necesaria la amputación.
Preocupaciones ambientales
Ambiente
Los clorofluorocarbonos (CFC) y bromofluorocarbonos (BFC) se han regulado estrictamente a través de una serie de acuerdos internacionales, el Protocolo de Montreal, ya que agotan la capa de ozono. Es el cloro y bromo de estas moléculas que causan daño, no flúor. Debido a la estabilidad inherente de estas moléculas totalmente halogenados (que los hace tan inflamable y útil), que son capaces de llegar a la parte alta de la atmósfera, antes de la descomposición, y luego liberar cloro y bromo para atacar el ozono a esas altitudes. Las predicciones son que se necesitarán generaciones, incluso después de la prohibición de los CFC, por estas moléculas para salir de la atmósfera y de la capa de ozono se recupere. Los primeros indicios apuntan a que el agotamiento de la capa de ozono funciona la prohibición de CFC se ha detenido y la recuperación está en marcha.
Los hidroclorofluorocarbonos (HCFC) son reemplazos actuales de los CFC; HCFC tienen aproximadamente una décima parte del ozono dañar potencial (PAO) de los CFC. Ellos fueron programadas originalmente para la eliminación en 2030 en los países desarrollados (2.040 en no urbanizable). En 2007, un nuevo tratado fue firmado por casi todas las naciones para mover esa eliminación gradual de hasta diez años, porque los HFC, que no tienen cloro y por lo tanto cero ODP, están disponibles. Mientras tanto, los HCFC individuales con el mayor potencial de agotamiento anti-ozono se están eliminando en primer lugar. Por ejemplo, en 2003, el HCFC-141b fue eliminado en los EE.UU. por la regulación Agencia de Protección Ambiental. Muchos de los otros HCFC ahora se están produciendo a una fracción de sus tasas de producción anteriores.
Gases de fluorocarbono de todo tipo (CFC, HFC, etc.) son gases de efecto invernadero aproximadamente 4.000 a 10.000 veces más potente que el dióxido de carbono. El hexafluoruro de azufre exhibe un efecto aún más fuerte, unos 20 mil veces el potencial de calentamiento atmosférico de dióxido de carbono.
Biopersistencia

Debido a la fuerza del enlace carbono-flúor, organofluorines soportar en el medio ambiente. El ácido perfluorooctanoico (PFOA) y ácido perfluorooctanosulfónico (PFOS), utilizado en los aerosoles de impermeabilización, son contaminantes globales persistentes. Trazas de estas sustancias se han detectado en todo el mundo, desde los osos polares en el Ártico a la población humana mundial. Un estudio indica que los niveles de PFOS en la vida silvestre están empezando a bajar debido a la reciente reducción de la producción de ese producto químico.
Distribución en los tejidos de PFOA en los seres humanos es desconocida, pero estudios en ratas sugieren que es probable que esté presente principalmente en el hígado, riñón, y la sangre. En el cuerpo, PFOA une a una proteína, albúmina de suero; se ha detectado en la leche materna y la sangre de los recién nacidos. PFOA no se metaboliza por el cuerpo, pero se excreta por los riñones.
Los potenciales efectos sobre la salud de PFOA no están claros. A diferencia de los hidrocarburos clorados, PFOA no es lipófilo (almacenado en grasa), ni es genotóxicos (genes dañinos). Mientras tanto el PFOA y PFOS causa cáncer en grandes cantidades en los animales, los estudios sobre seres humanos expuestos no han sido capaces de demostrar un impacto en las exposiciones actuales. Delfines nariz de botella tienen algunas de las más altas concentraciones de PFOS de cualquier especie silvestre estudiado; un estudio sugiere un impacto en sus sistemas inmunológicos.
Dado que los sistemas biológicos no metabolizan moléculas fluoradas fácilmente, farmacéuticos fluorados (a menudo antibióticos y antidepresivos) son algunos de los principales compuestos orgánicos fluorados que se encuentran en la ciudad de tratados de aguas residuales y de aguas residuales. Agroquímicos que contienen flúor son medibles en tierras de cultivo escorrentía y ríos cercanos.
Compuestos

Sólo común de flúor estado de oxidación es -1. Con otros átomos de flúor, formularios o bien enlaces covalentes polares o enlaces iónicos. Con mayor frecuencia, los enlaces covalentes que involucran átomos de flúor son enlaces simples, aunque existen al menos dos ejemplos de un bono de orden superior. El fluoruro puede actuar como un ligando puente entre dos metales en algunas moléculas complejas. Las moléculas que contienen flúor pueden también exhibir enlaces de hidr??geno. flúor tiene una química rica incluidos compuestos inorgánicos formados con hidrógeno, metales, no metales y gases nobles incluso; así como un conjunto diverso de compuestos orgánicos.
Inorg??nico
El fluoruro de hidrógeno
| HF y H2similitudes S | |
 |  |
| Puntos de ebullición de los haluros de hidrógeno (azul) y calcogenuros de hidrógeno (rojo): HF y H2tendencias de quiebre S. | Punto de HF / H Congelación2mezclas S: flechas indican compuestos en estado sólido. |
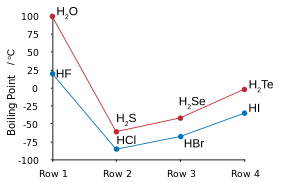
El flúor se combina con hidrógeno para hacer un compuesto (HF) llamado fluoruro de hidrógeno o, especialmente en el contexto de soluciones de agua, ácido fluorhídrico. El tipo de enlace HF es uno de los pocos capaces de enlace de hidrógeno (la creación de asociaciones de agrupación adicionales con moléculas similares). Esto influye en varios aspectos peculiares de las propiedades de fluoruro de hidrógeno. En algunas formas de la sustancia se comporta más como el agua, también muy propensos a la unión de hidrógeno, de uno de los otros haluros de hidrógeno, tales como HCl.
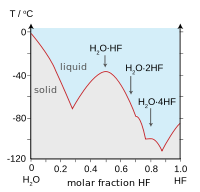
El enlace de hidrógeno entre moléculas de HF da lugar a la alta viscosidad en la fase líquida y menor que la presión esperada en la fase de gas. El fluoruro de hidrógeno no hierva hasta 20 ° C, en contraste con los haluros de hidrógeno más pesados ??????que hierven entre -85 ° C y -35 ° C (-120 a 30 ° F). HF es completamente miscible con agua (se disolverá en cualquier proporción), mientras que los otros haluros de hidrógeno tienen grandes lagunas de solubilidad con agua. El fluoruro de hidrógeno y el agua también forman varios compuestos en estado sólido, lo más notablemente una 1: 1 compuesto que no se derrite hasta -40 ° C (-40 ° F), que es 44 grados Celsius (79 grados Fahrenheit) por encima del punto de fusión HF de puro.
A diferencia de otros ácidos hidrácidos halogenados, tales como ácido clorhídrico , fluoruro de hidrógeno sólo es un ácido débil en solución de agua, con ácido constante de disociación (pK la ) igual a 3,19. La debilidad de HF como un ácido acuoso es paradójico teniendo en cuenta lo polar del enlace HF es, mucho más que el bono en HCl, HBr o HI. La explicación para el comportamiento es complicado, que tiene que ver con diversas tendencias racimo de formación de la IC, el agua y de iones fluoruro, así como cuestiones termodinámicas. En grandes concentraciones, una propiedad llamada homoconjugación se revela. HF comienza a aceptar iones fluoruro, formando los iones poliatómicos (tales como bifluoruro, HF -
2 ) y los protones, lo que aumenta en gran medida la acidez del compuesto. El ácido fluorhídrico es también el más fuerte de los ácidos hidrácidos halogenados en ácido acético y disolventes similares. Su acidez potencial oculto se revela también por el hecho de que protona ácidos como clorhídrico, sulfúrico o nítrico. A pesar de su debilidad, el ácido fluorhídrico es muy corrosivo, incluso atacando vidrio (hidratado solamente).
Fluoruro de hidrógeno seco se disuelve fluoruros metálicos bajo valentes fácilmente. Varios fluoruros moleculares también se disuelven en la IC. Muchas proteínas e hidratos de carbono se pueden disolver en HF seco y pueden ser recuperados de él. La mayoría de los productos químicos inorgánicos no fluoruro reaccionan con IC en lugar de disolverse.
Fluoruros metálicos
Fluoruros metálicos tienen similitudes con otros haluros de metal, pero son más iónico. En muchos aspectos, fluoruros de metales difieren de otros haluros metálicos (cloruros, bromuros, yoduros), muy similares entre sí. En cambio, los fluoruros son más similares a los óxidos, a menudo tienen estructuras de unión y cristalinas similares.
Los fluoruros de metales muestran tendencias generales basados ??????en la carga del metal. Los metales en un estado de oxidación de 3 o más baja tienden a formar, fluoruros iónicos refractarios. Metales pagan 5 o superior tienden a formar fluoruros unidos covalentemente, polímeros o moléculas discretas, y son más volátiles. (Los tetrafluorides son una zona de transición.) Las variaciones de unión significan que los fluoruros metálicos pueden ser sólidos, líquidos o gases a temperatura ambiente.
La solubilidad de los fluoruros varía en gran medida, pero tiende a disminuir a medida que la carga del ion de metal aumenta. Fluoruros disueltos producen soluciones básicas. (F - es una base débil porque HF es un ácido débil.) Como hidróxidos, fluoruros pueden ser vistos como básico, anfóteros, y ácido, con la propiedad de acidez generalmente aumenta con el estado de oxidación del metal; un fluoruro es una base mucho más débil que un hidróxido, sin embargo.
Estados de oxidación bajos
Los metales alcalinos forman monofluorides. Todos son solubles y tienen la estructura de cloruro de sodio (sal de roca), que también es adoptado por algunos óxidos alcalinotérreos tales como CaO. Debido a que el anión fluoruro es altamente básica, muchos fluoruros de metales alcalinos forman bifluoruros con la fórmula MHF 2 . También dan fuera de la fluoruro fácilmente cuando la reacción con un ácido. Entre otras monofluorides, solamente de plata (I) y talio (I) fluoruros son bien caracterizado. Ambos son muy solubles, a diferencia de los otros haluros de esos metales. Otra fluoruro de plata es desde este punto un "medio-fluoruro" (un subfluoride, compuesto que contiene menos de saturación normal con flúor), formulado como Ag 2 F . Este compuesto ha sido descrito como que tiene F - e inusuales "ag ½ + centros ".
A diferencia de los monofluorides, los difluoruros pueden ser o bien soluble o insoluble. Varios difluoruros de metales de transición, tales como los de cobre (II) y níquel (II), son solubles. Los metales alcalinotérreos forman difluoruros que son insolubles. En contraste, los cloruros alcalinotérreos son fácilmente solubles. La insolubilidad de fluoruros alcalinotérreos proviene de la alta energía reticular negativo de la común en la estructura química de fluorita (adoptada por varios dióxidos metálicos como CeO 2 , UO 2 , ThO 2 , etc.), de modo que sea más favorable para el sólido para mantenerse sólido en lugar de disolverse, por lo que son insolubles (véase la tabla, notar los signos menos omitidas). Sin embargo, el fluoruro de berilio muestra notables diferencias de otros fluoruros alcalino-térreos, tal es el berilio diferente a otros metales alcalinotérreos (que tiende a unir covalentemente, por lo BeF 2 muestra un carácter significativo covalente). Los compuestos tiene muchas similitudes con SiO 2 (cuarzo): una mayoría unida covalentemente red sólida, la formación gafas (son difíciles de cristalizar), la misma habitación estructura cristalina temperatura cuando cristalina, etc. Es muy soluble en agua, a diferencia de las otras tierras alcalinas .
Muchos metales forman trifluoruros, tales como hierro, bismuto, los elementos de tierras raras, y los metales en la columna de la aluminio de la tabla periódica. En este punto, la ionicidad de los fluoruros comienza a reducir, y la acidez comienza a crecer, a pesar de que los compuestos son todavía los sólidos iónicos, principalmente débilmente básicas. En muchos casos, mientras que los trifluoruros son todavía iónico, otros trihaluros puede ser volátil (por ejemplo, aluminio u oro). No trifluoruro es soluble en agua, pero son solubles en varios otros disolventes.
La tetrafluorides muestran una mezcla de enlace iónico y covalente: zirconio, hafnio, además de muchos de los actínidos formar tetrafluorides iónica, alto punto de fusión-antiprismatic cuadrados. Titanio, niobio, vanadio y tetrafluorides son poliméricos, con fusión o descomposición puntos por debajo de 400 ° C (vanadio de mayo también desproporcionada a 100-120 ° C para el trifluoruro y el pentafluoruro). Muchos tetrafluorides metales de transición muestran estructuras inusuales intermedias entre covalente iónica y monomérico (tetrafluoruro de iridio en particular con ambos átomos de flúor compartidos y no compartidos). Por lo general tienen bajos puntos de fusión (tetrafluoruro de osmio es, por ejemplo, 230 ° C) o son de baja estabilidad (tetrafluoruro de manganeso se descompone incluso a temperatura ambiente). tetrafluoruro de germanio moléculas formas tetraédricas y es un gas a temperatura ambiente.
Estados de oxidación de alta
Penta metal y fluoruros más altos están covalentemente unidos y volátil. Este comportamiento contrasta con los óxidos correspondientes. El oxígeno es un oxidante más débil e inherentemente más propensos a formar enlaces covalentes, pero sólo forma moléculas con cinco metales ( heptóxido de manganeso, heptóxido de tecnecio, tetróxido de rutenio, tetróxido de osmio, iridio y tetróxido). Formas flúor moléculas con quince metales debido a su pequeño tamaño y una sola carga como un ion permite rodea átomos de metal con más átomos de flúor que lata oxígeno.

Más alto de fluoruro de bismuto es un pentafluoruro volátil que es un potente agente de fluoración. En el estado sólido, es polimérico, que consiste en cadenas lineales de octaedros, compartiendo fluoruros axiales. Bismuto pentavalente se comporta como un ácido hexafluorobismuthate y formas, [BIF 6 ] - , tras la reacción con un donante de fluoruro, ya sea fuerte (tal como NaF) o no (tales como XeF 4 ), siendo por lo tanto un ácido. Niobio y tantalio pentafluoruros, mientras térmicamente estable, son también ácidos fuertes y por lo tanto se hidrolizan fácilmente. Ellos son realmente molecular, formando moléculas tetraméricas. Muchos metales que forman fluoruros más altos también pueden formar pentafluoruros, pero pueden ser inestable. Por ejemplo, osmio y rutenio pentafluoruros, mientras que también polimérica, tienen una estructura diferente, y son de baja estabilidad (hidrolizar fácilmente, no son del estado de oxidación más alto, ni un uno estable).
Los metales que hacen bien caracterizados hexafluoruros incluyen nueve metales en el centro de la tabla periódica y tres actínidos . A temperatura ambiente, el hexafluoruro de tungsteno es un gas, hexafluoruro de molibdeno y renio hexafluoruro son líquidos, y el resto son sólidos volátiles. Metal hexafluoruros son oxidantes debido a su tendencia a quedar reducidos: por ejemplo, el hexafluoruro de platino fue el primer compuesto para oxidar el oxígeno molecular y xenón. El hexafluoruro de menos inestable es la de osmio. polonio también forma un hexafluoruro, pero se understudied.
El renio es el único metal conocido por vincularse con siete fluoruros en compuesto de metal de carga neutra, que es el encargado-ligandos número de registro. renio heptafluoride pueden ser sintetizados a partir de los elementos, y es relativamente estable frente al calor. Químicamente, puede servir como un ácido no oxidante para formar el correspondiente anión, ReF -
8 , o con ácidos más fuertes como una base para formar un catión, ReF +
6 . La molécula adopta una geometría molecular bipirámide pentagonal (se espera para ser compartido con la heptafluoride actualmente desconocido, pero tal vez sea posible iridio (se está preparando el informe de síntesis), heptafluoride tecnecio y heptafluoride osmio).
Fluoruros no metálicos
La fluoruros binarios no metálicos son compuestos volátiles. Muestran una gran diferencia entre el período 2 y otros fluoruros. Por ejemplo, Período 2 elementos elementos fluoruros nunca exceden el octeto de sus átomos. ( Boron es una excepción debido a su posición específica en la tabla periódica.) elementos inferiores de periodo, sin embargo, pueden formar moléculas hipervalentes, tales como pentafluoruro de fósforo o hexafluoruro de azufre. La reactividad de estas especies varía enormemente hexafluoruro de azufre es inerte, mientras que el trifluoruro de cloro es extremadamente reactivo, pero hay algunas tendencias basadas en ubicaciones de la tabla periódica.
El trifluoruro de boro es una molécula plana. Tiene sólo seis electrones alrededor del átomo central de boro (y por lo tanto un octeto incompleto), pero acepta fácilmente una base de Lewis, la formación de aductos con moléculas o iones tales como que contiene par solitario- amoniaco u otro ion fluoruro que puede donar dos electrones más para completar el octeto. Boron monofluoruro es una molécula inestable con una (mayor que individual) vínculo inusual al flúor. El orden de enlace ha sido descrito como 1.4 (intermedio entre un sencillo y un doble enlace). Es isoelectrónico con N 2 .
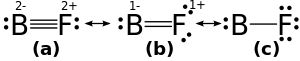
Tetrafluoruro de silicio, similar a tetrafluoruro de carbono y tetrafluoruro de germanio, adopta una molecular tetraédrica estructura. SiF 4 es estable contra el calentamiento o chispa eléctrica, pero reacciona con el agua (incluso aire húmedo), los metales y los álcalis, lo que demuestra escaso carácter ácido. Reacciones con compuestos de organomagnesio, alcoholes, aminas, y compuestos de aducción de rendimiento amoníaco. ácido fluorosilícico, un derivado de SiF 4 , es un ácido fuerte en solución acuosa (la forma anhidra no existe).
Pnictogens (columna de la tabla periódica de nitrógeno) muestran tendencias muy similares en reactividad y la acidez de los más altos fluoruros (pentafluoruros) y los más comunes (trifluoruros), con la dicha propiedad creciente hacia abajo el grupo: NF 3 es estable frente a la hidrólisis, PF 3 hidroliza muy lentamente en aire húmedo, mientras que AsF 3 hidroliza completamente. SbF 3 hidroliza sólo parcialmente debido a la cada vez mayor carácter iónico del enlace a flúor. Los compuestos son bases débiles de Lewis, con NF 3 ser de nuevo una excepción. Los pentafluoruros de fósforo y arsénico son mucho más reactivos que sus trifluoruros; pentafluoruro de antimonio es un ácido tal fuerte que tiene el título del ácido de Lewis más fuerte. El nitrógeno no se conoce para formar un pentafluoruro, aunque el catión tetrafluoroammonium ( NF +
4 ) dispone de nitrógeno en el estado de oxidación formal de 5. monofluoruro de nitrógeno es un especies metaestables que se ha observado en estudios de láser. Es isoelectrónico con O 2 y como BF, inusualmente, tiene un orden de enlace más alta que el flúor de un solo régimen de servidumbre.
La calcógenos (columna de la tabla periódica de oxígeno) son algo similares: Las tetafluorides son térmicamente inestable y se hidrolizan, y también están dispuestos a utilizar su par solitario para formar aductos de otros fluoruros (ácidos). Azufre y selenio son tetrafluorides molecular mientras TEF 4 es un polímero. Los hexafluoruros son el resultado de fluoración directa de los elementos (comparar: siquiera no existen otros hexahalides de los elementos). Aumentan en la reactividad con el número atómico: SF 6 es extremadamente inerte, SEF 6 es menos noble (por ejemplo, reacciona con amoníaco a 200 ° C (400 ° F)), y TEF 6 hidroliza fácilmente para dar una oxoácido. Más alto de fluoruro de oxígeno es difluoruro de oxígeno, pero el flúor puede teóricamente (a partir de 2012) oxidar a un estado excepcionalmente alta oxidación de 4 en el fluorocation: DE +
3 .
Los halógenos bien caracterizados más pesados ??????(cloro, bromo, y yodo) toda forma de mono-, tri-, y pentafluoruros: XF, XF 3 y XF 5 . De los neutrales 7 especies, sólo el yodo heptafluoride se sabe. Si bien no se conocen heptafluorides de cloro y bromo, los cationes correspondientes CLF +
6 y BRF +
6 , extremadamente oxidantes fuertes, son. Astatine no está bien estudiado, y aunque hay un informe de un monofluoruro astato no volátil, su existencia se debate. Muchos de los fluoruros halógenas son fluorinators poderosos. Trifluoruro de cloro es particularmente notable-fácilmente fluoración de amianto y óxidos refractarios, y puede ser incluso más reactivo que el pentafluoruro de cloro. Se utiliza industrialmente, ClF 3 requiere precauciones especiales similares a los de gas flúor debido a su corrosividad y los peligros para los seres humanos.
Superácidos
Varios ácidos inorgánicos importantes contienen flúor. Por lo general son muy fuertes debido a la alta electronegatividad del flúor. Uno de tales ácido, ácido fluoroantimónico (HSbF 6 ), es el ácido más fuerte carga neutra conocida. La dispersión de la carga en el anión afecta la acidez del protón solvatado (en forma de H 2 F + ): El compuesto tiene un muy bajo pK la de -28 y es 10 mil billones (10 16 ) veces más fuerte que el ácido sulfúrico puro. Ácido fluoroantimónico es tan fuerte que protona compuestos de otro modo inertes como los hidrocarburos. Químico húngaro-estadounidense George Olah recibió el Premio Nobel 1994 de Química por la investigación de este tipo de reacciones.
Compuestos de gases nobles
Los gases nobles son por lo general no reactiva, ya que se han llenado completamente capas electrónicas, que son extremadamente estables. Hasta la década de 1960, se conoce ningún enlace químico con un gas noble. En 1962, Neil Bartlett utiliza contiene flúor platino hexafluoruro de reaccionar con xenón. Llamó el compuesto se preparó hexafluoroplatinato de xenón, pero desde entonces el producto se ha revelado como mezcla de diferentes sustancias químicas. Bartlett probablemente sintetizó una mezcla de monofluoroxenyl (II) pentafluoroplatinate, [XeF] + [PtF 5 ] - , monofluoroxenyl (II) undecafluorodiplatinate, [XeF] + [Pt 2 F 11 ] - , y trifluorodixenyl (II) hexafluoroplatinate, [Xe 2 F 3 ] + [PtF 6 ] - . Fluoración de Bartlett de xenón ha sido llamado uno de los diez experimentos más bellos de la historia de la química. Más tarde, en 1962, se informó de xenón para reaccionar directamente con flúor para formar el di- y tetrafluorides. Desde entonces, los químicos han hecho grandes esfuerzos para formar otros fluoruros de gases nobles.
Después de haber iniciado la clase noble compuestos gases de flúor, el xenón es también el gas noble tener los dichos compuestos más conocidos. Sus compuestos binarios incluyen difluoruro de xenón, tetrafluoruro de xenón, y hexafluoruro de xenón, así como sus derivados. Xenon forma varios oxifluoruros, tales como oxydifluoride xenón, XeOF 2 , por reacción de tetrafluoruro de xenón con agua. Su vecino superior, criptón, es el único otro para formar un compuesto bien establecida: difluoruro de kriptón. Krypton tetrafluoruro se informó en 1963, pero se demostró posteriormente ser una identificación errónea; el compuesto parece ser muy difícil de sintetizar ahora (aunque incluso el hexafluoruro puede existir).
En fuerte de acuerdo con las tendencias periódicas, el radón es notablemente más reactivo a los oxidantes, incluyendo flúor. Se ha demostrado a reaccionar fácilmente con flúor para formar un compuesto sólido, que se cree generalmente que difluoruro de radón. La composición exacta es incierto como el compuesto es propensa a la descomposición. Los cálculos indican que difluoride radón puede ser iónica, a diferencia de todos los demás gases nobles fluoruros binarios.
Los gases nobles más ligeros (de helio a través de argón) no forman fluoruros binarios estables. Argon formas sin fluoruro binario, pero reacciona en condiciones extremas con fluoruro de hidrógeno para formar fluorohydride argón; es el único compuesto de argón "estable". Helio y neón no forman compuestos químicos estables en absoluto. Helio forma fluorohydride helio; se ha demostrado a ser inestables en fase gas, pero hay condiciones específicas para las que pueden ser estables. Neón, el elemento menos reactivo, no se espera ahora para formar un compuesto estable capaz de síntesis.
Ununoctium , el último actualmente conocido grupo 18 elemento , se prevé para formar difluoruro ununoctium, UuoF 2 , y tetrafluoruro de ununoctium, UuoF 4 , que es probable que tenga la geometría molecular tetraédrica. Sin embargo, sólo unos pocos átomos de ununoctium han sintetizado, y sus propiedades químicas no han sido examinados.
Estados de oxidación más altos: el flúor versus oxígeno
| Más alto de fluoruro y óxido de rutenio | |||
| Para grupos 1-5, 10, 13-16, los estados de oxidación más altos de óxidos y fluoruros son siempre iguales. Las diferencias sólo se ven en cromo, los grupos 7-9, cobre, mercurio, y los gases nobles. fluoración permite a los elementos para lograr estados relativamente bajos de oxidación que son, sin embargo, difícil de lograr. Por ejemplo, no hay óxido binario es conocido por el criptón, pero difluoruro de kriptón es bien estudiado. Al mismo tiempo, los estados muy altos de oxidación son conocidos por única especie a base de oxígeno. Para los óxidos volátiles mencionados anteriormente, no hay correspondientes octafluorides hepta- o. (Por ejemplo, es octafluoride rutenio poco probable que se alguna vez sintetizado, mientras que el tetróxido de rutenio incluso ha descubierto un uso industrial.) El principal problema que impide la formación de flúor los más altos estados en hepta- covalente y octafluorides es que es difícil de fijar tal gran número de ligandos alrededor de un único átomo; el número de ligandos se redujo a la mitad en óxidos análogos. Sin embargo, los aniones octafluoride, tales como la octafluoroiodate ( IF - 8 ), octafluorozirconate ( ZRF 4- 8 ), y octafluoroxenate ( XeF 2- 8 ) aniones son bien conocidos. Los estados de oxidación más altos pueden ser poco común en la vida diaria, o incluso el uso industrial. Por ejemplo, la síntesis de tetrafluoruro de mercurio, el primero compuesto para lograr un estado de oxidación por encima de 2 para un elemento del grupo 12, rompiendo el 5d-shell lleno, mostrando de nuevo la importancia de los efectos relativistas sobre los elementos pesados, y alimentando el debate sobre si el mercurio , el cadmio , y zinc son metales de transición, se produjo a temperaturas criogénicas y el compuesto se descompone a las temperaturas de nitrógeno sólido. Más aún inestable, la única especie de cobalto (V), la cancha de tiro + OrgánicoEl carbono-flúor enlace químico de los compuestos organofluorados es el vínculo más fuerte en química orgánica. Junto con la baja polarizabilidad de las moléculas, éstos son los factores más importantes que contribuyen a la gran estabilidad de los organofluorines. El enlace carbono-flúor de las moléculas más pequeñas se forma en tres formas principales: el flúor reemplaza un halógeno o hidrógeno, o se suma a través de un enlace múltiple. La reacción directa de hidrocarburos con gas flúor puede ser peligrosamente reactiva, por lo que puede necesitar la temperatura que bajar hasta -150 ° C (-240 ° F). "portadores de flúor en forma sólida", compuestos que pueden liberar flúor tras el calentamiento, en particular cobalto trifluoruro, se pueden utilizar en lugar, o fluoruro de hidrógeno. Después de la reacción, el tamaño molecular no se cambia significativamente, ya que los elementos tienen muy similar van der Waals radios. La fluoración directa se vuelve aún menos importante cuando se trata de compuestos organohalogenados o reacciones compuestos insaturados, o cuando se desea un prefluorocarbon (entonces electrólisis a base de HF se utiliza típicamente). En contraste, los fluoropolímeros se forman por polimerización de radicales libres; otras técnicas utilizadas para los polímeros de hidrocarburos no funcionan de esa manera con flúor. La gama de compuestos organofluorados es diversa, lo que refleja la complejidad inherente de la química orgánica . Un gran número de pequeñas moléculas existe con cantidades variables de sustitución de flúor, así como muchos polímeros investigación en áreas particulares es impulsada por el valor comercial de las aplicaciones.
| |||
Cuando todos los hidrógenos son reemplazados con flúor para lograr perfluoroalcanos, una gran diferencia se revela. Tales compuestos son extremadamente estables, y sólo de sodio en amoníaco líquido ellos ataques en condiciones estándar. También son muy insoluble, con pocos disolventes orgánicos capaces de disolver ellos.
Sin embargo, si un perfluorocarbono contiene enlaces dobles o triples (perfluorados alquenos o - alquinos)., muy reactivos frente a ligando aceptar resultado, incluso los menos estables que los hidrocarburos correspondiente Difluoroacetylene, que se descompone incluso bajo temperaturas de nitrógeno líquido, es un ejemplo notable. Si dicha molécula es asimétrica, entonces el carbono más fluorado es atacado, ya que tiene carga positiva causada por los enlaces C-F y está protegido débilmente (de forma similar a cómo insaturado hidrocarburos atacados por HF añadir hidrógeno al átomo más rico en hidrógeno por Regla de Markovnikov).
Los compuestos perfluorados, en contraposición a los perfluorocarbonos, es el término utilizado para las moléculas que serían perfluorocarbonos sólo en carbono y átomos de flúor, a excepción de que tiene un grupo funcional adicional (aunque existe otra definición). Ellos comparten la mayor parte de las propiedades de perfluorocarbono (inercia, la estabilidad, no wettingness y la insolubilidad en agua y aceites, deslizamiento, etc.), pero pueden diferir debido a las propiedades de grupos funcionales, aunque la cola de perfluorocarbono difieren las propiedades específicas de grupo en comparación con los de compuestos de hidrocarburos de cola.
Ácidos orgánicos Perfluoroalkanic ácidos también pueden verse como compuestos perfluorados, con perfluoroalquilo unido a un grupo carboxilo. A medida que se añaden los átomos de flúor en el ácido, su fuerza crece: considere ácido acético y su mono-, di-, y derivados trifluoroacético y sus pK la valores (4.74, 2.66, 1.24, y 0.23). Esto sucede porque con átomos de flúor, el anión formado después de dar el protón fuera se vuelve estable, un efecto causado por una gran de flúor efecto inductivo. Debido a esto, la derative trifluoro es 33.800 veces más fuerte que un ácido acético. Del mismo modo, la acidez es mucho mayor para los otros ácidos perfluorocarboxyl, así como las aminas (aquí, tiene más sentido hablar de eliminación de basicidad, sin embargo).
Los ácidos perfluoroalcanosulfónico son también muy notables por su acidez. El derivado de ácido sulfónico, ácido trifluorometanosulfónico, es comparable en fuerza para ??cido percl??rico. estos compuestos energéticos superficie inferior; por esta razón, que, sobre todo ácido perfluorooctanosulfónico (PFOS, anteriormente el componente activo en la marca "Scotchgard") han encontrado uso industrial como agentes tensioactivos (ver arriba).
Si un compuesto perfluorado tiene una cola fluorado, sino también un par de átomos de carbono no fluorados (típicamente dos) cerca del grupo funcional, se llama un fluorotelómero (tales moléculas se tratan comercialmente como perfluorado), pero dichas moléculas son más de valor industrial de química. El extremo de la cadena puede estar unido de manera similar a los diferentes grupos functiuonal (vía de carbono terminal hydrogenized), tales como hidroxilo resultante en alcoholes telómeros fluorados, sulfonato resultante en sulfonatos de telómeros fluorados, etc.
Pol??meros
Fluoropolímeros son similares en muchos aspectos con moléculas más pequeñas; la adición de flúor a un polímero afecta a las propiedades de la misma manera que en moléculas pequeñas (aumento de la estabilidad química, punto de fusión, la reducción de la inflamabilidad, solubilidad, etc.). Cada fluoropolímero tiene poseer propiedades características, sin embargo.
El fluoroplástico más simple es politetrafluoroetileno (PTFE, DuPont marca Teflon), que es un polímero de cadena lineal simple con la repetición de unidad estructural: -CF 2 -. PTFE tiene un esqueleto de carbonos solo unidos en una cadena larga, con todos los enlaces secundarios a átomos de flúor. No contiene hidrógenos y puede ser pensado como el análogo perfluoro de polietileno (unidad estructural: -CH 2 -). PTFE tiene alta estabilidad química y térmica, como se esperaba para un perfluorocarbono, mucho más fuerte que el polietileno. Su resistencia a las fuerzas de van der Waals hace PTFE la superficie sólo se conoce en que un gecko no puede pegarse. El compuesto, sin embargo, carece de una capacidad de transformar tras la fusión, que no es un problema para varias deratives de PTFE, a saber, FEP ( etileno propileno fluorado, con algunos átomos de flúor sustituidos con el -CF 3 grupo) o PFA ( perfluoroalcoxi, algunos átomos de flúor sustituidos con - OCF 3 ). Ellos comparten la mayoría de las propiedades con PTFE, pero todavía hay diferencias, es decir, temperatura de uso máximo (más alto para el PTFE no flexible).
Hay otros plásticos fluorados distintos de perfluorado. fluoruro de polivinilideno (PVDF, unidad estructural: -CF 2 CH 2 -), es un análogo de PTFE con la mitad de los átomos de flúor. PVF ( fluoruro de polivinilo, unidad estructural: -CH 2 CHF-) contiene uno de una cuarta los átomos de flúor de PTFE. A pesar de esto, todavía tiene muchas propiedades de los compuestos más fluorados. PCTFE ( policlorotrifluoroetileno, unidad estructural: -CF 2 CFCl-) es otro compuesto importante. Se diferencia de PTFE por tener un cuarto de flúor sustituido por átomos de cloro, sin embargo, esta diferencia hace aún mayor dureza, resistencia a la fluencia, y la persistencia de la humedad.
Fluoración leve de polietileno da no hacen todo el plástico pierde sus hidrógenos de flúor; entonces sólo se ve afectada una capa delgada (0,01 mm como máximo). Esto es algo similar a la pasivación de metales: las propiedades de volumen no se ven afectados, pero las propiedades de la superficie son, sobre todo, una mayor barrera de vapor. Por lo tanto, son una alternativa más barata a los plásticos perfluorados aunque sólo superficie es importante.
Nafion es un polímero estructuralmente complicado. Tiene una columna vertebral-PTFE similar, pero también contiene cadenas laterales de éter perfluoro que terminan en ácido sulfónico (-SO 2 OH) grupos. También posee una gran estabilidad química, mientras que las propiedades exactas varían con la morfología. Sin embargo, debido a la estructura química difícil, es también relativamente convertir fácilmente a un ionómero (muestra conductividad) mediante la adición de cationes como Na + o mediante la conversión en el ácido sulfónico en lugar del fluoruro de sulfonilo dado. La conductividad se debe a que la cadena principal de carbono se separa de las cadenas laterales, formando así las regiones polares y no polares. Esta forma también es muy higroscópico.
Fluoroelastómeros, como otros elastómeros (cauchos artificiales), consisten de cadenas de polímero desordenados conectados en tres dimensiones. Los principales retos en la toma de fluorelastomers son reticulación (reacción de los polímeros no reactivos), así como la eliminación de la HF forma durante el curado. Hay tres familias principales de fluoroelasters. VDF / HFP es un sistema de copolímero de fluoruro de vinilideno y (al menos 20%) hexafluoropropileno. TFE / propileno es otro sistema copylymer con una mejor resistencia química a algunos disolventes. TFE / PMVE (éter perfluoromethylvinyl) es un sistema de copolímero que crea un fluoroelastómero perfluorado.