
Ununtrium
Antecedentes
Esta selección wikipedia ha sido elegido por los voluntarios que ayudan Infantil SOS de Wikipedia para esta Selección Wikipedia para las escuelas. SOS Children trabaja en 45 países africanos; puede ayudar a un niño en África ?
| Ununtrium | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
113 Uut | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||||||||
| desconocido | |||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | ununtrium, Uut, 113 | ||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / U n U n t r yo ə m / oon- OON -tree-əm | ||||||||||||||||||||||||||||||||||||||||||
| Categoría metálico | desconocido presumiblemente metales de transición post- | ||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 13, 7, p | ||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | [286] | ||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Rn ] 5f 14 6d 10 7s 2 7p 1 (Valor de referencia) 2, 8, 18, 32, 32, 18, 3 (Valor de referencia)  | ||||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Instituto Conjunto de Investigación Nuclear y Laboratorio Nacional Lawrence Livermore (2003) | ||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido (prevista) | ||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 18 (valor de referencia) g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 700 K , 430 ° C, 810 (valor de referencia) ° F | ||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 1400 K, 1100 ° C, 2000 (prevista) ° F | ||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 130 (valor de referencia) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 1, 2, 3, 5 (predicción) | ||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 704,9 (predicción) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 170 (predicción) pm | ||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 136 (predicción) pm | ||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 54084-70-7 | ||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de ununtrium | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
Ununtrium es el nombre temporal de un elemento químico con el símbolo temporal Uut y número atómico 113. Es un extremadamente radioactivo elemento sintético (un elemento que se puede crear en un laboratorio pero no se encuentra en la naturaleza); el isótopo conocido más estable, ununtrium-286, tiene una vida media de 20 segundos. Ununtrium primero fue creado en 2003 por la Instituto Conjunto de Investigación Nuclear en Dubna, Rusia.
En la tabla periódica , es una p-bloque Transactínido. Es un miembro de la Séptimo período y se coloca en el grupo de boro, aunque no hay experimentos químicos han llevado a cabo para confirmar que se comporta como el más pesado homólogo de talio en el grupo de boro. Ununtrium se calcula que tiene unas propiedades similares a las de sus homólogos más ligeros, boro , aluminio , galio , indio y talio, aunque también debe mostrar varias diferencias importantes de ellos. A diferencia de todos los demás elementos p-bloque, incluso se prevé que mostrar un poco de metal de transición de carácter.
Historia
Colaboración Dubna-Livermore
El primer informe de ununtrium fue en agosto de 2003, cuando se identificó como un alfa producto de desintegración del elemento 115, Ununpentium . Estos resultados fueron publicados el 1 de febrero de 2004, por un equipo integrado por científicos rusos en Dubna ( Instituto Conjunto de Investigación Nuclear), y los científicos estadounidenses en la Lawrence Livermore National Laboratory:
- 243
95 Am + 48
20 Ca → 288
115 Uup + 3 1
0 n → 284
113 Uut + α - 243
95 Am + 48
20 Ca → 287
115 Uup + 4 1
0 n → 283
113 Uut + α
La colaboración Dubna-Livermore ha fortalecido su reclamación por el descubrimiento de ununtrium mediante la realización de experimentos químicos en la final producto de la desintegración 268 Db. En experimentos en junio de 2004 y diciembre de 2005, la dubnium isótopo se identificó con éxito mediante la extracción de los productos finales de descomposición, medir fisión espontánea (SF) actividades y el uso de técnicas de identificación química para confirmar que se comportan como un grupo 5 elemento (como dubnium es conocido por ser en el grupo 5 de la tabla periódica). Tanto el modo de vida media y la decadencia se confirmaron para el proyecto de 268 Db que presta apoyo a la asignación de los padres y núcleos hijos a Ununpentium y ununtrium respectivamente. Otros experimentos en Dubna en 2005 han confirmado plenamente los datos de la desintegración de Ununpentium y ununtrium, pero en 2011, el IUPAC / Grupo de Trabajo Conjunto IUPAP (PTC) no reconoció a los dos elementos como haber sido descubierto porque la teoría actual no podía distinguir entre grupo 4 y grupo 5 elementos por sus propiedades con la suficiente confianza, y la identificación del isótopo dubnium hija fue el factor más importante para confirmar el descubrimiento de Ununpentium y ununtrium.
RIKEN
El 23 de julio de 2004, un equipo de científicos japoneses en RIKEN bombardeó un blanco de bismuto-209 con núcleos acelerados de zinc-70 y se detectó un único átomo del isótopo ununtrium-278. Publicaron sus resultados el 28 de septiembre, 2004:
- 209
83 Bi + 70
30 Zn → 278
113 Uut + 1
0 n
Anteriormente, en 2000, un equipo dirigido por el PA Wilk identificó el producto de la desintegración 266 Bh como en descomposición con propiedades idénticas a lo que el equipo japonés había observado, por lo tanto prestar apoyo a su reclamo. Sin embargo, también observaron la hija de 266 Bh, 262 Db , se someten a la desintegración alfa en lugar de la fisión espontánea (que el equipo japonés observado).
El equipo RIKEN produjo un átomo más el 2 de abril de 2005, aunque los datos de decaimiento fueron ligeramente diferente de la primera cadena, tal vez debido a ya sea la formación de una estado metaestable o una partícula alfa escapa del detector antes de depositar su energía completa. Debido a estas inconsistencias en los datos de la desintegración, el pequeño número de átomos ununtrium producidos, y la falta de anclajes inequívocos para isótopos conocidos, el programa de trabajo conjunto no aceptaron esto como un descubrimiento concluyente de ununtrium en 2011.
Más recientemente, la producción y la identificación de otro núcleo Uut 278 ocurrieron en RIKEN el 12 de agosto de 2012. En este caso, se observó una serie de seis desintegraciones alfa:
- 278
113 Uut → 274
111 Rg + α → 270
109 Mt + α → 266
107 Bh + α → 262
105 Db + α → 258
103 Lr + α → 254
101 Md + α
Esta cadena de desintegración difería de las observaciones anteriores en RIKEN principalmente en el modo de desintegración de dubnium, que se observó previamente a someterse a la fisión espontánea, pero en este caso en lugar de alfa decayó. Debido a que la desintegración alfa del dubnium-262 a Laurencio-258 es bien sabido, esto proporciona una prueba inequívoca de que el elemento 113 es el origen de la cadena. Los científicos en este equipo calcularon la probabilidad de accidente coincidencia para ser 10 -28, o totalmente insignificante.
Naming
Ununtrium es el elemento más ligero que aún no ha recibido un nombre oficial. Uso Nomenclatura de Mendeleev para elementos sin nombre y sin descubrir, ununtrium debe ser conocido como eka- talio o DVI- indio . En 1979 la IUPAC publicó recomendaciones según las cuales el elemento iba a ser llamado ununtrium (con el símbolo correspondiente de Uut), un Nombre de elemento sistemático como marcador de posición, hasta que se confirmó y el descubrimiento del elemento de un nombre se decide. Las recomendaciones son ignoradas en gran medida entre los científicos, que la llaman "elemento 113", con el símbolo de (113) o incluso simplemente 113.
Reclamaciones al descubrimiento de ununtrium se han presentado tanto por los equipos de Dubna y RIKEN. La Grupo de Trabajo Conjunto de IUPAC / IUPAP (PTC) decidirá a quién se le dará el derecho de sugerir un nombre. En 2011, la IUPAC 2004 evaluó los experimentos RIKEN y 2004 y 2007 experimentos Dubna, y concluyó que no cumplían con los criterios para el descubrimiento.
Los siguientes nombres han sido sugeridos por los equipos antes mencionados afirman descubrimiento:
| Grupo | Nombre propuesto | Derivación |
|---|---|---|
| RIKEN | Japonium | Japón: el país de los demandantes de grupo |
| Rikenium | RIKEN: Instituto de demandantes de grupo | |
| Nishinanium | Yoshio Nishina, físico japonés |
Nucleosíntesis
Elementos súper pesados como ununtrium se producen mediante el bombardeo de elementos más ligeros en aceleradores de partículas que inducen reacciones de fusión. Considerando que la mayoría de los isótopos de ununtrium pueden sintetizarse directamente de esta manera, algunos otros más pesados sólo se han observado como productos de desintegración de elementos con mayores números atómicos .
Dependiendo de las energías involucradas, los primeros están separados en "caliente" y "frío". En las reacciones de fusión en caliente,, proyectiles de alta energía muy ligeros son acelerados hacia objetivos muy pesados ( actínidos ), dando lugar a núcleos compuestos en energía de alta excitación (~ 40-50 MeV) que puede evaporarse ya sea de fisión o varios 3 a 5) neutrones (. En las reacciones de fusión en frío, los núcleos condensados producidos tienen una energía de excitación relativamente baja (~ 10-20 MeV), que disminuye la probabilidad de que estos productos serán sometidos a las reacciones de fisión. Mientras los núcleos fundidos se enfríen a la estado fundamental, que requieren emisión de sólo uno o dos neutrones, y por lo tanto, permite la generación de productos más ricos en neutrones. Este último es un concepto diferente de la de la fusión nuclear, donde se reivindica que deberían alcanzarse en condiciones de temperatura ambiente (ver fusión fría).
Fusión fría
Antes de la síntesis exitosa de ununtrium por el equipo RIKEN, científicos de la Instituto de Investigación de Iones Pesados (Gesellschaft für Schwerionenforschung) en Darmstadt, Alemania también trató de sintetizar ununtrium mediante el bombardeo de bismuto-209 con zinc-70 en 1998. No hay átomos de ununtrium se identificaron dos carreras separadas de la reacción. Repitieron el experimento en 2003 otra vez sin éxito. A finales de 2003, el equipo de emergentes en RIKEN utilizando su GARIS aparato eficiente intentó la reacción y llegó a un límite de 140 fb. En diciembre 2003-agosto 2004, recurrieron a la "fuerza bruta" y llevó a cabo la reacción durante un período de ocho meses. Ellos fueron capaces de detectar un solo átomo de 278 Uut. Repitieron la reacción en varias carreras en 2005 y fueron capaces de sintetizar un segundo átomo.
Fusión caliente
En junio de 2006, el equipo de Dubna-Livermore sintetiza ununtrium directamente bombardeando un neptunio -237 objetivo con acelerada calcio-48 núcleos:
- 237
93 Np + 48
20 Ca → 282
113 Uut + 1
0 n
Se detectaron dos átomos de 282 Uut.
Como producto de la desintegración
| Residuo de evaporación | Isótopo ununtrium observada |
|---|---|
| 294 Uus, 290 Uup | 286 Uut |
| 293 Uus, 289 Uup | 285 Uut |
| 288 Uup | 284 Uut |
| 287 Uup | 283 Uut |
Ununtrium se ha observado que los productos de desintegración de Ununpentium. Ununpentium actualmente tiene cuatro isótopos conocidos; todos ellos se someten alfa decae para convertirse núcleos ununtrium, con números de masa entre 283 y 286. Los núcleos Ununpentium Padres pueden ser ellos mismos los productos de desintegración de ununseptium. Hasta la fecha, no hay otros elementos se han conocido a decaer a ununtrium. Por ejemplo, en enero de 2010, el equipo de Dubna ( ICIN) identificado ununtrium-286 como un producto en el decaimiento de ununseptium a través de una secuencia de desintegración alfa:
- 294
117 Uus → 290
115 Uup + 4
2 Él - 290
115 Uup → 286
113 Uut + 4
2 Él
Isótopos
| Isótopo | Media vida | Decaimiento modo | Descubrimiento año | Reacción |
|---|---|---|---|---|
| 278 Uut | 0,24 | α | 2004 | 209 Bi (70 Zn, n) |
| 282 Uut | 70 ms | α | 2006 | 237 Np (48 Ca, 3n) |
| 283 Uut | 0.10 s | α | 2003 | 287 Uup (-, α) |
| 284 Uut | 0.48 s | α | 2003 | 288 Uup (-, α) |
| 285 Uut | 5.5 s | α | 2009 | 293 Uus (-, 2α) |
| 286 Uut | 20 s | α | 2009 | 294 Uus (-, 2α) |
| 287 Uut | 20? min | α, SF? | desconocido | - |
Ununtrium no tiene isótopos estables o de origen natural. Varios isótopos radiactivos han sido sintetizados en el laboratorio, ya sea mediante la fusión de dos átomos o mediante la observación de la desintegración de elementos más pesados. Seis isótopos diferentes de ununtrium se han reportado con masas atómicas 278 y 282 a 286; todos ellos se descomponen a través de la desintegración alfa.
Estabilidad y vida media

Todos los isótopos ununtrium son extremadamente inestable y radiactivos; sin embargo, los isótopos más pesados ununtrium son más estables que el encendedor. El isótopo ununtrium más estable conocido, 286 Uut, es también el más pesado isótopo ununtrium conocido; que tiene una vida media de 20 segundos. El isótopo 285 Uut ha informado de que también tienen una vida media de más de un segundo. El isótopos 284 y 283 Uut Uut tienen vidas medias de 0,48 y 0,10 segundos, respectivamente. Los dos isótopos restantes tienen vidas medias entre 0,1 y 100 milisegundos: 282 Uut tiene una vida media de 70 milisegundos, y 278 Uut, el isótopo más ligero ununtrium conocido, es también el conocido isótopo ununtrium más corta vivido, con una vida media de sólo 0,24 milisegundos. Se predice que incluso los más pesados no descubierto isótopos ununtrium podrían ser mucho más estable: por ejemplo, 287 Uut se prevé contar con una vida media de alrededor de 20 minutos, cerca de dos órdenes de magnitud mayor que la de 286 Uut.
Estimaciones teóricas de desintegración alfa media-vida de los isótopos de ununtrium están en buen acuerdo con los datos experimentales. El isótopo no descubierto 293 Uut ha pronosticado para ser el más estable hacia desintegración beta; sin embargo, ningún isótopo ununtrium conocido se ha observado que someterse a la desintegración beta.
La estabilidad de los núcleos disminuye en gran medida con el aumento de número atómico después de plutonio , el más pesado elemento primordial, por lo que todos los isótopos con un número atómico de arriba 101 decaer radiactivamente con una vida media en virtud de un día, con la excepción de dubnium -268. No hay elementos con números atómicos por encima de 82 (después de plomo ) tienen isótopos estables. Sin embargo, debido razones no muy bien entendidas aún, hay un ligero aumento de la estabilidad nuclear alrededor de números atómicos 110 - 114 , que conduce a la aparición de lo que se conoce en la física nuclear como la " isla de estabilidad ". Este concepto, propuesto por Universidad de profesor de California Glenn Seaborg, explica por qué elementos superpesados duran más de lo previsto.
Propiedades predichas
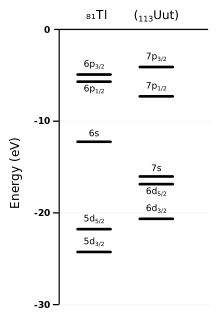
Ununtrium es el primer miembro de la serie 7p de elementos y el más pesado boro elemento de grupo en la tabla periódica, por debajo de boro , aluminio , galio , indio y talio . Se prevé para mostrar muchas diferencias de sus homólogos más ligeros: un efecto en gran medida contribuye es la spin-órbita (SO) la interacción. Es especialmente fuerte para el elementos superpesados, debido a que sus electrones se mueven mucho más rápido que en los átomos más ligeros, a velocidades comparables a la velocidad de la luz , que es donde las diferencias se deben a. En relación a los átomos de ununtrium, disminuye el 7s y los niveles de energía de electrones 7p (estabilizadoras los electrones correspondientes), pero dos de los niveles de energía de electrones 7p se estabilizan más de los otros cuatro. La estabilización de los electrones 7s se llama efecto inerte par, y el efecto "desgarro" la 7p subshell en el más estabilizada y las partes menos estabilizadas se llama la división subnivel. Químicos Computación ver la división como un cambio de la segunda ( azimutal) número cuántico l de 1 a 1/2 y 3/2 para las partes más estabilizados y menos estabilizadas de la subshell 7p, respectivamente. Para muchos propósitos teóricos, la configuración electrónica de valencia puede ser representado para reflejar la división subshell 7p como 7s 2 7p medio 1. Estos efectos se estabilicen los estados de oxidación más bajos: se espera que la primera energía de ionización de ununtrium ser 7.306 eV, el más alto entre los elementos del grupo del boro. Por lo tanto, el estado de oxidación más estable de ununtrium se prevé que sea el estado 1. También existen diferencias para otros niveles de electrones. Por ejemplo, los niveles de electrones 6d (también divididos en dos mitades, con cuatro siendo 6d 3/2 y 5/2 de seis ser 6d) están ambos en relieve, de modo que están cerca en energía a los 7s queridos. Por lo tanto, los niveles de electrones 6d, siendo desestabilizado, deben ser capaces de participar en las reacciones químicas en los 7p elementos anteriores (hasta alrededor Ununpentium ), lo que hace que se comporten de alguna manera como los metales de transición y permitir que los estados de oxidación superiores. Ununtrium por lo tanto también debe ser capaz de mostrar estables 2, 3 y 5 estados de oxidación. Sin embargo, el estado 3 todavía debe ser menos estable que el estado 1, siguiendo tendencias periódicas. Ununtrium debe ser el más electronegativo entre todos los elementos del grupo del boro: por ejemplo, en el compuesto Uut Uus, se espera que la carga negativa para estar en el átomo de ununtrium en lugar del átomo de ununseptium, lo contrario de lo que cabría esperar de la simple periodicidad. La afinidad electrónica del ununtrium se calcula que es alrededor de 0,68 eV; En comparación, la de talio es 0,4 eV. La alta afinidad electrónica y electronegatividad de ununtrium son debido a que es sólo un corto de electrones de la configuración electrónica de valencia cerrado-shell de flerovium (7s 2 7p media 2).
El compuesto ununtrium más simple posible es la monohidruro, Uut H . La unión es proporcionada por el 7p medio de electrones de ununtrium y el electrón 1s del hidrógeno. Sin embargo, la interacción hace que el SO energía de monohidruro ununtrium unión a reducirse en aproximadamente 1 eV y la longitud de enlace ununtrium-hidrógeno a disminuir a medida que la unión 7p media orbital es contratado relativista. El monofluoruro análoga (Uut F ) también debería existir. Ununtrium también debe ser capaz de formar el trihidruro (UutH 3), trifluoruro de (UutF 3), y tricloruro de (Uut Cl 3), con ununtrium en el estado de oxidación +3. Debido a que los electrones 6d están implicados en la unión en lugar de los 7S, estas moléculas se prevé están En forma de T y no trigonal plana. Aunque el UutF anión polifluoruro -
6 debe ser estable, la correspondiente UutF fluoruro neutro 5 debería ser inestable, de forma espontánea en descomposición en el trifluoruro y flúor elemental. Ununtrium (I) se prevé que sea más similar a la plata (I) de talio (I).
Se espera Ununtrium a ser mucho más denso que el talio, que tiene una densidad predicho de aproximadamente 18 g / cm 3, debido a la estabilización relativista y la contracción de sus 7s y 7p medio orbitales. Esto es porque los cálculos estimar que tenga un radio atómico de aproximadamente 170 pm, la misma que la de talio, aunque tendencias periódicas predicen para tener un radio atómico mayor que la de talio debido a que es uno período más abajo en la tabla periódica. Los puntos de fusión y ebullición de ununtrium no se conoce definitivamente, pero se han calculado en 430 ° C y 1100 ° C, respectivamente, superior a los valores de galio, indio, talio, y siguientes tendencias periódicas.
