
Tungsteno
Antecedentes de las escuelas de Wikipedia
SOS Children produjo este sitio web para las escuelas, as?? como este sitio web video sobre ??frica . Con Infantil SOS se puede elegir a apadrinar a los ni??os en m??s de cien pa??ses
| Tungsteno | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
74 W | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||||||||||||||||||||
blanco gris??ceo, lustroso  | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, s??mbolo, n??mero | tungsteno, W, 74 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciaci??n | / t ʌ ŋ s t ən / TUNG -stən; / w ʊ l F r əm / Wuul -frəm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Categor??a Elemento | metal de transici??n | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, per??odo, bloque | 6, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso at??mico est??ndar | 183.84 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuraci??n electr??nica | [ Xe ] 4f 14 5d 4 6s 2 2, 8, 18, 32, 12, 2 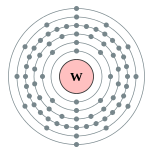 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Torbern Bergman (1781) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Juan Jos?? Elhuyar y Fausto Elhuyar (1783) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades f??sicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | s??lido | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 19,25 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| L??quido densidad en mp | 17,6 g ?? cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 3695 K , 3422 ?? C, 6192 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 5828 K, 5555 ?? C, 10.031 ?? F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto cr??tico | 13.892 K, MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusi??n | 35.3 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporizaci??n | 806.7 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calor??fica molar | 24.27 J ?? mol -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Presi??n del vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades at??micas | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidaci??n | 6, 5, 4, 3, 2, 1, 0, -1, -2 (Levemente ??cida ??xido) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,36 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Energ??as de ionizaci??n | Primero: 770 kJ ?? mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1700 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio at??mico | 139 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 162 ?? 19:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel??nea | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | centrada en el cuerpo c??bico  | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magn??tico | paramagn??tico | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad el??ctrica | (20 ?? C) 52,8 nΩ ?? m | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad t??rmica | 173 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansi??n t??rmica | (25 ?? C) 4,5 micras ?? m -1 ?? K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| El m??dulo de Young | 411 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| M??dulo de corte | 161 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| M??dulo de volumen | 310 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Relaci??n de Poisson | 0.28 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 7.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 3430 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 2570 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| N??mero de registro del CAS | 7440-33-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayor??a de los is??topos estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Art??culo principal: Los is??topos de tungsteno | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Tungsteno, tambi??n conocido como wolframio, es un elemento qu??mico con el s??mbolo qu??mico W y n??mero at??mico 74. La palabra de tungsteno viene del idioma sueco tung sten directamente traducible a piedra pesada, aunque el nombre es volfram en sueco para distinguirlo de Scheelita, en sueco tungsteno llamado alternativamente.
A, rara duro de metal en condiciones normales cuando no combinado, tungsteno se encuentra de forma natural en la Tierra s??lo en compuestos qu??micos. Se identific?? como un nuevo elemento en 1781, y primera aisl?? en forma de un metal en 1783. Su importante minerales incluyen wolframita y scheelita. La elemento libre es notable por su robustez, sobre todo el hecho de que tiene el m??s alto punto de fusi??n de todos los no- metales aleados y el segundo m??s alto de todos los elementos despu??s de carbono . Tambi??n es destacable su alta densidad de 19,3 veces la del agua, comparable a la de uranio y oro , y mucho m??s altos (aproximadamente 1,7 veces) que la de plomo . Tungsteno con peque??as cantidades de impurezas es a menudo fr??gil y duro, lo que hace dif??cil trabajo. Sin embargo, el tungsteno muy puro, aunque sigue siendo dif??cil, es m??s d??ctil, y se puede cortar con un acero duro sierra para metales.
Muchas aleaciones de tungsteno tienen numerosas aplicaciones, especialmente en incandescente filamentos de bombillas, Tubos de rayos X (como tanto el filamento y objetivo), electrodos de soldadura TIG , y superaleaciones. Dureza de tungsteno y de alta densidad dan aplicaciones militares en penetrar proyectiles. Los compuestos de tungsteno se utilizan con mayor frecuencia en la industria como catalizadores .
El tungsteno es el ??nico metal de la tercera transici??n serie que se sabe que ocurren en biomol??culas, donde se utiliza en unas pocas especies de bacterias y arqueas. Es el elemento m??s pesado conocido por ser utilizado por cualquier organismo vivo. Tungsteno interfiere con molibdeno y cobre metabolismo, y es algo t??xico para la vida animal.
Historia
En 1781, Carl Wilhelm Scheele descubri?? que un nuevo ??cido , ??cido t??ngstico, se podr??a hacer desde scheelita (en el momento llamado tungsteno). Scheele y Torbern Bergman sugiri?? que podr??a ser posible obtener un nuevo metal mediante la reducci??n de este ??cido. En 1783, Jos?? y Fausto Elhuyar encontr?? un ??cido a partir de wolframita que era id??ntico al ??cido t??ngstico. M??s tarde ese a??o, en Espa??a, los hermanos lograron aislar tungsteno por reducci??n de este ??cido con carb??n de le??a, y se le atribuye el descubrimiento del elemento.
En la Segunda Guerra Mundial , el tungsteno jug?? un papel significativo en el fondo las relaciones pol??ticas. Portugal, como la principal fuente europea del elemento, fue puesto bajo presi??n de ambos lados, a causa de sus yacimientos de mineral de wolframio en Panasqueira. La resistencia de tungsteno a altas temperaturas y su fortalecimiento de aleaciones hicieron una importante materia prima para la industria de las armas.
Etimolog??a
El nombre de "tungsteno" (de la Nordic tung sten, que significa "piedra pesada") se utiliza en Ingl??s, franc??s, y muchos otros idiomas como el nombre del elemento. Tungsteno era el nombre antiguo de Suecia para la scheelita mineral. El otro nombre "wolfram" (o "volfram"), que se utiliza por ejemplo en los idiomas m??s europea (especialmente germ??nicos y eslavos), se deriva del mineral wolframita, y esto tambi??n es el origen de su s??mbolo qu??mico, W. El nombre "wolframita" se deriva del alem??n "Rahm lobo" ("holl??n lobo" o "crema lobo"), el nombre dado al tungsteno por Johan Gottschalk Wallerius en 1747. Esto, a su vez, deriva de "Lupi spuma", el nombre Georg Agricola utiliza para el elemento en 1546, lo que se traduce en Ingl??s como "espuma de lobo" o "crema" (la etimolog??a no es del todo cierto), y es una referencia a las grandes cantidades de esta??o consumidos por el mineral durante su extracci??n.
Caracter??sticas
Propiedades f??sicas
En forma cruda de tungsteno, es un gris acero duro de metal que a menudo fr??gil y dif??cil de trabajo. Si se hace muy puro, tungsteno conserva su dureza (que excede a la de muchos aceros), y se convierte basta con que se puede trabajar f??cilmente maleable. Se trabaja por forja, dibujo, o extrusi??n. Objetos de tungsteno tambi??n se forman com??nmente por sinterizaci??n.
De todos los metales en forma pura, tungsteno tiene el m??s alto punto de fusi??n (3422 ?? C , 6192 ?? F), m??s bajo presi??n de vapor (a temperaturas superiores a 1650 ?? C, 3000 ?? F) y el mayor resistencia a la tracci??n. El tungsteno tiene la m??s baja coeficiente de expansi??n t??rmica de cualquier metal puro. La expansi??n t??rmica de baja y alta temperatura de fusi??n y resistencia a la tracci??n de tungsteno originados por el fuerte enlaces covalentes formados entre ??tomos de tungsteno por los electrones 5d. La aleaci??n de peque??as cantidades de tungsteno con acero aumenta en gran medida su tenacidad.
Tungsteno existe en dos principales formas cristalinas α y β:. El primero tiene una centrada en el cuerpo estructura c??bica y es la forma m??s estable. La estructura de la fase β se llama A15 c??bico; es metaestable, pero puede coexistir con la fase α en condiciones ambientales debido a la s??ntesis de no equilibrio o estabilizaci??n por las impurezas. Contrariamente a la fase α que cristaliza en granos isom??tricos, la forma β exhibe una columnar h??bito. La fase α tiene unas tres veces m??s bajo la resistividad el??ctrica y una mucho menor temperatura de transici??n superconductora T C que en la fase β: ca. 0.015 K vs. 1-4 K; mezclar las dos fases permite obtener valores de T C intermedicate. El valor T C tambi??n se puede elevar por de aleaci??n de tungsteno con otro metal (por ejemplo, 7,9 K para W- Tc ). Tales aleaciones de tungsteno se utilizan a veces en circuitos superconductores de baja temperatura.
Is??topos
Tungsteno de origen natural se compone de cinco is??topos cuyas vidas media son tan largos que pueden considerarse estable . En teor??a, los cinco puede decaer en is??topos del elemento 72 ( hafnio ) por emisi??n alfa, pero s??lo 180 W se ha observado que hacerlo con una vida media de (1,8 ?? 0,2) x 10 18 a??os; en promedio, esto produce alrededor de dos desintegraciones alfa de 180 W en un gramo de tungsteno natural por a??o. Los otros is??topos naturales no se han observado a las caries, lo que limita sus vidas medias para ser
- 182 W, T 1/2> 1,7 ?? 10 20 a??os
- 183 W, T 1/2> 8 ?? 10 19 a??os
- 184 W, T 1/2> 1,8 ?? 10 20 a??os
- 186 W, T 1/2> 4,1 ?? 10 18 a??os
Otro 30 artificial radiois??topos de tungsteno se han caracterizado, el m??s estable de los cuales son 181 W con una vida media de 121,2 d??as, 185 W con una vida media de 75,1 d??as, 188 W con una vida media de 69,4 d??as, 178 W con una la vida media de 21,6 d??as, y 187 W con una vida media de 23,72 h. Todos los restantes is??topos radiactivos tienen vidas medias de menos de 3 horas, y la mayor??a de ellos tienen vidas medias inferiores a 8 minutos. El tungsteno tambi??n tiene 4 estados de la meta, el ser m??s estable 179m W (T ?? 6,4 minutos).
Propiedades qu??micas
Tungsteno Elemental resiste el ataque del ox??geno, ??cidos , y ??lcalis.
El oficial m??s com??n estado de oxidaci??n del tungsteno es 6, pero exhibe todos los estados de oxidaci??n -2-6. Tungsteno normalmente se combina con el ox??geno para formar el amarillo ??xido t??ngstico, WO 3, que se disuelve en soluciones acuosas alcalinas para formar iones de tungstato, WO 2-
4.
Carburos de tungsteno (W 2 C y WC) son producidos por el calentamiento de tungsteno en polvo con carbono . W 2 C es resistente al ataque qu??mico, aunque reacciona fuertemente con el cloro para formar hexacloruro de tungsteno (WCl6).
En soluci??n acuosa, tungstato da la heteropoli??cidos y polioxometalato aniones en condiciones neutras y ??cidas. Como tungstato es tratado progresivamente con ??cido, se produce la primera soluble, metaestable "paratungstato A" ani??n , W
7 O 6-
24, que con el tiempo se convierte en el ani??n menos soluble "paratungstato B", H
2 W
12 O 10
42. Adem??s la acidificaci??n produce el ani??n metatungstato muy soluble, H
2 W
12 O 6-
40, despu??s de lo cual se alcanza el equilibrio. El i??n metawolframato existe como un conjunto sim??trico de doce tungsteno- ox??geno octaedros conocido como el Ani??n Keggin. Existen muchos otros aniones polioxometalato como especies metaestables. La inclusi??n de un ??tomo diferente, como el f??sforo en lugar de las dos centrales hidr??genos en metatungstato produce una amplia variedad de heteropoli??cidos, tales como H ??cido fosfot??ngstico 3 PW 12 O 40.
Puede formar tri??xido de tungsteno compuestos de intercalaci??n con metales alcalinos. Estos son conocidos como bronces; un ejemplo es bronce de tungsteno s??dico.
Aparici??n
Tungsteno se encuentra en los minerales wolframita ( hierro - manganeso tungstato, (Fe, Mn) WO 4), scheelita ( calcio tungstato, (CaWO 4), ferberita (FeWo 4) y h??bnerita (MnWO 4). China produjo 51.000 toneladas de concentrado de tungsteno en 2009, que era el 83% de la producci??n mundial. En la antesala de la Segunda Guerra Mundial la producci??n de China de tungsteno desempe??ado un papel a medida que China podr??a utilizar esta influencia para exigir la asistencia material del gobierno de Estados Unidos. La mayor parte de la producci??n restante se origin?? en Rusia (2.500 t), Canad?? (1.964 t), Bolivia (1.023 t), Austria (900 t), Portugal (900 t), Tailandia (600 t), Brasil (500 t), Per?? (500 t) y Ruanda (500 t). El tungsteno tambi??n se considera para ser una mineral, debido a las pr??cticas mineras no ??ticas observados en la Rep??blica Democr??tica del Congo conflicto.
Papel biol??gico
Tungsteno, en el n??mero at??mico 74, es el elemento m??s pesado conocido por ser biol??gicamente funcional, siendo el yodo pr??xima m??s pesada (Z = 53). Aunque no en eucariotas , tungsteno es utilizado por algunas bacterias. Por ejemplo, enzimas llamadas oxidorreductasas utilizan tungsteno de manera similar al molibdeno mediante su uso en un tungsteno- complejo pterina con molibdopterina (molibdopterina, a pesar de su nombre, no contiene molibdeno, pero pueden ser complejas, ya sea con molibdeno o tungsteno en uso por los organismos vivos). Enzimas de tungsteno que utilizan normalmente reducen los ??cidos carbox??licos a aldeh??dos. El tungsteno oxidorreductasas tambi??n pueden catalizar oxidaciones. La primera enzima de tungsteno que requieren ser descubierto tambi??n requiere selenio, y en este caso el par de tungsteno-selenio puede funcionar de manera an??loga a la pareja de molibdeno-azufre de algunos molibdeno cofactor que requieren enzimas. Una de las enzimas en la familia oxidorreductasa que a veces emplean tungsteno (bacteriana formiato deshidrogenasa H) se conoce el uso de una versi??n de selenio y molibdeno de molybdopterin. Aunque se ha encontrado una xantina deshidrogenasa que contiene volframio a partir de bacterias que contienen tungsteno-molydopterin y tambi??n no unido a prote??nas selenio, un complejo molybdopterin tungsteno-selenio no se ha descrito definitivamente.
En el suelo, tungsteno met??lico se oxida a la ani??n tungstato. Puede ser selectiva o no selectiva importado por algunos organismos procariotas y pueden sustituir a molibdato en cierta enzimas. Su efecto sobre la acci??n de estas enzimas es en algunos casos y en otros inhibidores positivos. La qu??mica del suelo determina c??mo se polimeriza el tungsteno; suelos alcalinos causan tungstatos monom??ricos; ??cidas suelos causan tungstatos polim??ricos.
Tungstato de sodio y plomo han sido estudiados por su efecto sobre la lombrices de tierra. El plomo se encontr?? que era letal en niveles bajos y tungstato de sodio fue mucho menos t??xico, pero el tungstato completamente inhibida su la capacidad reproductiva.
El tungsteno se ha estudiado como un metab??lica cobre biol??gica antagonista, en un papel similar a la acci??n de molibdeno. Se ha encontrado que tetrathiotungstates se pueden utilizar como cobre biol??gica productos qu??micos de quelaci??n, similar a la tetrathiomolybdates.
Producci??n

Acerca de 61.300 toneladas de concentrados de tungsteno se produjeron en el a??o 2009. El tungsteno se extrae de sus minerales en varias etapas. El mineral se convierte eventualmente a tungsteno (VI) ??xido (WO 3), que se calienta con hidr??geno o de carbono para producir tungsteno en polvo. Debido a la alta punto de fusi??n del tungsteno, no es comercialmente factible fundido de tungsteno lingotes. En lugar de ello, tungsteno en polvo se mezcla con peque??as cantidades de n??quel en polvo u otros metales, y sinterizado. Durante el proceso de sinterizaci??n, el n??quel se difunde en el tungsteno, la producci??n de una aleaci??n.
El tungsteno tambi??n se puede extraer por reducci??n con hidr??geno de WF 6:
- WF 6 + 3 H 2 → W + 6 HF
o descomposici??n pirol??tica:
- WF 6 → W + 3 F 2 ( Δ H r = +)
El tungsteno no se comercializa como un contrato de futuros y no se puede seguir en los intercambios como el Londres Bolsa de Metales. Los precios se cotizan generalmente para concentrado de tungsteno o WO 3. Si, convertido al equivalente de metal, que eran cerca de 19.000 por tonelada en 2009.
Aplicaciones


Aproximadamente la mitad de la de tungsteno se consume para la producci??n de materiales duros - a saber, carburo de tungsteno - con el uso principal restante estar en aleaciones y aceros. Menos de 10% se utiliza en otros compuestos qu??micos .
Los materiales duros
Tungsteno se utiliza principalmente en la producci??n de materiales duros basado en carburo de tungsteno, uno de los m??s dif??ciles carburos, con un punto de fusi??n de 2770 ?? C. WC es un eficiente conductor el??ctrico, pero W 2 C es menos. WC se utiliza para hacer resistente al desgaste abrasivos y cuchillas y cuchillos para ejercicios, sierras circulares, fresado y girando herramientas utilizadas por los de metal mec??nica, carpinter??a, miner??a , petr??leo y las industrias de cuentas y de la construcci??n de cerca del 60% del consumo actual de tungsteno.
La joyer??a de la industria hace que los anillos de carburo de tungsteno sinterizado, tungsteno compuestos de carburo / metal, y tambi??n de tungsteno met??lico. A veces los fabricantes o minoristas se refieren a carburo de tungsteno como un metal, pero es una cer??mica. Debido a la dureza de tungsteno de carburo, anillos hechos de este material son extremadamente resistente a la abrasi??n, y celebrar?? un acabado bru??ido m??s de anillos de tungsteno met??lico. Anillos de carburo de tungsteno son fr??giles, sin embargo, y pueden agrietarse bajo un golpe fuerte.
Aleaciones
La dureza y la densidad de tungsteno se aplican en la obtenci??n de metal pesado aleaciones. Un buen ejemplo es de acero de alta velocidad, que puede contener hasta un 18% de tungsteno. Alto punto de fusi??n del tungsteno tungsteno hace un buen material para aplicaciones como toberas de cohetes, por ejemplo en el UGM-27 Polaris lanzados desde submarinos de misiles bal??sticos. Superaleaciones que contienen tungsteno, tales como Hastelloy y Stellite, se utilizan en aspas de las turbinas y piezas resistentes al desgaste y recubrimientos.
Armamento
Tungsteno, generalmente aleado con n??quel y hierro o de cobalto para formar aleaciones pesadas, se utiliza en penetradores de energ??a cin??tica como una alternativa a uranio empobrecido, en aplicaciones en las que el uranio de radiactividad es problem??tico, o donde de adicional de uranio no se requieren propiedades pirof??ricas (por ejemplo, en peque??as balas de armas ordinarias dise??ados para penetrar la armadura corporal). Del mismo modo, aleaciones de tungsteno tambi??n se han utilizado en proyectiles de ca????n, granadas y misiles, para crear metralla supers??nica. El tungsteno tambi??n se ha utilizado en Explosivos de Metal Inerte Denso, que lo utilizan como polvo denso para reducir los da??os colaterales al tiempo que aumenta la letalidad de explosivos dentro de un radio peque??o.
Aplicaciones Qu??micas
Tungsteno (IV) sulfuro es una temperatura alta lubricante y es un componente de catalizadores para hidrodesulfuraci??n. MoS2 es m??s com??nmente utilizado para este tipo de aplicaciones.
Tungsteno ??xidos se utilizan en esmaltes cer??micos y de calcio / magnesio tungstatos se utilizan ampliamente en iluminaci??n fluorescente. Cristal tungstatos se utilizan como detectores de centelleo en la f??sica nuclear y medicina nuclear. Otras sales que contienen tungsteno se utilizan en la industria qu??mica y industrias del curtido.
??xido de tungsteno (WO 3) se incorpora en catalizadores de reducci??n catal??tica selectiva (SCR) que se encuentran en las plantas de energ??a de carb??n. Estos catalizadores convierten oxido de nitr??geno ( NOx) a nitr??geno (N 2) y agua (H 2 O) usando amoniaco (NH 3). El ??xido de tungsteno ayuda con la fuerza f??sica del catalizador y se extiende la vida del catalizador.
Usos de nicho
Las aplicaciones que requieren su alta densidad incluyen pesos, contrapesos, quillas de lastre para yates, lastre cola de aviones comerciales, y como lastre en los coches de carreras de NASCAR y F??rmula Uno ; uranio empobrecido se utiliza tambi??n para estos prop??sitos, debido a la alta densidad de manera similar. Bloques de 75 kg de tungsteno fueron utilizados como "dispositivos de medios de equilibrio de crucero" en la parte de veh??culo de entrada de la nave espacial Mars Science Laboratory 2012. Es un material ideal para usar como una mu??eca para remachado, donde la masa necesario para obtener buenos resultados se puede lograr en una barra compacta. Aleaciones de alta densidad de tungsteno con n??quel, cobre o hierro se utilizan en alta calidad dardos (para permitir un di??metro m??s peque??o y agrupaciones por lo tanto m??s estrictos) o para se??uelos de pesca (bolas de tungsteno permiten la mosca se hunda r??pidamente). Algunos tipos de Cuerdas de instrumentos musicales se enrollan con cables de tungsteno.
Tungstato de sodio se utiliza en El reactivo de Folin-Ciocalteu, una mezcla de diferentes productos qu??micos utilizados en el "ensayo de Lowry" para el an??lisis de contenido de prote??na.
Sustituci??n de Oro
Su densidad, similar a la de oro, permite tungsteno para ser usado en la joyer??a como una alternativa al oro o platino . Tungsteno met??lico es m??s dif??cil que las aleaciones de oro (aunque no tan duro como el carburo de tungsteno), y es hipoalerg??nico, por lo que es ??til para anillos que resistir?? los ara??azos, especialmente en dise??os con un acabado cepillado.
Debido a que la densidad es tan similar al oro (tungsteno es s??lo un 0,36% menos denso), tungsteno tambi??n se puede utilizar en la falsificaci??n de barras de oro, como mediante siembra de una barra de tungsteno con el oro, que se ha observado desde la d??cada de 1980, o tomar una barra de oro existente, los agujeros de perforaci??n, y reemplazar el oro extra??do con barras de tungsteno. Las densidades no son exactamente lo mismo, y otras propiedades de oro y tungsteno diferir, pero tungsteno chapado en oro pasar??n pruebas superficiales.
Tungsteno chapado en oro es comercialmente disponible de China (la principal fuente de tungsteno), tanto en joyer??a y en forma de barras.
Electr??nica
Debido a que conserva su resistencia a altas temperaturas y tiene un alto punto de fusi??n , tungsteno elemental se utiliza en muchas aplicaciones de alta temperatura, tales como bombilla, de rayos cat??dicos tubo, y filamentos del tubo de vac??o, elementos de calefacci??n, y toberas de los motores de cohetes. Su alto punto de fusi??n tambi??n hace de tungsteno adecuados para el sector aeroespacial y de alta temperatura utiliza tales como, aplicaciones de calefacci??n, y de soldadura el??ctricos, en particular en la soldadura por arco de tungsteno con gas de proceso (tambi??n llamado gas inerte de tungsteno (TIG)).
Debido a sus propiedades conductoras y la inercia qu??mica relativa, tungsteno tambi??n se utiliza en electrodos, y en el emisor consejos en instrumentos de haz electr??nico que utilizan ca??ones de emisi??n de campo, tales como microscopios electr??nicos. En electr??nica, tungsteno se utiliza como un material de interconexi??n en circuitos integrados , entre el di??xido de silicio material diel??ctrico y los transistores. Se utiliza en pel??culas met??licas, que sustituyen el cableado utilizado en la electr??nica convencional con una capa de tungsteno (o molibdeno ) en silicio .
La estructura electr??nica de tungsteno hace que sea una de las principales fuentes de Objetivos de rayos X, y tambi??n para el apantallamiento de radiaciones de alta energ??a (tal como en el industria radiof??rmaco para el blindaje de muestras radiactivas FDG). Polvo de tungsteno se utiliza como un material de relleno en pl??sticos compuestos, que se utilizan como un sustituto no t??xico para el plomo en balas, tiro, y escudos de radiaci??n. Dado que la expansi??n t??rmica de este elemento es similar a vidrio de borosilicato, que se utiliza para la fabricaci??n de juntas de vidrio-metal.
Precauciones
Debido a wolframio es rara y sus compuestos son generalmente inerte, los efectos de tungsteno sobre el medio ambiente son limitadas. La LD mediana de dosis letal 50 depende en gran medida del animal y el m??todo de administraci??n y var??a entre los 59 mg / kg (por v??a intravenosa, conejo) y 5000 mg / kg (de tungsteno de polvo de metal, intraperitoneal, ratas).
Reivindicaci??n de patente
El tungsteno es ??nico entre los elementos en que ha sido objeto de un procedimiento judicial. En 1928, un tribunal de Estados Unidos rechaz?? El intento de General Electric patentarlo, volcando Patente de Estados Unidos 1.082.933 concedida en 1913 a William Coolidge.

