
Protactinio
Acerca de este escuelas selecci??n Wikipedia
SOS cree que la educaci??n da una mejor oportunidad en la vida para los ni??os en el mundo en desarrollo tambi??n. Una buena manera de ayudar a otros ni??os es mediante el patrocinio de un ni??o
| Protactinio | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
91 Pa | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||||||||||||||
brillante, brillo met??lico plateado  | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, s??mbolo, n??mero | protactinio, Pa, 91 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciaci??n | / ˌ p r oʊ t ?? k t ɪ n yo ə m / PROH -tak- TIN -ee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categor??a Elemento | act??nidos | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, per??odo, bloque | n / a, 7, F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Peso at??mico est??ndar | 231.03588 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuraci??n electr??nica | [ Rn ] 5f 2 6d 1 7s 2 2, 8, 18, 32, 20, 9, 2 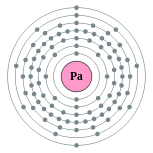 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||||||||||
| Predicci??n | Dmitri Mendeleev (1869) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | William Crookes (1900) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Primer aislamiento | William Crookes (1900) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Nombrado por | Otto Hahn y Lise Meitner (1917-8) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades f??sicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | s??lido | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 15,37 g ?? cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1841 K , 1568 ?? C, 2854 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | ? 4300 K,? 4027 ?? C,? 7280 ?? F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusi??n | 12.34 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporizaci??n | 481 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades at??micas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidaci??n | 2, 3, 4, 5 (D??bilmente ??xido b??sico) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,5 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energ??as de ionizaci??n | Primero: 568 kJ ?? mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radio at??mico | 163 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 200 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel??nea | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | tetragonal  | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magn??tico | paramagn??tico | ||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad el??ctrica | (0 ?? C) 177 nΩ ?? m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad t??rmica | 47 W ?? m -1 ?? K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| N??mero de registro del CAS | 7440-13-3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La mayor??a de los is??topos estables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Art??culo principal: Los is??topos del protactinio | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
El protactinio es un elemento qu??mico con el s??mbolo de Pa y n??mero at??mico 91. Es un metal denso, de color gris plateado que reacciona f??cilmente con el ox??geno , vapor de agua e inorg??nicos ??cidos . Forma diversos compuestos qu??micos , donde protactinium est?? usualmente presente en el estado de oxidaci??n +5, pero tambi??n puede asumir 4 y hasta 2 o 3 estados. Las concentraciones medias de protactinio en la corteza terrestre es t??picamente del orden de unas pocas partes por bill??n, pero pueden alcanzar hasta unas pocas partes por mill??n en algunos dep??sitos de mineral uraninite. Debido a su escasez, la alta radiactividad y de alta toxicidad, actualmente no existen usos para protactinium fuera de la investigaci??n cient??fica, y para este prop??sito, protactinio se extrae principalmente de pasado combustible nuclear.
El protactinio fue identificado por primera vez en 1913 por Kasimir Fajans y Oswald Helmuth G??hring y nombrado brevium debido a la corta vida media de la espec??fica de is??topos estudiado, a saber protactinio-234. Un is??topo m??s estable (231 Pa) de protactinio fue descubierto en 1917-1918 por Otto Hahn y Lise Meitner, y eligieron el nombre proto-actinio, pero entonces el IUPAC nombr?? finalmente protactinio en 1949 y confirm?? Hahn y Meitner como descubridores. El nuevo nombre significa "padre de actinio "y refleja el hecho de que actinio es un producto de la desintegraci??n radiactiva de protactinio.
La m??s larga duraci??n y m??s abundante (casi el 100%) de origen natural de is??topos de protactinio, protactinio-231, tiene una vida media de 32.760 a??os y es un producto de desintegraci??n de de uranio-235. Trazas mucho menor de la corta vida is??mero nuclear protactinio 234m se producen en la cadena de desintegraci??n de de uranio-238. El protactinio-233 resulta de la descomposici??n de torio -233 como parte de la cadena de eventos que se utilizan para producir de uranio-233 por irradiaci??n de neutrones de torio-232. Es un producto intermedio deseado en torio basa- Por lo tanto, los reactores nucleares y se retira de la zona activa del reactor durante el proceso de cr??a. An??lisis de las concentraciones relativas de diversos uranio, torio y protactinio is??topos en agua y minerales se utiliza en dataci??n radiom??trica de sedimentos que son de hasta 175.000 a??os de edad y en el modelado de los distintos procesos geol??gicos.
Historia
En 1871, Dmitri Mendeleev predicho la existencia de un elemento entre el torio y el uranio . El grupo de elementos act??nidos era desconocido en el momento. Por lo tanto, el uranio se coloca debajo de tungsteno y el torio debajo de circonio, dejando el espacio a continuaci??n tantalio vac??a, y hasta la d??cada de 1950 tablas peri??dicas se publicaron con esta estructura. Durante mucho tiempo los qu??micos buscaron eka-tantalio como un elemento con propiedades qu??micas similares como el tantalio, lo que hace un descubrimiento de protactinium casi imposible.
En 1900, William Crookes aislado protactinium como un material intensamente radiactivos de uranio; Sin embargo, no pod??a caracterizar como un nuevo elemento qu??mico y as?? lo nombr?? uranio-X. Crookes disuelto nitrato de uranio en ??ter , la fase acuosa residual contiene la mayor parte de la 234
90 Th y 234
91 Pa. Su m??todo todav??a se utiliza en la d??cada de 1950 para aislar 234
90 Th y 234
91 Pa a partir de compuestos de uranio. El protactinio fue identificado por primera vez en 1913, cuando Kasimir Fajans y Oswald Helmuth G??hring encontraron el is??topo 234 Pa durante sus estudios de las cadenas de desintegraci??n de de uranio-238: 238
92 U → 234
90 Th → 234
91 Pa → 234
92 U. Nombraron al nuevo elemento brevium (de la palabra latina, brevis, que significa breve o corto), debido a su corta vida media, 6,7 horas para el 234
91 Pa. En 1917-1918, dos grupos de cient??ficos, Otto Hahn y Lise Meitner de Alemania y Frederick Soddy y John Cranston de Gran Breta??a , independientemente descubrieron otro is??topo del protactinio, 231 Pa tener mucho m??s tiempo de vida media de alrededor de 32.000 a??os. As??, el nombre fue cambiado a brevium protoactinium como nuevo elemento era parte de la cadena de desintegraci??n del uranio-235 antes del actinio (del griego : πρῶτος = protos que significa primero, antes). Para facilitar la pronunciaci??n, el nombre fue acortado a protactinium por el IUPAC en 1949. El descubrimiento de protactinium complet?? el ??ltimo hueco en las primeras versiones de la tabla peri??dica, propuesta por Mendeleev en 1869, y que llev?? a la fama a los cient??ficos involucrados.
Aristid von Grosse produjo 2 miligramos de Pa 2 O 5 en 1927, y en 1934 primero protactinium elemental aislado de 0,1 miligramos de Pa 2 O 5. Se utiliza dos procedimientos diferentes: en el primero, ??xido de protactinio se irradi?? por 35 keV electrones en vac??o. En otro m??todo, llamado proceso van Arkel-de Boer, el ??xido se convierte qu??micamente en un haluro ( cloruro, bromuro o yoduro) y despu??s se redujo en el vac??o con un filamento met??lico calentado el??ctricamente:
- 2 Pai 5 → 2 Pa + 5 I 2
En 1961, los brit??nicos Autoridad de Energ??a At??mica (UKAEA) produjo 125 gramos de 99,9% protactinio puro mediante el procesamiento de 60 toneladas de material de desecho en un proceso de 12 etapas, con un costo de alrededor de 500.000 d??lares. Durante muchos a??os, esta fue s??lo importante suministro mundial de protactinio, que se entreg?? a varios laboratorios para estudios cient??ficos. Laboratorio Nacional de Oak Ridge en los EE.UU. est?? proporcionando protactinium a un costo de alrededor de 280 USD / gramo.
Aparici??n
El protactinio es uno de los elementos m??s raros y m??s caros de origen natural. Se encuentra en la forma de dos is??topos - 231 Pa y 234 Pa, con el is??topo 234 Pa ocurre en dos estados de energ??a diferentes. Casi todos protactinium natural es protactinio-231. Es un emisor alfa y est?? formado por la desintegraci??n del uranio-235, mientras que la beta radiante protactinio-234 se produce como resultado de la descomposici??n de uranio-238 . Casi todo el uranio-238 (99,8%) se descompone primero en el 234m Pa is??mero.
Protactinio se produce en uraninita (pitchblende) a concentraciones de aproximadamente 0,3-3 partes 231 Pa por mill??n de partes (ppm) de mineral. Considerando que el contenido habitual es de cerca de 0,3 ppm (por ejemplo, en J??chymov, Rep??blica Checa ), algunos minerales de la Rep??blica Democr??tica del Congo tiene alrededor de 3 ppm. Protactinio se dispersa homog??neamente en la mayor??a de materiales naturales y en agua, pero a concentraciones mucho menores en el orden de una parte por bill??n, que corresponde a la radioactividad de 0,1 picocurios (ICP) / g. Hay alrededor de 500 veces m??s protactinium en las part??culas del suelo de arena que en el agua, incluso el agua presente en la misma muestra de suelo. Mucho m??s altas proporciones de 2000 y por encima se miden en suelos y arcillas marga, como bentonita.
En los reactores nucleares
Dos de los principales is??topos protactinium, 231 Pa y 233 Pa, se producen a partir de torio en reactores nucleares; ambos son indeseables y se eliminan por lo general, lo que a??ade complejidad al dise??o del reactor y funcionamiento. En particular, a trav??s de 232 Th (n, n) 2 reacciones produce 231 Th que r??pidamente (vida media 25,5 horas) decae a 231 Pa. El ??ltimo de is??topos, aunque no es un residuos transur??nicos, tiene una larga vida media de 32.760 a??os y es un importante contribuyente a largo plazo radiotoxicidad del combustible nuclear gastado.
El protactinio-233 se forma sobre la captura de neutrones por 232 Th. Es m??s bien decae al uranio-233 o captura otro neutr??n y se convierte en el no fisionable uranio-234. 233 Pa tiene una vida media relativamente larga de 27 d??as y de alta secci??n transversal de captura de neutrones (el llamado " veneno de neutrones "). As??, en lugar de descomposici??n r??pidamente a la utilidad 233 U, una fracci??n significativa de 233 Pa convierte a los is??topos no fisibles y consume neutrones, degradando la eficiencia del reactor. Para evitar esto, 233 Pa se extrae de la zona activa de torio reactores de sales fundidas, durante su funcionamiento, de modo que s??lo se descompone a 233 U. Esto se consigue utilizando varios metros altas columnas de fundido de bismuto con litio disuelto en ella. En un escenario simplificado, el litio reduce selectivamente sales protactinium a protactinio de metal que luego se extrae del ciclo de sales fundidas, y el bismuto es simplemente un portador. Se elige debido a su bajo punto de fusi??n (271 ?? C), la presi??n de vapor baja, buena solubilidad para el litio y los act??nidos, y inmiscibilidad con fundido haluros.
Preparaci??n

Antes de la llegada de los reactores nucleares, protactinio fue separada para los experimentos cient??ficos de minerales de uranio. Hoy en d??a, se produjo principalmente como un producto intermedio de la fisi??n nuclear en reactores de alta temperatura de torio:
- Los tiempos son vidas medias.
Protactinio de metal se puede preparar por reducci??n de su fluoruro con fluoruro de calcio, de litio o de bario a una temperatura de 1300-1400 ?? C.
Propiedades f??sicas y qu??micas
Protactinio es un act??nidos que se coloca en el tabla peri??dica a la izquierda de uranio y a la derecha del torio , y muchas de sus propiedades f??sicas son intermedias entre las dos act??nidos. As??, protactinio es m??s denso y r??gido que el torio, pero es m??s ligero que el uranio, y su punto de fusi??n es inferior a la de torio y mayor que la de uranio. La expansi??n t??rmica, conductividad el??ctrica y t??rmica de estos tres elementos son comparables y son t??picos de "metales pobres". El estimado m??dulo de cizallamiento de protactinio es similar a la de titanio . El protactinio es un metal con brillo plateado-gris que se conserva desde hace alg??n tiempo en el aire. Protactinio reacciona f??cilmente con el ox??geno, vapor de agua y ??cidos, pero no con metales alcalinos.
A temperatura ambiente, el protactinio cristaliza en centrado cuerpo- estructura tetragonal que puede ser considerado como distorsionada red c??bica centrada en el cuerpo; esta estructura no cambia tras la compresi??n de hasta 53 GPa. Los cambios en la estructura de cara centrada c??bico (fcc) tras el enfriamiento de las temperaturas altas, a unos 1200 ?? C. El coeficiente de expansi??n t??rmica de la fase tetragonal entre temperatura ambiente y 700 ?? C es 9,9 ?? 10 -6 / ?? C.
El protactinio es transiciones paramagn??ticas y no magn??ticos son conocidos por ella a cualquier temperatura. Se convierte en superconductor a temperaturas inferiores a 1,4 K. protactinio tetracloruro es paramagn??tico a temperatura ambiente pero vueltas ferromagn??tico tras el enfriamiento a 182 K.
Protactinio existe en dos principales estados de oxidaci??n , 4 y 5, tanto en s??lidos y soluciones, y se observaron los 3 y 2 estados en algunas fases s??lidas. A medida que la configuraci??n electr??nica del ??tomo neutro es [Rn] 7s 2 6d 1 5f 2, el estado de oxidaci??n +5 corresponde con el bajo consumo de energ??a (y por tanto favorecida) 5f 0 configuraci??n. Ambos 4 y 5 estados forman f??cilmente hidr??xidos en el agua con los iones predominantes siendo Pa (OH) 3 +, Pa (OH) 2 +
2, Pa (OH) +
3 y Pa (OH) 4, todo incoloro. Otros iones protactinium conocidos incluyen PACL 2+
2, Paso 2 +
4, Paf 3+, Paf 2+
2, PAF -
6, Paf 2-
7 y PAF 3-
8.
Los compuestos qu??micos
| F??rmula | color | simetr??a | grupo espacial | No | S??mbolo de Pearson | un (pm) | b (pm) | c (pm) | Z | densidad, g / cm 3 |
|---|---|---|---|---|---|---|---|---|---|---|
| Pap?? | gris plateado | tetragonal | I4 / mmm | 139 | Ti2 | 392.5 | 392.5 | 323.8 | 2 | 15.37 |
| PaO | sal de roca | Fm 3 m | 225 | CF8 | 496.1 | 4 | 13.44 | |||
| PaO 2 | negro | fcc | Fm 3 m | 225 | CF12 | 550.5 | 4 | 10.47 | ||
| Pa 2 O 5 | blanco | Fm 3 m | 225 | CF16 | 547.6 | 547.6 | 547.6 | 4 | 10.96 | |
| Pa 2 O 5 | blanco | ortorr??mbica | 692 | 402 | 418 | |||||
| Pah 3 | negro | c??bico | Pm 3 n | 223 | CP32 | 664.8 | 664.8 | 664.8 | 8 | 10.58 |
| Paf 4 | marr??n-rojo | monocl??nico | C2 / c | 15 | MS60 | 2 | ||||
| PACL 4 | verde amarillo | tetragonal | I4 1 / amd | 141 | Ti20 | 837.7 | 837.7 | 748.1 | 4 | 4.72 |
| PaBr 4 | marr??n | tetragonal | I4 1 / amd | 141 | Ti20 | 882.4 | 882.4 | 795.7 | ||
| PACL 5 | amarillo | monocl??nico | C2 / c | 15 | MS24 | 797 | 1135 | 836 | 4 | 3.74 |
| PaBr 5 | rojo | monocl??nico | P2 1 / c | 14 | MP24 | 838.5 | 1120.5 | 1214.6 | 4 | 4.98 |
| PaOBr 3 | monocl??nico | C2 | 1691.1 | 387.1 | 933.4 | |||||
| Pa (PO 3) 4 | ortorr??mbica | 696.9 | 895.9 | 1500.9 | ||||||
| Pa 2 P 2 O 7 | c??bico | Pa3 | 865 | 865 | 865 | |||||
| Pa (C 8 H 8) 2 | amarillo dorado | monocl??nico | 709 | 875 | 1062 |
Aqu?? a, b y c son constantes de red en pic??metros, n es el n??mero de grupo de espacio y Z es el n??mero de por unidades de f??rmula celda unitaria; fcc representa el centrada en las caras simetr??a c??bica. Densidad no se midi?? directamente pero calcula a partir de los par??metros de red.
Los ??xidos y sales que contienen ox??geno
??xidos Protactinium son conocidos por los estados de oxidaci??n del metal 2, 4 y 5. El m??s estable es pent??xido de blanco Pa 2 O 5, que puede ser producido mediante la ignici??n protactinio (V) de hidr??xido en el aire a una temperatura de 500 ?? C. Su estructura cristalina es c??bica, y la composici??n qu??mica es a menudo no estequiom??trica, descrito como PaO 2,25. Tambi??n se ha descrito otra fase de este ??xido con simetr??a ortorr??mbica. El di??xido de negro PaO 2 se obtiene de la pent??xido de reduci??ndola a 1550 ?? C con hidr??geno. No es f??cilmente soluble en ya sea diluido o concentrado n??trico , clorh??drico o sulf??rico , pero f??cilmente se disuelve en acido hidrofluorico. El di??xido se puede convertir de nuevo a pent??xido por calentamiento en atm??sfera que contiene ox??geno a 1100 ?? C. El mon??xido de PaO s??lo se ha observado como un recubrimiento delgado sobre protactinium metal, pero no de una forma a granel aislado.
Formas Protactinium mezclan ??xidos binarios con diversos metales. Con los metales alcalinos A, los cristales tienen una f??rmula qu??mica APAO 3 y estructura perovskita, o A 3 PaO 4 y la estructura de sal gema distorsionada, o A 7 PaO 6 donde los ??tomos de ox??geno para una celos??a hexagonal compacta. En todos estos materiales, los iones protactinium se octa??dricamente coordinados. El pent??xido Pa 2 O 5 combina con ??xidos met??licos de tierras raras R 2 O 3 para formar diversos mixtos-??xidos no estequiom??tricos, tambi??n de estructura perovskita.
??xidos Protactinium son b??sico; que f??cilmente se convierten en hidr??xidos y pueden formar diversas sales, tales como sulfatos , fosfatos, nitratos , etc. El nitrato es generalmente de color blanco, pero pueden ser de color marr??n debido a la descomposici??n radiol??tica. El calentamiento de la nitrato en aire a 400 ?? C la convierte a la protactinium pent??xido de blanco. El polytrioxophosphate Pa (PO 3) 4 puede ser producido por reacci??n de sulfato de difluoruro de PAF 2 SO 4 con ??cido fosf??rico (H 3 PO 4) bajo atm??sfera de gas inerte. Calentar el producto a aproximadamente 900 ?? C elimina la subproductos de reacci??n tales como acido hidrofluorico, tri??xido de azufre y anh??drido fosf??rico. El calentamiento a temperaturas m??s elevadas en una atm??sfera inerte se descompone Pa (PO 3) 4 en el PaP difosfato 2 O 7, que es an??loga a difosfatos de otros act??nidos. En el difosfato, los PO 3 grupos forman pir??mides de simetr??a C 2v. Calefacci??n PaP 2 O 7 en el aire a 1400 ?? C se descompone en los pent??xidos de f??sforo y protactinio.
Haluros
El protactinio (V) formas de fluoruro cristales blancos donde los iones protactinium est??n dispuestos en bipir??mides pentagonales y coordinado por otros 7 iones. La coordinaci??n es la misma en protactinio (V) cloruro, pero el color es amarillo. Los cambios de coordinaci??n para octa??dricos en el bromuro de protactinium marr??n (V) y es desconocido para protactinio (V) de yoduro. La coordinaci??n protactinio en todas sus tetrahaluros es 8, pero el arreglo es antiprismatic cuadrado en protactinio (IV) y el fluoruro de dodecaedro en el cloruro y bromuro. Protactinium de color marr??n (III) de yoduro se ha informado donde los iones protactinium son 8-coordinados en una disposici??n prism??tica trigonal bicapped.
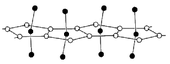
El protactinio (V) fluoruro y protactinio (V) cloruro tienen una estructura polim??rica de simetr??a monocl??nica. All??, dentro de una cadena polim??rica, todos los ??tomos de haluro se encuentran en un plano semejante al grafito y forman pent??gonos planas alrededor de los iones protactinium. La coordinaci??n 7 de protactinio se origina a partir de los 5 ??tomos de halogenuros y dos enlaces a ??tomos protactinium pertenecientes a las cadenas cercanas. Estos compuestos se hidrolizan f??cilmente en agua. El pentacloruro funde a 300 ?? C y se sublima a temperaturas a??n m??s bajas.
Protactinio (V) de fluoruro se puede preparar por reacci??n de ??xido de protactinium con cualquiera pentafluoruro de bromo o trifluoruro de bromo a aproximadamente 600 ?? C, y protactinio (IV) de fluoruro se obtiene a partir del ??xido y una mezcla de hidr??geno y fluoruro de hidr??geno a 600 ?? C; Se requiere un gran exceso de hidr??geno para eliminar fugas de ox??geno atmosf??rico en la reacci??n.
Protactinio (V) cloruro se prepara haciendo reaccionar ??xido de protactinium con tetracloruro de carbono a una temperatura de 200-300 ?? C. Los subproductos (como PaOCl 3) se eliminan mediante sublimaci??n fraccionada. Reducci??n de protactinio (V) cloruro de con hidr??geno a aproximadamente 800 ?? C produce protactinio (IV) cloruro de - un s??lido amarillo-verde que se sublima en vac??o a 400 ?? C; tambi??n se puede obtener directamente a partir de di??xido protactinium por tratamiento con tetracloruro de carbono a 400 ?? C.
Bromuros protactinium se producen por la acci??n de bromuro de aluminio, bromuro de hidr??geno, tetrabromuro de carbono o una mezcla de bromuro de hidr??geno y bromuro de tionilo en ??xido de protactinio. Una reacci??n alternativa es entre pentacloruro de protactinio y bromuro de hidr??geno o bromuro de tionilo. Protactinio (V) bromuro de monocl??nica tiene dos formas similares, uno se obtiene mediante sublimaci??n a 400-410 ?? C y otro por sublimaci??n a temperatura ligeramente inferior de 390-400 ?? C.
Yoduros Protactinium resultan de los ??xidos y yoduro de aluminio o yoduro de amonio calent?? a 600 ?? C. Protactinio (III) de yoduro se obtiene calentando protactinio (V) de yoduro en el vac??o. Como con ??xidos, haluros formas protactinium mezclan con metales alcalinos. Entre ellos, m??s notable es Na PAF 3 8 donde ion protactinium est?? sim??tricamente rodeada de 8 F - iones que forman un cubo casi perfecto.
Fluoruros protactinium m??s complejas son tambi??n conocidos como Pa 2 F 9 y fluoruros ternarias de los tipos MPAF 6 (M = Li, Na, K, Rb, Cs o NH 4), m 2 PAF 7 (M = K, Rb, Cs o NH 4) y M 3 PAF 8 (M = Li, Na, Rb, Cs), siendo todos los s??lidos cristalinos blancos. La f??rmula MPAF 6 se puede representar como una combinaci??n de MF y PAF 5. Estos compuestos se pueden obtener por evaporaci??n de una soluci??n de ??cido fluorh??drico que contiene estos complejos ambos. Para los peque??os cationes alcalinos como Na, la estructura cristalina es tetragonal, mientras que disminuye a orthorphombic para cationes mayores K +, Rb +, Cs + o NH 4 +. Una variaci??n similar se observ?? para los M 2 PAF 7 fluoruros, es decir, la simetr??a del cristal era dependiente de la cationes y difer??a de Cs 2 PAF 7 y M 2 PAF 7 (M = K, Rb o NH 4).
Otros compuestos inorg??nicos
Se conocen oxihaluros y oxisulfuros de protactinio. PaOBr 3 tiene una estructura monocl??nica compuesto de unidades de doble cadena donde protactinium tiene coordinaci??n 7 y est?? dispuesto a bipir??mides pentagonales. Las cadenas est??n interconectados a trav??s de ??tomos de ox??geno y de bromo, y cada ??tomo de ox??geno est?? relacionado con tres ??tomos Pa. PAOS es una luz de color amarillo no vol??til s??lido con una red cristalina c??bica isoestructural a la de otros oxisulfuros act??nidos. Se obtiene por reacci??n de protactinio (V) cloruro con una mezcla de sulfuro de hidr??geno y disulfuro de carbono a 900 ?? C.
En hidruros y nitruros, protactinium tiene un bajo estado de oxidaci??n de aproximadamente 3. El hidruro se obtiene por la acci??n directa del hidr??geno en el metal a 250 ?? C, y el nitruro es un producto de amoniaco y tetracloruro de protactinium o pentacloruro. Este s??lido de color amarillo brillante es estable al calentamiento hasta 800 ?? C en vac??o. Protactinio carburo de PaC se forma por reducci??n de tetrafluoruro de protactinium con bario en un crisol de carbono a una temperatura de aproximadamente 1400 ?? C. Formularios protactinium borohidruros que incluyen Pa (BH 4) 4. Tiene una estructura polim??rica inusual con cadenas helicoidales en el que el ??tomo de protactinium tiene n??mero de coordinaci??n de 12 y est?? rodeado por seis BH 4 - iones.
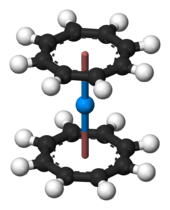
Los compuestos organomet??licos
Protactinio (IV) forma un tetrakis complejos (ciclopentadienil) protactinium tetra??drica (IV) (o Pa (C 5 H 5) 4) con cuatro anillos de ciclopentadienilo, que pueden ser sintetizados por reacci??n de protactinio (IV) cloruro de fundido con Be (C 5 H 5) 2. Un anillo puede ser sustituido con un ??tomo de haluro. Otro complejo organomet??lico es de color amarillo dorado bis (π-ciclooctatetraeno) protactinio, Pa (C 8 H 8) 2, que es an??logo en estructura a uranocene. All??, el ??tomo de metal se intercala entre dos ligandos ciclooctatetraeno. Similar a uranocene, se puede preparar por reacci??n de tetracloruro de protactinium con dipot??sico cyclooctatetraenide, K 2 C 8 H 8, en tetrahidrofurano.
Is??topos
Veintinueve radiois??topos de protactinio se han descubierto, ser m??s estable 231 Pa con una vida media de 32.760 a??os, 233 Pa, con una vida media de 27 d??as, y 230 Pa, con una vida media de 17,4 d??as. Todos los is??topos restantes tienen una vida media m??s corta de 1,6 d??as, y la mayor??a de ellos tienen una vida media de menos de 1,8 segundos. Protactinio tambi??n tiene dos is??meros nucleares, 217m Pa (vida media de 1,2 milisegundos) y 234m Pa (vida media de 1,17 minutos).
El primario modo de desintegraci??n de los is??topos de protactinium m??s ligero que (e incluyendo) el is??topo m??s estable 231 Pa (es decir, 212 Pa a 231 Pa) es desintegraci??n alfa y el modo primario de los is??topos m??s pesados (es decir, 232 Pa a 240 Pa) es desintegraci??n beta. El primario productos de desintegraci??n de is??topos del protactinio m??s ligero que (e incluyendo) 231 Pa son actinium is??topos y los productos de desintegraci??n primarios para los is??topos m??s pesados de protactinium son uranio is??topos.
Aplicaciones
Aunque protactinium se encuentra en la tabla peri??dica entre el uranio y el torio, que ambos tienen numerosas aplicaciones, debido a su escasez, alta radiactividad y alta toxicidad, actualmente no hay usos para protactinium fuera de la investigaci??n cient??fica.
El protactinio-231 surge de la desintegraci??n del uranio-235 formado en reactores nucleares, y por la reacci??n de 232 Th + n → 231 Th + 2n y posterior desintegraci??n beta. Se puede mantener una reacci??n nuclear en cadena, lo que podr??a, en principio, ser utilizado para construir armas nucleares . La f??sico Walter Seifritz calcula una vez que el asociado masa cr??tica como 750 ?? 180 kg, pero esta posibilidad (de una reacci??n en cadena) ha sido descartada por otros f??sicos nucleares desde entonces.
Con el advenimiento de altamente sensibles espectr??metros de masas , una aplicaci??n de 231 Pa como trazador en geolog??a y paleoceanograf??a se ha hecho posible. As??, la relaci??n de protactinio-231 al torio-230 se utiliza para dataci??n radiom??trica de los sedimentos que son de hasta 175.000 a??os de edad y en el modelado de la formaci??n de minerales. En particular, su evaluaci??n en los sedimentos oce??nicos permiti?? reconstruir los movimientos del Atl??ntico Norte cuerpos de agua durante la ??ltima fusi??n de la edad de hielo de los glaciares . Algunas de las variaciones de citas relacionadas protactinium-se basan en el an??lisis de las concentraciones relativas de varios miembros de larga vida de la cadena de desintegraci??n del uranio - uranio, el torio y el protactinio, por ejemplo. Estos elementos tienen 6, 5 y 4 f-electrones en la capa exterior y por lo tanto favorecen a 6, 5 y 4 estados de oxidaci??n, respectivamente, y muestran diferentes propiedades f??sicas y qu??micas. As??, torio y protactinio, pero no compuestos de uranio son poco solubles en soluciones acuosas, y precipitar en los sedimentos; la tasa de precipitaci??n es m??s r??pido para el torio que para protactinio. Adem??s, el an??lisis de la concentraci??n tanto para protactinio-231 (vida media 32.750 a??os) y el torio-230 (vida media de 75.380 a??os) permite mejorar la precisi??n en comparaci??n a cuando s??lo se mide un is??topo; este m??todo de doble is??topo tambi??n es d??bilmente sensible a la falta de homogeneidad en la distribuci??n espacial de los is??topos y a las variaciones en la tasa de precipitaci??n.
Precauciones
Protactinio es a la vez t??xico y altamente radiactivo y por lo tanto todas las manipulaciones con que se realizan en un sellada guantera. Su principal is??topo 231 Pa tiene una actividad espec??fica de 0.048 Ci / gramo y emite principalmente part??culas alfa de la energ??a 5 MeV, que puede ser detenido por una fina capa de cualquier material. Sin embargo, se desintegra lentamente, con la vida media de 32.760 a??os, en Ac 227, que tiene una actividad espec??fica de 74 Ci / gramo, emite tanto la radiaci??n alfa y beta, y tiene una vida media mucho m??s corta de 22 a??os. 227 Ac, a su vez, se desintegra en los is??topos m??s ligeros con la mayor brevedad, la vida media y actividades espec??ficas mucho mayores (SA), tal como se resume en la siguiente tabla.
| Is??topo | 231 Pa | 227 Ac | 227 Th | 223 Ra | 219 Rn | 215 Po | 211 Pb | 211 Bi | 207 Tl |
|---|---|---|---|---|---|---|---|---|---|
| SA ( Ci / g) | 0,048 | 73 | 3,1 ?? 10 4 | 5,2 ?? 10 4 | 1,3 ?? 10 10 | 3 ?? 10 13 | 2,5 ?? 10 7 | 4,2 ?? 10 8 | 1,9 ?? 10 8 |
| Decaimiento | α | α, β | α | α | α | α | β | α, β | β |
| Media vida | 33 ka | 22 una | 19 d??as | 11 d??as | 4 s | 1,8 ms | 36 min | 2,1 min | 4.8 min |
Como protactinium est?? presente en peque??as cantidades en la mayor??a de los productos naturales y materiales, que se ingiere con la comida o el agua e inhal?? con el aire. S??lo aproximadamente 0,05% de protactinium ingerido se absorbe en la sangre y el resto se excreta. De la sangre, aproximadamente el 40% de los dep??sitos protactinium en los huesos, aproximadamente el 15% va al h??gado, 2% a los ri??ones, y el resto sale del cuerpo. La vida media biol??gica de protactinio es de unos 50 a??os en los huesos, mientras que en otros ??rganos de la cin??tica tiene un componente r??pido y lento. As?? en el h??gado 70% de protactinium tienen una vida media de 10 d??as y 30% permanecer durante 60 d??as. Los valores correspondientes para los ri??ones son 20% (10 d??as) y 80% (60 d??as). En todos estos ??rganos, protactinium promueve el c??ncer a trav??s de su radiactividad. La dosis m??xima segura de Pa en el cuerpo humano es de 0,03 Ci que corresponde a 0,5 microgramos de 231 Pa. Este is??topo es 2,5 ?? 10 8 veces m??s t??xico que el ??cido cianh??drico . Las concentraciones m??ximas permitidas de 231 Pa en el aire es de 3 ?? 10 -4 Bq / m 3.

![\ Mathrm {^ {232} _ {\ 90} Th \ + \ ^ {1} _ {0} n \ \ longrightarrow \ ^ {233} _ {\ 90} Th \ \ xrightarrow [22,3 \ min] {\ beta ^ -} \ ^ {233} _ {\ 91} Pa \ \ xrightarrow [26.967 \ d] {\ beta ^ -} \ ^ {233} _ {\ 92} U}](../../images/2279/227997.png)
