
Arsénico
Antecedentes de las escuelas de Wikipedia
SOS ofrecen una descarga completa de esta selección de escuelas para su uso en escuelas intranets. Con Infantil SOS se puede elegir a apadrinar a los niños en más de cien países
| Arsénico | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
33 Como | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||
gris metálico  | |||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | arsénico, As, 33 | ||||||||||||||||||||||||||||||||||||
| Pronunciación | / ɑr s ɨ n ɪ k / AR -sə-nik, también / ɑr s ɛ n ɪ k / ar- SEN -ik cuando atributivo | ||||||||||||||||||||||||||||||||||||
| Categoría metálico | metaloide | ||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 15 (pnictogens), 4, p | ||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 74.92160 (2) | ||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Ar ] 4s 2 3d 10 4p 3 2, 8, 18, 5 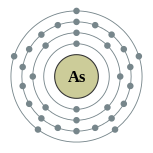 | ||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||
| Descubrimiento | Temprana Edad de Bronce ( 2500 aC) | ||||||||||||||||||||||||||||||||||||
| Primer aislamiento | Alberto Magno (1250) | ||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 5,727 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 5,22 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Punto de sublimación | 887 K, 615 ° C, 1137 ° F | ||||||||||||||||||||||||||||||||||||
| Punto Triple | 1090 K (817 ° C), 3628 kPa | ||||||||||||||||||||||||||||||||||||
| Punto crítico | 1673 K,? MPa | ||||||||||||||||||||||||||||||||||||
| Calor de fusión | (Gris) 24,44 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| El calor de vaporización | ? 34,76 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 24.64 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 5, 3, 2, 1, -3 (Levemente ácida óxido) | ||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,18 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 947.0 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Segundo: 1798 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Tercero: 2735 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Radio atómico | 119 pm | ||||||||||||||||||||||||||||||||||||
| Radio covalente | 119 ± 16:00 | ||||||||||||||||||||||||||||||||||||
| Van der Waals radio | 185 pm | ||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||
| Estructura cristalina | sencilla trigonal 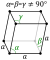 | ||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | ||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 333 nΩ · m | ||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 50.2 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| El módulo de Young | 8 GPa | ||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 22 GPa | ||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 3.5 | ||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 1440 MPa | ||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-38-2 | ||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de arsénico | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
El arsénico es un elemento químico con el símbolo de Como y número atómico 33. El arsénico se produce en muchos minerales, por lo general en combinación con azufre y metales, y también como un cristal elemental puro. En primer lugar, fue documentado por Albertus Magnus en 1250. El arsénico es un metaloide. Puede existir en diferentes alótropos , aunque sólo la forma gris tiene un uso importante en la industria.
El principal uso de arsénico metálico es para el fortalecimiento de las aleaciones de cobre y especialmente plomo (por ejemplo, en las baterías de coche). El arsénico es un tipo común n dopante en semiconductores dispositivos electrónicos, y la compuesto optoelectrónico arseniuro de galio semiconductor es el más común en uso después de silicio dopado. Arsénico y sus compuestos, especialmente el trióxido, se utilizan en la producción de pesticidas, productos de madera tratada, herbicidas, y insecticidas. Estas aplicaciones están disminuyendo, sin embargo.
El arsénico es venenoso notoriamente a la vida multicelular, aunque algunas especies de bacterias son capaces de utilizar compuestos de arsénico como metabolitos respiratorias. La contaminación por arsénico de las aguas subterráneas es un problema que afecta a millones de personas en todo el mundo.
Características
Características físicas

Los tres de arsénico más comunes alótropos son metálicos arsénico gris, amarillo y negro, con ser el gris. Gris arsénico más común (α-As, grupo espacial R3 m No. 166) adopta una estructura de doble capa que consiste en muchos volantes anillos de seis miembros entrelazados. Debido débil unión entre las capas, arsénico gris es quebradizo y tiene una relativamente baja dureza de Mohs de 3,5. Más cercano y próximos-vecinos más cercanos forman un complejo octaédrico distorsionado, con los tres átomos en el mismo ser un poco más cerca de los tres átomos en la próxima doble capa. Esta relativamente cerca de embalaje conduce a una alta densidad de 5,73 g / cm 3. Arsénico Gray es una semimetal, pero se convierte en un semiconductor con una banda prohibida de 1.2 a 1.4 eV si amorfizada. arsénico amarillo es suave y cerosa, y algo similar a tetrafósforo (P 4). Ambos tienen cuatro átomos dispuestos en un tetraédrica estructura en la que cada átomo está unido a cada uno de los otros tres átomos por un enlace sencillo. Este alótropo inestable, siendo molecular, es el más volátil, menos denso y más tóxica. Sólido amarillo arsénico se produce por enfriamiento rápido de vapor de arsénico, As 4. Se transforma rápidamente en el arsénico gris por la luz. La forma amarilla tiene una densidad de 1,97 g / cm 3. Arsénico Negro es similar en estructura a fósforo rojo.
Isótopos
Naturalmente arsénico ocurre se compone de una estable isótopo , 75 como. A partir de 2003, al menos 33 radioisótopos también se han sintetizado, que van en masa atómica de 60 a 92. El más estable de estos es 73 Al igual que con una vida media de 80,3 días. Los isótopos que son más ligeros que los estables 75 Como tienden a decaer por β + decadencia, y los que son más pesados tienden a decaer por β - decaimiento, con algunas excepciones.
Al menos 10 isómeros nucleares han descrito, que van de la masa atómica de 66 a 84. El más estable de isómeros del arsénico es 68m igual que con una vida media de 111 segundos.
Química
Cuando se calienta en aire, arsénico oxida a trióxido de arsénico; los humos de esta reacción tienen un olor parecido a ajo . Este olor puede ser detectada en los minerales de arseniuro llamativos como arsenopirita con un martillo. Arsénico (y algunos compuestos de arsénico) sublima por calentamiento a presión atmosférica, la conversión directamente a una forma gaseosa sin un estado líquido intervenir en 887 K (614 ° C). La punto triple es 3,63 MPa y 1090 K (820 ° C). Marcas de arsénico ácido arsénico con concentrado de ácido nítrico , ácido arsenioso con ácido nítrico diluido, y trióxido de arsénico con concentrado de ácido sulfúrico .

Compuestos
Los compuestos de arsénico en algunos aspectos se asemejan a las de fósforo , que ocupa el mismo grupo (columna) de la tabla periódica . El arsénico se observa con menor frecuencia en el estado pentavalente, sin embargo. Los más comunes estados de oxidación del arsénico son: -3 en el arseniuros, tales como compuestos intermetálicos de aleación similares; y 3 en el arsenitos, arseniatos (III), y compuestos más los orgánicos. El arsénico también adhiere fácilmente a sí mismo como se ve en la plaza como 3-
4 iones en el mineral Skutterudite. En el estado de oxidación +3, el arsénico es típicamente piramidal, debido a la influencia de la par solitario de electrones .
Inorgánico
Las formas de arsénico,, óxidos cristalinos incoloros e inodoros As 2 O 3 (" arsénico blanco ") y Como 2 O 5, que son higroscópico y fácilmente soluble en agua para formar soluciones ácidas. Arsénico ácido (V) es un ácido débil. Sus sales se denominan arseniatos, que es la base de la contaminación por arsénico de las aguas subterráneas, un problema que afecta a muchas personas. Arseniatos sintéticos incluyen Paris Green (de cobre (II) acetoarsenito), arseniato de calcio, y arseniato de hidrógeno plomo. Los tres últimos se han utilizado como agrícola insecticidas y venenos .
Los pasos de protonación entre el arseniato y ácido arsénico son similares a las que existen entre fosfato y ácido fosfórico . Desemejante ácido de fósforo, ácido arsenioso es genuinamente tribásico, con la fórmula de Como (OH) 3.
Una amplia variedad de compuestos de azufre de arsénico son conocidos. Oropimente ( Como 2 S 3) y rejalgar ( Como 4 S 4) son poco abundantes y antiguamente utilizado como pigmentos de pintura. En As 4 S 10, el arsénico tiene un estado de oxidación formal de +2 en As 4 S 4, que cuenta con As-Como bonos de manera que el total de covalencia Como sigue siendo tres.
El trifluoruro, tricloruro, tribromuro y triyoduro de arsénico (III) son bien conocidas, mientras que sólo el Pentafluoruro de arsénico (ASF 5) es el único pentahaluro importante. Una vez más lo que refleja la menor estabilidad del estado de oxidación 5+, la pentacloruro sólo es estable por debajo de -50 ° C.
Compuestos ORGANOARSENICAL
Una gran variedad de compuestos de los orgánicos son conocidos. Varios fueron desarrollados como agentes de guerra química durante la Primera Guerra Mundial, incluyendo vesicantes tales como agentes lewisite y vómitos como adamsite. Cacodílico ácido, que es de interés histórico y práctico, surge de la metilación de trióxido de arsénico, una reacción que no tiene analogía en la química de fósforo.
Aleaciones
El arsénico se utiliza como el elemento del grupo 5 en el Semiconductores III-V arseniuro de galio, arseniuro de indio, y arseniuro de aluminio. El número de electrones de valencia de GaAs es el mismo que un par de átomos de Si, pero el estructura de la banda es completamente diferente, que da como resultado propiedades a granel distintas. Otras aleaciones de arsénico incluyen el semiconductor II-IV arseniuro de cadmio.
Ocurrencia y producción

Minerales con los medios de fórmula y las AM 2 (M = Fe, Ni, Co) son las fuentes comerciales dominantes de arsénico, junto con rejalgar (un mineral de sulfuro de arsénico) y arsénico nativo. Un mineral es ilustrativa arsenopirita ( Fe Como S ), que está estructuralmente relacionada con pirita de hierro . Se conocen muchos menores como que contienen minerales. El arsénico también se produce en varias formas orgánicas en el medio ambiente. El arsénico inorgánico y sus compuestos, al entrar en el cadena alimentaria, se metabolizan progresivamente a una forma menos tóxica de arsénico a través de un proceso de metilación.
Otras vías naturales de exposición incluyen cenizas volcánicas, el desgaste de minerales y menas que contienen arsénico, y se disolvió en el agua subterránea. También se encuentra en los alimentos, el agua, el suelo y el aire. El arsénico es absorbida por todas las plantas, pero se concentra más en las verduras de hoja, arroz, jugo de manzana y uva, y mariscos. Una ruta adicional de la exposición es por inhalación.
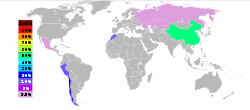
En 2005, China fue el principal productor de arsénico blanco con casi el 50% de la cuota mundial, seguido por Chile, Perú y Marruecos, según el British Encuesta Geológica de la Estados Unidos Servicio Geológico. La mayoría de las operaciones en los EE.UU. y Europa han cerrado por razones ambientales. El arsénico se recupera principalmente como un producto secundario de la purificación de cobre. El arsénico es parte de la de polvos de fundición de las fundiciones de cobre, oro y plomo.
En asar en el aire de arsenopirita, sublima de arsénico en arsénico (III) óxido de salir de óxidos de hierro, mientras que asar sin resultados de aire en la producción de arsénico metálico. La purificación adicional de azufre y otros calcógenos se consigue sublimación en vacío o en una atmósfera de hidrógeno o por destilación de la mezcla de plomo-arsénico fundido.
Historia


La palabra arsénico fue tomado de la Palabra siríaca ܠܐ ܙܐܦܢܝܐ (al) zarniqa y la Palabra persa زرنيخ Zarnikh, que significa "amarillo orpimento ", en griego como arsenikon (Αρσενικόν). También se relaciona con los Arsenikos palabra griega similares (Αρσενικός), que significa "masculino" o "potente". La palabra fue adoptada en arsenicum América y el Viejo arsénico francesa, de la que el Inglés palabra arsénico se deriva. sulfuros de arsénico (orpimento, rejalgar) y los óxidos se han conocido y utilizado desde la antigüedad. Zósimo (circa 300 dC) describe sandarach torrefacción (rejalgar) para obtener nube de arsénico ( óxido arsenioso), que luego se reduce a metálico arsénico. Como los síntomas de envenenamiento por arsénico eran algo mal definido, se utiliza con frecuencia para asesinato hasta el advenimiento de la Prueba de Marsh, una prueba química sensible para su presencia. (Otra prueba menos sensible pero más general es la Prueba Reinsch.) Debido a su uso por la clase dominante para asesinar a otros y su potencia y discreción, el arsénico ha sido llamado el veneno de los Reyes y el Rey de los venenos.
Durante la Edad de Bronce , el arsénico se incluye a menudo en bronce, lo que hizo que la aleación más difícil (la llamada " bronce arsenical "). Alberto Magno (Alberto Magno, 1193-1280) se cree que ha sido el primero en aislar el elemento de un compuesto en 1250, por el jabón de calentamiento junto con trisulfuro de arsénico. En 1649, Johann Schröder publicó dos formas de preparar el arsénico. Los cristales de arsénico elemental (nativo) se encuentran en la naturaleza, aunque es raro.
De Cadet humeante líquido (impuro cacodilo), a menudo se afirma que la primera sintética compuesto organometálico, fue sintetizado en 1760 por Louis Claude Cadet de Gassicourt por la reacción de acetato de potasio con trióxido de arsénico.
En el Era victoriana, "arsénico" ("arsénico blanco" o trióxido de arsénico) se mezcló con vinagre y tiza y comido por las mujeres para mejorar la tez de su rostro, por lo que su pálida piel para mostrar que no trabajan en los campos. El arsénico también se frota en la cara y los brazos de las mujeres a "mejorar su cutis". El uso accidental de arsénico en la adulteración de los alimentos llevó a la dulce intoxicación Bradford en 1858, lo que resultó en aproximadamente 20 muertes.
Aplicaciones
Agrícola
La toxicidad del arsénico a insectos , bacterias y hongos llevó a su uso como un conservante de la madera. En la década de 1950 un proceso de tratamiento de la madera con arseniato de cobre cromado (también conocido como CCA o Tanalith) fue inventado, y por décadas este tratamiento fue el más amplio uso industrial de arsénico. Una mayor apreciación de la toxicidad del arsénico resultó en una prohibición para el uso de CCA en productos de consumo; la Unión Europea y Estados Unidos iniciaron este proceso en 2004. CCA mantiene en uso pesado en otros países, sin embargo, por ejemplo, las plantaciones de caucho de Malasia.
El arsénico también se utilizó en diversos insecticidas agrícolas, terminación y venenos. Por ejemplo, arseniato de hidrógeno plomo era un insecticida común sobre árboles frutales, pero el contacto con el compuesto resultaron en veces daño cerebral entre los que trabajan los pulverizadores. En la segunda mitad del siglo 20, arseniato monosódico metilo (MSMA) y arseniato disódico metilo (DSMA) - formas orgánicas menos tóxicas de arsénico - han sustituido arseniato de plomo en la agricultura.
Arsénico todavía se añade a la alimentación animal, en particular en los EE.UU. como un método de prevención de enfermedades y la estimulación del crecimiento. Un ejemplo es roxarsone, que se utiliza como una broiler arranque en aproximadamente un 70% de los productores de pollos de engorde desde 1995. La Ley de Aves sin veneno de 2009 propone la prohibición de la utilización de roxarsone en cerdos industrial y la producción de aves de corral. Alpharma, una filial de Pfizer Inc., que produce roxarsone, ha suspendido voluntariamente las ventas de la droga en respuesta a estudios que muestran niveles elevados de arsénico en los pollos tratados.
El uso médico
Durante los siglos 20a 18a, 19a, y, una serie de compuestos de arsénico se han utilizado como medicamentos, incluyendo arsfenamina (por Paul Ehrlich) y trióxido de arsénico (por Thomas Fowler). Arsphénamine así como neosalvarsán fue indicado para sífilis y tripanosomiasis, pero ha sido sustituido por modernos antibióticos . El trióxido de arsénico se ha usado en una variedad de maneras en los últimos 500 años, pero más comúnmente en el tratamiento de cáncer . Los EE.UU. Food and Drug Administration en 2000 aprobó este compuesto para el tratamiento de pacientes con leucemia promielocítica aguda que es resistente a ATRA. También fue utilizado como La solución de Fowler en psoriasis. Recientemente nueva investigación se ha hecho en la localización de los tumores usando arsénico-74 (un emisor de positrones). Las ventajas de usar este isótopo en lugar del utilizado anteriormente yodo -124 es que la señal en el PET es más claro que el cuerpo tiende a transportar yodo para la producción de una gran cantidad de ruido de la glándula tiroides.
En dosis subtóxicas, compuestos de arsénico solubles actúan como estimulantes, y fueron una vez popular en pequeñas dosis como la medicina por la gente en el siglo de mid-18th.
Aleaciones
El uso principal de arsénico metálico es de aleación de plomo. Componentes de plomo en baterías de automóviles se ven reforzados por la presencia de un pequeño porcentaje de arsénico. Dezincificación puede ser fuertemente reducida por la adición de arsénico de latón, una aleación de cobre-zinc. Arseniuro de galio es un importante semiconductor de material, que se utiliza en los circuitos integrados . Circuitos hechos de GaAs son mucho más rápidos (pero también mucho más caro) que los fabricados en silicio . A diferencia de silicio que tiene una banda prohibida directa, y por lo tanto puede ser utilizado en diodos láser y LEDs para convertir directamente la electricidad en luz .
Militar
Después de la Primera Guerra Mundial , Estados Unidos construyó una reserva de 20.000 toneladas de lewisite (ClCH = CHAsCl 2), un arma química que es una vesicante (agente vesicante) y irritante pulmonar. La reserva se neutralizó con lejía y vierten en el Golfo de México después de la década de 1950. Durante la guerra de Vietnam el Estados Unidos utilizado Agente de azul, una mezcla de cacodilato de sodio y su forma de ácido, como una de las herbicidas del arco iris para privar a la invasión de soldados norvietnamitas de la cubierta de follaje y el arroz.
Otros usos
- Acetoarsenito cobre se utiliza como un verde pigmento conocido bajo muchos nombres, incluyendo " París Verde 'y' verde esmeralda '. Causó numerosos intoxicaciones por arsénico. Verde de Scheele, un arseniato de cobre, se usó en el siglo 19 como una agente colorante en dulces.
- También se utiliza en bronceado y pirotecnia.
- Hasta el 2% del arsénico se utiliza en aleaciones de plomo para perdigones de plomo y balas.
- El arsénico se añade en pequeñas cantidades a la alfa-latón para hacerla antidezincificación. Este grado de latón se utiliza para hacer las conexiones de tuberías u otros elementos que están en contacto constante con el agua.
- El arsénico también se utiliza para la conservación de la muestra taxonómica.
- Hasta hace poco se usó arsénico en vidrio óptico. Fabricantes de vidrio modernos, bajo la presión de los ecologistas, han eliminado, junto con el plomo .
Papel biológico
Bacterias
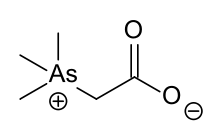
Algunas especies de bacterias obtienen su energía diversos combustibles oxidantes mientras la reducción de arseniato de arsenito. En condiciones ambientales oxidativos algunas bacterias utilizan arsenito, que se oxida a arseniato como combustible para su metabolismo. La enzimas implicadas son conocidos como arsenato reductasa (Arr).
En 2008, se descubrieron las bacterias que emplean una versión de la fotosíntesis en ausencia de oxígeno con arsenitos como donadores de electrones, arseniatos productores (sólo la fotosíntesis como ordinaria utiliza el agua como donador de electrones, produciendo oxígeno molecular). Los investigadores conjeturan que, en el transcurso de la historia, estos organismos fotosintéticos producen los arseniatos que permitieron a las bacterias reductoras de arseniato prosperen. Uno cepa PHS-1 ha sido aislado y está relacionado con el gammaproteobacterium Ectothiorhodospira shaposhnikovii. El mecanismo es desconocido, pero una enzima Arr codificada puede funcionar en sentido inverso a su conocida homólogos.
Aunque el arseniato y aniones fosfato son similares estructuralmente, no existe evidencia para la sustitución de fosfato en ATP o ácidos nucleicos mediante arsénico.
Herencia
El arsénico se ha vinculado a cambios epigenéticos, los cambios heredables en la expresión génica que se producen sin cambios en Secuencia de ADN. Estos incluyen la metilación del ADN, modificación de las histonas, y La interferencia de ARN. Los niveles tóxicos de arsénico causan la hipermetilación del ADN significativo de genes supresores de tumores p16 y p53, lo que aumenta el riesgo de carcinogénesis. Estos eventos epigenéticos se han estudiado in vitro utilizando células de riñón humano y in vivo utilizando células de hígado de rata y leucocitos de sangre periférica en los seres humanos. Acoplamiento inductivo espectrometría de masas de plasma (ICP-MS) se utiliza para detectar niveles precisos de arsénico intracelular y sus otras bases implicadas en la modificación epigenética del ADN. Estudios de investigación de arsénico como un factor epigenético ayudarán en el desarrollo de biomarcadores precisos de exposición y susceptibilidad.
El helecho freno Chino ( Pteris vittata) hyperaccumulates arsénico presente en el suelo en sus hojas y tiene un uso propuesto en fitorremediación.
Biometilación
El arsénico inorgánico y sus compuestos, al entrar en el cadena alimentaria, se metabolizan progresivamente a través de un proceso de metilación. Por ejemplo, el molde Scopulariopsis brevicaulis produce cantidades significativas de trimethylarsine si arsénico inorgánico está presente. El compuesto orgánico arsenobetaína se encuentra en algunos alimentos marinos como peces y algas, y también en las setas de las concentraciones más grandes. La ingesta de una persona promedio es de aproximadamente 10 a 50 mg / día. Valores unos 1000 mg no son inusuales tras el consumo de pescado o las setas, pero hay poco peligro en comer pescado porque este compuesto de arsénico es casi no tóxico.
Las cuestiones ambientales
Ocurrencia en el agua potable
La contaminación por arsénico generalizada de las aguas subterráneas ha llevado a una epidemia masiva de intoxicación por arsénico en Bangladesh y los países vecinos. Se estima que aproximadamente 57 millones de personas en el Cuenca de Bengala están bebiendo agua subterránea con concentraciones elevadas de arsénico por encima de la Organización Mundial de la Salud estándar de 10 's partes por billón (ppb). Sin embargo, un estudio de las tasas de cáncer en Taiwán sugiere que aumentos significativos en la mortalidad por cáncer sólo aparecen en niveles superiores a 150 ppb. El arsénico en el agua subterránea es de origen natural, y es liberado de los sedimentos en el agua subterránea, debido a la condiciones anóxicas del subsuelo. Esta agua subterránea comenzó a ser utilizado después de locales y occidentales ONG y el gobierno de Bangladesh emprendió un tubo superficial masiva así el programa de agua potable a finales del siglo XX. Este programa fue diseñado para prevenir el consumo de aguas superficiales contaminadas con bacterias, pero no logró probar para el arsénico en el agua subterránea. Muchos otros países y distritos en El sudeste asiático, como Vietnam y Camboya tienen ambientes geológicos favorables para la generación de las aguas subterráneas de alto arsénico. Arsenicosis se informó en Nakhon Si Thammarat, Tailandia , en 1987, y la Chao Phraya se sospecha que contiene altos niveles de arsénico de origen natural disuelto, pero no ha sido un problema de salud pública debido al uso de agua embotellada.
En los Estados Unidos, el arsénico se encuentra más comúnmente en las aguas subterráneas del suroeste. Partes de Nueva Inglaterra, Michigan, Wisconsin, Minnesota y las Dakotas también se sabe que tienen importantes concentraciones de arsénico en el agua subterránea. Los niveles elevados de cáncer de piel se han asociado a la exposición al arsénico en Wisconsin, incluso a niveles por debajo de la norma de agua potable de 10 partes por mil millones, aunque este vínculo no ha sido comprobado. De acuerdo con una película reciente financiado por los EE.UU. Superfund, millones de pozos privados tienen niveles de arsénico desconocidos, y en algunas áreas de los EE.UU., más del 20% de los pozos puede contener niveles que supere los límites establecidos.
Bajo nivel de exposición al arsénico en concentraciones que se encuentran comúnmente en los Estados Unidos el agua potable compromete la respuesta inmune inicial a H1N1 o la influenza porcina según los científicos apoyados por el NIEHS. El estudio, realizado en ratones de laboratorio, sugiere que las personas expuestas al arsénico en el agua potable pueden estar en mayor riesgo de contraer enfermedades más graves o la muerte en respuesta a la infección por el virus.
Algunos canadienses están agua que contiene arsénico inorgánico bebiendo. Privados aguas de pozo cavado más están en riesgo de que contiene arsénico inorgánico. Agua preliminar analiza bien normalmente no se comprueban las arsénico. Investigadores del Servicio Geológico de Canadá han modelado la variación relativa en el potencial de riesgo de arsénico natural para la provincia de Nueva Brunswick. Este estudio tiene implicaciones importantes para los problemas del agua potable y salud relativas al arsénico inorgánico.
La evidencia epidemiológica de Chile muestra una conexión dependiente de la dosis entre la exposición crónica al arsénico y varias formas de cáncer, en particular cuando otros factores de riesgo, como el tabaquismo, están presentes. Estos efectos se han demostrado a persistir por debajo de 50 ppb.
Analizando múltiples estudios epidemiológicos sobre la exposición al arsénico inorgánico sugiere un pequeño pero mensurable aumento de riesgo de cáncer de vejiga en 10 ppb. Según Peter Ravenscroft del Departamento de Geografía de la Universidad de Cambridge, cerca de 80 millones de personas en todo el mundo consumen entre 10 y 50 ppb de arsénico en el agua potable. Si todos ellos consumen exactamente 10 ppb de arsénico en el agua potable, el anteriormente citado análisis del estudio epidemiológico múltiple predeciría un adicional de 2.000 casos de cáncer vesical solo. Esto representa una clara subestimación del impacto global, ya que no incluye pulmón o cáncer de piel, y subestima explícitamente la exposición. Las personas expuestas a niveles de arsénico por encima del estándar actual de la OMS deben sopesar los costos y beneficios de la remediación de arsénico.
(1973) Las evaluaciones tempranas de la remoción de arsénico disuelto por el consumo de los procesos de tratamiento de agua demostraron que el arsénico se elimina muy eficazmente por co-precipitación con hierro o los óxidos de aluminio. El uso de hierro como un coagulante, en particular, se encontró que para eliminar el arsénico con eficiencias superiores al 90%. Varios sistemas de medios adsorbentes han sido aprobados para su uso en el punto de servicio en un estudio financiado por el Agencia de los Estados Unidos de Protección Ambiental (EPA) y el Fundación Nacional de Ciencia (NSF). Un equipo de científicos e ingenieros europeos e indios han establecido seis plantas de tratamiento de arsénico en Bengala Occidental basado en el método de remediación in-situ (tecnología SAR). Esta tecnología no utiliza ningún producto químico y el arsénico se deja como una forma insoluble (5 estado) en la zona subterránea recargando agua aireada en el acuífero y por lo tanto el desarrollo de una zona de oxidación para apoyar arsénico oxidante microorganismos. Este proceso no produce ninguna corriente de residuos o lodos y es relativamente barato.
Otro método efectivo y de bajo costo para eliminar el arsénico del agua de pozo contaminada es hundir los pozos 500 pies o más para llegar a aguas más puras. Un reciente estudio de 2011 financiado por el Instituto Nacional de Programa de Investigación de Ciencias de Salud Ambiental Superfund 'muestra que los sedimentos profundos pueden eliminar el arsénico y lo saca de la circulación. A través de este proceso llamado adsorción de arsénico en el que se pega a las superficies de las partículas de sedimentos profundos, arsénico pueden eliminarse naturalmente de agua de pozo.
Separaciones magnéticas de arsénico a muy bajo campo magnético gradientes se han demostrado en la purificación del agua de punto de uso con alta área superficial y monodisperso magnetita (Fe 3 O 4) nanocristales. Uso de la alta superficie específica de Fe 3 O 4 nanocristales la masa de residuos asociados a la eliminación de arsénico del agua se ha reducido drásticamente.
Los estudios epidemiológicos han sugerido una correlación entre el consumo crónico de agua potable contaminada con arsénico y la incidencia de todas las principales causas de mortalidad. La literatura proporciona razones para creer la exposición al arsénico es causal en la patogénesis de la diabetes.
Ingeniero húngaro László Schremmer ha descubierto recientemente que por el uso de filtros basados en chaff es posible reducir el contenido de arsénico de agua a 3 g / L. Esto es especialmente importante en zonas donde el agua potable es suministrada por filtrar el agua extraída del subsuelo acuífero.
Preservación de la madera en los EE.UU.
A partir de 2002, las industrias estadounidenses consumieron 19.600 toneladas de arsénico. El noventa por ciento de esto se utiliza para el tratamiento de la madera con arseniato de cobre cromado (CCA). En 2007, 50% de las 5.280 toneladas métricas de consumo se sigue utilizando para este propósito. En los Estados Unidos, la voluntaria eliminación gradual de arsénico en la producción de productos de consumo y productos residenciales y generales de construcción de consumo comenzó el 31 de diciembre de 2003, y los productos químicos alternativos se utilizan ahora, como Alcalina Cobre Cuaternario, boratos, azol de cobre, ciproconazol, y propiconazol.
Aunque descontinuado, esta aplicación es también una de las que más preocupan a la población en general. La gran mayoría de los mayores madera tratada a presión fue tratada con CCA. CCA madera se encuentra todavía en uso generalizado en muchos países, y fue muy utilizado durante la segunda mitad del siglo 20 como estructural y al aire libre material de construcción. Aunque el uso de la madera CCA fue prohibida en muchas áreas después de los estudios mostraron que el arsénico podría filtrarse fuera de la madera en los alrededores del suelo (de juegos infantiles, por ejemplo), el riesgo se presenta también por la quema de más edad de la madera CCA. La ingestión directa o indirecta de la ceniza de madera de la madera quemada CCA ha causado muertes en los animales y las intoxicaciones graves en los seres humanos; la dosis humana letal es de aproximadamente 20 gramos de ceniza. Scrap CCA madera de las obras de construcción y demolición que se puede utilizar de forma inadvertida en los incendios comerciales y domésticos. Los protocolos para la eliminación segura de los CCA madera no existen de manera uniforme en todo el mundo; también hay preocupación en algunos sectores sobre la generalizada la eliminación en vertederos de esa madera.
Asignación de emisiones industriales en los EE.UU.
Una herramienta que los mapas de comunicados de arsénico a determinados lugares, en los Estados Unidos y también proporciona información adicional acerca de estas liberaciones es TOXMAP. TOXMAP es un Sistema de Información Geográfica (SIG) de la División de Servicios Especializados de Información de la Biblioteca Estados Unidos Nacional de Medicina (NLM) que utiliza mapas de los Estados Unidos para ayudar a los usuarios explorar visualmente los datos de la Estados Unidos Agencia de Protección Ambiental de (EPA) Inventario de Emisiones Tóxicas y Programas de Investigación Básica Superfondo. TOXMAP es un recurso financiado por el Gobierno Federal de Estados Unidos. Química y la salud ambiental de la información TOXMAP se toma de la red de la NLM Toxicología de Datos (TOXNET) y PubMed, y de otras fuentes autorizadas.
Toxicidad y precauciones
Arsénico y muchos de sus compuestos son especialmente potentes venenos. Muchos suministros de agua cercanos a las minas son contaminados por estos venenos. En los Estados Unidos, la concentración máxima permitida en el agua potable es de 10 ppb y 5 ppb para el agua embotellada. No hay un estándar para la comida, aunque las llamadas para el desarrollo de este tipo en 2012 la cobertura de prensa se le solicite. La República Popular de China tiene una norma alimentaria.
Compuestos de arsénico Elemental y arsénico se clasifican como " tóxico "y" peligroso para el medio ambiente "en la Unión Europea bajo Directiva 67/548 / CEE. La Agencia Internacional para la Investigación sobre el Cáncer (IARC) reconoce, arsénico y compuestos de arsénico como carcinógenos del Grupo 1, y la UE se enumeran trióxido de arsénico, pentóxido de arsénico y sales arseniato como categoría 1 carcinógenos.
El arsénico se sabe que causa arsenicosis debido a su manifestación en el agua potable, "las especies más comunes son de arseniato [HASO 2-
4; As (V)] y arsenito [H 3 AsO 3; As (III)] ".
Tratamiento
El tratamiento de la intoxicación crónica por arsénico se logra fácilmente. Anti-lewisite Británica ( dimercaprol) se prescribe en dosis de 5 mg / kg hasta 300 mg cada 4 horas durante los primeros días, luego cada 6 horas para el segundo día, y finalmente cada 8 horas durante 8 días adicionales. Sin embargo, el EE.UU. de Agencia para Sustancias Tóxicas y el Registro de Enfermedades (ATSDR) afirma que los efectos a largo plazo de la exposición al arsénico no se pueden predecir. Sangre, orina, pelo y uñas pueden ser probados para el arsénico; Sin embargo, estas pruebas no pueden prever los posibles resultados de la salud de la exposición. La excreción se produce en la orina y a largo plazo de la exposición al arsénico se ha relacionado con el cáncer de vejiga y riñón, además de cáncer de hígado, próstata, piel, los pulmones y cavidad nasal.
Mecanismo biológico
La alta afinidad de arsénico (III) óxidos de tioles normalmente se asigna como la causa de la alta toxicidad. Los tioles, generalmente en la forma de residuos de cisteína, sino también en cofactores tales como ácido lipoico y coenzima A, se encuentran en los sitios activos de muchos importantes enzimas.
El arsénico altera ATP producción a través de varios mecanismos. En el nivel de la ciclo del ácido cítrico, el arsénico inhibe el ácido lipoico, que es un cofactor para piruvato deshidrogenasa. Además, al competir con fosfato, arseniato desacopla fosforilación oxidativa, lo que inhibe la reducción ligada energía de NAD +, la respiración mitocondrial y la síntesis de ATP. También se incrementa la producción de peróxido de hidrógeno, que, se especula, tiene potencial para formar especies reactivas del oxígeno y el estrés oxidativo. Estas interferencias metabólicas conducen a la muerte por múltiples sistemas insuficiencia de órganos. La insuficiencia de órganos se presume que es a partir de la muerte celular necrótica, no apoptosis, ya que las reservas de energía han sido demasiado agotado para la apoptosis que se produzca.
La post mortem en una muerte por envenenamiento de arsénico revela ladrillo de color rojo mucosa, debido a grave hemorragia .
Aunque el arsénico causa toxicidad, también puede desempeñar un papel protector.
