
Hierro
Acerca de este escuelas selección Wikipedia
SOS Children produjo este sitio web para las escuelas, así como este sitio web video sobre África . Con Infantil SOS se puede elegir a apadrinar a los niños en más de cien países
| Hierro | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
26 Fe | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||||||||||||||
metálico brillante con un tinte grisáceo  Las líneas espectrales de hierro | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | hierro, Fe, 26 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / aɪ . del ər n / | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | metal de transición | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 8, 4, d | ||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 55.845 (2) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Ar ] 3d 6 4s 2 2, 8, 14, 2 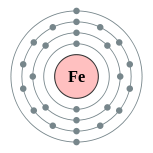 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | antes 5000 aC | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 7,874 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 6,98 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1811 K , 1538 ° C, 2800 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 3134 K, 2862 ° C, 5182 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 13.81 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 340 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 25.10 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 6, 5, 4, 3, 2, 1, -1, -2 ( óxido anfótero) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,83 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 762.5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1561,9 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 2957 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 126 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 132 ± 3 (de bajo espín), 152 ± 6 (alto spin) pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | centrada en el cuerpo cúbico  a = 286,65 pm; | ||||||||||||||||||||||||||||||||||||||||||||||||
cara cúbica centrada  entre 1185-1667 K | |||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | ferromagnético | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1043 K | |||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 96,1 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 80,4 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 11,8 m · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | ( rt) (electrolítico) 5120 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | 211 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | 82 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 170 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Relación de Poisson | 0.29 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 608 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 490 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7439-89-6 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de hierro | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
El hierro es un elemento químico con el símbolo de Fe (de América : Ferrum) y número atómico 26. Es una de metal en la primera serie de transición . Es el elemento más común (en masa) que forman el planeta Tierra en su conjunto, forman gran parte de la Tierra exterior y núcleo interno. Es la cuarta más común elemento en la corteza terrestre. Presencia muy común de hierro en planetas rocosos como la Tierra se debe a su abundante producción como resultado de la fusión de estrellas de gran masa, donde la producción de níquel-56 (que decae al isótopo más común de hierro) es el último reacción de fusión nuclear que es exotérmica. Esto hace que el níquel radiactivo para convertirse en el último elemento que se produce antes del colapso de un supernova conduce a los eventos explosivos que dispersan esta precursor radionucleidos de hierro en abundancia en el espacio.
Al igual que otros grupo 8 elementos, existe hierro en una amplia gama de estados de oxidación , -2-6, aunque 2 y 3 son los más comunes. Hierro elemental se produce en meteoritos y otros entornos bajos de oxígeno, pero es reactivo al oxígeno y al agua. Superficies de hierro frescas aparecen lustroso plateado-gris, pero se oxidan en el aire normal para dar hidratado óxidos de hierro, comúnmente conocido como óxido. A diferencia de muchos otros metales que forman pasivación capas de óxido, óxidos de hierro ocupan más volumen que el metal de hierro y óxidos de hierro por lo tanto se descaman y exponen superficies frescas para la corrosión.
De metal de hierro se ha utilizado desde la antigüedad, aunque las aleaciones de cobre, que tienen temperaturas de fusión más bajos, se utilizaron por primera vez en la historia. El hierro puro es suave (más blando que el aluminio ), pero es imposible de obtener por fundición. El material se endurece y reforzada por las impurezas del proceso de fundición, tales como significativamente de carbono . Una cierta proporción de carbono (entre 0,002% y 2,1%) produce acero , que puede ser de hasta 1000 veces más duro que el hierro puro. Metal de hierro crudo se produce en altos hornos, donde el mineral se reduce por coque arrabio, que tiene un alto contenido de carbono. El refinamiento adicional con oxígeno reduce el contenido de carbono a la proporción correcta para fabricar acero. Aceros y hierro de bajo carbono aleaciones con otros metales ( aleaciones de acero) son, con mucho, los metales más comunes en el uso industrial, debido a su gran variedad de propiedades deseables y la abundancia de hierro.
Compuestos químicos de hierro, que incluyen compuestos ferrosos y férricos, tienen muchos usos. El óxido de hierro mezclado con polvo de aluminio puede ser encendido para crear un reacción de la termita, que se utiliza en soldadura y purificación de minerales. Se forma compuestos binarios con los halógenos y el calcógenos. Entre sus compuestos organometálicos es ferroceno, la primera compuesto sándwich descubrió.
El hierro juega un papel importante en la biología , la formación de complejos con oxígeno molecular en hemoglobina y mioglobina; estos dos compuestos son comunes de transporte de oxígeno de proteínas en los vertebrados. El hierro es también el metal utilizado en el sitio activo de muchos importante enzimas redox que se ocupan de la respiración celular y la oxidación y la reducción en plantas y animales.
Características
Propiedades mecánicas
| Material | TS (MPa) | BH ( Brinell) |
|---|---|---|
| Bigotes Hierro | 11000 | |
| Ausformed (endurecido) acero | 2930 | 850-1200 |
| Acero martensítico | 2070 | 600 |
| Acero bainítico | 1380 | 400 |
| Acero Perlítico | 1200 | 350 |
| Hierro frío trabajados | 690 | 200 |
| Hierro de grano pequeño | 340 | 100 |
| De hierro que contiene carbono- | 140 | 40 |
| Pure, hierro monocristalino | 10 | 3 |
Las propiedades mecánicas de hierro y sus aleaciones pueden ser evaluados usando una variedad de pruebas, incluyendo el Prueba Brinell, Prueba Rockwell y el Prueba de dureza Vickers. Los datos sobre el hierro es tan consistente que a menudo se utiliza para calibrar las mediciones o para comparar las pruebas. Sin embargo, las propiedades mecánicas de hierro se ven significativamente afectados por la pureza de la muestra: la investigación de propósito cristales individuales puros de hierro son en realidad más suave que el aluminio, y el hierro puro producido industrialmente (99,99%) tiene una dureza de 20-30 Brinell. Un aumento en el contenido de carbono del hierro inicialmente causar un aumento correspondiente significativo en la dureza del hierro y resistencia a la tracción. Máxima dureza de 65 R c se consigue con un contenido de carbono 0,6%, aunque esto produce un metal con una baja resistencia a la tracción.
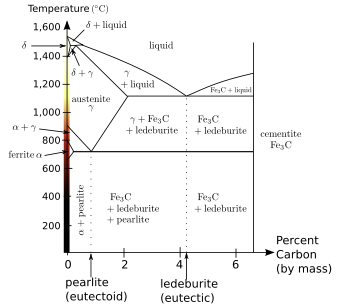
Diagrama de fase y alótropos
Hierro representa un ejemplo de alotropía en un metal. Hay por lo menos cuatro formas alotrópicas de hierro, conocidos como α, γ, δ, y ε; a presiones muy elevadas, existe alguna evidencia experimental controversial para una fase β estable a muy altas presiones y temperaturas.
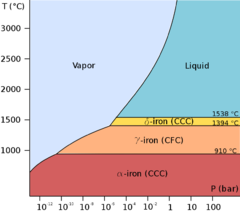
Como el hierro fundido se enfría se cristaliza a 1538 ° C en su forma alotrópica δ, que tiene una centrada en el cuerpo cúbico (CCO) estructura cristalina. Como se enfría aún más su estructura cristalina cambia a cara cúbica centrada (FCC) a 1394 ° C, cuando es conocido como γ-hierro, o austenita. A 912 ° C la estructura cristalina se convierte de nuevo CCO como α-hierro, o ferrita, se forma, y en 770 ° C (la Punto de Curie, Tc) de hierro se vuelve magnético . Como el hierro pasa a través de la temperatura de Curie no hay ningún cambio en la estructura cristalina, pero hay un cambio en la "estructura de dominio", donde cada dominio contiene átomos de hierro con un giro electrónico particular. En el hierro no magnetizado, todos los espines electrónicos de los átomos dentro de un dominio están en la misma dirección; los dominios vecinos apuntan en varias direcciones y por lo tanto se cancelan. En el hierro magnetizado, los espines electrónicos de todos los dominios están alineados, de modo que los efectos magnéticos de los dominios vecinos se refuerzan mutuamente. Aunque cada dominio contiene miles de millones de átomos, que son muy pequeñas, de unos 10 micrómetros de diámetro. A presiones por encima de aproximadamente 10 GPa y temperaturas de unos pocos cientos de kelvin o menos, cambios α-hierro en un (hcp) estructura hexagonal empaquetada de cerca, que también se conoce como ε-hierro; la γ-fase de mayor temperatura también cambia en hierro ε, pero lo hace a mayor presión. La β-fase, si existe, aparecerían a presiones de por lo menos 50 GPa y temperaturas de al menos 1.500 K; se ha pensado para tener una ortorrómbica o una estructura de doble hcp.
El hierro es de suma importancia cuando se mezcla con otros metales y con el carbono para formar aceros. Hay muchos tipos de aceros, todos con diferentes propiedades, y una comprensión de las propiedades de la alótropos de hierro es clave para la fabricación de aceros de buena calidad.
α-hierro, también conocido como ferrita, es la forma más estable de hierro a temperaturas normales. Es un metal bastante suave que puede disolver sólo una pequeña concentración de carbono (no más de 0,021% en masa a 910 ° C).
Por encima de 912 ° C y hasta 1400 ° C α-hierro se somete a una transición de fase de bcc a la configuración fcc de γ-hierro, también llamado austenita. Esto es igualmente suave y metálico, pero puede disolver considerablemente más carbono (tanto como 2,04% en masa a 1146 ° C). Esta forma de hierro se utiliza en el tipo de acero inoxidable utilizado para la fabricación de artículos de cuchillería, y el hospital y del servicio de alimentación del equipo.
Las fases de alta presión de hierro son importantes como modelos endmember para las partes sólidas de núcleos planetarios. La núcleo interno de la Tierra en general se supone que consisten esencialmente en un hierro níquel aleación con ε (o β) estructura.
El punto de fusión del hierro está bien definido experimentalmente para presiones de hasta aproximadamente 50 GPa. Para presiones superiores, diferentes estudios colocan la γ-ε-líquido punto triple a presiones diferentes por decenas de gigapascales y diferencias cedidos de más de 1.000 K para el punto de fusión. Generalmente hablando, simulaciones moleculares dinámicas computacionales de fusión de hierro y de ondas de choque experimentos sugieren altos puntos de fusión y una pendiente mucho más pronunciada de la curva de fusión de experimentos estáticos realizados en células de yunque de diamante.
Isótopos
Hierro de origen natural se compone de cuatro estables isótopos : 5.845% de 54 Fe, 91,754% de 56 Fe, 2,119% de 57 Fe y 0,282% de 58 Fe. De estos isótopos estables, sólo el 57 Fe tiene una nuclear giro (-1/2). La nucleido 54 Fe se predice que someterse doble desintegración beta, pero este proceso nunca se había observado experimentalmente para estos núcleos, y fue construido sólo el límite inferior en la vida media: 1/2 t> 3,1 × 10 22 años.
60 Fe es una radionúclido extinto de larga vida media (2,6 millones de años). No se encuentra en la Tierra, pero su producto de la desintegración final es el nucleido estable níquel-60.
Gran parte de la labor anterior en la medición de la composición isotópica de Fe se ha centrado en la determinación de 60 variaciones Fe debido a los procesos de acompañamiento nucleosíntesis (es decir, estudios de meteoritos) y la formación de mineral. En la última década, sin embargo, los avances en la espectrometría de masas de la tecnología han permitido la detección y cuantificación de minutos, de origen natural variaciones en las proporciones de los isótopos estables de hierro. Gran parte de este trabajo ha sido impulsado por la Tierra y comunidades científicas planetarias, aunque las aplicaciones a sistemas biológicos e industriales están comenzando a emerger.
El isótopo más abundante de hierro 56 Fe es de particular interés para los científicos nucleares, ya que representa el punto final más común de nucleosíntesis. Se cita a menudo, erróneamente, como el isótopo de más alta energía de enlace, una distinción que en realidad pertenece a níquel-62. Desde 56 Ni se produce fácilmente a partir de núcleos más ligeros en la proceso alfa en reacciones nucleares en las supernovas (véase proceso de grabación de silicio), níquel-56 (14 partículas alfa) es el punto final de las cadenas de fusión interior estrellas extremadamente masivas, ya que la adición de otra partícula alfa se traduciría en zinc-60, que requiere una gran cantidad más energía. Por lo tanto, se hace presente el níquel-56, que tiene una vida media de unos 6 días, en cantidad en estas estrellas, pero pronto se desintegra por dos emisiones de positrones sucesivas dentro de los productos de desintegración de la supernova en la nube supernova remanente de gas, primero al cobalto-56 radiactivo y luego estable hierro-56. Esta última nucleido tanto, es común en el universo, en relación con otros estable metales de aproximadamente el mismo peso atomico.
En las fases de los meteoritos Semarkona y Chervony Kut una correlación entre la concentración de 60 Ni, el producto hija de 60 Fe, y la abundancia de los isótopos estables de hierro se pudo encontrar que es evidencia de la existencia de 60 Fe en el momento de formación del Sistema Solar. Posiblemente la energía liberada por la decadencia de 60 Fe contribuyó, junto con la energía liberada por la desintegración del radionúclido 26 Al, a la refusión y diferenciación de los asteroides después de su formación hace 4,6 millones de años. La abundancia de 60 Ni presente en material extraterrestre también puede proporcionar más información sobre el origen del Sistema Solar y su historia temprana.
Los núcleos de los átomos de hierro tienen algunas de las más altas energías de enlace por nucleón, solo superado por el níquel isótopo 62 Ni. Este está formado por la fusión nuclear en las estrellas. Aunque una ganancia de energía más pequeña podría ser extraído mediante la síntesis de 62 Ni, condiciones en las estrellas no son adecuados para este proceso para ser favorecido. Distribución Elemental en la Tierra favorece en gran medida de hierro sobre el níquel, y también probablemente en la producción de elementos de supernova.
Iron-56 es el isótopo estable más pesado producido por el proceso alfa en nucleosíntesis estelar; elementos más pesados que el hierro y el níquel requieren una supernova para su formación. El hierro es el elemento más abundante en el núcleo de las gigantes rojas , y es el metal más abundante en meteoritos de hierro y en el metal denso núcleos de planetas como la Tierra .
Nucleosíntesis
El hierro es creado por muy grandes, muy caliente (más de 2,5 mil millones kelvin) estrellas a través de la proceso de grabación de silicio. Es el elemento estable más pesado para ser producido de esta manera. El proceso comienza con el segundo más grande núcleo estable creado por la quema de silicio, que es el calcio. Un núcleo estable de calcio se fusiona con un núcleo de helio, creando de titanio inestable. Antes de que el titanio se descompone, puede fusionarse con otro núcleo de helio, la creación de cromo inestable. Antes de que el cromo se descompone, puede fusionarse con otro núcleo de helio, creando hierro inestable. Antes de que el hierro se descompone, puede fusionarse con otro núcleo de helio, creando inestabilidad de níquel-56. Cualquier fusión adicional de níquel-56 consume energía en lugar de la producción de energía, así que después de la producción de níquel-56, la estrella no produce la energía necesaria para mantener el núcleo se colapse. Eventualmente, el níquel-56 decae al cobalto-56 inestable, que a su vez se desintegra a estable hierro-56. Cuando el núcleo de la estrella colapsa, crea una supernova . Las supernovas también crean formas adicionales de hierro estable a través de la r-proceso.
Aparición
Ocurrencia Planetaria

El hierro es el más sexto abundante elemento en el universo , y el más común elemento refractario. Se forma como la final fase exotérmica de nucleosíntesis estelar, por fusión de silicio en las estrellas masivas.
Metálico o hierro nativo raramente se encuentra en la superficie de la Tierra, ya que tiende a oxidarse, pero sus óxidos son omnipresentes y representan los minerales primarios. A pesar de que constituye alrededor del 5% de la corteza de la Tierra , tanto la de la Tierra interior y núcleo externo se cree que consisten en gran medida de un hierro de níquel aleación que constituye el 35% de la masa de la Tierra en su conjunto. El hierro es en consecuencia el elemento más abundante en la Tierra, pero sólo el cuarto elemento más abundante en la corteza terrestre. La mayor parte del hierro en la corteza se encuentra combinado con oxígeno como minerales de óxido de hierro tales como hematita y magnetita. Grandes depósitos de hierro se encuentran en formaciones de hierro bandeado. Estas formaciones geológicas son un tipo de roca que consiste en finas capas repetidas de óxidos de hierro, ya sea magnetita (Fe 3 O 4) o hematita (Fe 2 O 3), alternando con bandas de hierro de los pobres esquisto y sílex. Las formaciones de hierro bandeado se establecieron en el tiempo entre 3700 Hace millones de años y 1800 Hace millones de años
Aproximadamente 1 de cada 20 meteoritos consisten de los minerales de hierro-níquel únicas taenite (35-80% de hierro) y kamacite (90-95% de hierro). Aunque es raro, meteoritos de hierro son la principal forma de hierro metálico naturales en la superficie de la Tierra. Fue probado por Espectroscopía Mössbauer que el color rojo de la superficie de Marte se deriva de ricos en óxido de una plancha regolito.
Las existencias en uso en la sociedad
De acuerdo con la Internacional de Recursos del Grupo Especial de Las existencias del metal en el informe de la Sociedad, las existencias mundiales de hierro en uso en la sociedad per cápita es 2.200 kg. Mucho de esto es en los países más desarrollados (7000-14000 kg per cápita) en lugar de los países menos desarrollados (2,000 kg por habitante).
Química y compuestos
| Oxidación estado | Compuesto representativo |
|---|---|
| -2 | Tetracarbonylferrate disódico (reactivo de Collman) |
| -1 | |
| 0 | Pentacarbonilo de hierro |
| 1 | Ciclopentadienilhierro dicarbonılico dímero ("Fp 2") |
| 2 | El sulfato ferroso, ferroceno |
| 3 | El cloruro férrico , ferrocenio tetrafluorborato |
| 4 | Ferrato de bario (IV) |
| 5 | |
| 6 | Ferrato de potasio |
El hierro forma compuestos principalmente en los 2 y 3 estados de oxidación . Tradicionalmente, hierro compuestos (II) se denominan ferroso y hierro (III) compuestos férrico. El hierro también se produce en los estados de oxidación más altos, siendo un ejemplo la púrpura ferrato de potasio (K 2 FeO 4) que contiene hierro en su estado de oxidación +6. Hierro (IV) es un intermedio común en muchas reacciones de oxidación bioquímicos. Numeroso compuestos organometálicos contienen estados de oxidación formales de 1, 0, -1, -2 o incluso. Los estados de oxidación y otras propiedades de unión a menudo se evaluó a través de la técnica de Espectroscopia Mössbauer. También hay muchos compuestos de valencia mixta que contienen tanto hierro (II) y hierro (III) centros, como magnetita y Azul de Prusia (Fe 4 (Fe [CN] 6) 3). Este último se utiliza como el tradicional "azul" en planos.

Los compuestos de hierro producido en la escala más grande en la industria son de hierro (II) sulfato (FeSO4 · 7 H 2 O) y hierro (III) cloruro (FeCl3). El primero es una de las fuentes más fácilmente disponibles de hierro (II), pero es menos estable a la oxidación aérea de Sal de Mohr ((NH4) 2 Fe (SO4) 2 · 6H 2 O). Hierro (II) compuestos tienden a ser oxidado a hierro (III) compuestos en el aire.
A diferencia de muchos otros metales, el hierro no forma amalgamas con mercurio. Como resultado, el mercurio se comercializa en frascos estandarizados 76 libras (34 kg) de hierro.
Los compuestos binarios
El hierro reacciona con el oxígeno del aire para formar diversos compuestos de óxido e hidróxido; los más comunes son de hierro (II, III) óxido (Fe 3 O 4), y de hierro (III) óxido (Fe 2 O 3). De hierro (II) óxido también existe, a pesar de que es inestable a temperatura ambiente. Estos óxidos son los principales minerales para la producción de hierro (ver bloomery y altos hornos). También se utilizan en la producción de ferritas, útil medios magnéticos de almacenamiento en computadoras, y pigmentos. El más conocido es el sulfuro de pirita de hierro (FeS 2), también conocido como el oro de los tontos debido a su brillo dorado.
Los haluros ferrosos y férricos binarios son bien conocidos, con la excepción de yoduro férrico. Los haluros ferrosos normalmente surgen de tratamiento de metal de hierro con el ácido halógeno binaria correspondiente para dar las sales hidratadas correspondientes.
- Fe + 2 HX → FeX 2 + H 2
El hierro reacciona con flúor, cloro, y bromo para dar los correspondientes haluros férricos, cloruro férrico siendo los más comunes:
- 2 Fe + 3 X 2 → 2 FeX 3 (X = F, Cl, Br)
Compuestos de coordinación y organometálicos
Se conocen varios complejos de cianuro. El ejemplo más famoso es Azul de Prusia, (Fe 4 (Fe [CN] 6 3)). Ferricianuro de potasio y ferrocianuro de potasio también son conocidos; la formación del azul de Prusia tras la reacción con hierro (II) y hierro (III) forma respectivamente la base de un análisis químico "húmedo". Azul de Prusia también se utiliza como un antídoto para talio y radiactivos de cesio envenenamiento. Azul de Prusia se puede utilizar en azulado de lavandería para corregir el tinte amarillento dada por sales ferrosas en el agua.
Se conocen varios compuestos de carbonilo de hierro. El hierro de primera (0) compuesto es pentacarbonilo de hierro, Fe (CO) 5, que se utiliza para producir polvo de hierro carbonilo, una forma altamente reactiva de hierro metálico. La termólisis de pentacarbonilo de hierro da el clúster trinuclear, dodecacarbonilo trihierro. Reactivo de Collman, tetracarbonylferrate disódico, es un reactivo útil para la química orgánica; que contiene hierro en el estado de oxidación -2. Ciclopentadienilhierro dicarbonilo dímero contiene hierro en el estado de oxidación +1 raro.
El ferroceno es un complejo extremadamente estable. La primera compuesto sandwich, que contiene una plancha central (II) con dos ligandos ciclopentadienilo unidos a través de todos los diez átomos de carbono. Este arreglo fue una novedad impactante cuando fue descubierto por primera vez, pero el descubrimiento de ferroceno ha llevado a una nueva rama de la química organometálica. El ferroceno en sí puede ser utilizado como la columna vertebral de un ligando, por ejemplo, dppf. El ferroceno puede en sí ser oxidado a la catión ferroceno (Fc +); la pareja ferroceno / ferrocenio a menudo se utiliza como referencia en la electroquímica.
Historia
El hierro forjado

Los objetos de hierro de gran edad son mucho más raros que los objetos hechos de oro o plata, debido a la facilidad de corrosión del hierro. Pieza hecha de meteórica hierro en 3500 aC o anterior se encontraron en Gerzah, Egipto por GA Wainwright. Las perlas contienen 7,5% de níquel, que es una firma de origen meteórico desde hierro que se encuentra en la corteza terrestre tiene muy poco o ningún contenido de níquel. Hierro meteórico estaba muy bien considerado por su origen en los cielos y con frecuencia se usa para forjar armas y herramientas o especímenes enteros colocados en las iglesias. Los elementos que probablemente se hicieron de hierro por los egipcios datan 2500-3000 aC. Hierro tuvo una clara ventaja sobre el bronce en los implementos de guerra. Fue mucho más duro y más duradero que el bronce, aunque susceptible a la roya. Sin embargo, esto se pone en duda. Hittitologist Trevor Bryce argumenta que antes se desarrollaron técnicas para trabajar el hierro avanzados en la India , armas de hierro de meteoritos usados por los primeros mesopotámicos ejércitos tenían una tendencia a romperse en combate, debido a su alto contenido de carbono.
La primera producción de hierro comenzó en la Edad del Bronce Medio , pero tardó varios siglos antes de hierro desplazados bronce. Muestras de hierro fundido de Asmar, Mesopotamia y Tall Chagar Bazar, en el norte de Siria se hicieron en algún momento entre 2700 y 3000 antes de Cristo. La Hititas parecen ser los primeros en comprender la producción de hierro de sus minerales y lo consideran altamente en su sociedad. Ellos empezaron a fundir el hierro entre 1500 y 1200 antes de Cristo y la práctica se extendió al resto de Oriente Próximo después de su imperio cayó en 1180 antes de Cristo. El período siguiente se llama la Edad de Hierro . La fundición del hierro, y por lo tanto la Edad del Hierro, llegaron a Europa 200 años más tarde y llegaron a Zimbabwe , África en el siglo octavo. En China, el hierro sólo aparece alrededor del año 700 a 500 antes de Cristo. La fundición del hierro puede haber sido introducido en China a través de Asia Central. La evidencia más temprana del uso de un alto horno en China data del siglo primero dC, y los cubilotes se utilizaron como principios ya en el Época de Guerras (403-221 aC). Uso de la explosión y la cúpula del horno seguía siendo generalizada durante las canciones y las dinastías Tang .
Los artefactos de hierro fundido se producen en India 1800-1200 antes de Cristo, y en el Levante desde alrededor de 1500 aC (sugiriendo fundición en Anatolia o el Cáucaso).
La Libro del Génesis, capítulo cuarto, versículo 22 contiene la primera mención de hierro en el Antiguo Testamento de la Biblia ; "Tubal-Caín, un instructor de toda obra de bronce y de hierro." Otros versos aluden a la minería de hierro (Job 28: 2), el hierro utilizado como un lápiz (Job 19:24), horno (Deuteronomio 04:20), carros (Josué 17:16), uñas (I Crón. 22: 3) , sierras y hachas (II Sam 12:31.), y utensilios de cocina (Ezequiel 4: 3). El metal también se menciona en el Nuevo Testamento , por ejemplo, en Hechos capítulo 12 versículo 10, "[Peter pasó por] la puerta de hierro que daba a la ciudad" de Antioquía.
Hierro de trabajo fue presentado a Grecia a finales del siglo 11 antes de Cristo. La difusión de la metalurgia del hierro en Europa Central y Occidental se asocia con Expansión celta. De acuerdo a Plinio el, el uso de hierro viejo era común en el romano era. La producción de hierro anual del Imperio Romano se estima en 84.750 t, mientras que la similar poblada Han China produce alrededor de 5.000 t.
Durante la Revolución Industrial en Gran Bretaña, Henry Cort comenzó perfeccionamiento de hierro a partir de arrabio a hierro forjado (o barra de hierro), utilizando los sistemas de producción innovadores. En 1783 patentó el proceso de mineral de hierro de refinación encharcamiento. Más tarde fue mejorado por otros, incluyendo Joseph Hall.
Hierro fundido
Hierro fundido fue producido por primera vez en China, durante el siglo quinto antes de Cristo, pero fue apenas en Europa hasta la época medieval. Lo más temprano artefactos de hierro fundido fueron descubiertos por los arqueólogos en lo que hoy es moderno Luhe County, Jiangsu en China. Hierro fundido fue utilizado en la antigua China para la guerra, la agricultura y la arquitectura. Durante la Edad Media periodo, las medias se encuentran en Europa de producir hierro forjado de hierro fundido (en este contexto conocido como arrabio) usando galas forja. Para todos estos procesos, carbón fue requerido como combustible.

Medieval altos hornos eran de unos 10 pies (3,0 m) de altura y hecha de ladrillo a prueba de fuego; aire forzado se suele realizar por fuelles manuales. Los altos hornos modernos han crecido mucho más grande.
En 1709, Abraham Darby I estableció un coque disparó alto horno para producir hierro fundido. La disponibilidad resultante de hierro de bajo costo fue uno de los factores que conducen a la Revolución Industrial. Hacia el final del siglo 18, el hierro fundido comenzó a reemplazar el hierro forjado para ciertos propósitos, porque era más barato. El contenido de carbono en el hierro no fue implicado como la causa de las diferencias en las propiedades de hierro forjado, hierro fundido y acero hasta el siglo 18.
Puesto que el hierro se estaba convirtiendo más barato y más abundante, sino que también se convirtió en un material estructural importante a raíz de la construcción de la innovadora primer puente de hierro en 1778.
Acero
Acero (con contenido de carbono menor que el hierro oxidado, pero más que el hierro forjado) se produjo por primera vez en la antigüedad mediante el uso de un bloomery. Herreros en Luristán en el oeste de Irán estaban haciendo buen acero en 1000 antes de Cristo. Entonces versiones mejoradas, Acero Wootz por la India y el acero de Damasco por parte de China se han desarrollado alrededor de 300 aC y 500 dC, respectivamente. Estos métodos estaban especializados, por lo que el acero no se convirtieron en un producto importante hasta la década de 1850.
Los nuevos métodos de producción por bares cementación de hierro en la proceso de cementación se diseñaron en el siglo 17 dC. En la Revolución Industrial , los nuevos métodos de producción de hierro en barra sin carbón se idearon y éstos se aplicaron más tarde para producir acero. A finales de la década de 1850, Henry Bessemer inventó un nuevo proceso de fabricación de acero, que implica que sopla aire a través de arrabio fundido, para producir acero dulce. Este acero hecho mucho más económico, lo que conduce a hierro forjado ya no se produce.
Los fundamentos de la química moderna
Antoine Lavoisier utilizó la reacción de vapor de agua con hierro metálico en el interior de un tubo de hierro incandescente para producir hidrógeno en sus experimentos que condujeron a la demostración de la conservación de la masa. La oxidación anaerobia de hierro a alta temperatura se puede representar esquemáticamente mediante las siguientes reacciones:
- Fe + H2O → FeO + H 2
- 2 Fe + 3 H 2 O → Fe 2 O 3 + 3 H 2
- 3 Fe + 4 H 2 O → Fe 3 O 4 + 4 H 2
Producción industrial
La producción de hierro o acero es un proceso que contiene dos etapas principales, a menos que el producto deseado es de hierro fundido. La primera etapa es para producir arrabio en un alto horno. Alternativamente, se puede reducir directamente. La segunda es hacer de hierro forjado o acero de arrabio por un proceso adicional.

Durante unos fines limitados como corazones de electroimán, hierro puro se produce por electrólisis de una solución de sulfato ferroso
El alto horno
El noventa por ciento de toda la minería metálica de minerales es para la extracción de hierro. Industrialmente, la producción de hierro implica minerales de hierro, principalmente hematita (nominalmente Fe 2 O 3) y magnetita (Fe 3 O 4) en una reacción carbotérmica (reducción con carbono) en un alto horno a temperaturas de aproximadamente 2000 ° C. En un alto horno, el mineral de hierro, carbono en forma de coque, y un flujo tales como piedra caliza (que se utiliza para eliminar las impurezas de dióxido de silicio en el mineral que de otra manera obstruir el horno con el material sólido) se alimenta en la parte superior del horno, mientras que una explosión masiva de calefacción de aire , alrededor de 4 toneladas por tonelada de hierro, se ve obligado en el horno en la parte inferior.
En el horno, el coque reacciona con el oxígeno en el chorro de aire para producir monóxido de carbono :
- 2 C + O 2 → 2 CO
El monóxido de carbono reduce el mineral de hierro (en el ecuación química a continuación, hematita) a hierro fundido, convirtiéndose en dióxido de carbono en el proceso:
- Fe 2 O 3 + 3 CO → 2 Fe + 3 CO 2
Algunos de hierro en la región de alta temperatura inferior del horno reacciona directamente con el coque:
- 2 Fe 2 O 3 + 3 C → 4 Fe + 3 CO 2
El flujo está presente para fundir impurezas en el mineral, principalmente dióxido de silicio arena y otra silicatos. Flujos comunes incluyen piedra caliza (principalmente carbonato de calcio ) y dolomita (carbonato de calcio y magnesio). Otros fundentes pueden ser usados dependiendo de las impurezas que necesitan ser removidos de la mena. En el calor del horno de la castinas descompone óxido de calcio (también conocido como cal viva):
- CaCO3 → CaO + CO 2
A continuación, el óxido de calcio se combina con el dióxido de silicio para formar un líquido escoria.
- CaO + SiO 2 → 3 CaSiO
La escoria se derrite en el calor del horno. En la parte inferior del horno, la escoria fundida flota en la parte superior de la plancha más denso fundido, y las aberturas en el lado del horno se abrió para funcionar fuera de la plancha y la escoria por separado. El hierro, una vez enfriado, se llama arrabio, mientras que la escoria se puede utilizar como un material en la construcción de carreteras o para mejorar los suelos minerales pobres para la agricultura

Reducción de hierro directo
Desde coque es cada vez más regulado debido a las preocupaciones ambientales, se han desarrollado métodos alternativos de hierro procesamiento. Uno de ellos se conoce como reducción de hierro directo. Se reduce el mineral de hierro en polvo a una sustancia llamada esponja de hierro o "hierro directa", que es adecuado para la fabricación de acero. Hay dos reacciones principales que tienen lugar en el proceso de reducción directa:
El gas natural se oxida parcialmente (con calor y un catalizador):
- 2 CH 4 + O 2 → 2 CO + 4 H 2
Estos gases son luego tratados con mineral de hierro en un horno, la producción de esponja de hierro sólido:
- Fe 2 O 3 + CO + 2 H 2 → 2 Fe + CO2 + 2 H 2 O
La sílice se elimina mediante la adición de un flujo, es decir, piedra caliza, más adelante.
Otros procedimientos
El arrabio no es hierro puro, pero tiene 4-5% de carbono disuelto en ella con pequeñas cantidades de otras impurezas como el azufre, magnesio, fósforo y manganeso. Como el carbono es la principal impureza, el hierro (arrabio) se vuelve quebradizo y duro. Esta forma de hierro, también conocido como hierro fundido, se utiliza para moldeadas, en fundiciones como estufas, tuberías, radiadores, postes de luz y rieles.
Alternativamente arrabio puede ser hecho en acero (con hasta aproximadamente un 2% de carbono) o hierro forjado (hierro comercialmente puro). Varios procesos han sido utilizados para esto, incluyendo fraguas galas, hornos de pudelar, Convertidores Bessemer, hornos de hogar abierto, hornos básicos de oxígeno, y hornos de arco eléctrico. En todos los casos, el objetivo es para oxidar una parte o todo el carbono, junto con otras impurezas. Por otro lado, se pueden añadir otros metales para hacer aceros de aleación.
La dureza del acero depende de su contenido de carbono: cuanto mayor es el porcentaje de carbono, mayor es la dureza y la menor la maleabilidad. Las propiedades del acero también se pueden cambiar por varios métodos.
El recocido implica el calentamiento de una pieza de acero a 700-800 ° C durante varias horas y luego enfriamiento gradual. Esto hace que el acero suave y más viable.
Acero se endurezca por trabajo en frío. El metal se dobla o clavado en su forma final a una temperatura relativamente fresca. Forja en frío es la estampación de una pieza de acero en forma de una prensa pesada. Llaves se hacen comúnmente mediante forjado en frío. Laminación en frío, lo que implica la realización de una hoja delgada pero fuerte, y estirado en frío, lo que hace un alambre delgado pero fuerte, son otros dos métodos de trabajo en frío. Para endurecer el acero, se calienta al rojo-caliente y luego se enfría por enfriamiento rápido en el agua. Se hace más difícil y más frágil. Si es demasiado endurecido, se calienta luego a una temperatura requerida y se deja enfriar. El acero formado de esta manera es menos frágil.
El tratamiento térmico es otra manera de endurecer el acero. El acero se calienta al rojo vivo, luego se enfría rápidamente. Las moléculas de carburo de hierro se descompone por el calor, pero no tienen tiempo para reformar. Dado que los átomos de carbono libre están atrapados, hace que el acero mucho más duro y más fuerte que antes.
A veces se desean tanto la tenacidad y dureza. Un proceso llamado caso de endurecimiento puede ser utilizado. El acero se calentó a aproximadamente 900 ° C y luego se sumergió en aceite o agua. Carbon del aceite puede difundirse en el acero, haciendo que la superficie muy dura. La superficie se enfría rápidamente, pero el interior se enfría lentamente, haciendo una superficie extremadamente dura y una capa interior durable, resistente.
El hierro puede ser pasivado por inmersión en un concentrado ácido nítrico solución. Esto forma una capa protectora de óxido sobre el metal, que lo protege de la corrosión adicional.
Aplicaciones
Metalúrgico
| País | Mineral de hierro | Arrabio | Hierro directo | Acero |
|---|---|---|---|---|
| China | 1,114.9 | 549.4 | 573.6 | |
| Australia | 393.9 | 4.4 | 5.2 | |
| Brasil | 305.0 | 25.1 | 0,011 | 26.5 |
| Japón | 66.9 | 87.5 | ||
| India | 257.4 | 38.2 | 23.4 | 63.5 |
| Rusia | 92.1 | 43.9 | 4.7 | 60.0 |
| Ucrania | 65.8 | 25.7 | 29.9 | |
| Corea Del Sur | 0.1 | 27.3 | 48.6 | |
| Alemania | 0.4 | 20.1 | 0.38 | 32.7 |
| Mundo | 1,594.9 | 914.0 | 64.5 | 1,232.4 |
El hierro es el más utilizado de todos los metales, que representan el 95% de la producción de metales en todo el mundo. Su bajo costo y de alta resistencia hacen que sea indispensable en aplicaciones de ingeniería como la construcción de máquinas y máquinas herramientas, automóviles , los cascos de los grandes barcos y componentes estructurales para edificios. Desde hierro puro es bastante suave, se combina comúnmente con elementos de aleación a fabricar acero.
Comercialmente hierro disponible se clasifican sobre la base de la pureza y la abundancia de los aditivos. arrabio tiene 3.5 a 4.5% de carbono y contiene cantidades variables de contaminantes como el azufre , silicio y fósforo . Arrabio no es un producto vendible, sino un paso intermedio en la producción de hierro fundido y acero. La reducción de contaminantes en el arrabio que afectan negativamente a las propiedades del material, tales como el azufre y el fósforo, los rendimientos de hierro fundido que contiene 2-4% de carbono, 1-6% de silicio, y pequeñas cantidades de manganeso . Tiene un punto de fusión en el intervalo de 1420-1470 K, que es inferior a cualquiera de sus dos componentes principales, y hace que el primer producto que se funde cuando el carbono y el hierro se calientan juntos. Sus propiedades mecánicas varían mucho y dependen de la forma de la toma de carbono en la aleación.
"Blancos" fundiciones contienen su carbono en forma de cementita, o hierro-carburo. Esto, compuesto quebradizo duro domina las propiedades mecánicas de hierro fundido blanco, lo que hace que sean difíciles, pero unresistant a golpes. La superficie rota de una fundición blanca está llena de facetas finas de hierro-carburo roto, un material muy pálido, plateado, brillante, de ahí la denominación de origen.
En hierro gris existe el carbono finas escamas como separadas, de grafito, y también hace que el frágil material debido a las escamas de grafito bordes afilados que producen sitios de concentración de esfuerzos dentro del material. Una variante más reciente de hierro gris, denominado hierro dúctil se trata especialmente con trazas de magnesio para alterar la forma de grafito para esferoides, o nódulos, reduciendo las concentraciones de esfuerzos y aumentando enormemente la dureza y resistencia del material.
El hierro forjado contiene menos de 0,25% de carbono, pero grandes cantidades de escoria que le dan una característica fibrosa. Es un producto duro, maleable, pero no como fusible como arrabio. Si a un borde afilado, pierde rápidamente. El hierro forjado se caracteriza por la presencia de fibras finas de escoria atrapadas dentro del metal. El hierro forjado es más resistente que el acero contra la corrosión. Ha sido casi completamente reemplazado por acero dulce para los productos tradicionales "hierro forjado" y herrería.
Acero dulce corroe más fácilmente que el hierro forjado, pero es más barato y más ampliamente disponibles. acero al carbono contiene 2,0% de carbono o menos, con pequeñas cantidades de manganeso , azufre , fósforo y silicio. aceros de aleación contienen cantidades variables de carbono, así como otra metales, tales como cromo , vanadio , molibdeno , níquel, tungsteno , etc. Su contenido de la aleación aumenta su costo, y por lo que en general sólo se emplean para usos especialista. Una aleación de acero común, sin embargo, es acero inoxidable. La evolución reciente de la metalurgia ferrosa han producido una creciente gama de aceros microaleados, también denominada ' HSLA "o de alta resistencia, aceros de baja aleación, que contienen pequeñas adiciones para producir altas resistencias y, a menudo espectacular dureza a un costo mínimo .
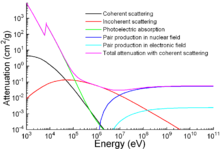
Aparte de las aplicaciones tradicionales, hierro también se utiliza para la protección de la radiación ionizante. Aunque es más ligero que el otro material de protección tradicional, plomo, es mucho más fuerte mecánicamente. La atenuación de la radiación como una función de la energía se muestra en el gráfico.
La principal desventaja de hierro y acero es que el hierro puro, y la mayoría de sus aleaciones, sufren gravemente deóxido si no se protege de alguna manera.Pintura,galvanización,pasivación, revestimiento de plástico yde azulado se usan para proteger de la oxidación de hierro mediante la exclusión deaguay oxígeno o porprotección catódica.
Compuestos de hierro
Aunque su papel metalúrgica es dominante en términos de cantidades, compuestos de hierro son omnipresentes en la industria, así que se utilizan en muchas aplicaciones de nicho. Catalizadores de hierro se utilizan tradicionalmente en el proceso de Haber-Bosch para la producción de amoniaco y el proceso de Fischer-Tropsch para la conversión de monóxido de carbono a hidrocarburos para carburantes y lubricantes. Hierro en polvo en un disolvente ácido se utilizó en la reducción de Bechamp la reducción de nitrobenceno a anilina.
De hierro (III) cloruro encuentra uso en la purificación de agua y tratamiento de aguas residuales, en el teñido de tela, como un agente colorante en las pinturas, como aditivo en la alimentación animal, y como un reactivo de ataque para el cobre en la fabricación de placas de circuito impreso. También se puede disolver en alcohol para formar tintura de hierro. Los otros haluros tienden a ser limitados a los usos de laboratorio.
Hierro (II) sulfato se utiliza como un precursor de otros compuestos de hierro. También se utiliza para reducir el cromato en cemento. Se utiliza para fortificar alimentos y tratar la anemia por deficiencia de hierro. Estos son sus principales usos. de hierro (III) sulfato se utiliza en la solución de partículas de aguas residuales minutos en agua del tanque. de hierro (II) cloruro se utiliza como un agente reductor de floculación, en la formación de complejos de hierro y óxidos de hierro magnéticos, y como una reducción agente en la síntesis orgánica.
Papel biológico
El hierro es abundante en la biología. Hierro-proteínas se encuentran en todos los organismos vivos, que van desde la evolutivamente primitiva arqueas a los seres humanos. El color de la sangre es debido a la hemoglobina, una proteína que contiene hierro. Como se ilustra por la hemoglobina, el hierro a menudo está obligado a cofactores, por ejemplo, en hemes. La clústeres de hierro-azufre son omnipresentes e incluyen nitrogenasa, las enzimas responsables de biológico fijación de nitrógeno . Teorías influyentes de evolución han invocado el papel de sulfuros de hierro en la teoría del mundo de hierro-azufre.
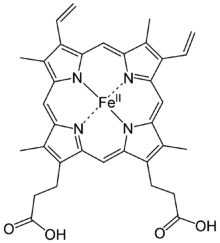
El hierro es una condición necesaria oligoelemento que se encuentra en casi todos los organismos vivos. El hierro que contiene enzimas y proteínas, que a menudo contienen hemo grupos prostéticos, participar en muchas oxidaciones biológicas y en el transporte. Ejemplos de proteínas que se encuentran en organismos superiores incluyen hemoglobina, citocromo (ver hierro de alta-valente), y la catalasa.
Compuestos Bioinorgánicos
Los más comúnmente conocidos y estudiados " compuestos bioinorgánicos "de hierro (es decir, compuestos de hierro utilizados en biología) son las proteínas hemo: ejemplos son hemoglobina, la mioglobina y citocromo P450. Estos compuestos se transportan los gases, construir enzimas, y ser usado en la transferencia de electrones . Metalloproteins son un grupo de proteínas con iones metálicos cofactores. Algunos ejemplos de metaloproteínas hierro son ferritina y rubredoxina. Muchas enzimas vitales para la vida contienen hierro, tales como catalasa, lipoxigenasas, y IRE-BP.
Salud y alimentación
El hierro es un fenómeno generalizado, pero particularmente ricas fuentes de hierro en la dieta incluyen las carnes rojas, las lentejas, las habas , las aves de corral , pescado , hortalizas de hoja, berros, queso de soja , garbanzos, guisantes de ojo negro, melaza, fortificada pan , y fortificada cereales para el desayuno. de hierro en cantidades bajas se encuentra en la melaza , teff y harina. El hierro en la carne ( hierro hemo) se absorbe más fácilmente que el hierro en los vegetales. Aunque algunos estudios sugieren que hemo / hemoglobina de la carne roja tiene efectos que pueden aumentar la probabilidad de cáncer colorrectal, aún existe cierta controversia, e incluso algunos estudios que sugieren que no hay suficiente evidencia para apoyar tales afirmaciones.
Hierro proporcionada por los suplementos dietéticos se encuentra a menudo como hierro (II) fumarato, aunque sulfato de hierro es más barato y se absorbe igualmente bien. Hierro elemental, o hierro reducido, a pesar de ser absorbida a sólo un tercio a dos tercios de la eficiencia (en relación con sulfato de hierro), a menudo se añaden a los alimentos, como cereales para el desayuno o la harina de trigo enriquecida. El hierro es más disponible para el cuerpo cuando quelado a los aminoácidos y también está disponible para su uso como un común suplemento de hierro. A menudo, el aminoácido elegido para este propósito es el aminoácido más barata y más común, glicina, lo que lleva a los suplementos "glicinato de hierro". La Ingesta Diaria Recomendada (RDA) para el hierro varía dependiendo considerablemente de la edad, el género, y la fuente de hierro en la dieta (hemo hierro con base tiene mayor biodisponibilidad). Los bebés pueden requerir suplementos de hierro si son alimentados con biberón de leche de vaca. Los donantes de sangre y las mujeres embarazadas están en riesgo especial de niveles bajos de hierro y, a menudo se les recomienda incrementar la ingesta de hierro.
La captación y almacenamiento
La adquisición de hierro plantea un problema para los organismos aerobios, porque el hierro férrico es poco soluble cerca de pH neutro. Por lo tanto, las bacterias han evolucionado de alta afinidad agentes secuestradores llamados sideróforos.
Después de la absorción, en células , almacenamiento de hierro es cuidadosamente regulado; Iones de hierro "libre" no existen como tales. Un componente importante de este reglamento es la proteína transferrina, que se une iones de hierro absorbido desde el duodeno y la lleva en la sangre a las células. En los animales, las plantas y los hongos, el hierro es a menudo el ion metálico incorporado en el complejo hemo. El hemo es un componente esencial de las proteínas del citocromo, que median las reacciones redox, y de oxígeno proteínas portadoras tales como hemoglobina, la mioglobina, y leghemoglobina.
El hierro inorgánico contribuye a reacciones redox en las agrupaciones de hierro-azufre de muchas enzimas, como la nitrogenasa (implicados en la síntesis de amoníaco a partir de nitrógeno y de hidrógeno ) y hidrogenasa. Proteínas hierro no hemo incluyen el enzimas metano monooxigenasa (oxida el metano a metanol ), ribonucleótido reductasa (reduce ribosa a desoxirribosa; biosíntesis de ADN), hemerythrins ( oxígeno transporte y la fijación en invertebrados marinos) y púrpura de la fosfatasa ácida ( hidrólisis de fosfato ésteres).
La distribución de hierro está fuertemente regulada enmamíferos, en parte porque los iones de hierro tienen un alto potencial para la toxicidad biológica.
Reglamento de la absorción
La absorción del hierro está estrechamente regulada por el cuerpo humano, que no tiene medios fisiológicos regulados de la excreción de hierro. Solamente pequeñas cantidades de hierro se pierden diariamente debido a la mucosa epitelial de la piel y el desprendimiento de células, por lo que el control de los niveles de hierro es en su mayoría mediante la regulación de la absorción. Regulación de la captación de hierro se ve afectada en algunas personas como resultado de un defecto genético que se asigna a la región del gen HLA-H en el cromosoma 6. En estas personas, la ingesta excesiva de hierro puede resultar en trastornos de sobrecarga de hierro, tales como hemocromatosis. Muchas personas tienen una susceptibilidad genética a la sobrecarga de hierro sin darse cuenta o ser consciente de los antecedentes familiares del problema. Por esta razón, se aconseja que las personas no toman suplementos de hierro a menos que sufren de deficiencia de hierro y haber consultado a un médico. La hemocromatosis se estima que causa la enfermedad en entre 0,3 y 0,8% de los caucásicos.
MRI encuentra que el hierro se acumula en elhipocampo de los cerebros de las personas conla enfermedad de Alzheimery en lasustancia negra de las personas conenfermedad de Parkinson.
Barreras reactivas permeables
Hierro cero-valente es el principal material reactivo debarreras reactivas permeables.
Precauciones
| NFPA 704 |
|---|
 1 0 1 |
| Diamante de fuego por un metal de hierro en polvo |
Grandes cantidades de hierro ingerido puede causar niveles excesivos de hierro en la sangre. Los niveles altos de hierro ferroso libres reaccionan con peróxidos para producir radicales libres, que son altamente reactivos y pueden dañar el ADN , proteínas , lípidos , y otros componentes celulares. Por lo tanto, la toxicidad de hierro se produce cuando hay hierro libre en la célula, que generalmente se produce cuando los niveles de hierro exceden la capacidad de la transferrina de obligar a la plancha. El daño a las células del tracto gastrointestinal también puede evitar que la regulación de la absorción de hierro que conduce a nuevos aumentos en los niveles sanguíneos. Hierro típicamente daña las células en el corazón , el hígado y en otros lugares, lo que puede causar efectos adversos significativos, incluyendo coma, acidosis metabólica, choque, insuficiencia hepática, coagulopatía, síndrome de dificultad respiratoria del adulto, daño orgánico a largo plazo, e incluso la muerte. Los seres humanos experimentan toxicidad de hierro por encima de 20 miligramos de hierro por cada kilogramo de masa, y 60 miligramos por kilogramo se considera una dosis letal. El consumo excesivo de hierro, a menudo el resultado de los niños que comen grandes cantidades de tabletas de sulfato ferroso destinados a la alimentación de adultos, es una de las causas toxicológicos más comunes de muerte en niños menores de seis años. La Ingesta Dietética de Referencia (DRI) muestra el nivel superior de ingesta tolerable (UL ) para los adultos como 45 mg / día. Para niños menores de catorce años la UL es de 40 mg / día.
El tratamiento médico de la toxicidad de hierro es complicado, y puede incluir el uso de un específicoagente quelante llamadeferoxamina para atar y expulsar el exceso de hierro del cuerpo.
