
Metano
Antecedentes
Esta selección Wikipedia está disponible sin conexión de SOS Children para su distribución en el mundo en desarrollo. Haga clic aquí para obtener información sobre el apadrinamiento de niños.
| Metano | |
|---|---|
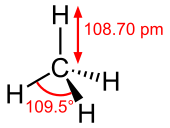 | |
 |  |
| |
| Identificadores | |
| CAS | 74-82-8 |
| PubChem | 297 |
| Propiedades físicas | 291 |
| Número CE | 200-812-7 |
| Número ONU | 1971 |
| KEGG | C01438 |
| MeSH | Metano |
| ChEBI | CHEBI: 16183 |
| ChEMBL | CHEMBL17564 |
| Número RTECS | PA1490000 |
| Beilstein Referencia | 1718732 |
| Gmelin Referencia | 59 |
| 3DMet | B01450 |
| Imágenes-Jmol 3D | Image 1 |
SONRISAS
| |
InChI
| |
| Propiedades | |
| Fórmula molecular | CH 4 |
| Masa molar | 16,04 g mol -1 |
| Apariencia | Gas incoloro |
| Olor | Inodoro |
| Densidad | 0,6556 g L -1 |
| Punto de fusion | -182 ° C, 90.7 K, -296 ° F |
| Punto de ebullicion | -164 A -160 ° C, 109-113 K, -263 a -256 ° F |
| Solubilidad en agua | 22,7 mg L -1 |
| log P | 1.09 |
| k H | 14 nmol Pa -1 kg -1 |
| Estructura | |
| Forma molecular | Tetraedro |
| Momento bipolar | 0 D |
| Termoquímica | |
| Std entalpía de formación Δ f H | -74.87 KJ mol -1 |
| Std entalpía de combustión Δ c H | -891,1--890,3 KJ mol -1 |
| Molar estándar entropía S | 186.25 JK -1 mol -1 |
| Calor específico, C | 35.69 JK -1 mol -1 |
| Peligros | |
| MSDS | MSDS externa |
| Pictogramas del SGA |  |
| Palabra de advertencia GHS | PELIGRO |
| Indicaciones de peligro del SGA | H220 |
| Prudencia del SGA | P210 |
| Índice de la UE | 601-001-00-4 |
| Clasificación de la UE | |
| Frases R | R12 |
| Frases S | (S2), S16, S33 |
| NFPA 704 |  4 1 0 |
| Punto de inflamabilidad | -188 ° C |
| Autoignición temperatura | 537 ° C |
| Límites de explosividad | 5-15% |
| Compuestos relacionados | |
| Alcanos relacionados |
|
| Página de datos complementaria | |
| Estructura y propiedades | n, ε r, etc. |
| Termodinámica datos | Comportamiento de fase Sólido, líquido, gas |
| Los datos espectrales | UV, IR, RMN , MS |
Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
El metano (pronunciado / Mɛθeɪn / o / miːθeɪn /) es un compuesto químico con la fórmula química CH 4. Es el más simple alcano , el principal componente del gas natural , y probablemente el más abundante compuesto orgánico en la tierra. La abundancia relativa de metano hace que sea un atractivo combustible. Sin embargo, debido a que es un gas en condiciones normales, el metano es difícil de transportar de su fuente.
El metano es un relativamente potente gas de efecto invernadero . La concentración de metano en la atmósfera de la Tierra en 1998, expresado como fracción molar, era 1745 nmol / mol (partes por mil millones, ppb), frente a los 700 nmol / mol en 1750. Para 2008, sin embargo, los niveles de metano globales, que se habían quedado en su mayoría plano desde 1998, había aumentado a 1.800 nmol / mol.
Propiedades y unión
El metano es un molécula tetraédrica con cuatro enlaces CH equivalentes. Su estructura electrónica es descrito por cuatro orbitales moleculares de unión (MOS) que resultan de la superposición de los orbitales de valencia en C y H. El MO de energía más bajo es el resultado de la superposición de las orbital 2s en el carbono con la combinación en fase de la orbitales 1s en los cuatro átomos de hidrógeno. Por encima de este nivel en energía es un conjunto degenerado triplemente de OMs que implican superposición de los orbitales 2p en el carbono con diversas combinaciones lineales de los orbitales 1s en hidrógeno. El esquema de enlace "de tres más uno" resultante es consistente con mediciones espectroscópicas de fotoelectrones.
En temperatura ambiente y presión estándar, el metano es un gas incoloro e inodoro. El olor familiar de gas natural tal como se utiliza en los hogares es una medida de seguridad alcanzado por la adición de una odorante, por lo general mezclas que contienen terc-butiltiol. El metano tiene un punto de ebullición -161 ° C (-257,8 ° F) a una presión de uno atmósfera. Como un gas que es inflamable sólo sobre un rango estrecho de concentraciones (5-15%) en el aire. El metano líquido no se quema menos sometido a alta presión (normalmente 4-5 atmósferas).
Reacciones químicas
Reacciones principales con el metano son: de combustión, reformado con vapor de gas de síntesis, y halogenación. En general, las reacciones de metano son difíciles de controlar. La oxidación parcial de metanol , por ejemplo, es un reto porque la reacción progresa típicamente todo el camino a dióxido de carbono y agua , incluso con cantidades incompletas de oxígeno. Las enzimas metano monooxigenasa puede producir metanol a partir de metano, pero no puede ser utilizado para reacciones a escala industrial.
Reacciones ácido-base
Al igual que otros hidrocarburos, el metano es un ácido muy débil. Su pKa en DMSO se estima en 56. No puede ser desprotonado en solución, pero el base conjugada con metil-litio se conoce.
Una variedad de iones positivos se han observado derivados de metano, principalmente como especies inestables en mezclas de gas de baja presión. Éstos incluyen methenium o catión metilo CH3 +, metano cación CH 4 +, y methanium protonada o metano CH 5 +. Algunos de ellos han sido detectado en el espacio exterior. Methanium también se pueden producir como soluciones diluidas de metano con ácidos super. Los cationes de mayor carga, tales como CH 6 ++ y +++ CH 7, se han estudiado de forma teórica y conjeturado para ser estable.
A pesar de la fuerza de sus enlaces CH, existe un gran interés en los catalizadores que facilitan Activación C-H de bonos en el metano (y otros bajos alcanos ).
Combustión
En el combustión de metano, múltiples pasos son los involucrados. Las siguientes ecuaciones son parte del proceso, con el ser neta resultado:
CH 4 + 2 O 2 → CO 2 + 2 H 2 O (H = -891 k J / mol (en condiciones normales))
- CH 4 + M * → CH 3 + H + M
- CH 4 + O2 → CH 3 + 2 HO
- CH 4 + 2 HO → CH 3 + 2 OH
- CH 4 + OH → CH 3 + H 2 O
- O 2 + H → O + OH
- CH 4 + O → CH 3 OH +
- CH 3 + O 2 → CH 2 O + OH
- CH 2 O + O → CHO + OH
- CH 2 O + OH → CHO + H 2 O
- CH 2 O + H → CHO + H 2
- CHO + O → CO + OH
- CHO + OH → CO + H 2 O
- CHO + H → CO + H2
- H 2 + O → H + OH
- H 2 + OH → H + H 2 O
- CO + HO → CO 2 + H
- H + OH + H → H 2 O + M *
- H + H + M → H 2 + M *
- H + O2 + M → HO 2 + M *
La especie M * significa un tercio cuerpo energético, de la que se transfiere la energía durante una colisión molecular. El formaldehído (HCHO o H 2 CO) es un intermedio temprano (reacción 7). La oxidación de formaldehído da la formilo radicales (HCO) (reacciones 8, 9 y 10), que luego dan el monóxido de carbono (CO) (reacciones 11, 12 y 13). Cualquier H 2 resultante se oxida a H 2 O u otros intermedios de reacción (14 y 15). Finalmente, el CO oxida, formando CO 2 (reacción 16). En las etapas finales (reacciones 17, 18 y 19), la energía se transfiere de nuevo a otros terceros cuerpos. La velocidad global de la reacción es una función de la concentración de las diversas entidades durante el proceso de combustión. Cuanto mayor sea la temperatura, mayor es la concentración de especies de radicales y más rápido es el proceso de combustión.
Reacciones con halógenos
El metano reacciona con halógenos dadas las condiciones apropiadas de la siguiente manera:
- X 2 + UV → 2 X •
- • X + CH 4 → HX + CH 3 •
- CH 3 • + X 2 → CH 3 X + X •
donde X es un halógeno : flúor (F), cloro (Cl), bromo (Br), o yodo (I). Este mecanismo para este proceso se llama halogenación por radicales libres. Se inicia con luz UV o algún otro iniciador de radicales. Un átomo de cloro se genera a partir de cloro elemental, que abstrae un átomo de hidrógeno a partir de metano, resultando en la formación de cloruro de hidrógeno. El radical metilo resultante, CH 3 ·, puede combinarse con otra molécula de cloro para dar cloruro de metilo (CH 3 Cl) y un nuevo átomo de cloro. Reacciones similares pueden producir diclorometano (CH 2 Cl 2), cloroformo (CHCl 3), y, en última instancia, tetracloruro de carbono (CCl 4), dependiendo de las condiciones de reacción y el cloro relación al metano.
Usos
El metano se utiliza en procesos químicos industriales y puede ser transportado como un líquido refrigerado (gas natural licuado, o GNL). Mientras que las fugas de un recipiente de líquido refrigerado son inicialmente más pesados que el aire debido a la mayor densidad del gas frío, el gas a temperatura ambiente es más ligero que el aire. Gasoductos distribuir grandes cantidades de gas natural, de los cuales el metano es el principal componente.
Combustible
Gas natural
El metano es importante para generación eléctrica por la quema como combustible en una turbina de gas o de vapor caldera. En comparación con otros combustibles de hidrocarburos , la quema de metano produce menos dióxido de carbono por cada unidad de calor liberado. A unos 891 kJ / mol, de metano calor de combustión es inferior a cualquier otro hidrocarburo, pero la relación entre el calor de combustión (891 kJ / mol) a la masa molecular (16,0 g / mol, de los cuales 12,0 g / mol es carbono) muestra que el metano, siendo el hidrocarburo más simple , produce más calor por unidad de masa (55.7 kJ / g) que otros hidrocarburos complejos. En muchas ciudades, el metano se canaliza a los hogares para el hogar calefacción y cocina. En este contexto, se conoce generalmente como gas natural , que se considera que tiene un contenido energético de 39 megajulios por metro cúbico, o 1000 BTU per pie cúbico estándar.
El metano en la forma de gas natural comprimido se utiliza como combustible para vehículos y se afirma que es más ecológico que otros combustibles fósiles como la gasolina / gasolina y diesel. La investigación en ha llevado a cabo métodos de adsorción de metano de almacenamiento para su uso como combustible de automoción.
El gas natural licuado
El gas natural licuado o GNL es gas natural (principalmente metano, CH 4), que se ha convertido en forma líquida para facilitar su almacenamiento o transporte.
El gas natural licuado ocupa alrededor de 1 / 600o el volumen de gas natural en estado gaseoso. Es inodoro, incoloro, no tóxico y no corrosivo. Los riesgos incluyen la inflamabilidad, la congelación y asfixia.
La proceso de licuefacción implica la eliminación de ciertos componentes, como el polvo, gases ácidos, helio , agua y pesada hidrocarburos, que podrían causar dificultad aguas abajo. El gas natural es entonces condensado en un líquido a cerca de la presión atmosférica (presión de transporte máxima fijado en alrededor de 25 kPa / 3,6 psi) por enfriamiento a aproximadamente -162 ° C (-260 ° F).
LNG logra una mayor reducción en el volumen de gas natural comprimido (CNG) para que la densidad de energía de LNG es 2,4 veces más pesado que el de GNC o 60% de la de combustible diesel. Esto hace que el costo de GNL eficientes para el transporte a largas distancias donde no existen tuberías. Especialmente diseñado buques de mar criogénico ( Metaneros) o cisternas criogénicas carretera se utilizan para su transporte.
GNL, cuando no es muy refinado para usos especiales, se utiliza principalmente para el transporte de gas natural a los mercados, donde es regasificado y distribuir el gas natural gasoducto. Se puede utilizar en vehículos de gas natural, aunque es más común para diseñar los vehículos a utilizar gas natural comprimido. Su coste relativamente alto de producción y la necesidad de almacenar en más caro tanques criogénicos han obstaculizado el uso comercial generalizado.
Combustible para cohetes de metano líquido
En una forma altamente refinado, metano líquido ha sido investigado como una combustible para cohetes. Un número de rusos se han propuesto cohetes usar metano líquido desde la década de 1990, y las compañías estadounidenses Orbitech y XCOR Aerospace desarrolló un motor de oxígeno líquido / líquido cohete metano en 2005 y una más grande 7.500 libras-fuerza (33000 N) del motor -thrust en 2007 para su uso potencial como la CEV motor retorno lunar. Más recientemente, el Americana privado compañía espacial SpaceX anunció (en 2012) una iniciativa para desarrollar motores de cohetes de metano líquido, incluyendo un primer momento, la Raptor segunda etapa motor de cohete.
La investigación ha sido llevada a cabo por la NASA con respecto al potencial de metano como combustible para cohetes. Una de las ventajas de metano es que es abundante en muchas partes del sistema solar y que podría potencialmente ser cosechada en la superficie de otro cuerpo del sistema solar, el suministro de combustible para un viaje de regreso. Motores de metano actuales en desarrollo producen un empuje de 7500 libra-fuerza (33 kN), que está lejos del 7.000.000 lbf (31 MN) necesario para poner en marcha el Transbordador Espacial. En lugar de ello, estos motores lo más probable es propulsar viajes desde la Luna o enviar expediciones robóticas a otros planetas en el sistema solar.
Materia prima química
Aunque existe un gran interés en la conversión de metano a compuestos útiles o licuado con mayor facilidad, los únicos procesos prácticos son relativamente no selectivo. En la industria química, el metano se convierte a gas de síntesis, una mezcla de monóxido de carbono e hidrógeno, por reformado con vapor. Este proceso endergónica (que requiere energía) utiliza níquel catalizadores y requiere altas temperaturas, alrededor de 700 a 1100 ° C:
- CH 4 + H2O → CO + 3 H 2
Químicas relacionadas se explotan en el Haber-Bosch Síntesis de amoníaco a partir de aire, que se reduce con gas natural a una mezcla de dióxido de carbono , agua y amoniaco .
El metano también se somete a los radicales libres cloración en la producción de clorometanos, aunque el metanol es un precursor más típico.
Producción
Rutas biológicas
De origen natural metano es producido principalmente por el proceso de metanogénesis. Este proceso de pasos múltiples es utilizado por los microorganismos como fuente de energía. La reacción neta es:
- CO 2 + H + 8 + 8 e - → CH 4 + 2 H 2 O
El paso final en el proceso es catalizada por la enzima metil-coenzima M reductasa. Metanogénesis es una forma de la respiración anaerobia utilizado por organismos que ocupan vertedero, rumiantes (por ejemplo, el ganado), y la tripa de termitas.
No está claro si las plantas son una fuente de emisiones de metano.
Serpentinización
El metano también podría ser producido por un proceso no biológico llamado serpentinización la participación de agua, dióxido de carbono, y el mineral olivino, que se sabe que es común en Marte.
Rutas Industriales
El metano puede ser producido por la hidrogenación de dióxido de carbono a través de la Proceso Sabatier. El metano es también un producto secundario de la hidrogenación de monóxido de carbono en el Proceso de Fischer-Tropsch. Esta tecnología se practica a gran escala para producir moléculas de cadena más larga que el metano.
El gas natural es tan abundante que la producción intencionada de metano es relativamente raro. La única instalación a gran escala de este tipo es el Gran planta Plains Synfuels, iniciado en 1984 en Beulah, Dakota del Norte como una manera de desarrollar los abundantes recursos locales de bajo grado lignito, un recurso que es por otra parte muy difícil de transportar por su peso, contenido de cenizas, bajo valor calórico y la propensión a la combustión espontánea durante el almacenamiento y el transporte.
La síntesis de Laboratorio
El metano también se puede producir por el destilación destructiva de ácido acético en presencia de cal sodada o similar. El ácido acético es descarboxila en este proceso. El metano también se puede preparar por reacción de carburo de aluminio con agua o ácidos fuertes.
Aparición
El metano fue descubierto y aislado por Alessandro Volta entre 1776 y 1778 en el estudio de gas de los pantanos de Lago Maggiore. Es el componente principal del gas natural, aproximadamente un 87% en volumen. La principal fuente de metano es la extracción de los depósitos geológicos conocidos como campos de gas natural, con la extracción de gas de veta de carbón convertirse en una fuente importante (véase Extracción de metano del lecho de carbón, un método para extraer metano de un carbón de depósitos, mientras que recuperación mejorada de carbón metano es un método de recuperación de metano de capas de carbón no explotables). Se asocia con otra combustibles de hidrocarburos, y, a veces acompañados de helio y nitrógeno . El gas en niveles someros (baja presión) formas de anaeróbico decadencia de la materia orgánica y el metano reelaborado desde las profundidades de la superficie de la Tierra. En general, los sedimentos enterrados temperaturas más altas y más profundas en que los que contienen aceite de generar gas natural.
Por lo general, se transporta a granel por gasoducto en su forma de gas natural, o Metaneros en su forma licuado; pocos países lo transportan en camión.
El metano atmosférico
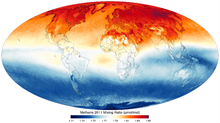
El metano se crea cerca de la superficie de la Tierra, principalmente por los microorganismos por el proceso de metanogénesis. Se realiza en el estratosfera por aire ascendente en los trópicos . Incontrolada acumulación de metano en la atmósfera es, naturalmente, comprueba - aunque la influencia humana puede alterar esta regulación natural - por la reacción del metano con radicales hidroxilo formados a partir de átomos de oxígeno singlete y con vapor de agua. Tiene una vida neto de alrededor de 10 años, y se elimina principalmente por la conversión a dióxido de carbono y agua.
El metano también afecta a la degradación de la capa de ozono.
Además, hay una gran (pero desconocida) la cantidad de metano en clatratos de metano en los fondos oceánicos, así como de la Tierra corteza . La mayoría de metano es el resultado de proceso biológico llamado metanogénesis.
En 2010, se midieron los niveles de metano en el Ártico en 1850 nmol / mol, un nivel más de dos veces mayor que en cualquier momento en los 400.000 años anteriores a la revolución industrial . Históricamente, las concentraciones de metano en la atmósfera del mundo han oscilado entre 300 y 400 nmol / mol durante los períodos glaciales conocidas comúnmente como edades de hielo , y entre 600 a 700 nmol / mol durante el calentamiento períodos interglaciares. Tiene un alto potencial de calentamiento global: 72 veces la del dióxido de carbono en 20 años, y 25 veces más de 100 años, y los niveles están aumentando. Investigaciones recientes sugieren que los océanos de la Tierra son una nueva fuente potencialmente importante de metano del Ártico.
A la Universidad de Bristol estudio publicado en Naturaleza afirma que el metano bajo la Capa de hielo de la Antártida todavía puede desempeñar un papel importante a nivel mundial. Los investigadores creen que estos ambientes sub-hielo para ser biológicamente activa, en la que los microbios están convirtiendo carbono orgánico a dióxido de carbono y metano.
El metano en la atmósfera de la Tierra es un importante gas de efecto invernadero con un potencial de calentamiento global de 25 en comparación con el CO 2 durante un período de 100 años (aunque las cifras aceptadas probablemente representan una subestimación). Esto significa que una emisión de metano tendrá 25 veces la efecto sobre la temperatura de una emisión de dióxido de carbono de la misma masa durante los siguientes 100 años. El metano tiene un gran efecto durante un breve período (toda una vida neto de 8,4 años en la atmósfera), mientras que el dióxido de carbono tiene un pequeño efecto por un período largo (más de 100 años). Debido a esta diferencia en el efecto y el período de tiempo, el potencial de calentamiento global del metano durante un período de 20 años es la concentración de metano en la atmósfera 72. El de la Tierra ha aumentado en un 150% desde 1750, y representa el 20% del total forzamiento radiativo de todos los de larga vida y mezclados mundialmente gases de efecto invernadero (estos gases no incluyen el vapor de agua que es con mucho el mayor componente del efecto invernadero). Por lo general, el exceso de metano de los vertederos y otros productores naturales de metano se quema tan CO 2 se libera a la atmósfera en lugar de metano, porque el metano es un gas de efecto invernadero más eficaz. Recientemente, el metano emitido por las minas de carbón se ha utilizado con éxito para generar electricidad.
Clatratos
Liberación Ártico metano de permafrost y clatratos de metano es una consecuencia esperada y además causa del calentamiento global .
Seguridad
El metano no es tóxico; sin embargo, es extremadamente inflamable y puede formar mezclas explosivas con el aire. El metano es violentamente reactivo con oxidantes, halógenos , y algunos compuestos que contienen halógeno. El metano es también una asfixiante y puede desplazar el oxígeno en un espacio cerrado. La asfixia puede resultar si la concentración de oxígeno se reduce por debajo de aproximadamente 16% por el desplazamiento, como la mayoría de la gente puede tolerar una reducción del 21% al 16% sin efectos nocivos. La concentración de metano en el que el riesgo de asfixia se vuelve significativa es mucho mayor que la concentración de 5-15% en una mezcla inflamable o explosivo. Posibles efectos en la salud de la inhalación de metano en concentraciones altas, lo que resulta en la deficiencia de oxígeno, se incrementan las tasas de respiración y pulso, falta de coordinación muscular, malestar emocional, náusea y vómitos, pérdida de conciencia, colapso respiratorio y muerte. El metano off-gas puede penetrar en los interiores de edificios cerca vertederos y exponen ocupantes a niveles significativos de metano. Algunos edificios han diseñado especialmente sistemas de recuperación por debajo de sus sótanos para capturar activamente este gas y de ventilación lejos del edificio.
Explosiones de gas metano son responsables de muchos desastres mineros mortales. Una explosión de gas metano fue la causa de la Upper Big Branch desastre de la mina de carbón en Virginia Occidental el 5 de abril de 2010, matando a 25.
Metano Extraterrestre
El metano se ha detectado o se cree que existen en varios lugares del sistema solar . En la mayoría de los casos, se cree que fue creado por procesos abióticos. Las posibles excepciones son Marte y Titán.
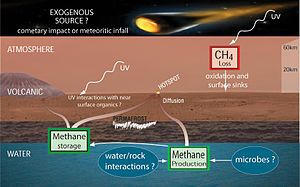
- Venus - la atmósfera contiene una gran cantidad de metano de 60 kilometros (37 millas) de la superficie según los datos recogidos por el Pioneer Venus grande Sonda Neutro Espectrómetro de Masas
- Luna - trazas se desgasifica de la superficie
- Marte - la Atmósfera de Marte contiene 10 nmol / mol de metano. La fuente de metano en Marte no se ha determinado. Investigaciones recientes sugieren que el metano puede provenir de volcanes , fallas , o metanógenos, o que pueden ser un subproducto de descargas eléctricas de remolinos de polvo y tormentas de polvo, o que pueden ser el resultado de UV radiación. En enero de 2009, científicos de la NASA anunciaron que habían descubierto que el planeta menudo ventila metano a la atmósfera en áreas específicas, lo que lleva a algunos a especular que esto puede ser un signo de actividad biológica pasando por debajo de la superficie. Análisis de las observaciones hechas por un Investigación Meteorológica y el modelo de pronóstico para Marte (MarsWRF) y relacionados Marte modelo de circulación general (MGCM) sugiere que es potencialmente posible aislar ubicaciones de origen columna de metano a dentro de decenas de kilómetros, que es dentro de las capacidades de mecha de los futuros exploradores de Marte . La Rover Curiosity, que aterrizó en Marte en agosto de 2012, es capaz de realizar mediciones que distinguen entre diferentes isotopólogos de metano; pero incluso si la misión es determinar que la vida marciana microscópica es la fuente del metano, las formas de vida probablemente residen lejos de la superficie, fuera del alcance del rover. La curiosidad de Análisis de las muestras en Marte (SAM) instrumento es capaz de rastrear la presencia de metano en el tiempo para determinar si es constante, variable, de temporada, o al azar, que prevé nuevas pistas sobre su origen. Las primeras mediciones con el Tunable láser espectrómetro (TLS) indica que hay menos de 5 ppb de metano en el lugar de aterrizaje en el punto de la medición. La Marte Traza Misión Gas orbitador previsto poner en marcha en el año 2016 sería estudiar más a fondo el metano, así como sus productos de descomposición, tales como formaldehído y metanol . Alternativamente, estos compuestos en lugar pueden ser repuestos por medio geológicas volcánicas u otros, como serpentinización.
- Jupiter - la atmósfera contiene aproximadamente 0,3% de metano
- Saturno - la atmósfera contiene aproximadamente 0,4% de metano
- Japeto
- Titan - la atmósfera contiene 1,6% de metano y miles de lagos de metano se han detectado en la superficie En la atmósfera superior que el metano se convierte en moléculas más complejas incluyendo acetileno , un proceso que también produce molecular de hidrógeno . Hay pruebas de que el acetileno y el hidrógeno se reciclan en metano cerca de la superficie. Esto sugiere la presencia de un catalizador o bien exótico, o una forma desconocida de la vida metanogénica. Una aparente lago de metano líquido ha sido visto por la Cassini-Huygens de la sonda, lo que los investigadores a especular sobre la posibilidad de vida en Titán. Lluvias de metano, probablemente provocadas por el cambio de las estaciones, también se han observado.
- Encelado - la atmósfera contiene 1,7% de metano
- Urano - la atmósfera contiene 2,3% de metano
- Ariel - metano se cree que es un constituyente de hielo de la superficie de Ariel
- Miranda
- Oberon - alrededor del 20% del hielo de la superficie de Oberon se compone de compuestos de carbono / nitrógeno relacionadas metano
- Titania - aproximadamente el 20% de hielo de la superficie de Titania se compone de compuestos orgánicos relacionados metano-
- Umbriel - metano es un constituyente de hielo de la superficie de Umbriel
- Neptuno - la atmósfera contiene 1,6% de metano
- Triton - Triton tiene una tenue atmósfera de nitrógeno con pequeñas cantidades de metano cerca de la superficie.
- Plutón - espectroscópica análisis de la superficie de Plutón lo revela a contener trazas de metano
- Se cree presente en Caronte metano, pero no está completamente confirmado - Caronte
- Eris - luz infrarroja del objeto reveló la presencia de hielo de metano
- El cometa Halley
- Cometa Hyakutake - observaciones terrestres encontró etano y metano en el cometa
- Los planetas extrasolares - metano se detectó en el planeta extrasolar 189733b HD; esta es la primera detección de un compuesto orgánico en un planeta fuera del sistema solar. Su origen es desconocido, ya alta temperatura del planeta (700 ° C) normalmente favorecer la formación de monóxido de carbono en su lugar. Las investigaciones indican que los meteoroides golpeando contra exoplanetas atmósferas podrían añadir gases orgánicos como metano, haciendo los exoplanetas se ven como si están habitados por vida, incluso si no lo son.
- Las nubes interestelares
