
Roentgenium
Antecedentes
Voluntarios SOS ayudaron a elegir artículos e hicieron otro material curricular Apadrinar un niño para hacer una diferencia real.
| Roentgenium | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
111 Rg | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||
| plateado (prevista) | |||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | roentgenium, Rg, 111 | ||||||||||||||||||||||||||||||||||||
| Pronunciación | / r ʌ n t ɡ ɛ n yo ə m / runt- GEN -ee-əm o / r ɛ n t ɡ ɛ n yo ə m / Rent- GEN -ee-əm | ||||||||||||||||||||||||||||||||||||
| Categoría Elemento | desconocido pero probablemente un metal de transición | ||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 11, 7, d | ||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | [281] | ||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Rn ] 5f 14 6d 9 7s 2 (Valor de referencia) 2, 8, 18, 32, 32, 17, 2 (Valor de referencia) 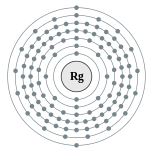 | ||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||
| Descubrimiento | Gesellschaft für Schwerionenforschung (1994) | ||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||
| Fase | sólido (prevista) | ||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 28.7 (prevista) g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 5, 3, 1, -1 (prevista) | ||||||||||||||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 1022.7 (estimado) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Segundo: 2074.4 (estimado) kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Tercero: 3077.9 (estimado) kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Radio atómico | 114 (valor de referencia) pm | ||||||||||||||||||||||||||||||||||||
| Radio covalente | 121 (estimado) pm | ||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 54386-24-2 | ||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de roentgenium | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Roentgenium es un elemento químico con el símbolo Rg y número atómico 111. Es un extremadamente radioactivo elemento sintético (un elemento que se puede crear en un laboratorio pero no se encuentra en la naturaleza); el isótopo conocido más estable, roentgenium-281, tiene una vida media de 26 segundos. Roentgenium primero fue creado en 1994 por la GSI cerca Darmstadt, Alemania. Se llama así en honor al físico Wilhelm Röntgen (también escrito Roentgen).
En la tabla periódica , es una d-bloque Transactínido. Es un miembro de la Séptimo período y se coloca en el grupo 11 elementos, aunque no hay experimentos químicos han llevado a cabo para confirmar que se comporta como el más pesado homólogo de oro en el grupo 11. Roentgenium se calcula que tiene propiedades similares a sus homólogos más ligeros, de cobre , de plata , y oro, aunque puede mostrar algunas diferencias de ellos.
Historia

Descubrimiento Oficial
Roentgenium era primero sintetizado por un equipo internacional liderado por Sigurd Hofmann en el Gesellschaft für Schwerionenforschung (GSI) en Darmstadt, Alemania , el 8 de diciembre de 1994. El equipo bombardeó un blanco de bismuto-209 con núcleos acelerados de níquel -64 y detectado un solo átomo del isótopo roentgenium-272:
En 2001, el Grupo de Trabajo Conjunto de IUPAC / IUPAP (PTC) concluyó que no había pruebas suficientes para el descubrimiento en ese momento. El equipo GSI repitió su experimento en 2002 y detectó tres átomos más. En su informe de 2003, el programa de trabajo conjunto decidió que el equipo GSI debe ser reconocido por el descubrimiento de este elemento.
Naming
El nombre roentgenium (Rg) fue sugerido por el equipo de GSI en honor al físico alemán Wilhelm Conrad Röntgen, el descubridor de Los rayos X, en 2004. Este nombre fue aceptado por IUPAC el 1 de noviembre de 2004.
Nucleosíntesis
Elementos súper pesados como roentgenium se producen mediante el bombardeo de elementos más ligeros en aceleradores de partículas que inducen reacciones de fusión. Considerando que el isótopo más ligero de roentgenium, roentgenium-272, se pueden sintetizar directamente de esta manera, todos los isótopos más pesados Roentgenium sólo se han observado como productos de desintegración de elementos con mayores números atómicos .
Dependiendo de las energías implicadas, reacciones de fusión se pueden clasificar como "caliente" o "frío". En las reacciones de fusión en caliente,, proyectiles de alta energía muy ligeros son acelerados hacia objetivos muy pesados ( actínidos ), dando lugar a núcleos compuestos en energía de alta excitación (~ 40-50 MeV) que puede evaporarse ya sea de fisión o varios 3 a 5) neutrones (. En las reacciones de fusión en frío, los núcleos condensados producidos tienen una energía de excitación relativamente baja (~ 10-20 MeV), que disminuye la probabilidad de que estos productos serán sometidos a las reacciones de fisión. Mientras los núcleos fundidos se enfríen a la estado fundamental, que requieren emisión de sólo uno o dos neutrones, y por lo tanto, permite la generación de productos más ricos en neutrones. Este último es un concepto diferente de la de la fusión nuclear, donde se reivindica que deberían alcanzarse en condiciones de temperatura ambiente (ver fusión fría).
Fusión fría
Antes de la primera síntesis exitosa de roentgenium en 1994 por la Equipo GSI, un equipo de la Instituto Conjunto de Investigación Nuclear en Dubna, Rusia, también trató de sintetizar roentgenium bombardeando bismuto-209 con el níquel-64 en 1986. No se identificaron roentgenium átomos. Después de una actualización de sus instalaciones, el equipo de GSI éxito detectado 3 átomos de 272 Rg en su experimento descubrimiento. Otros 3 átomos se sintetizaron en 2002. Se confirmó el descubrimiento de roentgenium en 2003, cuando un equipo de la RIKEN mide las desintegraciones de 14 átomos de 272 Rg.
Lo mismo isótopo roentgenium también fue observado por un equipo americano en la Laboratorio Nacional Lawrence Berkeley (LBNL) de la reacción:
- 208
82 Pb + 65
29 Cu → 272
111 Rg + n
Esta reacción se llevó a cabo como parte de su estudio de los proyectiles con impar número atómico en las reacciones de fusión fría.
Como producto de la desintegración
| Residuo de evaporación | Isótopo roentgenium observada |
|---|---|
| 294, 290 Uus UUP, 286 Uut | 282 Rg |
| 293, 289 Uus UUP, 285 Uut | 281 Rg |
| 288 Uup, 284 Uut | 280 Rg |
| 287 Uup, 283 Uut | 279 Rg |
| 282 Uut | 278 Rg |
| 278 Uut | 274 Rg |
Todos los isótopos de roentgenium excepto roentgenium-272 se han detectado sólo en las cadenas de desintegración de elementos con un mayor número atómico , como ununtrium . Ununtrium actualmente tiene seis isótopos conocidos; todos ellos se someten alfa decae para convertirse núcleos Roentgenium, con números de masa entre 274 y 282. Los núcleos ununtrium Padres pueden ser ellos mismos los productos de desintegración de Ununpentium o ununseptium. Hasta la fecha, no hay otros elementos se han conocido a decaer a roentgenium. Por ejemplo, en enero de 2010, el equipo de Dubna ( ICIN) identificado roentgenium-281 como un producto final en el decaimiento de ununseptium a través de una secuencia de desintegración alfa:
- 293
117 Uus → 289
115 Uup + 4
2 Él - 289
115 Uup → 285
113 Uut + 4
2 Él - 285
113 Uut → 281
111 Rg + 4
2 Él
Isótopos
| Isótopo | Media vida | Decaimiento modo | Descubrimiento año | Reacción |
|---|---|---|---|---|
| 272 Rg | 3.8 ms? | α | 1994 | 209 Bi (64 Ni, n) |
| 273 Rg | 5? sra | α? | desconocido | - |
| 274 Rg | 6.4 ms | α | 2004 | 278 Uut (-, α) |
| 275 Rg | 10? sra | α? | desconocido | - |
| 276 Rg | 100? sra | α, SF? | desconocido | - |
| 277 Rg | 1? s | α, SF? | desconocido | - |
| 278 Rg | 4.2 ms | α | 2006 | 282 Uut (-, α) |
| 279 Rg | 0.17 s | α | 2003 | 287 Uup (-, 2α) |
| 280 Rg | 3.6 s | α | 2003 | 288 Uup (-, 2α) |
| 281 Rg | 26 s | SF | 2009 | 293 Uus (-, 3α) |
| 282 Rg | 0.5 s | α | 2009 | 294 Uus (-, 3α) |
| 283 Rg | 10? min | α, SF? | desconocido | - |
Roentgenium no tiene isótopos estables o de origen natural. Varios isótopos radiactivos han sido sintetizados en el laboratorio, ya sea por fusión de los núcleos de elementos más ligeros o como productos de desintegración intermedios de elementos más pesados. Siete isótopos diferentes de roentgenium se han reportado con masas atómicas 272, 274, y 278 a 282, de los cuales dos, roentgenium-272 y roentgenium-274, han conocido, pero sin confirmar estados metaestables. Todo esto a través de la descomposición desintegración alfa excepto roentgenium-281, que pasa por la fisión espontánea.
Estabilidad y vida media
Todos los isótopos Roentgenium son extremadamente inestable y radiactivos; En general, los isótopos más pesados son más estables que el encendedor. El isótopo roentgenium conocido más estable, 281 Rg, es también el segundo mayor roentgenium conocido isótopo; que tiene una vida media de 26 segundos. El isótopo 280 Rg ha informado de que también tienen una vida media de más de un segundo. El isótopos 282 y 279 Rg Rg tienen vidas medias de 0,5 y 0,17 segundos, respectivamente. Los cuatro isótopos restantes tienen vidas medias entre 1 y 10 milisegundos. El isótopo no descubierto 287 Rg ha pronosticado para ser el más estable hacia desintegración beta; sin embargo, no se conoce ningún isótopo roentgenium se ha observado que someterse desintegración beta. También se espera que los isótopos desconocidos Rg 277 y 283 Rg tener larga vida media de 1 segundo y 10 minutos respectivamente. Antes de su descubrimiento, los isótopos 278 Rg, 281 Rg y 282 Rg se prevé que tenga larga vida media de 1 segundo, 1 minuto, y 4 minutos, respectivamente; sin embargo, se descubrió que tienen vidas medias más cortas de 4,2 milisegundos, 26 segundos y 0,5 segundos respectivamente.
Isomería Nuclear
- 274 Rg
Dos átomos de 274 Rg se han observado en el cadena de desintegración del 278 Uut. El decaen por emisión alfa, que emite partículas alfa con energías diferentes y tienen diferentes vidas. Además, las dos cadenas de desintegración enteras parecen ser diferentes. Esto sugiere la presencia de dos isómeros nucleares, pero se requiere más investigación.
- 272 Rg
Cuatro partículas alfa emitidas desde 272 Rg con energías de 11,37, 11,03, 10,82, y 10,40 MeV se han detectado. El GSI medido 272 Rg tener una vida media de 1,6 ms, mientras que los últimos datos de RIKEN han dado una vida media de 3,8 ms. Los datos contradictorios pueden deberse a isómeros nucleares, pero los datos actuales son insuficientes para llegar a cualquier asignación en firme.
Propiedades predichas
Químico
Roentgenium es el noveno miembro de la serie 6d de metales de transición . Desde copernicium (elemento 112) ha demostrado ser un metal de transición, se espera que todos los elementos de 104 a 112 formarían una cuarta serie de metales de transición. Los cálculos sobre su potenciales de ionización y atómico y radios iónicos son similares a la de su homólogo más ligero de oro , lo que implica que las propiedades básicas de Roentgenium se asemejan a los de la otra grupo 11 elementos, cobre , plata , y oro; Sin embargo, también se prevé para mostrar varias diferencias con sus homólogos más ligeros.
Roentgenium se prevé que sea una noble metal. Con base en los estados de oxidación más estable de los grupos más ligero 11 elementos, roentgenium se predice para mostrar estables 5, estados 3 y -1 de oxidación, con un 1 estado menos estable. El estado 3 se prevé que sea la más estable. Se espera Roentgenium (III) a ser de reactividad comparable a la de oro (III), pero debe ser más estable y formar una variedad más grande de compuestos. El oro también se forma un estado -1 o menos estable debido a los efectos relativistas, y roentgenium puede hacer lo mismo. Los orbitales 6d se desestabilizan por efectos relativistas y interacciones spin-órbita cerca del final de la cuarta serie de metales de transición, con lo que los estados de oxidación más altos como roentgenium (V) y copernicium (IV) más estable que sus homólogos más ligeros oro (V) y mercurio (IV) (cada uno de los cuales se conocen sólo en un compuesto) como los electrones 6d participan en la unión a un mayor grado. Las interacciones spin-órbita estabilizan compuestos Roentgenium moleculares con electrones 6d más de unión; por ejemplo, RGF -
Se espera 6 a ser más estable que RGF -
4, que se espera que sea más estable que RGF -
Se espera que 2. Roentgenium (I) a ser difícil de obtener.
La química probable de roentgenium ha recibido más interés que el de los dos elementos anteriores, meitnerium y darmstadtium , como la valencia s- subniveles del grupo se espera que 11 elementos para ser relativista contratado más fuertemente en roentgenium. Los cálculos sobre el compuesto molecular Rg H muestran que los efectos relativistas doble de la fuerza de la unión roentgenium-hidrógeno, a pesar de que las interacciones spin-órbita también debilitan por 0,7 eV. Los compuestos Au X y RGX, donde X = F , Cl , Br , O , Au, o Rg, fueron también estudiados.
Física y atómica
Se espera Roentgenium a ser un sólido en condiciones normales. Debe ser una muy pesada de metal con una densidad de alrededor de 28,7 g / cm 3; En comparación, el elemento más denso conocido que ha tenido midió su densidad, osmio , tiene una densidad de sólo 22,61 g / cm 3. Esto resulta de alto peso atómico de roentgenium, la lantánidos y actínidos contracciones, y efectos relativistas, aunque la producción de suficiente roentgenium para medir esta cantidad sería poco práctico, y la muestra decaería rápidamente.
El grupo estable 11 elementos, cobre, plata y oro, todos tienen una configuración electrónica externa nd 10 (n + 1) s 1. Para cada uno de estos elementos, el primer estado excitado de sus átomos tiene una configuración nd 9 (n + 1) s 2. Debido a acoplamiento spin-órbita entre los electrones d, este estado se divide en un par de niveles de energía. Para el cobre, la diferencia en energía entre el estado fundamental y el más bajo estado excitado hace que el metal a aparecer rojizo. Para la plata, la brecha de energía se ensancha y se convierte en plateado. Sin embargo, como el número atómico aumenta, los niveles excitados se estabilizan por los efectos relativistas y en oro la brecha de energía disminuye de nuevo y parece oro. Para roentgenium, los cálculos indican que el nivel de 6d 9 7s 2 se estabiliza hasta tal punto que se convierte en el estado fundamental y el nivel 6d 10 7s 1 se convierte en el primer estado excitado. La diferencia de energía resultante entre el nuevo estado fundamental y el primer estado excitado es similar a la de la plata, y se espera roentgenium ser plateado en apariencia. Se espera que el radio atómico de roentgenium estar alrededor de 114 pm.
Química Experimental
Determinación inequívoca de las características químicas de roentgenium aún tiene que se han establecido debido a los bajos rendimientos de las reacciones que producen isótopos Roentgenium. Para los estudios químicos que se llevarán a cabo en un transactinide, al menos cuatro átomos deben ser producidos, la vida media del isótopo utilizado debe ser de al menos 1 segundo, y la tasa de producción deben ser de al menos un átomo por semana. A pesar de que la vida media de 281 Rg, la conocida isótopo roentgenium más estable, es 26 segundos, el tiempo suficiente para llevar a cabo estudios químicos, otro obstáculo es la necesidad de aumentar la tasa de producción de isótopos Roentgenium y permitir experimentos para continuar durante semanas o meses para que se pueden obtener resultados estadísticamente significativos. Separación y detección deben llevarse a cabo de manera continua para separar los isótopos Roentgenium y los sistemas automatizados pueden entonces experimentar en la fase gaseosa y la solución química de roentgenium como los rendimientos de los elementos más pesados se predicen a ser más pequeñas que las de los elementos más ligeros. Sin embargo, la química experimental de roentgenium no ha recibido tanta atención como la de los elementos más pesados copernicium y flerovium .
