
Lutecio
Acerca de este escuelas selección Wikipedia
SOS Children ha intentado que el contenido de Wikipedia más accesible por esta selección escuelas. Una rápida conexión para el apadrinamiento de niños es http://www.sponsor-a-child.org.uk/
| Lutecio | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
71 Lu | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||
blanco plateado  | |||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||
| Nombre, símbolo, número | lutecio, Lu, de 71 años | ||||||||||||||||||||||||||||||
| Pronunciación | / lj U t yo ʃ yo ə m / TEE lew- -shee-əm | ||||||||||||||||||||||||||||||
| Categoría Elemento | lantánidos a veces considerado un metal de transición | ||||||||||||||||||||||||||||||
| Grupo, período, bloque | n / a, 6, d | ||||||||||||||||||||||||||||||
| Peso atómico estándar | 174.9668 (4) | ||||||||||||||||||||||||||||||
| Configuración electrónica | [ Xe ] 6s 2 4f 14 5d 1 2, 8, 18, 32, 9, 2 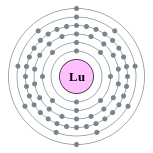 | ||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||
| Descubrimiento | Georges Urbain y Carl Auer von Welsbach (1906) | ||||||||||||||||||||||||||||||
| Primer aislamiento | Carl Auer von Welsbach (1906) | ||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 9,841 g · cm -3 | ||||||||||||||||||||||||||||||
| Líquido densidad en mp | 9.3 g · cm -3 | ||||||||||||||||||||||||||||||
| Punto de fusion | 1925 K , 1652 ° C, 3006 ° F | ||||||||||||||||||||||||||||||
| Punto de ebullicion | 3675 K, 3402 ° C, 6156 ° F | ||||||||||||||||||||||||||||||
| Calor de fusión | ca. 22 kJ · mol -1 | ||||||||||||||||||||||||||||||
| El calor de vaporización | 414 kJ · mol -1 | ||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 26.86 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||
| Estados de oxidación | 3, 2, 1 (Débilmente óxido básico) | ||||||||||||||||||||||||||||||
| Electronegatividad | 1,27 (escala de Pauling) | ||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 523.5 kJ · mol -1 | ||||||||||||||||||||||||||||||
| Segundo: 1340 kJ · mol -1 | |||||||||||||||||||||||||||||||
| Tercero: 2022,3 kJ · mol -1 | |||||||||||||||||||||||||||||||
| Radio atómico | 174 pm | ||||||||||||||||||||||||||||||
| Radio covalente | 187 ± 20:00 | ||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal compacta | ||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético | ||||||||||||||||||||||||||||||
| La resistividad eléctrica | ( rt) (poli) 582 nΩ · m | ||||||||||||||||||||||||||||||
| Conductividad térmica | 16.4 W · m -1 · K -1 | ||||||||||||||||||||||||||||||
| Expansión térmica | ( rt) (poli) 9,9 m / (m · K) | ||||||||||||||||||||||||||||||
| El módulo de Young | 68.6 GPa | ||||||||||||||||||||||||||||||
| Módulo de corte | 27.2 GPa | ||||||||||||||||||||||||||||||
| Módulo de volumen | 47.6 GPa | ||||||||||||||||||||||||||||||
| Relación de Poisson | 0,261 | ||||||||||||||||||||||||||||||
| Dureza Vickers | 1160 MPa | ||||||||||||||||||||||||||||||
| Dureza Brinell | 893 MPa | ||||||||||||||||||||||||||||||
| Número de registro del CAS | 7439-94-3 | ||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de lutecio | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Lutecio es un elemento químico con el símbolo Lu y número atómico 71. Es un blanco plateado de metal resistente a la corrosión en seco, pero no húmedo, aire. Es el último elemento de la lantánidos serie, y tradicionalmente cuenta entre los tierras raras.
Lutecio fue descubierto independientemente en 1907 por el científico francés Georges Urbain, mineralogista austríaco Baron Carl Auer von Welsbach y químico estadounidense Charles James. Todos estos hombres encontraron lutecio como una impureza en el mineral iterbia, que se pensaba que consiste en su totalidad de iterbio. La disputa sobre la prioridad del descubrimiento se produjo poco después, con Urbain y von Welsbach acusándose mutuamente de la publicación de resultados influidos por la investigación publicada de la otra; el honor de nombrar fue a Urbain como publicó sus resultados antes. Él eligió el nombre lutecio para el nuevo elemento, pero en 1949 la ortografía del elemento 71 se cambió a lutecio. En 1909, finalmente se le concedió la prioridad a Urbain y sus nombres fueron adoptados como los oficiales; sin embargo, el nombre casiopeo (o cassiopium tarde) para el elemento 71 propuesto por von Welsbach fue utilizado por muchos científicos alemanes hasta la década de 1950.
Lutecio no es un elemento particularmente abundante, aunque significativamente más común que la plata en la corteza terrestre; tiene pocos usos específicos. Lutecio-176 es relativamente abundante (2,5%) isótopo radiactivo con una vida media de aproximadamente 38 millones de años, y lo utiliza para determinar la edad de meteoritos. Lutecio ocurre generalmente en asociación con el elemento itrio y se utiliza a veces en el metal aleaciones y como un catalizador en diversas reacciones químicas. 177 Lu- DOTA-TATE se utiliza para la terapia con radionucleidos (ver La medicina nuclear) sobre los tumores neuroendocrinos.
Características
Propiedades físicas
Un átomo de lutecio tiene 71 electrones, dispuestos en el configuración [ Xe ] 4f 14 5d 1 6s 2. Al entrar en una reacción química, el átomo pierde sus dos electrones más externos y la única 5d-electrón; esto es inusual ya que las reacciones de los otros lantánidos implican invariablemente electrones f-shell. El átomo de lutecio es el más pequeño entre los átomos de lantánido, debido a la la contracción de los lantánidos, y como resultado lutecio tiene la mayor densidad, punto de fusión, y la dureza de los lantánidos.
Propiedades químicas y combinaciones
Compuestos de lutecio siempre contienen el elemento en el estado de oxidación +3. Las soluciones acuosas de la mayoría de las sales de lutecio es incolora y forman sólidos cristalinos blancos tras el secado, con la excepción común del yoduro. Las sales solubles, tales como nitrato, sulfato y acetato de formar hidratos por cristalización. La óxido, hidróxido, fluoruro, carbonato, fosfato y oxalato son insolubles en agua.
Lutecio metal es ligeramente inestable en aire en condiciones normales, pero se quema fácilmente a 150 ° C para formar óxido de lutecio. El compuesto resultante se conoce para adsorber agua y dióxido de carbono , y puede ser utilizado para eliminar los vapores de estos compuestos derivados de atmósferas cerradas. Observaciones similares se realizan durante la reacción entre el lutecio y agua (lento cuando está frío y rápido cuando está caliente); hidróxido de lutecio se forma en la reacción. Lutecio metal se sabe que reaccionan con los cuatro halógenos más ligeros para formar tri haluros; todos ellos (excepto el flúor) son solubles en agua.
Lutecio se disuelve fácilmente en ácidos débiles y diluir el ácido sulfúrico para formar soluciones que contienen los iones de lutecio incoloros, que existen como un [Lu (H 2 O) 9] 3+ complejo:
- 2 Lu + 3 H 2 SO 4 + 18 H 2 O → 2 [Lu (H 2 O) 9] 3+ + 3 SO 2-
4 + 3 H 2 ↑
Isótopos
Lutecio ocurre en la Tierra en forma de dos isótopos: lutecio-175 y lutecio-176. Fuera de estos dos, sólo el primero es estable, haciendo que el elemento monoisotópico. Este último, lutecio-176, decae a través de desintegración beta con una vida media de 3,78 × 10 10 años; que representa aproximadamente el 2,5% de lutecio natural. Hasta la fecha, 32 radioisótopos sintéticos del elemento se han caracterizado, que varían en masa de 149.973 (lutecio-150) a 183.961 (lutecio-184); los más estables tales isótopos son lutecio-174 con una vida media de 3,31 años, y lutecio-173 con una vida media de 1,37 años. Todos los restantes isótopos radiactivos tienen vidas medias que son menos de 9 días, y la mayoría de ellos tienen vidas medias que son menos de media hora. Los isótopos más ligeros que el estable decadencia lutecio-175 a través de captura de electrones (para producir isótopos de iterbio ), con algunas alfa y por emisión de positrones); los isótopos más pesados se descomponen principalmente a través de la desintegración beta, productoras de isótopos de hafnio.
El elemento también tiene 42 isómeros nucleares, con masas de 150, 151, 153-162, 166-180 (no todos los número de masa corresponde a un solo isómero). El más estable de ellos son lutecio 177 millones, con una vida media de 160,4 días y lutecio 174 millones, con una vida media de 142 días; este es más largo que la vida media de los estados fundamentales de todos los isótopos radiactivos lutecio, con la única excepción de lutecio-173, 174, y 176.
Historia
Lutecio, derivado del latín Lutetia ( París ), era independiente descubierto en 1907 por el científico francés Georges Urbain, mineralogista austríaco Baron Carl Auer von Welsbach y químico estadounidense Charles James. Ellos encontraron que como impureza en iterbia, que fue considerado por el químico suizo Jean Charles de Marignac Galissard a compuestos enteramente de iterbio . Los científicos proponen diferentes nombres para los elementos: Urbain eligió neoytterbium y lutecio, mientras Welsbach eligió aldebaranium y casiopeo. Ambos artículos se acusaron mutuamente de la publicación de resultados sobre la base de la otra parte.
La Comisión de Masa Atómica, que entonces era responsable de la atribución de nuevos nombres de elementos, resolver la controversia en 1909 al otorgar prioridad a Urbain y la adopción de sus nombres como las oficiales, basadas en el hecho de que la separación de lutecio del iterbio de Marignac fue primero descrito por Urbain; después fueron reconocidos nombres de Urbain, neoytterbium se revirtió a iterbio. Hasta la década de 1950, algunos químicos alemanes llaman lutecio por nombre casiopeo de von Welsbach; en 1949, la ortografía del elemento 71 se cambió a lutecio. Sin embargo, 1.907 muestras de Welsbach de lutecio habían estado puro, mientras que 1.907 muestras de Urbain sólo contenían trazas de lutecio. Esta tarde engañó Urbain en el pensamiento de que había descubierto el elemento 72, que él nombró celtio , que en realidad era lutecio muy puro. Charles James, que se quedó fuera de la discusión de prioridades, trabajó en una escala mucho más grande y posee la mayor oferta de lutecio en el momento. Metales lutecio puro se produjo por primera vez en 1953.
Ocurrencia y producción

Encontrado con casi todos los otros metales de las tierras raras, pero nunca por sí misma, lutecio es muy difícil de separar de otros elementos. El director de mineral comercialmente viable de lutecio es el de tierras raras mineral de fosfato de monacita: ( Ce , La , etc.) P O 4 que contiene 0,0001% del elemento. La abundancia de lutecio en la corteza terrestre es de sólo 0,5 mg / kg. Las principales zonas mineras son de China , Estados Unidos , Brasil , India , Sri Lanka y Australia . La producción mundial de lutecio (en forma de óxido) es de alrededor de 10 toneladas por año. Lutecio Pure de metal es muy difícil de preparar. Es uno de los más raros y más caro de los metales de tierras raras con el precio de alrededor de US $ 10.000 por kilogramo, o cerca de una cuarta parte del de oro .
Minerales triturados son tratados con concentrado caliente de ácido sulfúrico para producir sulfatos de solubles en agua de tierras raras. torio precipita de la solución como hidróxido y se retira. Después de que la solución se trata con oxalato de amonio para convertir tierras raras en sus oxalatos insolubles. Los oxalatos se convierten en óxidos mediante recocido. Los óxidos se disuelven en ácido nítrico que excluye a uno de los componentes principales, de cerio , óxido de cuya es insoluble en HNO 3. Varios metales de tierras raras, incluyendo lutecio, se separan como una sal doble con nitrato de amonio por cristalización. Lutecio se separa por intercambio iónico. En este proceso, los iones de tierras raras son absorbidos en la resina de intercambio iónico adecuada por intercambio con hidrógeno, amonio o iones cúpricos presentes en la resina. Sales de lutecio se lavan a continuación selectivamente a cabo por el agente complejante adecuado. Lutecio metal se obtiene entonces reducción de la anhidro Lu Cl 3 o Lu F 3 ya sea por una de metal alcalino o metal alcalinotérreo .
- 2 LucL 3 + 3 Ca → 2 Lu + 3 CaCl2
Aplicaciones
Debido a la rareza y alto precio, lutecio tiene muy pocos usos comerciales. Sin embargo, lutecio estable se puede usar como catalizadores en petróleo formación de grietas en las refinerías y también puede ser utilizado en la alquilación, hidrogenación , y aplicaciones de polimerización.
Granate lutecio de aluminio (Al 5 Lu 3 O 12) se ha propuesto para su uso como un material de lente en alto índice de refracción litografía de inmersión. Además, se añade una pequeña cantidad de lutecio como una dopante a galio gadolinio granate (GGG), que se utiliza en dispositivos de memoria de burbuja magnética. El cerio dopado con lutecio oxiortosilicato (LSO) es actualmente el compuesto preferido para los detectores en La tomografía por emisión de positrones (PET). Lutecio se utiliza como un fósforo en bombillas de luz LED.
Aparte de lutecio estable, sus isótopos radiactivos tienen varios usos específicos. El modo de vida media y la decadencia adecuada hecha lutecio-176 utilizado como un emisor beta puro, usando lutecio que ha sido expuesto a activación de neutrones, y en lutecio hafnio que data de fecha meteoritos. El isótopo sintética lutecio-177 obligado a octreotato (una análogo de la somatostatina), se utiliza experimentalmente en específica terapia con radionucleidos para Los tumores neuroendocrinos.
Lutecio tantalato (LuTaO 4) es el material más denso conocido estable blanco (densidad de 9,81 g / cm 3) y por lo tanto es un anfitrión ideal para los fósforos de rayos X. El material blanco sólo es más denso dióxido de torio, con una densidad de 10 g / cm 3, pero el torio que contiene es radiactivo.
Precauciones
Al igual que otros metales de las tierras raras, lutecio se considera que tiene un bajo grado de toxicidad, pero sus compuestos debe ser manejado con cuidado, sin embargo: por ejemplo, la inhalación de fluoruro lutecio es peligroso y el compuesto irrita la piel. Nitrato lutecio puede ser peligroso, ya que puede explotar y quemar una vez calentado. Polvo de óxido de lutecio es tóxico, así si es inhalado o ingerido.
De manera similar a otra grupo 3 elementos y lantánidos, lutecio no ha conocido papel biológico, pero se encuentra aún en los seres humanos , concentrándose en los huesos, y en menor medida en el hígado y los riñones. Sales lutecio se sabe que ocurren junto con otras sales de lantánidos en la naturaleza; el elemento es el menos abundante en el cuerpo humano de todos los lantánidos. Dietas humanos no han sido controlados por el contenido lutecio, por lo que no se sabe cuánto tarda el ser humano promedio, pero las estimaciones muestran que la cantidad es sólo alrededor de varios microgramos por año, todos ellos procedentes de pequeñas cantidades tomadas por las plantas. Sales de lutecio solubles son ligeramente tóxico, pero los insolubles no lo son.
