
Prometeo
Antecedentes
Esta selecci??n Wikipedia est?? disponible sin conexi??n de SOS Children para su distribuci??n en el mundo en desarrollo. Antes de decidir sobre el patrocinio de un ni??o, ??por qu?? no aprender sobre diferentes obras de caridad de patrocinio primero ?
| Prometeo | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
61 Pm | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||
| met??lico | ||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||
| Nombre, s??mbolo, n??mero | prometio, Pm, 61 | |||||||||||||||||||||||||||
| Pronunciaci??n | / p r ɵ m yo θ yo ə m / pro- MEE -thee-əm | |||||||||||||||||||||||||||
| Categor??a Elemento | lant??nidos | |||||||||||||||||||||||||||
| Grupo, per??odo, bloque | n / a, 6, F | |||||||||||||||||||||||||||
| Peso at??mico est??ndar | [145] | |||||||||||||||||||||||||||
| Configuraci??n electr??nica | [ Xe ] 6s 2 4f 5 2, 8, 18, 23, 8, 2 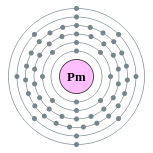 | |||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||
| Descubrimiento | Chien Shiung Wu, Emilio Segre Hans Bethe (1942) | |||||||||||||||||||||||||||
| Primer aislamiento | Charles D. Coryell, Jacob A. Marinsky, Lawrence E. Glendenin, Harold G. Richter (1945) | |||||||||||||||||||||||||||
| Nombrado por | Gracia Mar??a Coryell (1945) | |||||||||||||||||||||||||||
| Propiedades f??sicas | ||||||||||||||||||||||||||||
| Fase | s??lido | |||||||||||||||||||||||||||
| Densidad (cerca rt) | 7,26 g ?? cm -3 | |||||||||||||||||||||||||||
| Punto de fusion | 1315 K , 1042 ?? C, 1908 ?? F | |||||||||||||||||||||||||||
| Punto de ebullicion | 3273 K, 3000 ?? C, 5432 ?? F | |||||||||||||||||||||||||||
| Calor de fusi??n | 7.13 kJ ?? mol -1 | |||||||||||||||||||||||||||
| El calor de vaporizaci??n | 289 kJ ?? mol -1 | |||||||||||||||||||||||||||
| Propiedades at??micas | ||||||||||||||||||||||||||||
| Estados de oxidaci??n | 3 (medianamente ??xido b??sico) | |||||||||||||||||||||||||||
| Electronegatividad | ? 1,13 (escala de Pauling) | |||||||||||||||||||||||||||
| Energ??as de ionizaci??n | Primero: 540 kJ ?? mol -1 | |||||||||||||||||||||||||||
| Segundo: 1050 kJ ?? mol -1 | ||||||||||||||||||||||||||||
| Tercero: 2150 kJ ?? mol -1 | ||||||||||||||||||||||||||||
| Radio at??mico | 183 pm | |||||||||||||||||||||||||||
| Radio covalente | 199 pm | |||||||||||||||||||||||||||
| Miscel??nea | ||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal  | |||||||||||||||||||||||||||
| Ordenamiento magn??tico | paramagn??tico | |||||||||||||||||||||||||||
| La resistividad el??ctrica | ( rt) est. 0,75 μΩ ?? m | |||||||||||||||||||||||||||
| Conductividad t??rmica | 17.9 W ?? m -1 ?? K -1 | |||||||||||||||||||||||||||
| Expansi??n t??rmica | ( rt) (α, poli) est. 11 m / (m ?? K) | |||||||||||||||||||||||||||
| El m??dulo de Young | (Α formulario) est. 46 GPa | |||||||||||||||||||||||||||
| M??dulo de corte | (Α formulario) est. 18 GPa | |||||||||||||||||||||||||||
| M??dulo de volumen | (Α formulario) est. 33 GPa | |||||||||||||||||||||||||||
| Relaci??n de Poisson | (Α formulario) est. 0,28 | |||||||||||||||||||||||||||
| N??mero de registro del CAS | 7440-12-2 | |||||||||||||||||||||||||||
| La mayor??a de los is??topos estables | ||||||||||||||||||||||||||||
| Art??culo principal: Los is??topos de prometio | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Prometio, originalmente Prometheum, es un elemento qu??mico con el s??mbolo Pm y n??mero at??mico 61. Todos sus is??topos son radiactivos; es uno de los dos ??nicos elementos que se siguen en la tabla peri??dica de los elementos con formas estables, una distinci??n compartida con tecnecio . Qu??micamente, el prometio es un lant??nido , que forma sales cuando se combina con otros elementos. Prometio muestra s??lo un estado de oxidaci??n estable de 3; Sin embargo, pueden existir unos 2 compuestos.
En 1902, Bohuslav Brauner sugiri?? que hab??a un elemento con propiedades intermedias entre las de los conocidos elementos de neodimio (60) y samario (62); esto fue confirmado en 1914 por Henry Moseley quien, despu??s de haber medido los n??meros at??micos de todos los elementos conocidos hasta entonces, encontr?? que no hab??a ning??n elemento con n??mero at??mico 61. En 1926, un grupo americano italiano y afirm?? haber aislado una muestra del elemento 61; tanto los "descubrimientos" fueron r??pidamente demostrado ser falsa. En 1938, durante un experimento nuclear realizado en Universidad del Estado de Ohio, unos nucleidos radiactivos fueron producidos que ciertamente no eran radiois??topos de neodimio o samario, pero hab??a una falta de pruebas qu??micas se produjo ese elemento 61, y el descubrimiento no fue generalmente reconocidos. Prometio fue producida por primera vez y que se caracteriza por lo Laboratorio Nacional de Oak Ridge en 1945 por la separaci??n y an??lisis de los productos de fisi??n de combustible de uranio irradiado en un reactor de grafito. Los descubridores propusieron el nombre de "Prometheum" (la ortograf??a fue cambiado posteriormente), deriva de Prometeo, el Tit??n de la mitolog??a griega que rob?? el fuego del Olimpo y se lo llev?? a los humanos, para simbolizar "tanto la audacia y el posible mal uso de la inteligencia de la humanidad." Sin embargo, una muestra del metal se hizo s??lo en 1963.
Hay dos posibles fuentes para prometio natural: rara decae de naturales europio -151 (produciendo prometio-147), y el uranio (distintos is??topos). Existen aplicaciones pr??cticas s??lo para compuestos qu??micos de prometio-147, que se utilizan en la pintura luminosa, bater??as at??micas y dispositivos de medici??n de espesores, aunque prometio-145 es el is??topo m??s estable prometio. Desde prometio natural es sumamente escasa, el elemento es normalmente sintetizada bombardeando el uranio-235 ( uranio enriquecido) con neutrones t??rmicos para producir prometio-147.
Propiedades
Propiedades f??sicas
Un ??tomo prometio tiene 61 electrones, dispuestos en el configuraci??n [ Xe ] 4f 5 6s 2. En los compuestos que forman el ??tomo pierde sus dos electrones m??s externos y uno de los 4F-electrones, que pertenece a un subnivel abierto. Radio at??mico del elemento es el tercero m??s grande entre todos los lant??nidos, pero es s??lo ligeramente mayor que las de los elementos vecinos. Es la ??nica excepci??n a la tendencia general de la contracci??n de los ??tomos con aumento del radio at??mico (causada por la contracci??n de los lant??nidos) que no es causada por el lleno (o medio lleno) 4f-subnivel.
Muchas de las propiedades de prometio conf??an en su posici??n entre los lant??nidos y son intermedios entre los de neodimio y samario. Por ejemplo, el punto de fusi??n, las tres primeras energ??as de ionizaci??n, y la energ??a de hidrataci??n son mayores que los de neodimio y menores que los de samario; Del mismo modo, la estimaci??n para el punto de ebullici??n, i??nico (Pm 3+) de radio, y el calor est??ndar de formaci??n de gas monoat??mico son mayores que las de samario y menos los de neodimio.
Prometio tiene una embalado (dhcp) estructura de doble cierre hexagonal y una dureza de 63 kg / mm 2. Esta forma alfa de baja temperatura se convierte en una versi??n beta, fase c??bica centrada en el cuerpo (BCC) por calentamiento a 890 ?? C.
Propiedades qu??micas y combinaciones
Prometio pertenece a la grupo de los lant??nidos cerio y es qu??micamente muy similar a los elementos vecinos. Debido a su inestabilidad, estudios qu??micos de prometio son incompletos. A pesar de que algunos de los compuestos han sido sintetizados, no se estudian totalmente; en general, tienden a ser de color rosa o de color rojo. El tratamiento de soluciones ??cidas que contienen iones Pm 3+ con amon??aco resultados en un sedimento de color marr??n claro gelatinoso de hidr??xido, Pm (OH) 3, que es insoluble en agua. Cuando se disuelve en ??cido clorh??drico, una sal de color amarillo soluble en agua, PMCL 3, se produce; Del mismo modo, cuando se disuelve en ??cido n??trico, un nitrato resultados, Pm (NO 3) 3. Este ??ltimo tambi??n es bien soluble; cuando se seca, forma cristales de color rosa, similar a Nd (NO 3) 3. La configuraci??n electr??nica para Pm 3+ es [Xe] 4f 4, y el color del ion es de color rosa. El t??rmino s??mbolo estado fundamental es 5 I 4. El sulfato es ligeramente soluble, como los otros sulfatos del grupo de cerio. Los par??metros de celda est??n calculadas para su octahidrato; conducen a la conclusi??n de que la densidad de Pm 2 (SO 4) 3 ?? 8 H2O es 2,86 g / cm 3. El oxalato, Pm 2 (C 2 O 4) 3 ?? 10 H 2 O, tiene la solubilidad m??s baja de todos los oxalatos de lant??nidos.
A diferencia de la de nitrato, la ??xido es similar a la sal correspondiente de samario y no la sal de neodimio. Como-sintetizado, por ejemplo calentando el oxalato, es un polvo blanco o de color lavanda con estructura desordenada. Este polvo cristaliza en una red c??bica tras el calentamiento a 600 ?? C. Adem??s de recocido a 800 ?? C y luego a 1750 ?? C irreversiblemente transforma a una monocl??nico y las fases hexagonales, respectivamente, y las dos ??ltimas fases se pueden interconvertir mediante el ajuste del tiempo de recocido y la temperatura.
| F??rmula | simetr??a | grupo espacial | No | S??mbolo de Pearson | un (pm) | b (pm) | c (pm) | Z | densidad, g / cm 3 |
|---|---|---|---|---|---|---|---|---|---|
| α-Pm | dhcp | P6 3 / mmc | 194 | HP4 | 365 | 365 | 1165 | 4 | 7.26 |
| β-Pm | bcc | Fm 3 m | 225 | CF4 | 410 | 410 | 410 | 4 | 6.99 |
| Pm 2 O 3 | c??bico | Ia 3 | 206 | cI80 | 1099 | 1099 | 1099 | 16 | 6.77 |
| Pm 2 O 3 | monocl??nico | C2 / m | 12 | MS30 | 1422 | 365 | 891 | 6 | 7.40 |
| Pm 2 O 3 | hexagonal | P 3 m1 | 164 | HP5 | 380.2 | 380.2 | 595,4 | 1 | 7.53 |
Promethium formas s??lo un estado de oxidaci??n estable, 3, en forma de iones; esto est?? en consonancia con otros lant??nidos. De acuerdo con su posici??n en la tabla peri??dica , el elemento no se puede esperar que forma estable 4 o 2 estados de oxidaci??n; agentes de tratamiento compuestos qu??micos que contienen iones Pm 3+ con un fuerte oxidante o reductor mostraron que el i??n no se oxida f??cilmente o se reduce.
| F??rmula | color | coordinaci??n n??mero | simetr??a | grupo espacial | No | S??mbolo de Pearson | pf (?? C) |
|---|---|---|---|---|---|---|---|
| PMF 3 | P??rpura-rosa | 11 | hexagonal | P 3 c1 | 165 | hP24 | 1338 |
| PMCL 3 | Lavanda | 9 | hexagonal | P6 3 / mc | 176 | HP8 | 655 |
| PMBR 3 | Rojo | 8 | ortorr??mbica | Cmcm | 63 | oS16 | 624 |
| α-PMI 3 | Rojo | 8 | ortorr??mbica | Cmcm | 63 | oS16 | α → β |
| β-PMI 3 | Rojo | 6 | rhombohedral | R 3 | 148 | HR24 | 695 |
Is??topos
Prometio es el ??nico de los lant??nidos y uno de los dos elementos entre los primeros 82 que no tiene estable (o incluso de larga vida) is??topos; este es un resultado de una rara vez se producen efecto de la modelo de la gota l??quida y estabilidades de is??topos de elementos pr??jimo; tambi??n es el elemento menos estable de la primera 84. Los productos de desintegraci??n primarios son de neodimio y samario is??topos (prometio-146 decae a ambos, los is??topos m??s ligeros en general a trav??s de neodimio decaimiento de positrones y captura de electrones, y los is??topos m??s pesados a trav??s de samario desintegraci??n beta). Prometeo is??meros nucleares pueden decaer a otros is??topos promethium y un is??topo (145 Pm) tiene un modo de desintegraci??n alfa muy raro praseodimio .
El is??topo m??s estable del elemento es prometio-145, que tiene una actividad espec??fica de 940 Ci (35 TBq) / g y una vida media de 17,7 a??os a trav??s captura de electrones. Debido a que tiene 84 neutrones (dos m??s que el 82, que es un n??mero m??gico que corresponde a una configuraci??n de neutrones estable), se puede emitir una part??cula alfa (que tiene 2 neutrones) para formar praseodimio-141 con 82 neutrones. Por lo tanto, es el ??nico is??topo prometio con un observado experimentalmente desintegraci??n alfa. Su vida media parcial para la desintegraci??n alfa es de aproximadamente 6,3 ?? 10 9 a??os, y la probabilidad relativa de un n??cleo 145 Pm a la descomposici??n de esta manera es 2,8 ?? 10 -7%. Varios otros Pm is??topos (144 m, 146 m, 147 Pm etc.) tambi??n tienen una autorizaci??n positiva energ??a de desintegraci??n alfa; sus desintegraciones alfa se prev?? que se produzcan, pero no se han observado.
El elemento tambi??n tiene 18 is??meros nucleares, con n??meros de masa de 133 a 142, 144, 148, 149, 152, y 154 (algunos n??meros de masa tienen m??s de un is??mero). El m??s estable de ellos es prometio-148m, con una vida media de 43,1 d??as; esto es m??s larga que las vidas medias de los estados fundamentales de todos los is??topos prometio, excepto solamente para prometio-143 a 147 (obs??rvese que prometio-148m tiene una vida media m??s larga que el estado fundamental, prometio-148).
Aparici??n

En 1934, Willard Libby encontr?? una d??bil actividad beta en neodimio puro, que se atribuy?? a una vida media de m??s de 10 y 12 a??os. Casi 20 a??os m??s tarde, se afirm?? que el elemento se produce en neodimio natural en equilibrio en cantidades inferiores a 10 -20 gramos de prometio por un gramo de neodimio. Sin embargo, estas observaciones fueron refutadas por las investigaciones m??s recientes, ya que para las siete de origen natural is??topos de neodimio, los decaimientos beta individuales (que pueden producir nucleidos promethium) est??n prohibidas por la conservaci??n de la energ??a. En particular, las mediciones cuidadosas de masas at??micas muestran que la diferencia de masa 150 Nd 150 Pm es negativo (-87 keV), lo que impide absolutamente la ??nica desintegraci??n beta de 150 Nd a 150 m.
Ambos is??topos de europio natural tienen mayor excesos masivos que sumas de las de sus potenciales hijas alfa m??s la de una part??cula alfa; por lo tanto, (estable en la pr??ctica) pueden Alpha Decay. La investigaci??n en Laboratori Nazionali del Gran Sasso mostr?? que europio-151 decae experimentalmente para prometio-147 con la vida media de 5 ?? 10 18 a??os. Se ha demostrado que el europio es "responsable" de unos 12 gramos de prometio en la corteza terrestre. Alfa decae por europio-153 no se han encontrado todav??a, y su vida media calculada te??ricamente es tan alta (debido a la baja energ??a de la decadencia) que probablemente nunca se observ?? este proceso.
Finalmente, prometio se puede formar en la naturaleza como un producto de fisi??n espont??nea de de uranio-238. S??lo cantidades traza se pueden encontrar en los minerales de origen natural: una muestra de pitchblende se ha encontrado que contienen prometio a una concentraci??n de cuatro partes por trill??n (10 18) en masa. El uranio es as?? "responsable" de 560 g prometio en la corteza terrestre .
Prometio tambi??n ha sido identificado en el espectro de la estrella HR 465 en Andr??meda; tambi??n se ha encontrado en HD 101065 ( La estrella de Przybylski) y HD 965. Debido a la corta vida media de los is??topos prometio, deben formarse cerca de la superficie de esas estrellas.
Historia
Las b??squedas de elemento 61
En 1902, el qu??mico Checa Bohuslav Brauner se enter?? de que la diferencia entre neodimio y samario es el m??s grande de todos los vecinos lant??nidos pares; como conclusi??n, sugiri?? que hab??a un elemento con propiedades intermedias entre ellas. Esta predicci??n fue apoyada en 1914 por Henry Moseley quien, despu??s de haber descubierto que el n??mero at??mico era una propiedad experimentalmente mensurable de elementos, que se encuentra unos n??meros at??micos ten??an ning??n elemento que corresponda: las lagunas fueron 43, 61, 72, 75, 85 y 87. Con el conocimiento de una brecha en la tabla peri??dica varios grupos comenzaron a buscar el elemento predicho entre otras tierras raras en el medio ambiente natural.
La primera reclamaci??n de un descubrimiento fue publicado por Luigi Rolla y Lorenzo Fern??ndez de Florencia, Italia. Despu??s de separar una mezcla de unos pocos elementos de tierras raras nitrato de concentrado de la brasile??a mineral monacita por cristalizaci??n fraccionada, que produjo una soluci??n que contiene la mayor??a de samario. Esta soluci??n dio espectros de rayos x atribuido a samario y el elemento 61. En honor de su ciudad, nombraron elemento 61 "florentium." Los resultados fueron publicados en 1926, pero los cient??ficos afirmaron que los experimentos se realizaron en 1924. Tambi??n en 1926, un grupo de cient??ficos de la Universidad de Illinois en Urbana-Champaign, Smith Hopkins y Len Yntema public?? el descubrimiento del elemento 61. Lo llamaron "illinium," despu??s de la universidad. Ambos de estos descubrimientos reportados mostraron ser err??nea porque la l??nea espectro que "corresponde" al elemento 61 era id??ntico al de didimio; las l??neas que se cree que pertenecen al elemento 61 resultaron pertenecer a unas pocas impurezas (bario, cromo y platino).
En 1934, Josef Mattauch finalmente formul?? la regla de isobaras. Una de las consecuencias indirectas de la era esta regla era que el elemento 61 no pudo formar is??topos estables. En 1938, un experimento nuclear se llev?? a cabo por HB Law et al. En Universidad del Estado de Ohio. Los n??clidos producidos desde luego no eran radiois??topos de neodimio o samario, y se propuso el nombre de "cyclonium", pero hab??a una falta de pruebas qu??micas se produjo ese elemento 61 y el descubrimiento no en gran medida reconocida.
Descubrimiento y s??ntesis de prometio de metal
Prometio fue producida por primera vez y que se caracteriza por lo Laboratorio Nacional de Oak Ridge (Clinton Laboratorios en ese momento) en 1945 por Jacob A. Marinsky, Lawrence E. Glendenin y Charles D. Coryell por la separaci??n y an??lisis de los productos de fisi??n de uranio en el combustible irradiado reactor de grafito; sin embargo, estar demasiado ocupado con la investigaci??n relacionada con militares durante la Segunda Guerra Mundial , que no anunciaron su descubrimiento hasta 1947. El nombre original propuesto era "clintonium", despu??s de que el laboratorio donde se realiz?? el trabajo; Sin embargo, el nombre "Prometheum" fue sugerido por la Gracia Mar??a Coryell, la esposa de uno de los descubridores. Se deriva de Prometeo, el Tit??n de la mitolog??a griega que rob?? el fuego del Olimpo y se lo llev?? a los humanos y simboliza "tanto la audacia y el posible mal uso de la inteligencia a la humanidad." A continuaci??n, la ortograf??a fue cambiado a "prometio," ya que era m??s cerca de conformidad con otros metales.

Jacob A. Marinsky

Lawrence E. Glendenin

Charles D. Coryell
En 1963, se utiliz?? el prometio (III) de fluoruro para hacer prometio metal. Provisionalmente purificado de las impurezas de samario, neodimio, y americio, que fue puesto en un tantalio crisol que se encuentra en otro crisol de t??ntalo; el crisol exterior conten??a metal de litio (10 veces en exceso en comparaci??n con el prometio). Despu??s de crear un vac??o, los productos qu??micos se mezclan para producir metal prometio:
- PMF 3 + 3 Li → Pm + 3 LiF
La muestra prometio producido se us?? para medir algunas de las propiedades del metal, tales como su punto de fusi??n .
En 1963, se utilizaron m??todos de intercambio i??nico en ORNL para preparar unos diez gramos de prometio a partir de desechos de procesamiento de combustible de reactor nuclear.
Hoy en d??a, el prometio est?? todav??a recuperado de los subproductos de la fisi??n del uranio; tambi??n puede ser producido mediante el bombardeo de 146 Nd con neutrones , convirti??ndolo en 147 Nd que se desintegra en 147 Pm a trav??s de la desintegraci??n beta con una vida media de 11 d??as.
Producci??n
Los m??todos de producci??n para diferentes is??topos var??an, y s??lo para que prometio-147 se da porque es el ??nico is??topo con aplicaciones industriales. Prometio-147 se produce en grandes cantidades (en comparaci??n con otros is??topos) bombardeando el uranio-235 con neutrones t??rmicos. La salida es relativamente alta, al 2,6% del producto total. Otra manera de producir prometio-147 es a trav??s de neodimio-147, que decae a prometio-147 con una vida media corta. Neodimio-147 se puede obtener ya sea mediante el bombardeo de neodimio-146 enriquecido con neutrones t??rmicos o bombardeando un uranio objetivo de carburo con protones energ??ticos en un acelerador de part??culas. Otro m??todo consiste en bombardear uranio-238 con neutrones r??pidos para causar fisi??n r??pida, lo que, entre varios productos de reacci??n, crea prometio-147.
Ya en la d??cada de 1960, el Laboratorio Nacional de Oak Ridge podr??a producir 650 gramos de prometio al a??o y era la ??nica instalaci??n de s??ntesis de gran volumen en el mundo. Producci??n Gram-escala de prometio ha sido descontinuado en los EE.UU. a principios de 1980, pero posiblemente se reanud?? despu??s de 2010 en el Reactor de Is??topos de Alto Flujo. Actualmente, Rusia es el ??nico pa??s productor prometio-147 en una escala relativamente grande.
Aplicaciones
La mayor??a prometio se utiliza solamente para fines de investigaci??n, a excepci??n de prometio-147, que se puede encontrar fuera de los laboratorios. Se obtiene como el ??xido o cloruro, en cantidades de miligramos. Este is??topo no emite rayos gamma, y su radiaci??n tiene una relativamente peque??a profundidad de penetraci??n en la materia y una vida media relativamente larga.
Algunas luces de se??al utilizan un pintura luminosa, que contiene una f??sforo que absorbe la radiaci??n beta emitida por prometio-147 y emite luz. Este is??topo no causa el envejecimiento del f??sforo, como emisores alfa hacen, y por lo tanto la emisi??n de luz es estable durante unos pocos a??os. Originalmente, el radio -226 se utiliz?? para este fin, pero fue reemplazado m??s tarde por el prometio-147 y tritio (hidr??geno-3). Prometio puede ser favorecida sobre tritio para razones de seguridad.
En bater??as at??micas, las part??culas beta emitidas por el prometio-147 se convierten en corriente el??ctrica intercalando una peque??a fuente de Pm entre dos placas de semiconductores. Estas bater??as tienen una vida ??til de unos cinco a??os. La bater??a basada prometio-primero se ensambl?? en 1964 y gener?? "unos pocos milivatios de energ??a a partir de un volumen de aproximadamente 2 cent??metros c??bicos, incluyendo blindaje".
Prometio tambi??n se utiliza para medir el espesor de los materiales mediante la evaluaci??n de la cantidad de radiaci??n de una fuente prometio que pasa a trav??s de la muestra. Cuenta con posibles usos futuros en fuentes de rayos X port??tiles, y como fuentes de calor o de potencia auxiliar para sondas y sat??lites espaciales (aunque el emisor alfa plutonio-238 se ha convertido en est??ndar para la mayor??a de los usos relacionados con la exploraci??n espacial).
Precauciones
El elemento, al igual que otros lant??nidos, no tiene ning??n papel biol??gico. Prometio-147 puede emitir Los rayos X durante su desintegraci??n beta, que son peligrosos para todos las formas de vida. Interacciones con peque??as cantidades de prometio-147 no son peligrosos si se siguen ciertas precauciones. En general, los guantes, las cubiertas de calzado, gafas de seguridad, y una capa externa de la ropa de protecci??n eliminado f??cilmente debe ser utilizado.
No se sabe qu?? ??rganos humanos se ven afectados por la interacci??n con el prometio; un posible candidato es el tejidos ??seos. Sealed prometio-147 no es peligroso. Sin embargo, si el embalaje est?? da??ado, el prometio vuelve peligroso para el medio ambiente y los seres humanos. Si se encuentra contaminaci??n radiactiva, la zona contaminada debe lavarse con agua y jab??n, pero, a pesar de que prometio afecta principalmente a la piel, la piel no debe rasparse. Si se encuentra una fuga prometio, el ??rea debe ser identificado como peligrosos y evacuada, y los servicios de emergencia se debe contactar. No se conocen peligros del prometio aparte de la radiactividad.

