
Plomo
Antecedentes de las escuelas de Wikipedia
Voluntarios SOS ayudaron a elegir artículos e hicieron otro material curricular Patrocinar los niños ayuda a los niños en el mundo en desarrollo para aprender también.
| Plomo | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
82 Pb | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||||||||||||||
gris metálico  | ||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | plomo, Pb, 82 | |||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / l ɛ d / LED | |||||||||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | metálica posterior a la transición | |||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 14, 6, p | |||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 207.2 | |||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Xe ] 4f 14 5d 10 6s 2 6p 2 2, 8, 18, 32, 18, 4 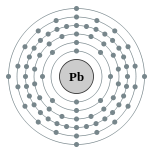 | |||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Orientales Medio ( 7000 aC) | |||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | |||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 11,34 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 10,66 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 600,61 K , 327.46 ° C, 621,43 ° F | |||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 2022 K, 1749 ° C, 3180 ° F | |||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 4.77 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 179.5 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 26.650 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 4, 3, 2, 1 ( Anfótero óxido) | |||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,33 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 715.6 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1450,5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 3081,5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 175 pm | |||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 146 ± 17:00 | |||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radio | 202 pm | |||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | cara cúbica centrada  | |||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | |||||||||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) 208 nΩ · m | |||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 35.3 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | (25 ° C) 28,9 m · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | ( rt) (recocido) 1190 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | 16 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | 5,6 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 46 GPa | |||||||||||||||||||||||||||||||||||||||||||||
| Relación de Poisson | 0.44 | |||||||||||||||||||||||||||||||||||||||||||||
| Dureza de Mohs | 1.5 | |||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 38,3 MPa | |||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7439-92-1 | |||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de plomo | ||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||
El plomo es un elemento químico en el grupo de carbono con el símbolo Pb (del latín : Plumbum) y número atómico 82. El plomo es un suave y maleable de metal , que se considera como una metales pesados y pobres metal. El plomo metálico tiene un color azulado-blanco después de haber sido recién cortada, pero pronto empaña a un color grisáceo opaco cuando se expone al aire. El plomo tiene un brillo cromo-plateado brillante cuando se funde en un líquido.
El plomo se utiliza en la construcción de edificios, baterías de plomo-ácido, balas y tiro, pesas, como parte de soldaduras, pewters, aleaciones fusibles, y como escudo de radiación. El plomo tiene el más alto número atómico de todo el elementos estables, aunque el siguiente elemento superior, bismuto , tiene una vida media que es tan largo (mucho más que la edad del universo) que puede considerarse estable. Sus cuatro estables isótopos tienen 82 protones , una número mágico en el modelo de capas nuclear de los núcleos atómicos .
El plomo, en ciertos grados de contacto, es una sustancia venenosa a animales, incluyendo los seres humanos. Daña las sistema nervioso y causa cerebrales trastornos. Cable excesiva también causa trastornos de la sangre en los mamíferos. Al igual que el elemento mercurio , otro metal pesado, el plomo es un neurotoxina que se acumula tanto en los tejidos blandos y los huesos. El envenenamiento por plomo se ha documentado desde la antigua Roma , la antigua Grecia y la antigua China .
Características

El plomo es un metal brillante y plateado con un diseño muy ligero tono de azul en una atmósfera seca. Al contacto con el aire, comienza a empañar mediante la formación de una mezcla compleja de compuestos dependiendo de las condiciones. El color de los compuestos puede variar. La capa de deslustre puede contener cantidades significativas de carbonatos y hidroxicarbonatos. Tiene algunas propiedades características: alta densidad , suavidad, ductilidad y maleabilidad, pobres conductividad eléctrica en comparación con otros metales, alta resistencia a la corrosión y capacidad de reaccionar con los productos químicos orgánicos.
Varios trazas de otros metales cambian sus propiedades significativamente: la adición de pequeñas cantidades de antimonio o cobre al plomo aumenta la dureza de la aleación y mejora la resistencia a la corrosión de ácido sulfúrico . Algunos otros metales también mejoran sólo dureza y lucha fatiga del metal, tales como el cadmio , estaño , o teluro ; metales como el sodio o el calcio también tienen esta capacidad, pero debilitan la estabilidad química. Por último, el zinc y bismuto simplemente deterioran la resistencia a la corrosión (0,1% de contenido de bismuto es el umbral de uso industrial). A cambio, las impurezas de plomo en su mayoría empeoran la calidad de los materiales industriales, aunque hay excepciones: por ejemplo, pequeñas cantidades de plomo mejorar la ductilidad del acero.
El plomo tiene sólo un alótropo común, que es cara cúbica centrada, con la distancia de plomo-plomo siendo 349 pm. En 327.5 ° C (621,5 ° F), el plomo se funde; el punto de fusión es superior a la de estaño (232 ° C, 449,5 ° F), pero significativamente inferior a la de germanio (938 ° C, 1721 ° F). El punto de ebullición del plomo es 1749 ° C (3180 ° F), que está por debajo de los de tanto de estaño (2602 ° C, 4716 ° F) y germanio (2833 ° C, 5131 ° F). Las densidades aumentan por el grupo: los valores de Sn (5,23 y 7,29 g · cm -3, respectivamente) Ge y están muy por debajo de la del plomo: 11,32 g · cm -3.
Un átomo de plomo tiene 82 electrones, que tiene una configuración electrónica de [ Xe ] 4f 14 5d 10 6s 2 6p 2. En sus compuestos, el plomo (a diferencia de la otra grupo de 14 elementos) pierde más comúnmente sus dos y no cuatro electrones más externos, convirtiéndose (II) iones de plomo, Pb 2+. Tal comportamiento inusual es racionalizado por considerar el efecto de par inerte, que se produce debido a la estabilización de los 6S-orbitales debido a los efectos relativistas, que son más fuertes cerca de la parte inferior de la tabla periódica. Estaño muestra tal efecto más débil: el estaño (II) es todavía un reductor.
Las cifras de electrodo espectáculo potencial que llevan es sólo un poco más fácil de oxidar de hidrógeno . Plomo por lo tanto se puede disolver en ácidos, pero esto es a menudo imposible debido a problemas específicos (tales como la formación de sales insolubles). Plomo en polvo arde con una llama de color blanco azulado. Al igual que con muchos metales, finamente dividido exposiciones de plomo en polvo piroforicidad. Los gases tóxicos se liberan cuando se quema el plomo.
Isótopos
El plomo se encuentra naturalmente en la Tierra exclusivamente en forma de cuatro isótopos: plomo-204, -206, -207, -208 y. Los cuatro puede haber radiactivo como la desintegración alfa de cualquier hipotética sería exotérmica, pero el límite de vida media más baja se ha puesto sólo para el plomo-204: más de 1,4 × 10 17 años. Este efecto es, sin embargo, tan débil que el plomo natural, no representa ningún peligro de radiación. Tres isótopos también se encuentran en tres de los cuatro principales cadenas de desintegración: plomo-206, -207 y -208 son productos de desintegración finales de uranio-238, uranio-235 y torio-232, respectivamente. Dado que las cantidades de los mismos en la naturaleza dependen también de la presencia de otros elementos, la composición isotópica del plomo natural varía por ejemplo: en particular, la cantidad relativa de plomo-206 varía entre 20,84% y 27,78%.
Aparte de los estables, treinta y cuatro radioisótopos se han sintetizado: tienen números de masa de 178-215. Lead-205 es el radioisótopo más estable de plomo, con una vida media de más de 10 7 años. 47 isómeros nucleares (vivieron largo estados nucleares excitados), correspondiente a 24 isótopos de plomo, se han caracterizado. El isómero más longevo es el plomo-204m2 (vida media de alrededor de 1,1 horas).
Reactividad química
El plomo se clasifica como una metálica posterior a la transición y también es miembro de la grupo de carbono. Plomo sólo forma una capa protectora de óxido aunque finamente pulverizado plomo altamente purificado puede inflamarse en el aire. Plomo fundido se oxida en el aire monóxido de plomo. Todos calcógenos oxidan plomo al calentarse.
El flúor no se oxida cable frío. Plomo caliente se puede oxidar, pero la formación de un protector capa de haluro disminuye la intensidad de la reacción por encima de 100 ° C (210 ° F). La reacción con el cloro es similar: gracias a la capa de cloruro, la persistencia de plomo contra el cloro supera los de cobre o acero de hasta 300 ° C (570 ° F).
El agua en la presencia de ataques de oxígeno conduce a iniciar una reacción acelerando. La presencia de carbonatos o sulfatos resultados en la formación de sales de plomo insolubles, que protegen al metal de la corrosión. Lo mismo sucede con el dióxido de carbono , ya que el insoluble carbonato de plomo se forma; sin embargo, un exceso del gas conduce a la formación del bicarbonato soluble; esto hace que el uso de tuberías de plomo peligrosos. El plomo se disuelve en ácidos orgánicos (en presencia de oxígeno) y concentrado (≥80%) de ácido sulfúrico gracias a la complejación; sin embargo, sólo está débilmente afectada por el ácido clorhídrico y es estable contra el ácido fluorhídrico, como los correspondientes haluros son débilmente soluble. El plomo también se disuelve en muy concentrado álcalis (≥10%) debido a la carácter anfótero y la solubilidad de plumbites.
Compuestos
Existen compuestos de plomo principalmente en dos estados principales de oxidación, 2 y 4. El primero es más común. Plomo inorgánico (IV) compuestos son típicamente oxidantes fuertes o sólo existen en soluciones altamente ácidas.
Los óxidos y sulfuros
Tres óxidos son conocidos: plomo (II) óxido o monóxido de plomo (PbO), tetróxido de plomo (Pb 3 O 4) (a veces llamado "minio"), y dióxido de plomo (PbO 2). El monóxido existe como dos alótropos: α-PbO y β-PbO, ambos con estructura de capas y el plomo tetracoordinado. El alfa polimorfo es de color rojo y tiene la distancia Pb-O de 230 horas; el polimorfo beta es de color amarillo y tiene la distancia Pb-O de 221 y 249 horas (debido a la asimetría). Ambos polimorfos pueden existir bajo condiciones estándar (beta con pequeñas (10 -5 relativas) impurezas, tales como Si, Ge, Mo, etc.). PbO reacciona con los ácidos para formar sales, y con álcalis para dar plumbites, [Pb (OH) 3] - o [Pb (OH) 4] 2-. El monóxido de oxida en el aire para tetróxido de trilead, que a 550 ° C (1020 ° F) degrada de nuevo en PbO.
El dióxido se puede preparar mediante, por ejemplo, sales de halogenization de plomo (II). Independientemente del polimorfo, tiene un color negro-marrón. El alótropo alfa es romboédrico, y el alótropo beta es tetragonal. Ambos alótropos son negro-marrón en color y siempre contienen algo de agua, que no se puede quitar, como calefacción también causa la descomposición (a PbO y Pb 3 O 4). El dióxido es un poderoso oxidante: puede oxidar ácidos clorhídrico y sulfúrico. No reacciona con una solución alcalina, pero reacciona con los álcalis sólidos para dar hydroxyplumbates, o con óxidos básicos para dar plumbatos.
La reacción de sales de plomo con los rendimientos de sulfuro de hidrógeno monosulfuro plomo. El sólido tiene la rocksalt-como estructura cúbica simple, que se mantiene hasta el punto de fusión, 1.114 ° C (2.037 ° F). Cuando se calienta al aire, se oxida a la sulfato y entonces el monóxido. Monosulfuro de plomo es casi insoluble en agua, ácidos débiles, y (NH 4) 2 S / (NH 4) 2 S 2 solución es la clave para la separación del plomo de los grupos I a III analíticos iones, estaño , arsénico y antimonio . Sin embargo, se disuelve en nítrico y ácido clorhídrico , para dar elemental de azufre y sulfuro de hidrógeno, respectivamente. Tras el calentamiento bajo altas presiones con azufre, que da la disulfuro. En el compuesto, los átomos de plomo están vinculados octaédricamente con los átomos de azufre. También es un semiconductor. Una mezcla de monóxido y el monosulfuro cuando se forma el metal calentadas.
- 2 PbO + PbS → 3 Pb + SO 2
Haluros y otras sales

Carbonato de plomo Calefacción con fluoruro de hidrógeno produce el hidrofluoruro, que se descompone a la difluoride cuando se derrite. Este polvo cristalino blanco es más soluble que la diyoduro, pero menos que la dibromuro y la dicloruro. El tetrafluoruro, un polvo cristalino de color amarillo, es inestable.
Otros dihalogenuros se obtienen por plomo calefacción (II) sales con los haluros de otros metales; dihalogenuros plomo precipitan para dar blanco cristales ortorrómbicos (formas diyoduro cristales hexagonales de color amarillo). También se pueden obtener por reacción directa de sus elementos constitutivos a temperatura superiores a puntos de fusión de dihaluros. Su solubilidad aumenta con la temperatura; la adición de más haluros disminuye primero la solubilidad, pero luego aumenta debido a complejación, con el máximo número de coordinación es 6. La formación de complejos depende de los números de ion haluro, número atómico del metal alcalino , el haluro de que se añade, la temperatura y la solución de fuerza iónica. El tetracloruro se obtiene al disolver el dióxido de ácido clorhídrico; para evitar la descomposición exotérmica, que se mantiene bajo de ácido sulfúrico concentrado. El tetrabromuro no puede, y la tetrayoduro definitivamente no existe. El diastatide También se ha preparado.
El metal no es atacado por sulfúrico o clorhídrico ácidos. Se disuelve en ácido nítrico con la evolución de gas de óxido nítrico para formar disuelve Pb (NO3) 2 . Es un bien sólido soluble en agua; es por lo tanto una clave para recibir los precipitados de halogenuros, sulfato, cromato, carbonato, y carbonato básico de Pb 3 (OH) 2 (CO 3) 2 sales de plomo. |
Organoplomo
Los compuestos más conocidos son los dos más simple derivados Plumbano: tetrametilplomo (TML) y tetraetilo de plomo (TEL). La homólogos de éstos, así como hexaethyldilead (HEDL), son de menor estabilidad. Los derivados de tetraalquil contienen plomo (IV), donde los bonos Pb-C son covalente. De este modo, se asemejan a los compuestos orgánicos típicos.
El plomo forma fácilmente una aleación equimolar con sodio metal que reacciona con haluros de alquilo para formar compuestos organometálicos de plomo, tales como tetraetilo de plomo. Las energías de enlace Pb-C en TML y TEL son sólo 167 y 145 kJ / mol; Así, los compuestos se descomponen tras el calentamiento, con primeros signos de composición TEL vistos a 100 ° C (210 ° F). La los rendimientos de la pirólisis de plomo y radicales alquilo elementales; su interreacción provoca la síntesis de HEDL. TML y TEL también se descomponen a la luz solar o la luz UV. En presencia de cloro, los alquilos comienzan a ser reemplazado con cloruros; el R 2 PBCL 2 en presencia de HCl (un subproducto de la reacción anterior) conduce a la mineralización completa para dar PBCL 2. La reacción con bromo sigue el mismo principio.
Historia



El plomo ha sido utilizado comúnmente para miles de años, ya que está muy extendida, fácil de extraer y fácil de trabajar. Es altamente maleable, así como fácil de fundir. Cuentas de plomo metálico que datan de 6400 aC se han encontrado en Çatalhöyük en la actual Turquía. A principios de la Edad de Bronce , el plomo se utilizó con antimonio y arsénico .
El mayor preindustrial productor de plomo fue la Economía romana, con una producción anual estimada de 80.000 toneladas, que típicamente se obtuvo como un subproducto de la extensa fundición de plata. Actividades mineras romanas se produjeron en Europa central , la Gran Bretaña romana , la Balcanes, Grecia , Asia Menor y Hispania que representa por sí sola el 40% de la producción mundial.
Romano tuberías de plomo a menudo llevaban la insignia de los emperadores romanos (véase Plomo romano inscripciones de tubería). Cañerías de plomo en el Occidente latino se pudo haber continuado más allá de la edad de Teodorico el Grande en el período medieval. Muchos de los "cerdos" romanas (lingotes) de la figura principal en Derbyshire historia de la minería de plomo y en la historia de la industria en otros centros de inglés. Los romanos también usaban el plomo en forma fundida para fijar pernos de hierro que mantienen unidos grande bloques de piedra caliza en ciertos edificios monumentales. En la alquimia , se pensaba que conducen a ser el metal más antiguo y se asoció con el planeta Saturno . En consecuencia alquimistas utilizaron el símbolo de Saturno (la guadaña, ♄) para referirse al plomo.
Hasta el siglo 17, el estaño estaba a menudo no se distingue de Plomo: El plomo se llamaba Plumbum nigrum (literalmente, "plomo negro"), mientras que el estaño se llamaba Plumbum candidum (literalmente, "plomo brillante"). Su inherencia a través de la historia también se puede ver en otras lenguas: la palabra "olovo" significa conducir en Checa, pero en Rusia es ("олово") significa estaño. Símbolo de plomo Pb es una abreviatura de su América nombre Plumbum para metales blandos; las palabras en inglés " fontanería "," plomero "," vertical ", y" plomada "también deriva de esta raíz latina.
La producción de plomo en los EE.UU. comenzó tan pronto como a finales de los años 1600 por los indios en el El Southeast Missouri plomo Distrito, comúnmente llamada Lead Belt, es un distrito de la minería de plomo en la parte sureste de Missouri. Significativa entre empresas mineras de plomo de Missouri en el distrito fue el Desloge Familia y Desloge Consolidado plomo en Desloge, Missouri y Bonne Terre - haber estado activa en el comercio de plomo, la minería y la fundición de plomo a partir de 1823 en Potosí a 1929.
Aparición
El plomo metálico se produce en la naturaleza, pero es raro. El plomo se encuentra generalmente en de mineral con zinc , plata y (lo más abundantemente) de cobre , y se extrae junto con estos metales. La principal ventaja de mineral es galena (PbS), que contiene 86,6% de plomo en peso. Otras variedades comunes son cerussite (PbCO3) y anglesita (PbSO 4).
Procesamiento de minerales

La mayoría de los minerales contienen menos de 10% de plomo, y minerales que contienen tan poco como 3% de plomo pueden ser explotados económicamente. Minerales se trituran y se concentran por espuma de flotación normalmente a 70% o más. Minerales de sulfuro son , la producción de óxido de plomo principalmente tostado y una mezcla de sulfatos y silicatos de plomo y otros metales contenidos en el mineral. El óxido de plomo del proceso de tostado se reduce en una despedida de coque alto horno al metal. Las capas adicionales se separan en el proceso y flotan en la parte superior de la plomo metálico. Estos son escoria (silicatos que contienen 1,5% de plomo), mate (sulfuros que contienen 15% de plomo), y speiss (arseniuros de hierro y cobre). Estos desechos contienen concentraciones de cobre, zinc, cadmio, y el bismuto que se pueden recuperar económicamente, al igual que su contenido de plomo no reducido.
El plomo metálico que resulta de los procesos de tostación y de alto horno todavía contiene contaminantes significativos de arsénico, antimonio, bismuto, zinc, cobre, plata y oro. La masa fundida se trata en una horno de reverbero con aire, vapor, y azufre, que oxida los contaminantes excepto plata, oro y bismuto. Los contaminantes oxidados se eliminan por escoria, donde flotan a la cima y se desnatado. Desde minerales de plomo contienen concentraciones significativas de plata , el metal fundido también está contaminado comúnmente con la plata. La plata metálica así como el oro se elimina y se recuperan económicamente por medio de la Proceso Parkes. Plomo desplateada se libera de bismuto de acuerdo con la Proceso de Betterton-Kroll por tratamiento con calcio y magnesio metálico, que forma una escoria de bismuto que se puede desnatado. Muy plomo puro puede obtenerse a través de procesamiento de plomo fundido electrolíticamente por medio de la Proceso Betts. El proceso utiliza ánodos de plomo impuro y cátodos de plomo puro en un electrólito de fluoruro de sílice.
Producción y reciclaje
Producción y consumo de plomo está aumentando en todo el mundo. La producción total anual es de alrededor de 8 millones de toneladas; alrededor de la mitad se produce a partir de chatarra reciclada. Los productores de los países de plomo superiores, a partir de 2008, son Australia, China, EE.UU., Perú, Canadá, México, Suecia, Marruecos, Sudáfrica y Corea del Norte. Australia, China y los Estados Unidos representan más de la mitad de la producción primaria. En 2010, se produjeron 9,6 millones de toneladas de plomo, de los cuales 4,1 millones de toneladas procedían de la minería.
En las tasas de uso actuales, se estima que el suministro de plomo a agotarse en 42 años. Analista Ambiental Lester Brown ha sugerido plomo podría quedarse sin un plazo de 18 años basado en una extrapolación de crecimiento del 2% anual. Esto puede ser necesario revisar para tener en cuenta el renovado interés en el reciclaje , y un rápido progreso en la tecnología de células de combustible. De acuerdo con la Internacional de Recursos del Grupo Especial de Las existencias del metal en el informe de la Sociedad, la reserva global de plomo en su uso en la sociedad por habitante es de 8 kg. Mucho de esto es en los países más desarrollados (20-150 kg per cápita) en lugar de los países menos desarrollados (4.1 kg per cápita).
Aplicaciones
Forma elemental

Contrariamente a la creencia popular, minas de lápices de lápices de madera nunca se han hecho de plomo. El término proviene del stylus romano, llamado el Penicillus, un cepillo pequeño utilizado para la pintura. Cuando el lápiz se originó como una herramienta de escritura de grafito envuelta, el tipo particular de grafito siendo utilizado fue nombrado plumbago (acto iluminado por plomo, o maqueta de plomo).
El plomo se utiliza en aplicaciones donde su bajo punto de fusión, ductilidad y alta densidad son ventajosas. El bajo punto de fusión hace que la fundición de plomo fácil, y por lo tanto, munición para armas pequeñas y escopeta pelets se puede lanzar con el equipo técnico mínimo. Es también barato y más denso que otros metales comunes.
Debido a su alta densidad y resistencia a la corrosión, el plomo se utiliza para la lastre de la quilla de los barcos de vela. Su alta densidad permite contrarrestar el efecto de escora del viento sobre las velas mientras que al mismo tiempo que ocupan un pequeño volumen y ofreciendo así la menor resistencia bajo el agua. Por la misma razón se utiliza en submarinismo cinturones de peso para contrarrestar la flotabilidad natural del buzo y el de su equipo. No tiene la relación peso-a-volumen de muchos metales pesados, pero su bajo costo aumenta su uso en estas y otras aplicaciones.



Más de la mitad de la producción de plomo de Estados Unidos (al menos 1,15 millones de toneladas en 2000) se utiliza para automóviles, sobre todo como electrodos en el plomo-ácido de la batería, que se utiliza ampliamente como un batería de coche.
Catódicos ( reducción)
- PbO 2 + 4 + H + SO 2-
4 + 2e - → PbSO 4 + 2 H 2 O
Ánodo ( oxidación)
- Pb + SO 2-
4 → PbSO 4 + 2e -
El plomo se utiliza como electrodos en el proceso de electrólisis . Se utiliza en soldar para la electrónica, aunque este uso se está eliminando por algunos países para reducir la cantidad de el medio ambiente los residuos peligrosos, y en los cables de alimentación de alta tensión como material de revestimiento para evitar la difusión del agua en el aislamiento. El plomo es uno de los tres metales utilizados en la Oddy prueba para los materiales de museo, ayudar a detectar ácidos orgánicos, aldehídos, y gases ácidos. También se utiliza como protegiéndolo de la radiación (por ejemplo, en Salas de rayos X). Plomo fundido se utiliza como una refrigerante (por ejemplo, para plomo reactores rápidos refrigerados).
El plomo se añadió a latón para reducir desgaste de la herramienta de la máquina. En la forma de tiras o cinta, el plomo se usa para la personalización de raquetas de tenis. Raquetas de tenis del pasado a veces habían plomo añadido a ellos por el fabricante para aumentar de peso. También se utiliza para formar barras de acristalamiento para vidrieras u otras ventanas multi-iluminada. La práctica se ha vuelto menos común, no para el peligro, pero por razones estilísticas. El plomo, o una hoja de plomo, se utiliza como una capa de amortiguación del sonido en algunas zonas de la pared, piso y techo de diseño en estudios de sonido donde los niveles de ruido aéreo y producido mecánicamente son objeto de reducción o eliminación virtual. Es el metal base tradicional de tubos de órgano, mezcladas con cantidades variables de estaño para controlar el tono de la tubería.
El plomo tiene muchos usos en la industria de la construcción (por ejemplo, láminas de plomo se utilizan como metales arquitectónicos en el material para techos, revestimientos, tapajuntas, canaletas y las articulaciones de alcantarilla, y en parapetos de techo). Molduras detalladas de plomo se utilizan como motivos decorativos utilizados para fijar las planchas de plomo. El plomo es aún ampliamente utilizado en las estatuas y esculturas. El plomo se utiliza a menudo para equilibrar las ruedas de un coche; este uso se está eliminando gradualmente en favor de otros materiales por razones ambientales. Debido a su vida media de 22,20 años, el isótopo radiactivo 210 Pb se utiliza para el material que data de marinos sedimentos núcleos por métodos radiométricos.
Compuestos
Los compuestos de plomo se utilizan como un elemento de colorante en esmaltes cerámicos, sobre todo en los colores rojo y amarillo. El plomo se utiliza con frecuencia en cloruro de polivinilo (PVC), que recubre los cables eléctricos.
El plomo se utiliza en algunas velas para el tratamiento de la mecha para asegurar una más larga, más quemado uniforme. Debido a los peligros, los fabricantes europeos y norteamericanos utilizan alternativas más caras, como el zinc. Vidrio de plomo se compone de 12 a 28% óxido de plomo. Se cambia las características ópticas del vidrio y reduce la transmisión de la radiación.
Algunos artistas utilizan pinturas a base de aceite continúan utilizando carbonato de plomo blanco, citando sus propiedades en comparación con las alternativas. Plomo Tetra-etilo se utiliza como aditivo antidetonante del combustible para aviones en los aviones de pistón de motor. A base de plomo semiconductores , tales como teluro de plomo, seleniuro de plomo y antimoniuro plomo están encontrando aplicaciones en células fotovoltaicas (energía solar) y detectores de infrarrojos.
Plomo, ya sea en forma pura o aleado con estaño o antimonio es el material tradicional para balas y tiro en las armas de fuego del uso.
Ex aplicaciones
Pigmentos de plomo se utilizan en pintura de plomo para el blanco, así como amarillo, anaranjado, y rojo. La mayoría de los usos se han suprimido debido a los peligros de la intoxicación por plomo. A partir del 22 de abril de 2010 los Estados Unidos la ley federal requiere que los contratistas que realizan proyectos de renovación, reparación y pintura que alteren más de seis pies cuadrados de pintura en casas, instalaciones de cuidado infantil y escuelas construidas antes de 1978 deben estar certificados y capacitados para seguir un trabajo específico prácticas para prevenir la contaminación por plomo. El cromato de plomo se encuentra todavía en uso industrial. Carbonato de plomo (blanco) es el pigmento tradicional para el medio de cebado de la pintura al óleo, pero se ha desplazado en gran medida por los pigmentos de óxido de zinc y de titanio. También fue reemplazado rápidamente en medios de la pintura a base de agua. Blanco carbonato de plomo fue utilizado por los japoneses geisha y en Occidente por cara para blanquear el maquillaje, que era perjudicial para la salud.
El plomo es el metal caliente que se utilizó en composición tipográfica de metal caliente. Fue utilizado para plomería (de ahí el nombre), así como una conservante de alimentos y bebidas en la antigua Roma . Hasta principios de 1970, el plomo se utilizó para unir las tuberías de agua de hierro fundido y se utiliza como material para las tuberías de agua de pequeño diámetro.
Tetraetilo de plomo se utilizó en combustibles con plomo para reducir golpeteo del motor, pero esta práctica ha sido eliminado en muchos países del mundo en los esfuerzos para reducir la contaminación tóxica que afectaron a los seres humanos y el medio ambiente.
El plomo se usaba para hacer balas para eslingas. El plomo se utiliza para perdigones en los EE.UU., hasta cerca de 1992, cuando fue declarado ilegal (por sólo caza de aves acuáticas) y sustituido por disparo no tóxico, principalmente esferas de acero. En los Países Bajos , el uso de plomo para la caza y tiro deportivo fue prohibido en 1993, lo que provocó una gran caída en la emisión de plomo, de 230 toneladas en 1990 a 47,5 toneladas en 1995, dos años después de la prohibición.
El plomo es un componente de la pintura utilizada en los juguetes de los niños - ahora restringido en los Estados Unidos y en toda Europa ( Directiva RoHS). El plomo se utilizó en el rellenador de coche, que fue utilizado en muchos coches personalizados en los 1940s-60s. De ahí el término Leadsled. El plomo es un superconductor con una temperatura de transición de 7,2 K, y por lo tanto IBM intentó hacer una Efecto Josephson ordenador de una aleación de plomo.
El plomo también se utilizó en los pesticidas antes de la década de 1950, cuando los huertos de frutas fueron tratados especialmente contra la gusano de la manzana. Un cilindro de plomo unido a una larga línea fue utilizada por los marineros para la tarea de navegación vital de la determinación de la profundidad del agua por echar la sonda a intervalos regulares. Un inserto de sebo blando en su base permite la naturaleza del lecho marino a ser determinado, ayudando también la constatación posición.
Efectos en la salud
El plomo es un metal altamente tóxico (sin tener en cuenta si se inhala o se ingiere), que afecta a casi todos los órganos y sistemas del cuerpo. El objetivo principal de la toxicidad del plomo es el sistema nervioso, tanto en adultos y niños. La exposición a largo plazo de los adultos puede resultar en una disminución del rendimiento en algunas pruebas que miden funciones del sistema nervioso. La exposición prolongada al plomo o sus sales (especialmente sales solubles o el oxidante fuerte PbO 2) puede causar nefropatía, y tipo cólico dolores abdominales. También puede causar debilidad en los dedos, las muñecas o los tobillos. La exposición al plomo también causa pequeños aumentos de la presión arterial, sobre todo en las personas de mediana edad y de edad avanzada y puede causar anemia. La exposición a niveles altos de plomo puede dañar seriamente el cerebro y los riñones en los adultos o en niños y causar la muerte. En las mujeres embarazadas, los altos niveles de exposición al plomo puede causar aborto involuntario. , La exposición crónica de alto nivel han demostrado reducir la fertilidad en los hombres. El plomo también daña las conexiones nerviosas (especialmente en niños pequeños) y causar enfermedades de la sangre y el cerebro. El envenenamiento por plomo típicamente resulta de la ingestión de alimentos o agua contaminada con plomo; pero también puede ocurrir después de la ingestión accidental de suelo contaminado, polvo o pintura a base de plomo. Se absorbe rápidamente en el torrente sanguíneo y se cree que tiene efectos adversos en el sistema nervioso central, el sistema cardiovascular, los riñones y el sistema inmunológico. El límite de los componentes de plomo (1,0 mg / g) es un punto de referencia de prueba para los productos farmacéuticos, lo que representa la ingesta diaria máxima que una persona debe tener. Sin embargo, incluso en este nivel bajo, un consumo prolongado puede ser peligroso para los seres humanos. El tratamiento para la intoxicación por plomo consiste en dimercaprol y succímero.
| NFPA 704 |
|---|
 1 3 0 |
| "Diamante fuego" para los gránulos de plomo |
La preocupación por el papel de liderazgo en los déficits cognitivos en los niños ha provocado la reducción generalizada de su uso (exposición al plomo ha sido relacionado con dificultades de aprendizaje). La mayoría de los casos de adultos elevados niveles de plomo en la sangre están relacionados con el lugar de trabajo. Los niveles altos están asociados con el retraso en la pubertad en las niñas. El plomo se ha demostrado muchas veces para reducir permanentemente la capacidad cognitiva de los niños en niveles extremadamente bajos de exposición.
Durante el siglo 20, el uso de plomo en la pintura pigmentos fue muy reducida, debido al peligro de intoxicación por plomo, especialmente a los niños. A mediados de la década de 1980, un cambio significativo en los patrones de uso final de plomo había tenido lugar. Gran parte de este cambio fue el resultado del cumplimiento de los EE.UU. de plomo de los consumidores con las regulaciones ambientales que significativamente reducir o eliminar el uso del plomo en productos que no son de baterías, incluyendo gasolina, pinturas, soldaduras y sistemas de agua. Uso de plomo se está restringiendo aún más por la Unión Europea de Directiva RoHS. El plomo aún se puede encontrar en cantidades nocivas de gres, vinilo (tal como el usado para la tubería y el aislamiento de los cables eléctricos), y latón chino. Las casas antiguas todavía pueden contener cantidades sustanciales de pintura con plomo. Pintura con plomo blanco ha sido retirado de la venta en los países industrializados, pero el amarillo cromato de plomo está todavía en uso. La pintura vieja no debe ser despojado por el lijado, ya que esto produce polvo inhalable.
Las sales de plomo utilizados en cerámica vidriada en ocasiones han causado la intoxicación, cuando las bebidas ácidas, como jugos de frutas, han lixiviado iones de plomo del esmalte. Se ha sugerido que lo que se conocía como " Cólico Devon "surgió de la utilización de prensas forradas de plomo para extraer el jugo de manzana en la fabricación de la sidra . El plomo se considera que es especialmente perjudicial para la capacidad de las mujeres para reproducirse. Plomo (II) acetato (también conocida como azúcar de plomo) se utilizó en el Imperio Romano como edulcorante para el vino, y algunos consideran esto una explicación plausible para la demencia de muchos emperadores romanos, y, que la intoxicación crónica por plomo contribuyó a la disminución gradual del imperio. (Ver Decadencia del Imperio Romano envenenamiento # plomo)
Bioquímica de la intoxicación
En el cuerpo humano, el plomo inhibe porfobilinógeno sintasa y ferroquelatasa, evitando tanto formación porfobilinógeno y la incorporación de hierro en protoporfirina IX, el paso final en síntesis del grupo hemo. Esto provoca la síntesis de hemo ineficaz y subsiguiente anemia microcítica. A niveles más bajos, actúa como un análogo de calcio, interfiriendo con los canales de iones durante la conducción nerviosa. Este es uno de los mecanismos por los que interfiere con la cognición. Envenenamiento agudo con plomo se trata usando edetato de calcio disódico: el calcio quelato de la sal disódica del ácido etileno-diamina-tetraacético ( EDTA). Este agente quelante tiene una mayor afinidad para el plomo que para calcio y por lo que el quelato de plomo se forma por intercambio. Esto se excreta en la orina luego dejando tras de calcio inofensivo. De acuerdo con la Agencia para Sustancias Tóxicas y el Registro de Enfermedades, una pequeña cantidad de plomo ingerido (1%) almacenará en sí en los huesos, y el resto se excreta por un adulto a través de la orina y las heces dentro de unas semanas de la exposición. Sin embargo, sólo alrededor del 32% del plomo se excreta por un niño.
La exposición al plomo y los productos químicos de plomo puede producirse por inhalación, ingestión y contacto dérmico. La mayor parte de la exposición se produce por la ingestión o inhalación; en los EE.UU. es poco probable que la exposición de la piel como aditivos de la gasolina con plomo ya no se usan. La exposición al plomo es un problema global como la minería de plomo y la fundición de plomo son comunes en muchos países. La mayoría de los países han dejado de utilizar gasolina con plomo antes de 2007. La exposición al plomo en su mayoría se produce a través de la ingestión. La pintura con plomo es la principal fuente de exposición al plomo para los niños. Como la pintura de plomo se deteriora, se pela, se pulveriza en el polvo y luego entra en el cuerpo a través de contacto de las manos a la boca oa través de alimentos contaminados, agua o alcohol. La ingestión de ciertos medicamentos remedio casero también puede exponer a las personas al plomo o compuestos de plomo. El plomo puede ser ingerido a través de frutas y verduras contaminadas con altos niveles de plomo en los suelos que se cultivan en. El suelo está contaminado a través de la acumulación de partículas de plomo en las tuberías, pintura con plomo y emisiones residuales de la gasolina con plomo que se utilizaba antes de la emisión Agencia de Protección del Medio Ambiente la regulación alrededor de 1980. El uso de plomo para tuberías de agua es problemática en áreas con suave o (y) el agua ácida. El agua dura forma capas insolubles en los tubos mientras que el agua blanda y ácida disuelve las tuberías de plomo. La inhalación es la segunda ruta principal de la exposición, especialmente para los trabajadores en ocupaciones relacionadas con el plomo. Casi todo el plomo inhalado se absorbe en el cuerpo, la tasa es de 20 a 70% para el plomo ingerido; niños absorben más que los adultos. La exposición dérmica puede ser importante para una categoría limitada de personas que trabajan con compuestos orgánicos de plomo, pero es de poco interés para la población en general. La tasa de absorción de la piel también es baja para el plomo inorgánico.
